文献解读|Sci Adv(13.6):通过空间多维蛋白质组学深入了解神经胶质瘤的机制
✦ +
+
论文ID
原名:Mechanistic insight into glioma through spatially multidimensional proteomics
译名:通过空间多维蛋白质组学深入了解神经胶质瘤的机制
期刊:Science Advances
影响因子:13.6
发表时间:2024.02.16
DOI号:10.1126/sciadv.adk1721
背 景
在分子水平上表征肿瘤微环境(TME)对于理解肿瘤发生和进化的机制至关重要。然而,肿瘤局部区域血液蛋白质组的特异性及其与其他系统的联系很难研究。胶质瘤是最常见的恶性脑肿瘤,而多形性胶质母细胞瘤(GBM)是恶性程度最高、侵袭性最强的胶质瘤,导致患者预后不良。然而,神经胶质瘤的发生和进化机制仍不清楚。
实验设计
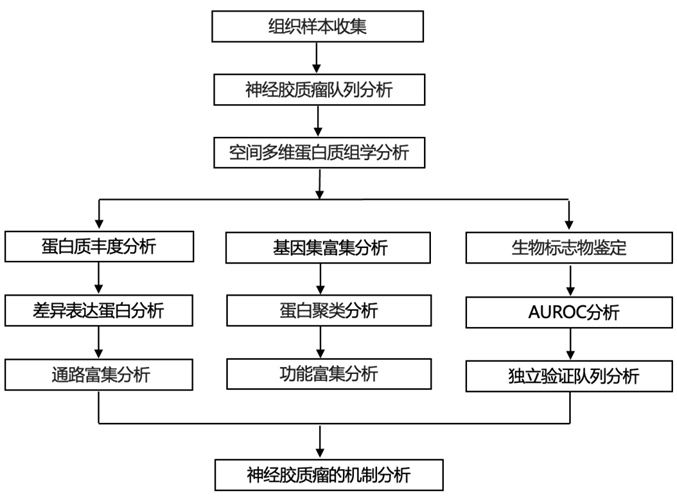
结 果
01
研究设计和队列特征
在本研究中,研究团队开发了一种用于神经胶质瘤的机制研究和生物标志物发现的空间多维比较蛋白质组学策略(图1)。通过在手术期间同时收集来自神经胶质瘤区域的供血动脉(gA)和引流静脉(gV)的血液以及来自患者背足的静脉血,建立了包含来自神经胶质瘤局部环境和外周静脉的血浆的空间配对队列,并用于系统地研究与血液循环相关的蛋白质组学差异。这项研究的特点是在不同的循环部位收集空间特定的血浆样本,特别是在神经胶质瘤的局部环境中(图1A-B)。得注意的是,这些队列的各组之间在性别、年龄和身体质量指数(BMI)方面没有发现显著差异。这种空间多维、多队列的比较蛋白质组学研究将为胶质瘤的分子机制提供深入的了解(图1C)。
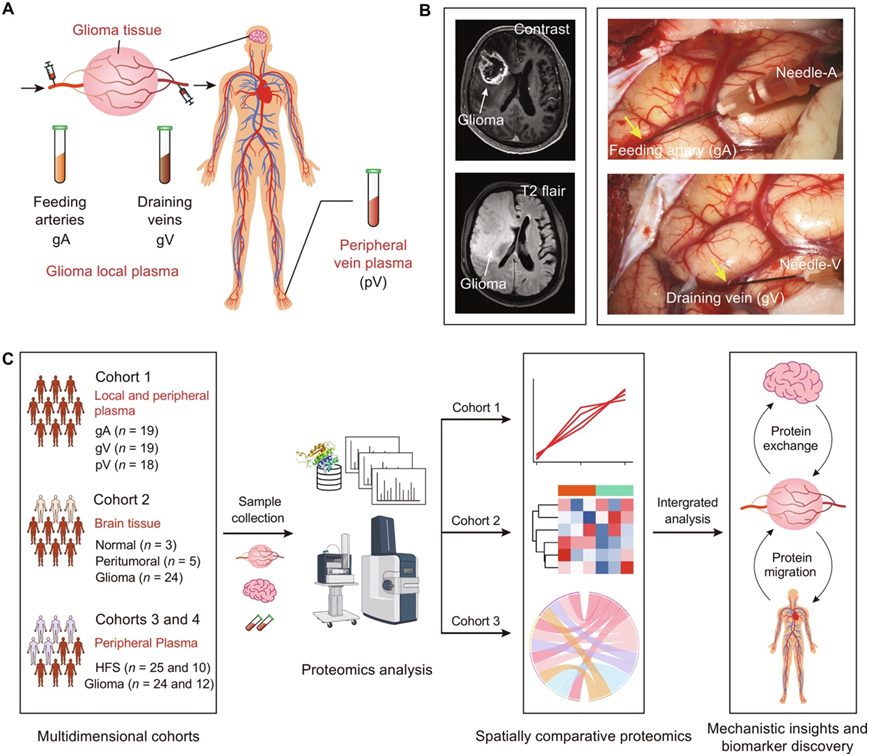
图1. 神经胶质瘤研究的空间多维蛋白质组学示意图。
(A) 收集空间特定样本以进行多维分析。在不同的循环部位采集血浆样本,包括来自神经胶质瘤局部环境中的供血动脉(gA)和引流静脉(gV)的血浆以及来自背侧pV的静脉血浆。还收集了脑肿瘤组织来研究肿瘤与局部血液之间的蛋白质交换。(B) 神经胶质瘤的磁共振成像代表性图像(左)和肿瘤切除手术期间收集神经胶质瘤局部血浆的过程(右)。(C) 研究设计概述。
02
胶质瘤局部环境血浆与 pV 之间的蛋白质组差异
他们首先采用非靶向蛋白质组学策略比较了胶质瘤局部环境和外周静脉血浆的蛋白质组,总共对血浆样本中的393种蛋白质进行了定量,观察到来自血液循环空间不同部位的蛋白质的差异表达。gA血浆中55种蛋白质的相对丰度与pV血浆中的显著不同,其中25种蛋白质在gA中较高,30种蛋白质较低(图2A)。gV和pV的差异蛋白数也为55个,其中25个蛋白的gV较高,30个蛋白的gV较低。神经胶质瘤局部环境血浆和外周血浆之间总共存在74个显著差异的蛋白质。GO分析结果显示(图2B),这74种蛋白主要存在于细胞外空间,富集于免疫应答、细胞粘附、缺氧应答和糖酵解等途径,暗示了胶质瘤局部环境中免疫状态、糖代谢和细胞迁移的变化。血液循环不同部位蛋白质表达的巨大差异可能包含与胶质瘤发病机制相关的重要信息。
他们还对神经胶质瘤的上游(gA)和下游血浆(gV)进行了动静脉比较。与gA/gV和pV之间的结果不同,gA和gV之间的蛋白质丰度差异较小。9个蛋白质在gA和gV之间表现出差异,其中6个蛋白质的gV较高,3个蛋白质的gV较低(图2A)。将动脉血和静脉血的差异与血流方向结合起来,可能为胶质瘤与局部血液之间的分子交换提供线索。
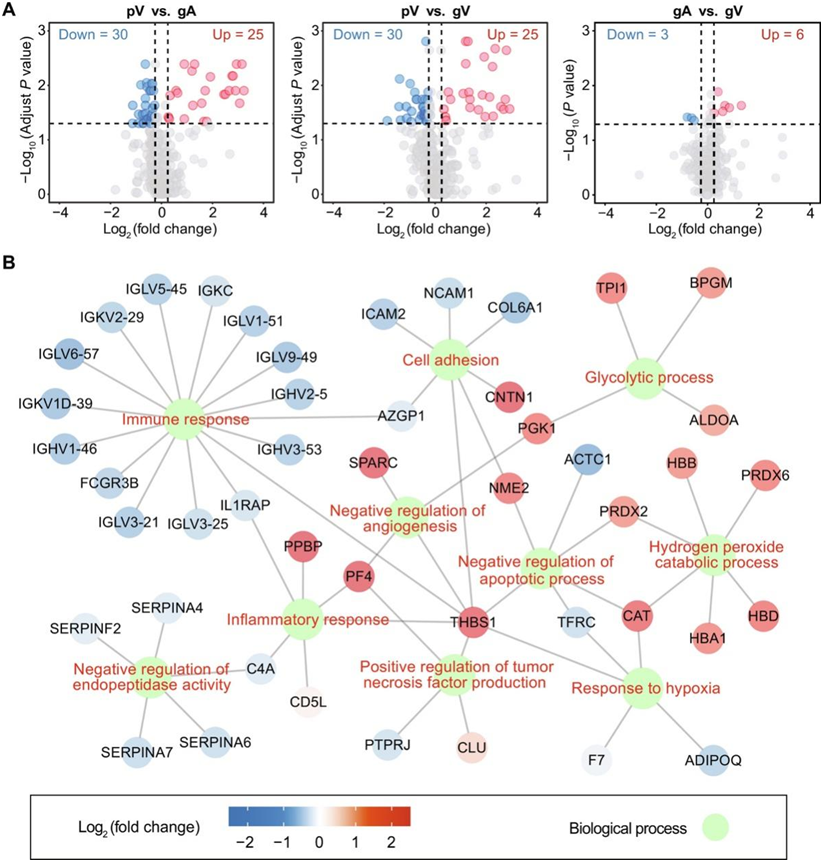
图2. 来自神经胶质瘤局部环境和外周静脉的空间特异性血浆的蛋白质组的配对比较。
(A) pV 与 gA/gV 以及 gA 与 gV 之间差异蛋白的火山图。(B)通过GO分析,神经胶质瘤局部血浆和外周血浆之间涉及74个显著差异蛋白的生物过程网络。
03
神经胶质瘤相关的组织和外周血尺寸的蛋白质组差异
他们下一步的目标是研究组织和外周血维度中的神经胶质瘤相关蛋白,因此首先将神经胶质瘤组织的蛋白质组与瘤周组织和正常脑组织的蛋白质组进行比较。蛋白质组分析鉴定出正常脑组织和胶质瘤组织之间有1785个显著差异蛋白,以及瘤周脑组织和胶质瘤组织之间有1171个差异蛋白(图3A)。在这些蛋白质中,有 807 种蛋白质在两次比较中是相同的。相比之下,只有一种蛋白质(FDX2)在正常脑组织和瘤周脑组织之间发现显著差异,并且差异倍数(FC)也较低。根据基因集富集分析(GSEA)结果,发现了剪接体、粘着斑、细胞周期、磷脂酰肌醇3-激酶-Akt信号、转化生长因子-β信号的通路活跃,表明神经胶质瘤组织中的细胞增殖和迁移得到增强。此外,还发现三羧酸循环(TCA)和氧化磷酸化途径受到抑制,表明细胞能量产生和物质代谢过程出现紊乱(图3B)。
然后,对非神经胶质瘤和神经胶质瘤患者的外周血浆进行蛋白质组分析和比较。结果显示,18种蛋白表现出不同的表达,其中大部分位于胞外区(图3C)。这些差异蛋白在胶质瘤患者血液中的表达变化很可能与胶质瘤的病理过程有关。功能富集分析表明,这些蛋白富集于高密度脂蛋白颗粒重塑、脂质转运和胆固醇代谢通路中(图3D)。
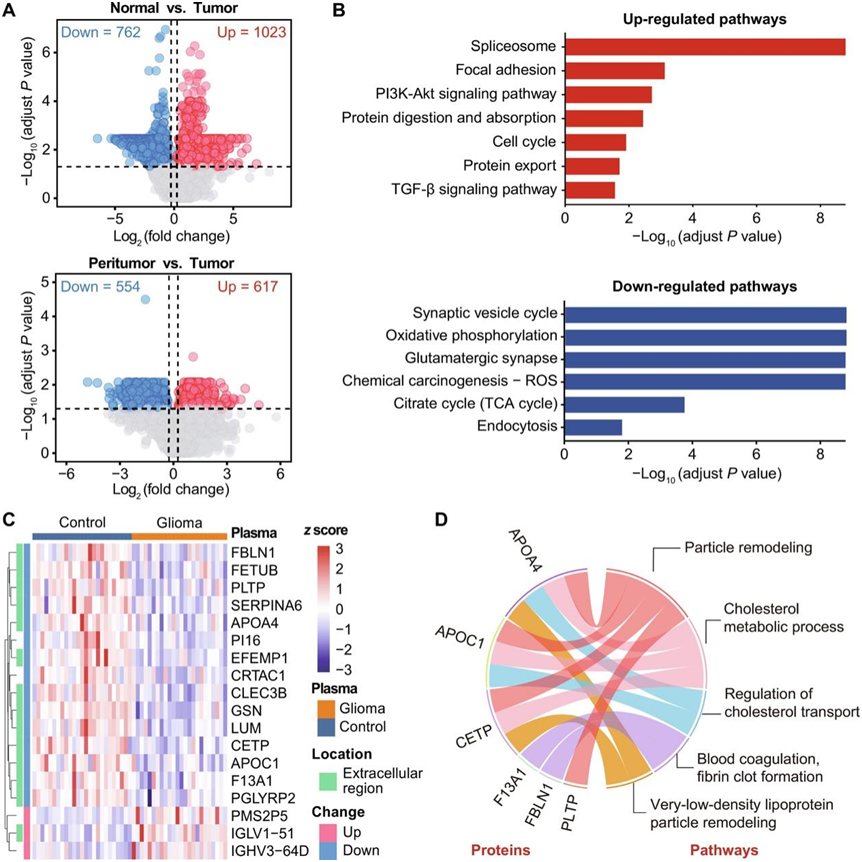
图3. 组织和外周血的差异蛋白分析。
(A) 与无肿瘤组织相比,在神经胶质瘤组织中发现的显著差异蛋白质的火山图。(B)胶质瘤组织与无瘤组织间显著上调和下调的通路。 (C) 非神经胶质瘤和神经胶质瘤患者外周血浆比较中 18 种显著差异蛋白的热图。(D) 弦图显示了差异蛋白显著富集的 GO 生物过程。
04
从多维蛋白质组学角度探讨神经胶质瘤发病机制
对来自神经胶质瘤局部环境(gA 和 gV)和外周背侧 pV 的空间特异性血浆样本进行蛋白质组分析后,以明确的方式揭示了神经胶质瘤相关的蛋白质组差异。为了进一步研究差异蛋白可能的生物学功能,通过模糊聚类分析将74个蛋白分为4个聚类(图4)。
31 种蛋白质可以归类为聚类 1,其 pV 丰度最高,gA 和 gV 丰度依次递减(图 4A)。它们主要由免疫球蛋白、补体系统相关蛋白、丝氨酸蛋白酶抑制蛋白等组成。考虑到血液循环过程和方向,这些蛋白可能主要从中枢神经系统(CNS)以外的组织转运到胶质瘤的局部环境。功能富集分析表明,这些蛋白主要富集于免疫球蛋白介导的免疫反应、肽链内切酶活性的负调节和血小板脱颗粒途径中(图4B)。
聚类2包含20个蛋白质,其中大部分是与血小板和糖酵解相关的蛋白质,呈现出pV显著低于胶质瘤区域且gA略高于gV的趋势(图4A)。通过功能富集分析,这些蛋白质在凝血、糖酵解和活性氧(ROS)代谢过程途径中富集(图4B)。胶质瘤血浆中血小板相关蛋白(PPBP 和 PF4)的高表达表明存在高凝状态,这与 GBM 患者频繁静脉血栓形成和凝血障碍的研究一致。
聚类3中的11种蛋白质显示出丰度从pV到gA再到gV连续增加的模式(图4A),表明这些蛋白质由神经胶质瘤组织产生并分泌到局部环境的血液中。功能富集分析表明,这些蛋白在补体激活和ROS代谢过程途径中富集(图4B),这意味着ROS代谢可能是胶质瘤响应氧化应激的重要途径。
聚类4由12个蛋白组成,表现出pV高于胶质瘤局部血浆且gV高于gA的趋势(图4A)。这意味着这些蛋白质可能是由神经胶质瘤和中枢神经系统以外的组织产生的。这些蛋白质在免疫效应器、血小板衍生生长因子受体的调节和凝血途径中富集(图4B)。
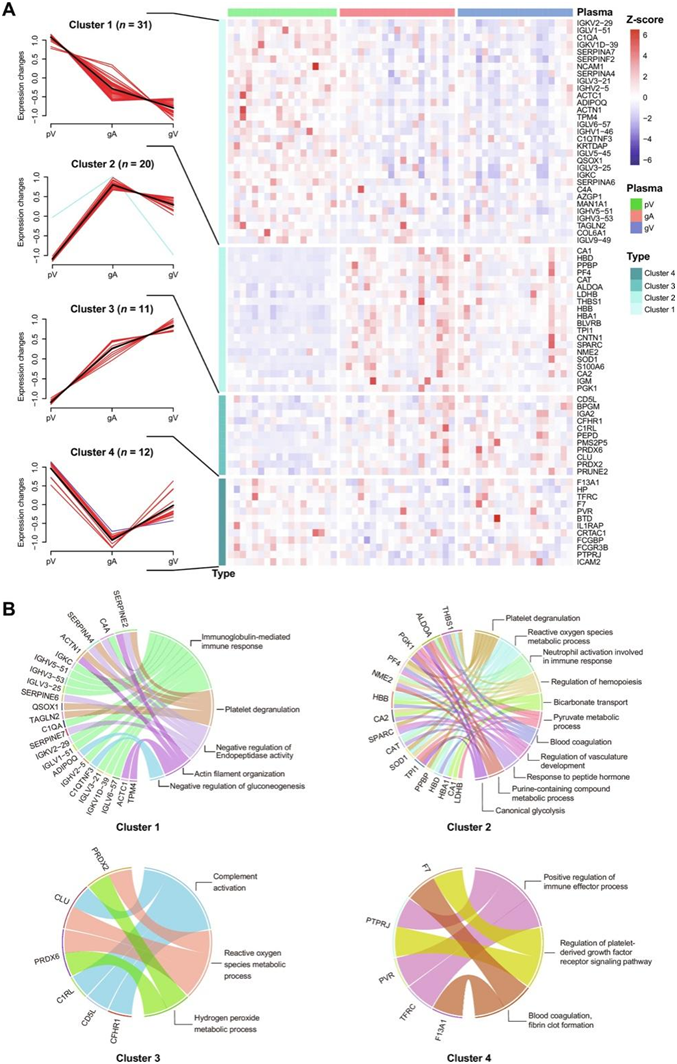
图4. 胶质瘤局部环境和周围区域血浆中循环蛋白的不同表达模式。
(A) 神经胶质瘤局部血浆和外周静脉之间 74 个显著差异蛋白的四个聚类(左)和热图(右)。模糊聚类分析用于蛋白质聚类。(B) 弦图显示不同聚类中蛋白质显著富集的 GO 生物过程。
上述信息表明,胶质瘤的发生可能会增强免疫球蛋白和补体蛋白的产生,随后将其输送到胶质瘤区域并改变肿瘤免疫微环境。在这种情况下,总共观察到 13 种免疫球蛋白。值得注意的是,与非神经胶质瘤患者相比,在神经胶质瘤患者的 pV 血浆中还观察到其中一种免疫球蛋白 IGLV1-51 的丰度显著更高(图 5A)。这一结果进一步证实了胶质瘤发生过程中免疫球蛋白的上调。此外,还有四种蛋白(SERPINA2、SERPINA4、SERPINA6和SERPINA7)属于丝氨酸蛋白酶抑制剂(serpin)超家族,其中SERPINA6在胶质瘤患者pV血浆中的表达显著降低(图5B)。
在这些蛋白中,参与错配修复途径的名为 PMS2P5 的蛋白在神经胶质瘤局部环境的血浆中的表达量远高于 pV 中的表达量。与非神经胶质瘤患者相比,在神经胶质瘤患者的血浆中也观察到显著较高的PMS2P5水平(图5C)。
CRTAC1在抑制膀胱癌细胞迁移、侵袭和上皮间质转化中发挥关键作用。他们推测CRTAC1也可能与胶质瘤进展相关。在外周静脉和神经胶质瘤静脉血中观察到的这种肿瘤抑制因子的丰度高于动脉血,表明该蛋白质可能在组织中产生,然后分泌到静脉血中。神经胶质瘤患者血浆中 CRTAC1 的丰度显著低于非神经胶质瘤患者的血浆(图 5D),这表明与其相关的肿瘤抑制途径在神经胶质瘤发展过程中受到抑制。
他们还鉴定了一种凝血相关蛋白 F13A1,其主要作用是在凝血过程中促进纤维蛋白原形成纤维蛋白。此外,在胶质瘤组织中检测到该蛋白,发现其表达水平显著高于无肿瘤组织(图5D)。因此,肿瘤组织中的F13A1蛋白可能分泌到胶质瘤局部血浆中,导致gV中的丰度高于gA中。此外,这种凝血相关蛋白的高表达与在神经胶质瘤区域观察到的高凝现象一致。
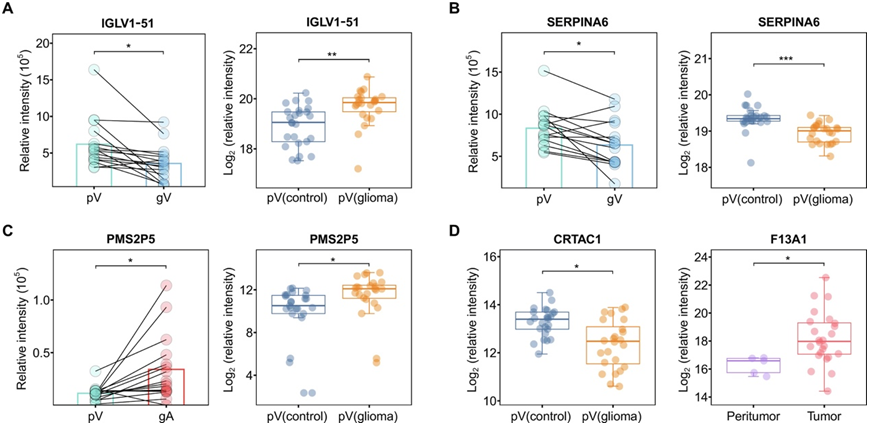
图5. 研究队列中关键蛋白质的变化分析。
(A-C) 队列1患者的胶质瘤局部血浆(gV和gA)/pV血浆和队列2患者血浆中IGLV1-51、SERPINA6和PMS2P5蛋白的丰度差异。(D) 非神经胶质瘤/神经胶质瘤患者(队列 2)血浆和队列 3 患者的瘤周/神经胶质瘤(肿瘤)组织中 CRTAC1 和 F13A1 的丰度差异。
05
血浆 SERPINA6 是神经胶质瘤的潜在生物标志物
基于多维蛋白质组学结果,观察到神经胶质瘤患者中丝氨酸蛋白酶活性负调节的抑制,并且SERPINA6在神经胶质瘤患者血浆中表现出显著较低的表达(图5B)。为了评估这些候选生物标志物的诊断性能,他们使用受试者工作特征曲线下面积 (AUROC) 分析来评估这些检测方法在区分神经胶质瘤患者和非神经胶质瘤对照方面的总体区分力。仅使用SERPINA6作为生物标志物,曲线下面积(AUC)可以达到0.89。因此,敏感性和特异性可分别达到87.5%和88.0%(图6A)。这些结果意味着血浆 SERPINA6 表现出高判别能力,可以作为神经胶质瘤的生物标志物。
为了验证所发现的 SERPINA6 生物标志物,他们另外招募了一个由 10 名神经胶质瘤患者和 10 名非神经胶质瘤患者组成的独立验证队列(队列 4)。经过相同的样品收集、制备和 LC-MS 分析过程后,对队列 4 的基于强度的绝对定量 (iBAQ) 值进行分位数归一化,以用于比较蛋白质组分析。结果再次表明,神经胶质瘤患者血液中SERPINA6蛋白的丰度显著下调(图6B)。当用SERPINA6进行AUROC分析时,AUC高达0.78,正确诊断了队列4中90%的胶质瘤患者和70%的非胶质瘤患者(图6C-D)。结果进一步证明了 SERPINA6 作为快速初步筛查神经胶质瘤的血液生物标志物的前景。
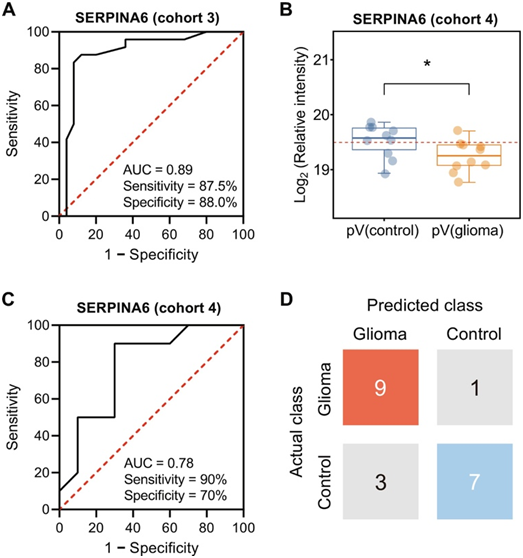
图6. 血浆蛋白SERPINA6的诊断能力。
(A) 通过 AUROC 曲线分析队列 3 中血浆 SERPINA6 的判别力。(B) 对照受试者和神经胶质瘤患者之间外周血浆 SERPINA6 相对强度的差异。(C) 通过 AUROC 曲线分析队列 4 中血浆 SERPINA6 的判别力。(D) 队列 4分类结果的矩阵。
+ + + + + + + + + + +
结 论
本项研究以神经胶质瘤为例提出了一种空间多维比较蛋白质组学策略,通过原位收集大脑胶质瘤区域的动脉和静脉血并与外周血进行比较,专门鉴定了肿瘤微环境的血液蛋白质组特征。此外,通过整合不同维度的组织和外周血蛋白质组学,揭示了胶质瘤相关蛋白的发生、迁移和交换信息,为肿瘤机制研究和生物标志物发现提供了有力的方法。该研究招募了多维临床队列,使蛋白质组学结果相互证实,可靠地揭示了神经胶质瘤特有的生物过程,并鉴定了高度准确的生物标志物。
+ + + + +



 English
English


