文献解读|Cell(64.5):肿瘤免疫的泛癌蛋白质组学表征
✦ +
+
论文ID
原名:Pan-cancer proteogenomics characterization of tumor immunity
译名:肿瘤免疫的泛癌蛋白质组学表征
期刊:Cell
影响因子:64.5
发表时间:2024.02.14
DOI号:10.1016/j.cell.2024.01.027
背 景
尽管近几十年来免疫疗法在癌症治疗中取得了成功,但只有不到 10%–20% 的癌症病例表现出免疫检查点封锁的持久反应。为了增强免疫疗法的功效,人们越来越多地考虑抑制多种免疫逃避机制的联合疗法。
实验设计
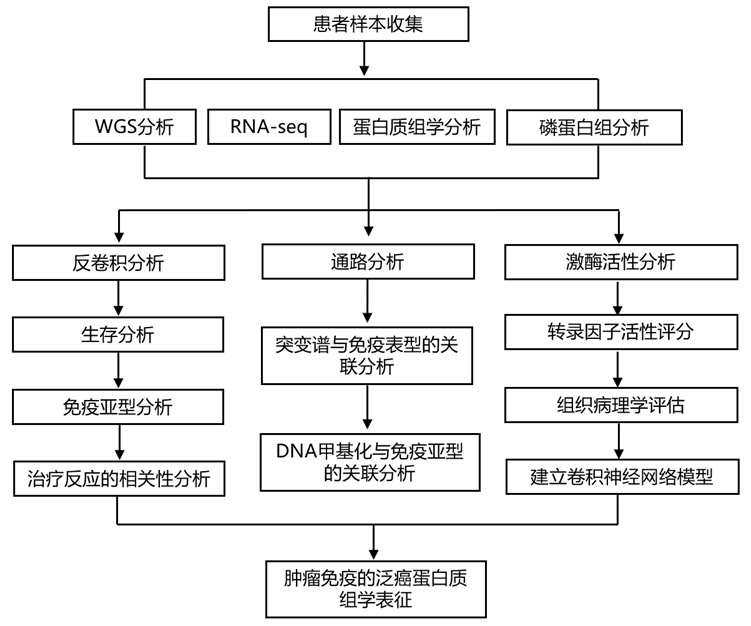
结 果
01
多组学泛癌数据
研究团队使用蛋白质组学方法[包括全基因组测序 (WGS)、转录组分析(RNA-seq)、定量蛋白质组学和磷酸蛋白质组学]对来自代表 10 种癌症的患者的 1056 个未接受治疗的样本进行了分析。鉴定了不同癌症的样本分布:乳腺癌(BC)、肾透明细胞癌(CCRCC)、结肠癌(CO)、胶质母细胞瘤(GBM)、头颈部鳞状细胞癌(HNSCC)、肺鳞状细胞癌(LSCC)、肺腺癌(LUAD)、卵巢癌(OV)、胰腺导管腺癌(PDAC)和子宫癌(UCEC)(图1A)。
泛癌肿瘤在肿瘤细胞百分比以及免疫细胞和基质细胞百分比方面表现出显著的异质性。具体而言,CCRCC、LUAD 和 PDAC 成为免疫浸润最高的癌症,而与其他癌症相比,CCRCC 和 PDAC 也表现出更高的基质成分。相反,UCEC 显示出最高的肿瘤细胞百分比,但免疫和基质成分最低(图 1 B)。
为了深入了解这些肿瘤中不同免疫/基质细胞类型的浸润模式,他们使用最近开发的反卷积算法估计了肿瘤微环境(TME)中的细胞类型组成分数。不同肿瘤间细胞类型组分的比较揭示了不同肿瘤间细胞类型组成的广泛异质性(图1B)。CCRCC和LUAD具有明显较高的CD8+ T细胞浸润,而GBM、CO和UCEC具有较低的CD8+ T细胞浸润。B细胞在LUAD中浸润程度较高,而在GBM、BR和UCEC中浸润程度较低。GBM中CD8+ T细胞和B细胞的低表达与脑肿瘤中众所周知的现象一致,即小胶质细胞和巨噬细胞在数量上超过T细胞和B细胞。另一方面,与其他癌症相比,单核细胞在CCRCC、GBM和OV中似乎更丰富。CCRCC是成纤维细胞和内皮细胞富集程度最高的肿瘤(图1B)。
不同细胞类型的百分比与不同癌症的无进展生存(PFS)相关,如CCRCC、LUAD、PDAC和UCEC(图1C-D)。具体来说,CD8 T细胞的增加导致CCRCC、LUAD和PDAC患者的PFS更好,但UCEC患者的PFS更差。在CO中,不同类型细胞的高浸润导致总生存率(OS)降低(图1C)。
除了细胞类型分数外,他们还利用427个免疫相关特征来表征肿瘤的肿瘤微环境(TME)。鉴于这些免疫相关特征之间的高度相关性,他们首先根据它们的单样本基因集富集分数(来自泛癌症蛋白质组学数据)将它们分为10个不同的免疫模块。除了髓细胞和淋巴细胞模块外,他们还观察到代表伤口愈合增殖、干扰素和TGFB/基质的特征组。然后,他们根据蛋白质组学数据得出每个肿瘤样本的模块活性评分。利用它们与细胞类型分数一起进行共识聚类,以检测不同TME的免疫亚型(图1A)。
他们确定了7个聚类:CD8+/IFNG+、嗜酸性粒细胞/内皮细胞、成纤维细胞/TGF-β、CCRCC/内皮细胞、脑/神经细胞、CD8 - /IFNG+和CD8 - /IFNG -(图1E-F)。CD8 /IFNG包含来自所有10种癌症的肿瘤,其特征是CD8+ T细胞的富集,干扰素的激活以及T细胞受体信号传导等免疫相关途径(图1E-F,图2B)。
嗜酸性细胞/内皮细胞在PDAC、LUAD和LSCC肿瘤中富集,并以嗜酸性细胞的存在为特征(图1E-F)。成纤维细胞/TGF-β的特征是TGF-β、成纤维细胞的上调,以及上皮间充质转化(EMT)和局灶黏附等细胞外基质相关通路的激活(图2B)。缺氧的激活与TGF-β一起影响TME,刺激细胞外基质成分的产生,这是EMT的一个特征。有趣的是,仅基于蛋白质组学,在成纤维细胞/TGF-β中观察到缺氧的上调(图2C),表明整合蛋白质基因组学方法的价值。
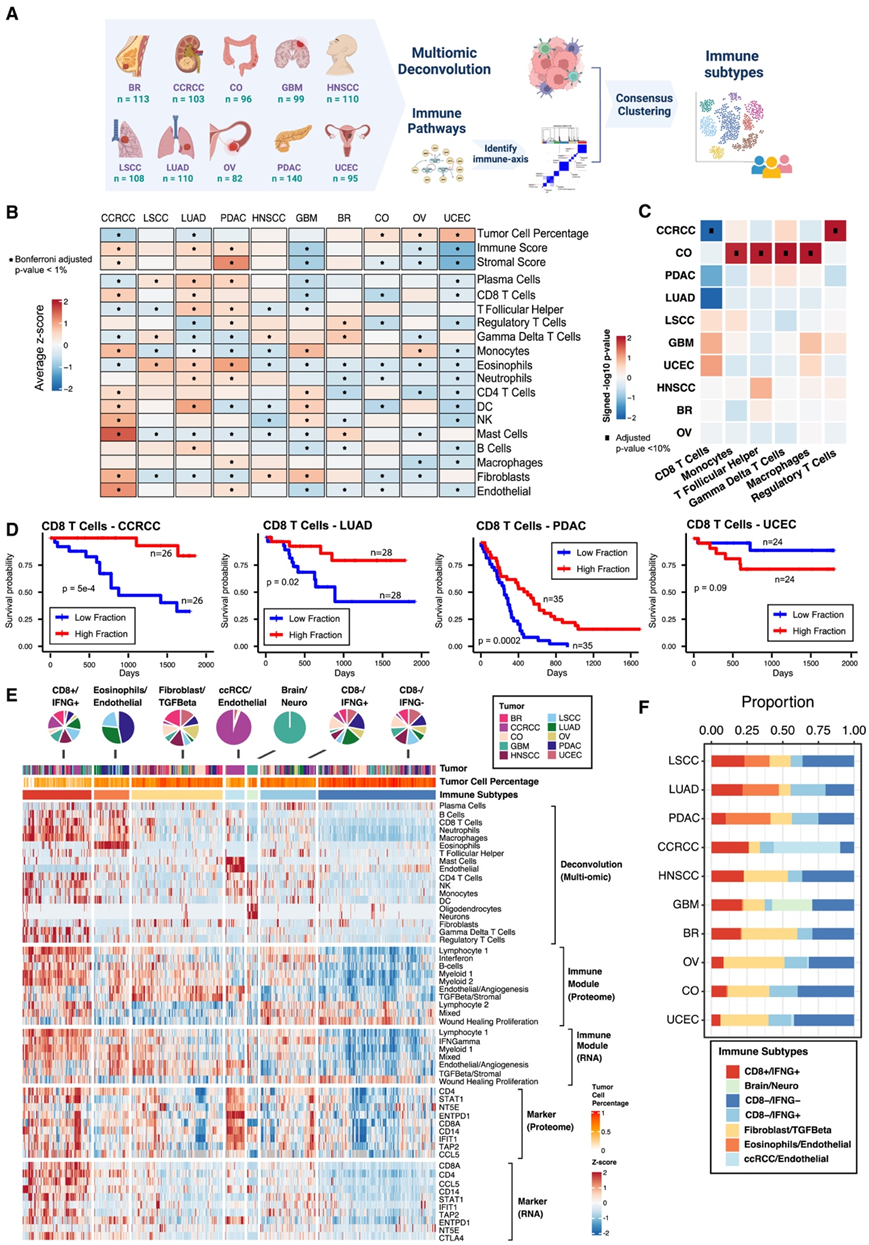
图1. 免疫亚型的推导。
(A) 免疫亚型的推导概要。(B) 热图显示每种癌症的肿瘤细胞百分比、免疫和基质评分以及细胞类型分数的平均值。(B) 热图显示每种癌症的肿瘤细胞百分比、免疫和基质评分以及细胞类型分数的平均值。(D) Kaplan-Meier 曲线显示 CD8+ T 细胞分数与患者生存结果之间的癌症特异性关联。(E) 热图从上到下显示 (1) 通过反卷积分析估计的细胞类型分数;(2-3)分别基于蛋白质组和RNA的免疫模块的通路评分;(4-5)细胞类型标志物的蛋白质和RNA表达。(F) 条形图显示每种癌症中分配给不同免疫亚型的样本比例。
CD8−/IFNG+代表了一种免疫亚型,其特征是CD8+ T细胞和B细胞的免疫浸润低,但干扰素γ信号的强烈激活。相比之下,CD8−/IFNG−在所有免疫细胞和基质细胞类型中所占比例最低。对于这两个聚类,他们观察到细胞周期相关通路的上调,如DNA损伤/修复和MYC靶点(图2B)。有趣的是,同种异体移植排斥反应在CD8−/IFNG+中上调,而在CD8−/IFNG−中下调,这与在这两种亚型之间观察到的干扰素γ信号的变化一致(图2B)。值得注意的是,仅基于蛋白质组学数据,PPARA激活基因表达在CD8−/IFNG−中升高(图2C)。
其余两个聚类,CCRCC/内皮细胞和脑/神经细胞,代表癌症特异性亚型(图1E),与CD8−/IFNG−相比,这些亚型表现出显著差异。脑/神经亚型显示神经元富集,氧化磷酸化和丙酮酸代谢途径上调(图2C)。
CCRCC/内皮亚型是CCRCC中主要的免疫亚型。虽然在低T细胞浸润方面与CD8−/IFNG−相似,但该亚型表现出显著升高的肥大细胞和内皮细胞浸润水平,并伴有局灶黏附途径的上调(图2B)。
在研究免疫亚型和人口统计学变量之间的关联时,他们发现在CD8−/IFNG−中,女性的比例低于男性(图2D)。东亚患者的CD8−/IFNG−水平高于欧洲患者(图2D)。此外,吸烟者的成纤维细胞/TGF-β富集(图2D)。事实上,在从不吸烟者和曾经吸烟者(现在不吸烟)的HNSCC样本中,相关通路(包括EMT和IFNG)的活性显著不同(图2E)。
为了探讨免疫亚型与癌症治疗反应之间的关联,他们使用 III 期 OAK 临床试验 (NCT02008227) 的数据进行了分析,该试验涉及 425 名接受免疫疗法 (atezolizumab/MPDL3280A) 治疗的非小细胞肺癌患者。他们在344个肿瘤中鉴定出75个属于CD8−/IFNG+。引人注目的是,这些患者表现出明显更好的PFS(图2A)。当考虑OAK试验中接受化疗(多西紫杉醇)的独立患者组时,未发现这种关联(图2A)。
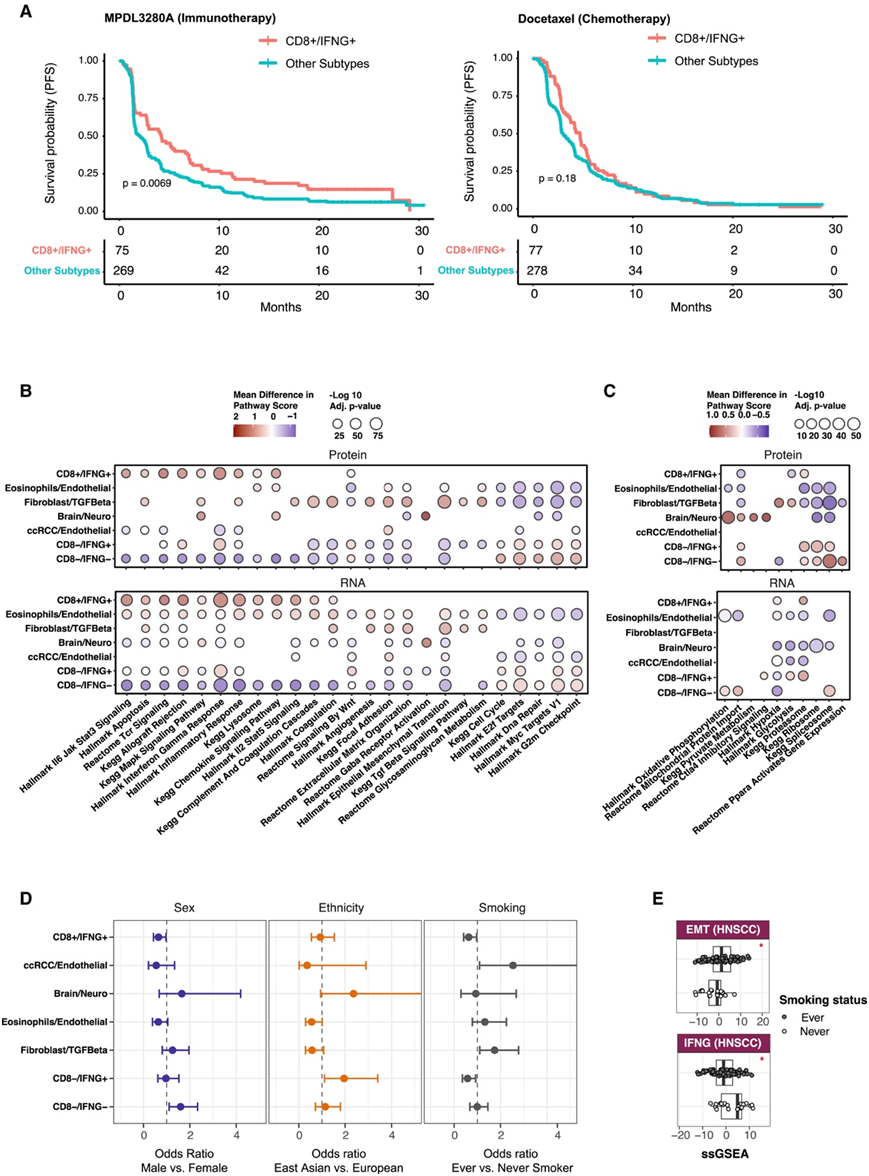
图2. 免疫亚型与治疗反应、通路活动和患者人口统计变量的关联。
(A) Kaplen-Meier 曲线显示III 期 OAK 临床试验中免疫治疗组(左)和化疗组(右)样本中CD8 + /IFNG +与 PFS 之间的关联。(B) 气泡图显示免疫亚型和生物途径之间关联分析的汇总统计数据。(C) 气泡图显示与 (B) 相同的通路分析结果,但仅基于蛋白质组学发现激活的通路。(D) 免疫亚型和人口变量之间的泛癌关联。(E) 按吸烟状况分层的 HNSCC 癌症中上皮间质转化 (EMT) 和干扰素伽马信号传导 (IFNG) 通路评分的箱线图。
02
DNA 畸变对免疫亚型的影响
总体而言,他们鉴定了 102 个基因,其突变显示出与至少一种免疫表型显著相关(图3A-B)。值得注意的是,STK11突变与CD8−/IFNG+呈正相关,并下调LUAD中CD8−/IFNG+的RNA和蛋白表达(图3A-C)。与其他亚型相比,CD8−/IFNG+中的STK11蛋白水平显著降低(图3D)。这些结果表明,STK11可能有助于干扰素γ信号激活患者的免疫浸润减少。
另一方面,他们观察到BAP1和CASP8突变与高免疫原性亚型CD8 /IFNG呈正相关(图3B)。BAP1突变是所有癌症中CCRCC中最常见的突变(图3A),并促进CD8 T细胞在CCRCC中的浸润。BAP1突变与CCRCC中同源RNA和蛋白表达下调相关(图3C)。这与之前的观察结果一致,即BAP1表达降低导致免疫细胞浸润增加。CASP8是外源性细胞凋亡途径的关键参与者。它的突变有助于肿瘤细胞逃离细胞毒性T细胞,反映了免疫压力下的免疫逃避机制。在CD8 +/IFNG+和CD8−/IFNG+中,CASP8的基因和蛋白表达均上调,扩展了先前在CASP8缺陷肿瘤中细胞溶解活性增加的观察结果(图3D)。
他们检测了各种免疫表型与基因水平拷贝数变异(CNV)之间的关联,发现Chr3p、4p、5p和9p富集了这种关联。具体而言,Chr3p包含的基因数量最多,其CNV与CD8+ T细胞和巨噬细胞浸润均显著相关(图3E)。在研究队列中,CCRCC肿瘤显示出最高的Chr3p缺失百分比。一小部分预后良好的CCRCC患者具有CD8+ T细胞效应标志物表达水平升高以及低水平拷贝数丢失的特点。这与Chr3p缺失与CD8+ T细胞信号负相关以及CD8+ T细胞浸润与CCRCC患者PFS正相关一致(图1D)。
另一个值得注意的区域是9p21,包含CDKN2A/B和MTAP等基因,其CNV与伤口愈合增殖模块显著相关(图3F)。9p21缺失导致了冷TME和对免疫检查点治疗的原发性抵抗。
多项研究表明,生殖系遗传变异除了在癌症风险方面的传统研究作用外,还可以在形成TME方面发挥重要作用。为了更好地了解种系变异的影响,他们利用基因表达(eQTL)和蛋白质表达(pQTL)以及WGS数据进行了数量性状位点(QTL)分析,发现了显著的QTL调控基因(eGenes)和/或蛋白(pProteins)。在eGenes和pprotein中富集的基因集包括多种免疫途径,如补体和凝血级联、中性粒细胞脱粒和细胞对化学应激的反应(图3G)。
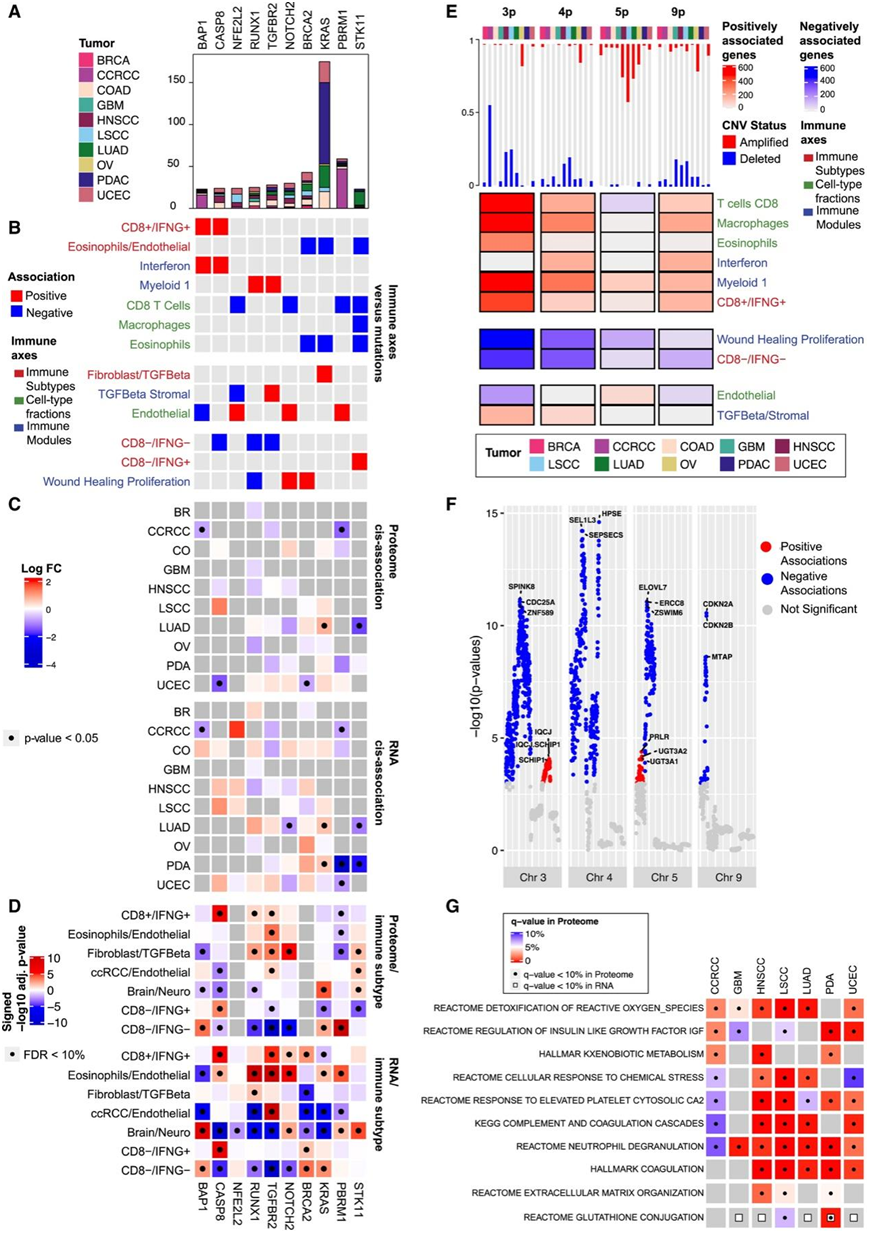
图3. 免疫亚型与 DNA 改变的关联。
(A) 条形图显示按癌症分层的每个基因的突变总数。(B) 基于弹性网回归的突变谱与免疫特征之间的泛癌关联。(B) 基于弹性网回归的突变谱与免疫特征之间的泛癌关联。(D) 热图显示蛋白质/RNA 表达与免疫亚型之间的关联。(D) 热图显示蛋白质/RNA 表达与免疫亚型之间的关联。(F) 曼哈顿图总结了基因级 CNV 数据与选定染色体的伤口愈合增殖模块之间的泛癌关联。(G) 热图显示了每种癌症在 pProtein 和 eGene 组中过度表达的路径。
03
DNA甲基化与免疫亚型的关联
基于基因水平的DNA甲基化(DNAm)数据,他们确定了一系列基因,它们的DNA甲基化与免疫亚型之间存在泛癌症关联(图4A)或癌症特异性关联(图4B)。特别是,在HNSCC中,大量基因的DNA甲基化与CD8−/IFNG−相关。注意,与RNA/蛋白表达与免疫亚型之间的关联相比,DNAm与免疫亚型之间的关联在很大程度上是相反的,因为基因水平的DNAm通常会导致基因和蛋白质表达的下调。
为了研究吸烟对TME的影响是否通过表观遗传改变介导,他们进行了一项中介分析,以确定吸烟相关的DNA对HNSCC、LSCC和LUAD中TME的影响(图4C)。他们关注了160个基因,这些基因的DNAm在泛癌症或癌症特异性分析中显示与免疫亚型相关,并鉴定了69个基因的显著中介效应(图4D)。在69个基因中,有13个基因的DNA与正常肺组织中的吸烟有关(图4D)。该分析中出现的一个感兴趣的基因是PYCR1,其dnAm与LUAD和HNSCC的吸烟特征最显著相关(图4E)。同时,HNSCC、LUAD和LSCC中,CD8+ /IFNG+中PYCR1的DNA水平较高,而CD8−/IFNG−中较低(图4F)。PYCR1的表达可能有助于免疫抑制微环境。总之,这些结果表明吸烟诱导的PYCR1低甲基化在促进这一结果中的作用。
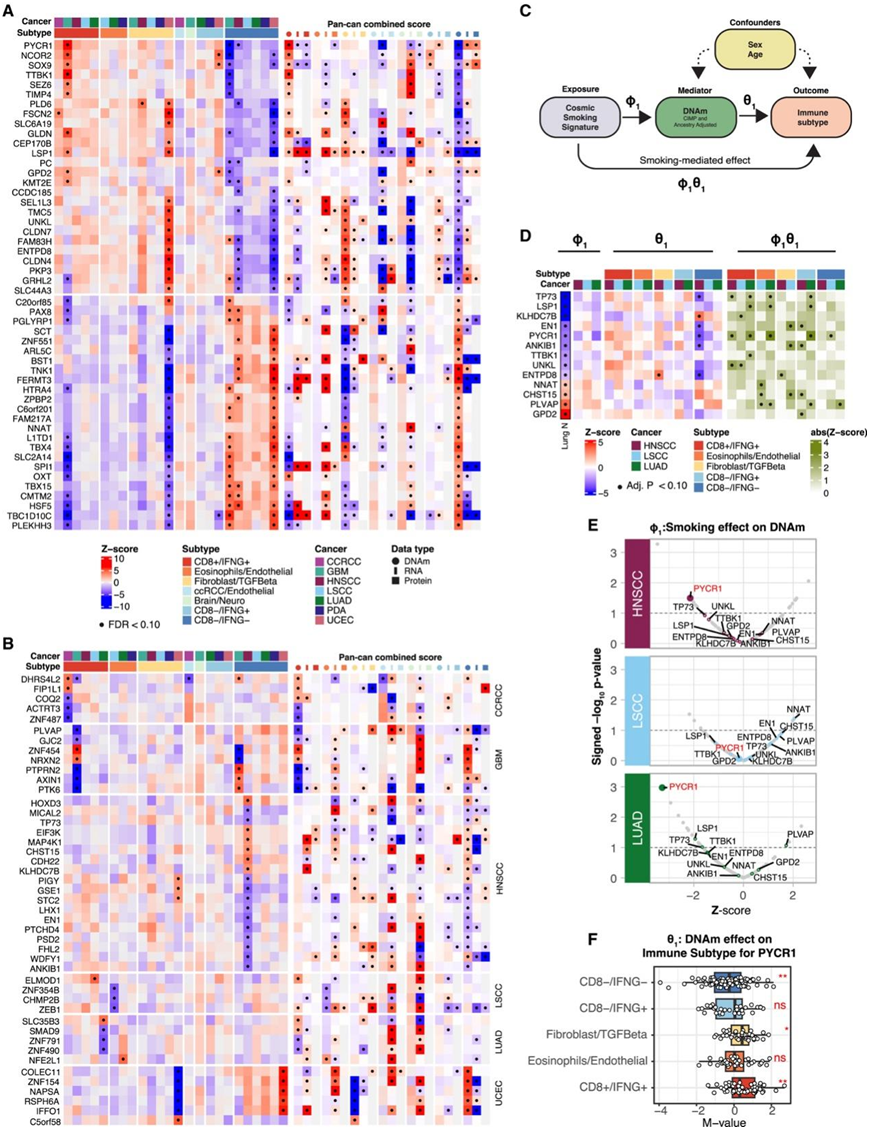
图4. 免疫亚型与DNA甲基化的关联。
(A) 热图说明了一组基因的 DNAm 与免疫亚型的关联,这些基因在至少两种癌症或泛癌分析中表现出显著的关联。(B) 热图显示了 DNAm 与免疫亚型的关联,如 (A) 所示,其中最重要的基因的 DNAm 仅与一种癌症中的免疫亚型相关。(C) 中介分析图。(D) 热图显示了每种癌症中每个基因的三个关联分析:COSMIC 吸烟特征与 DNAm(左)、DNAm 与免疫亚型(中)以及吸烟介导的 DNAm 与免疫亚型(右)的子集具有显著介导作用的基因。(E) 火山图总结了中介分析中考虑的基因子集的 DNAm 和 COSMIC 吸烟特征之间的 Z 得分(x 轴)和关联强度(y 轴)。 (F) 箱线图显示 PYCR1 DNAm 水平在免疫亚型中的分布。
04
不同免疫亚型的激酶激活
磷酸化蛋白质组学数据提供了一个独特的机会来表征不同免疫亚型之间的激酶激活,揭示重要的TME机制,并提示将低免疫原性(冷)肿瘤转变为高免疫原性(热)肿瘤的潜在靶点。基于激酶文库,他们发现CD8+ /IFNG+中上调的磷酸化位点显著富集由MAPKAPK、IKKβ和TBK1调控的底物(图5A)。这组激酶在多种癌症(包括GBM、LSCC和PDAC)的CD8+ /IFNG+肿瘤中发生激活(图5A)。基于生物化学的方法独立鉴定了TBK1的一系列潜在下游靶点,这些靶点富含在高免疫原性肿瘤中上调的磷酸化位点。
另一组在CD8+/IFNG+中活跃的激酶是AKT激酶(图5A)。Ser/thr 激酶 AKT 是 PI3K 信号通路的核心介质,已知在多种癌症的发病机制中发挥关键作用。此外,对于酪氨酸激酶的子集,通过 KEA3 的富集分析揭示了它们在CD8+/IFNG+中的激活(图 5B)。
相比之下,根据激酶库,发现细胞周期蛋白依赖性激酶(包括 CDK1 和 CDK2)在CD8-/IFNG-和 CD8 - /IFNG+中激活(图 5A),这表明这些肿瘤中较高比例的细胞正在活跃增殖。KEA3分析还表明,对于 CCRCC、GBM、HNSCC、LSCC、LUAD 和 PDAC, CD8- /IFNG-中的细胞周期激酶 (CDK1-6) 的激活显著较高(图 5B)。
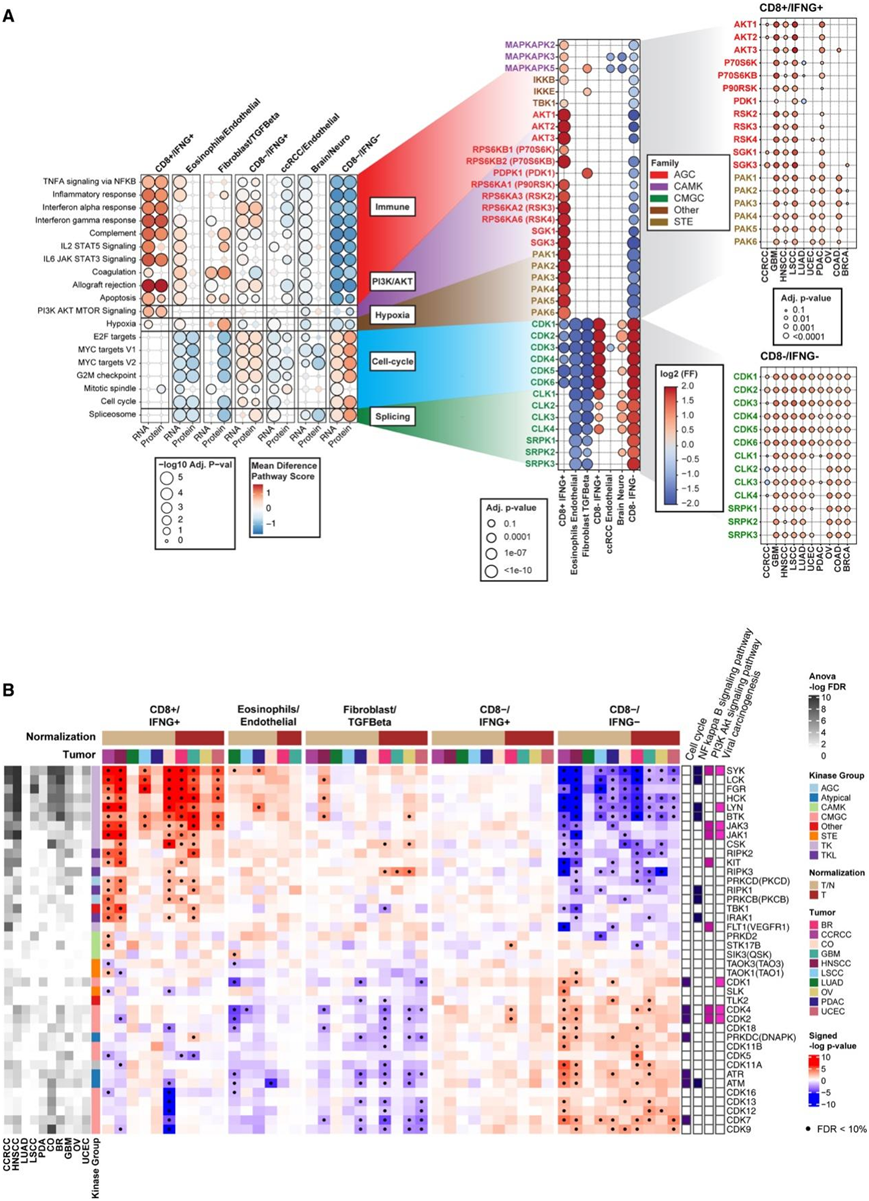
图5. 免疫亚型与激酶活性的关联。
(A) 左:气泡图显示基于 RNA-seq 和蛋白质组学的与不同免疫亚型相关的途径。中:对于每条通路,绘图显示了通过激酶库发现其激活在泛癌水平上跨免疫亚型存在差异的激酶。右:对于一些关键激酶,CD8 + /IFNG +和 CD8−/IFNG−中的癌症特异性激活使用类似的气泡图显示。(B) 热图显示了所选激酶的每种癌症中基于 KEA3 的激酶活性与免疫亚型之间的关联。
05
与免疫亚型相关的激酶和转录因子调控
他们通过应用 ChEA3 得出每个肿瘤样本的转录因子 (TF) 活性评分,基于 CPTAC 泛癌 RNA-seq 数据,并进一步将这些 TF 评分与激酶活性评分相关联,以检测不同免疫亚型中的活跃细胞信号传导调节。具体来说,他们将重点放在CD8+/IFNG(热)和CD8- /IFNG -(冷)上,并计算出一对激酶和TF都发生富集的肿瘤的数量。他们确定了由激酶调节的TF的各种模块,这些激酶对应于热肿瘤或冷肿瘤特有的不同细胞信号通路。重要的是,包括STAT1、STAT5A和CEBPB在内的一组免疫相关TF鉴定为受到具有特定酪氨酸激酶(即LYN和SYK)的免疫模块的正调控,同时受到糖酵解激酶模块的MYO3B和PDK1/3/4的负调控(图6A)。
为了通过计算验证糖酵解激酶模块和免疫TF模块之间的负相关(图6A),他们结合了公开数据集进行分析。首先,他们发现敲除PDK1/3/4和MYO3B可诱导几种细胞背景下先天免疫系统相关基因的表达(图6B)。此外,免疫相关TF模块中的一个关键TF CEBPB已鉴定为共有许多已知的下游靶标,这些靶标是由CRISPR-Cas敲除PDK1/3/4和MYO3B导致的基因特征上调。最后,他们在不同细胞系中观察到CEBPB靶点与PDK1/3/4和MYO3B CRISPR-Cas敲除时上调的基因集之间存在显著重叠(图6B)。这一观察结果强烈提示PDK1/3/4和MYO3B对CEBPB活性具有抑制作用,表明敲除这些糖酵解相关的激酶会导致免疫相关途径的上调。
他们观察到与多种癌症中的热肿瘤细胞和免疫/基质细胞相比,冷肿瘤细胞中酪氨酸激酶(即FYN、LYN和LCK)的激活较低(图6C)。然而,对于 GBM,与热肿瘤细胞和免疫/基质细胞相比,在冷肿瘤细胞中检测到更高的 FYN 激活(图6C)。然而,对于GBM,与热肿瘤细胞和免疫/基质细胞相比,在冷肿瘤细胞中检测到更高的FYN激活(图6C)。在GBM中,FYN在肿瘤细胞中的激活比在免疫/基质细胞中的激活水平更高(图6C-D)。此外,与冷肿瘤细胞和免疫/基质细胞相比,热肿瘤细胞中CDK19、CDK20和PTK2 (FAK)的活化更高(图6C)。
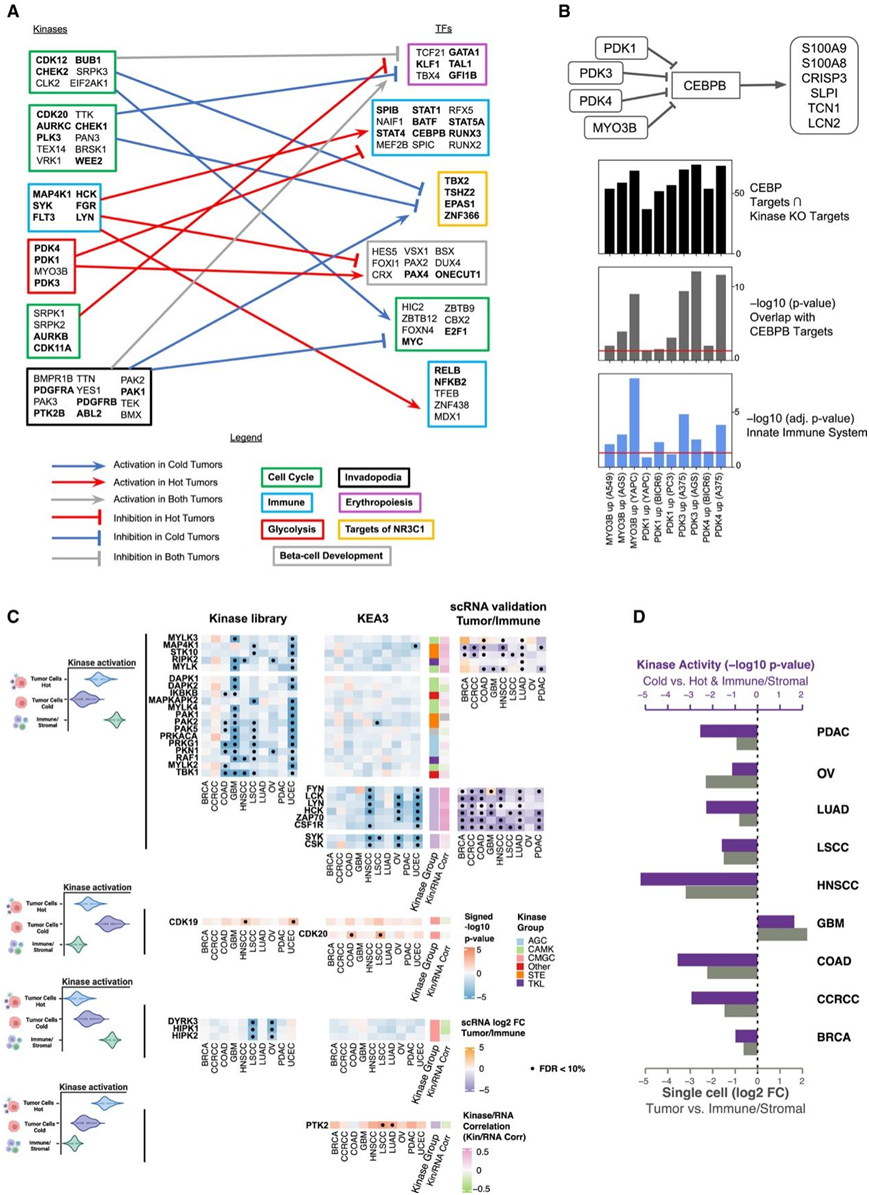
图6. 激酶-TF调节和细胞类型特异性激酶激活。
(A) 来自热肿瘤和冷肿瘤评分前 1% 的激酶-TF 对的激酶-TF 模块。(B) 上:图表描述了所提出的机制。中:条形图(灰色)显示费舍尔精确检验的 p 值,用于检测重叠基因集是否显著大于随机发生的基因集。下:条形图(蓝色)说明了先天免疫系统 R-HSA-168249 Reactome 途径的激酶扰动 L1000 特征的富集。(C) 通过 KEA3 和激酶库激活细胞类型特异性激酶。(D) 不同细胞类型之间 FYN 的差异激酶活性变化(紫色条)以及基于 scRNA 的肿瘤细胞和免疫/基质细胞之间 FYN 基因表达的差异倍数。
06
免疫亚型的组织病理学评估
他们利用数字扫描的肿瘤 H&E 图像来构建用于预测免疫亚型的卷积神经网络模型。由于样本量有限,他们重点区分冷肿瘤(CD8- /INFG-)和热肿瘤(CD8 + /INFG +和嗜酸性粒细胞/内皮细胞),使用 4 倍分割验证构建了 10 个组织特异性模型和一个泛癌模型。还分别评估了每种癌症的泛癌模型。使用受试者工作曲线下面积 (AUC) 的比较性能(图 7A)表明,对于大多数癌症,泛癌模型的表现优于组织特异性模型。
为了直观地检查模型的识别,他们从最后一个卷积层提取潜在特征,并使用tSNE对图像块进行聚类(图7B)。生成的 tSNE 图显示低免疫原性(冷)图块和高免疫原性(热)图块呈对角线分离,没有明显的癌症聚类。细胞类型分数和预测概率之间的相关性表明,已知免疫细胞与预测为高免疫原性(热)的图像之间存在正相关,而与病理检查后的非免疫细胞类型之间存在负相关(图7C)。用细胞类型分数覆盖tSNE图证实了热样品中免疫细胞的含量,以及低免疫原性(冷)样品中非免疫细胞的含量(图7D)。
他们还分析了肿瘤细胞的形态,并使用 Pearson 相关性将其与细胞因子表达特征相关联(图 7E)。在泛癌水平上,肿瘤细胞的面积和大小与细胞因子表达呈负相关,表明炎症细胞因子可能限制肿瘤细胞的生长。
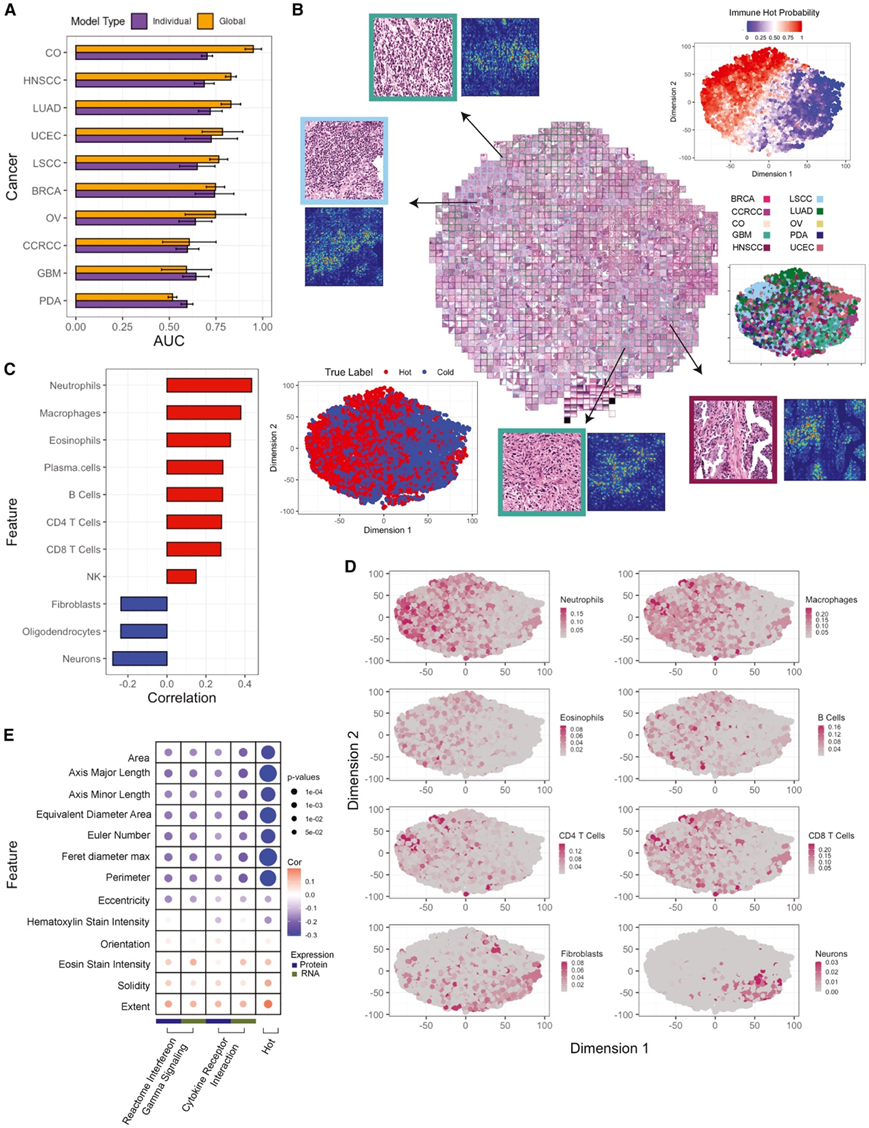
图7. 免疫亚型的组织病理学评估。
(A) 条形图显示根据不同癌症的组织病理学图像预测肿瘤的 AUC。(B) 基于泛癌模型,从倒数第二层提取成像特征并通过 tSNE 聚类进行分离。右上图显示了模型预测分数的分离,左下图根据真实标签进行了颜色编码。(C) 条形图报告细胞类型分数与图像预测概率之间的 Pearson 相关性。(D) tSNE 图用细胞类型分数进行颜色编码。(E) 气泡图显示泛癌水平上细胞形态与细胞因子表达之间的 Pearson 相关性。
+ + + + + + + + + + +
结 论
本项研究使用 CPTAC 泛癌蛋白质组数据全面表征了 10 种不同癌症的 1000 多个肿瘤的免疫状况,根据细胞类型组成和途径活动的综合学习,确定了七种不同的免疫亚型。然后,对与每个亚型相关的独特基因组、表观遗传、转录组和蛋白质组变化进行了彻底分类。进一步利用深度磷酸化蛋白质组数据,研究了不同免疫亚型中的激酶活性,揭示了潜在的亚型特异性治疗靶点。这项工作的见解将促进未来免疫治疗策略的发展,并增强现有药物的精确靶向性。
+ + + + +



 English
English


