文献解读|Cancer Cell(48.8):高级别胶质瘤的多尺度信号传导和肿瘤演变
✦ +
+
论文ID
原名:Multi-scale signaling and tumor evolution in high-grade gliomas
译名:高级别胶质瘤的多尺度信号传导和肿瘤演变
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.07.08
DOI号:10.1016/j.ccell.2024.06.004
背 景
胶质母细胞瘤 (GBM) 和其他高级别星形细胞瘤是最常见和最致命的脑肿瘤之一,尽管进行了数十年的基因组分析,但 5 年生存率仍在 5% 以下,目前仍需对其发病机制进行深入研究。
实验设计
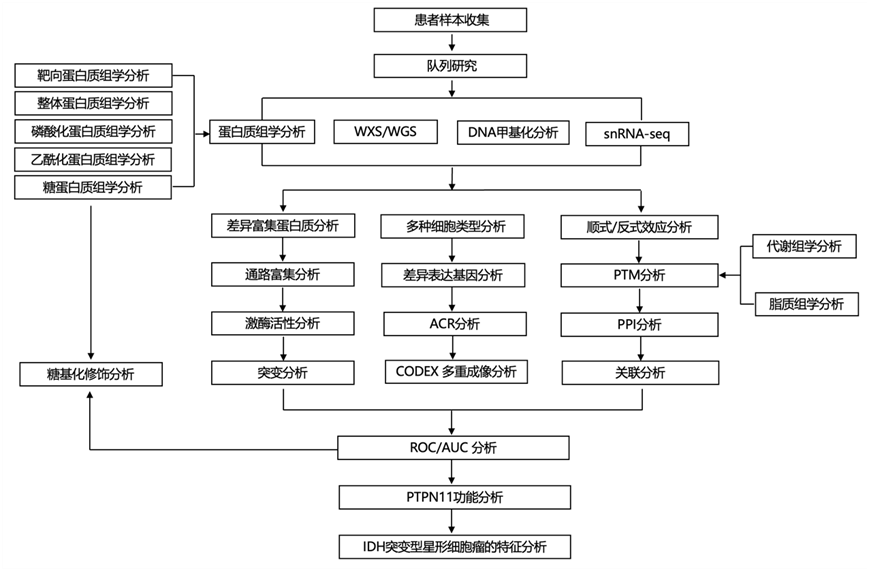
结 果
01
高级别胶质瘤从诊断到复发的演变与基因组和蛋白质组驱动因素有关
研究团队收集了 200 例高级别胶质瘤 (HGG) 患者的 228 个肿瘤样本以及 25 例患者纵向队列中的 18 个正常脑样本、14 个脑转移瘤的切除样本,并进行了多组学分析(图 1 A),包括 WXS(全外显子组测序)、WGS (全基因组测序)、DNA 甲基化、miRNA、mRNA、snRNA-seq (单细胞核转录组分析)、蛋白质组、磷酸化蛋白质组、乙酰化组、糖蛋白质组、选择反应监测 (SRM)、PRISM (高压、高分辨率智能选择和多路复用分离)-SRM、IMAC(固定化金属亲和色谱)-SRM、代谢组和脂质组分析(图 1 B),这使得他们能够研究肿瘤复发时的蛋白质组变化,以及共有和独特的分子特征和翻译后修饰 (PTM) 事件(图 1 C)。
他们分析了从 25 名 4 级异柠檬酸脱氢酶-野生型 (IDH-WT) (GBM)和 IDH 突变型星形细胞瘤(无进展生存期 1 个月至 4 年)(图 2 A)患者中采集的 53 个肿瘤样本的纵向队列,以确定复发性肿瘤中差异表达的蛋白质(图 2 B)。蛋白质丰度变化与 RNA相关,并且大多数病例都具有最高的差异富集的蛋白质。通路分析揭示了,复发时上调的蛋白质在氧化磷酸化、活性氧和肌肉生成相关等通路中富集;复发时下调的蛋白质在细胞周期、MYC 靶标和 DNA 修复通路中富集。
他们利用激酶库(包含三百多种丝氨酸/苏氨酸激酶的底物特异性图谱)基于差异调节的磷酸化位点探索了复发性肿瘤与原发性肿瘤中的激酶活性(图 2D)。与转录组数据一致,CLK1-4 和 SRPK1-3 等剪接激酶在原发性肿瘤中的活性更高(图 2 E)。此外,酪蛋白激酶 2 (CK2) 家族(CK2A1 和 CK2A2)和 G 蛋白偶联受体激酶 (GRK) 家族 (GRK1-7) 成员在原发性肿瘤中表达更高,表明 G 蛋白偶联受体 (GPCR) 信号在肿瘤进展中发挥作用。相反,c-Jun N 端激酶 (JNK) 家族通常在炎症和缺氧等应激条件下发生激活,在复发性肿瘤中上调。
为了研究肿瘤基因进化,他们检测了每对原发-复发肿瘤中的突变变化(图 2 A),计算了所有突变的变异等位基因频率 (VAF),并观察了每对肿瘤中共有和独特的突变,他们观察到了四种模式:驱动突变的稳定、缺失、获得和恢复(图 2 F),进展时间较短的患者在原发性肿瘤和复发性肿瘤之间有更多共有突变(图 2 G)。克隆相似性与进展时间呈负相关,表明复发性肿瘤从其原发性肿瘤不断演变(图2G)。原发性和复发性肿瘤的突变特征分析确定了两个主要特征:SBS1 和 SBS11,它们与年龄和替莫唑胺 (temozolomide, TMZ) 治疗相关,。SBS1 与患者年龄呈正相关(图2H)。该患者的原发性肿瘤和复发性肿瘤显示出不同的突变谱,复发性肿瘤中有 4439 个突变,而原发性肿瘤中有 68 个突变,包括POLE、MSH2和MSH6的突变。在 GSAM 和 GLASS 队列中,在接受 TMZ 治疗的一部分患者中也观察到了这种具有高 SBS11 特征的超突变,但在未接受 TMZ 治疗的患者中未观察到(图 2 H)。SBS11 相关的高突变与低级别胶质瘤向高级别转化有关,他们在复发性 4 级星形细胞瘤中也发现了该特征。
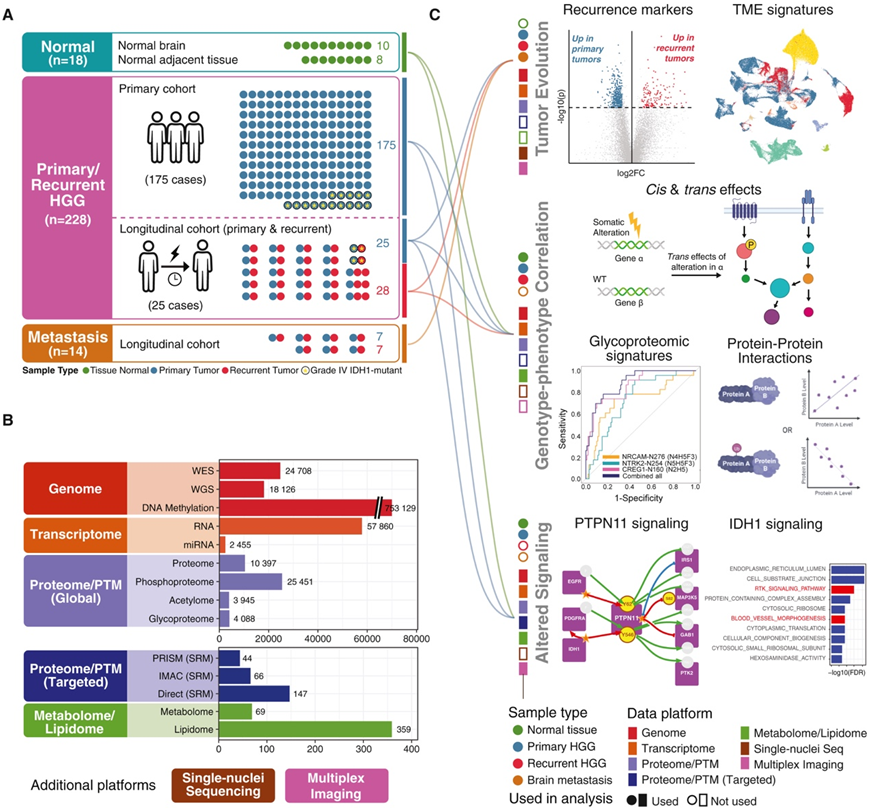
图1. 研究队列和实验流程概述。
(A) 队列概述。(B) 在 14 个数据平台上分析的特征。(C) 每次分析中使用的子队列。
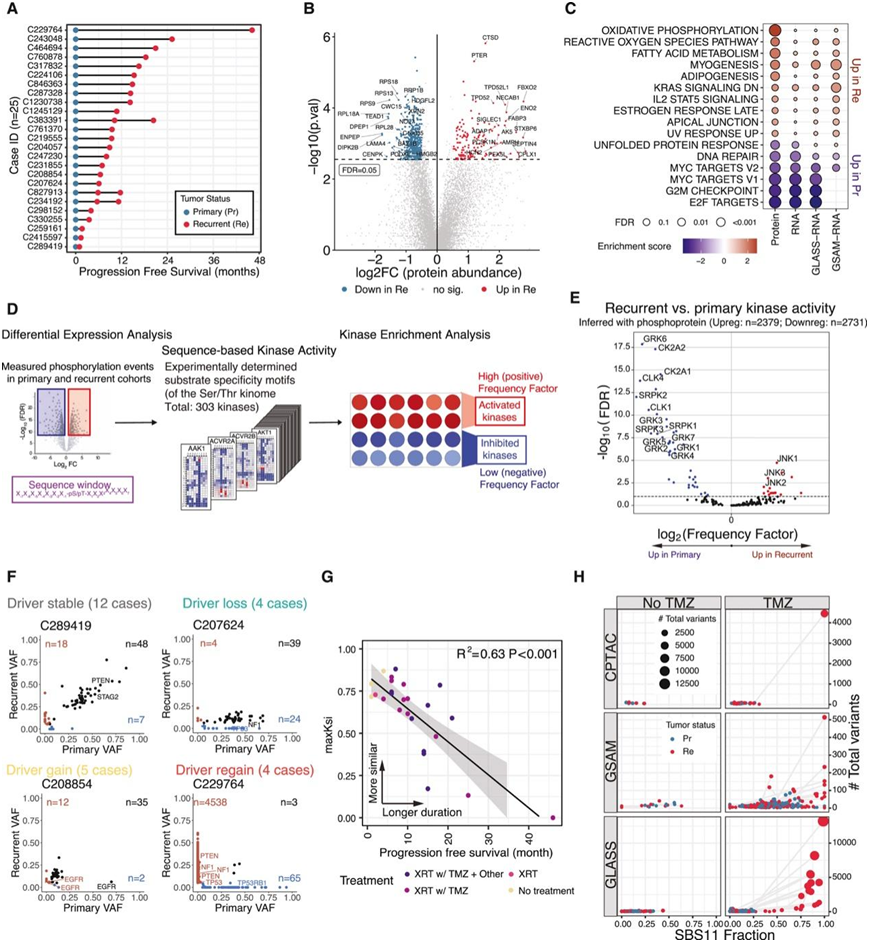
图2. 肿瘤进化的蛋白质组学分析。
(A) 25 名 4 级星形细胞瘤患者的原发性和复发性肿瘤样本采集。(B) 复发性肿瘤和原发性肿瘤之间差异富集的蛋白质。(C) 本研究队列以及 GLASS 和 GSAM 队列中的差异富集通路。(D) 激酶库富集分析的工作流程。(E) 激酶富集分析的工作流程。 (F) 变异等位基因频率 (VAF) 相关图,表明观察到的 4 种驱动突变进展模式。(G) 基于体细胞突变,无进展生存期与肿瘤克隆相似性统计数据(MaxKsi)呈负相关。(H) 具有 SBS11 特征的体细胞突变比例与每个肿瘤样本中体细胞突变总数之间的关系,按患者在复发性肿瘤采集前是否接受 TMZ 治疗分类。
02
原发性和复发性高级别胶质瘤的内在特征和肿瘤微环境 (TME) 相关特征
他们对 10 个原发性和复发性 HGG 对(以 134K 细胞核为代表)进行了 snRNA-seq。原发性和复发性胶质瘤的 snRNA-seq 谱差异很大,一个极端病例(患者C229764)表现出与原发和复发性样本明显不同的肿瘤细胞聚类(图 3 A)。从转录本中检测到的RB1和MSH6突变进一步证明了驱动突变的转变,这些突变分别是患者原发性和复发性肿瘤细胞所特有的(图 2 F)。为了了解特定细胞类型如何导致差异富集蛋白质(图 2 B),他们计算了每种细胞类型的平均转录表达(图 3 B),在不同的细胞类型中,包括恶性细胞、免疫细胞和基质细胞,都存在大量上调和下调的蛋白质(图 3 B)。为了研究恶性细胞的转录变化,他们对原发性肿瘤和复发性肿瘤中的恶性细胞在队列水平和患者水平进行了差异表达分析。原发性恶性细胞和复发性恶性细胞之间的差异表达基因 (DEG) 在上皮-间质转化、紫外线反应、雄激素反应和缺氧通路中富集(图 3 C),并且这些DEG都存在于这些患者中(图 3 D)。他们鉴定出 78787 个可及染色质区域 (ACR),并且69% 的 ACR未曾报道过(图3D)。在NDRG1 和 KIF1B 等基因启动子和增强子区域之间的差异可及染色质区域 (DACR) 表明复发性恶性细胞中存在潜在的表观遗传调控(图 3E),基序富集分析表明复发时的转录因子活性存在差异(图 3F)。原发性恶性细胞中的转录因子 NRF1、Sp/KLF 和 E2F 表现出更高的活性,这些因子与代谢活跃和增殖状态有关。复发性恶性细胞中的 SOX4、SOX10 和 HIF1A 中表现出活性,表明治疗后细胞向干细胞样状态转变。比较复发性肿瘤和原发性肿瘤,结果显示复发性肿瘤中内皮细胞和 1 型 T 辅助细胞 (Th1) 的富集评分显著降低,调节性 T 细胞 (Treg) 显著增加(图 3 G)。对纵向肿瘤样本进行的 snRNA-seq 和蛋白质反卷积数据也证明内皮细胞的减少(图 3 H)。对 12 个样本进行索引联合检测 (CODEX) 多重成像显示了脑内的主要细胞类型(图 3 I)。全载玻片定量显示复发时 6 名患者中有 5 名的内皮细胞比例低于所有非恶性细胞(图 3 J)。总之,复发性高级别胶质瘤表现出恶性细胞的转录和表观遗传变化以及 TME 重塑。
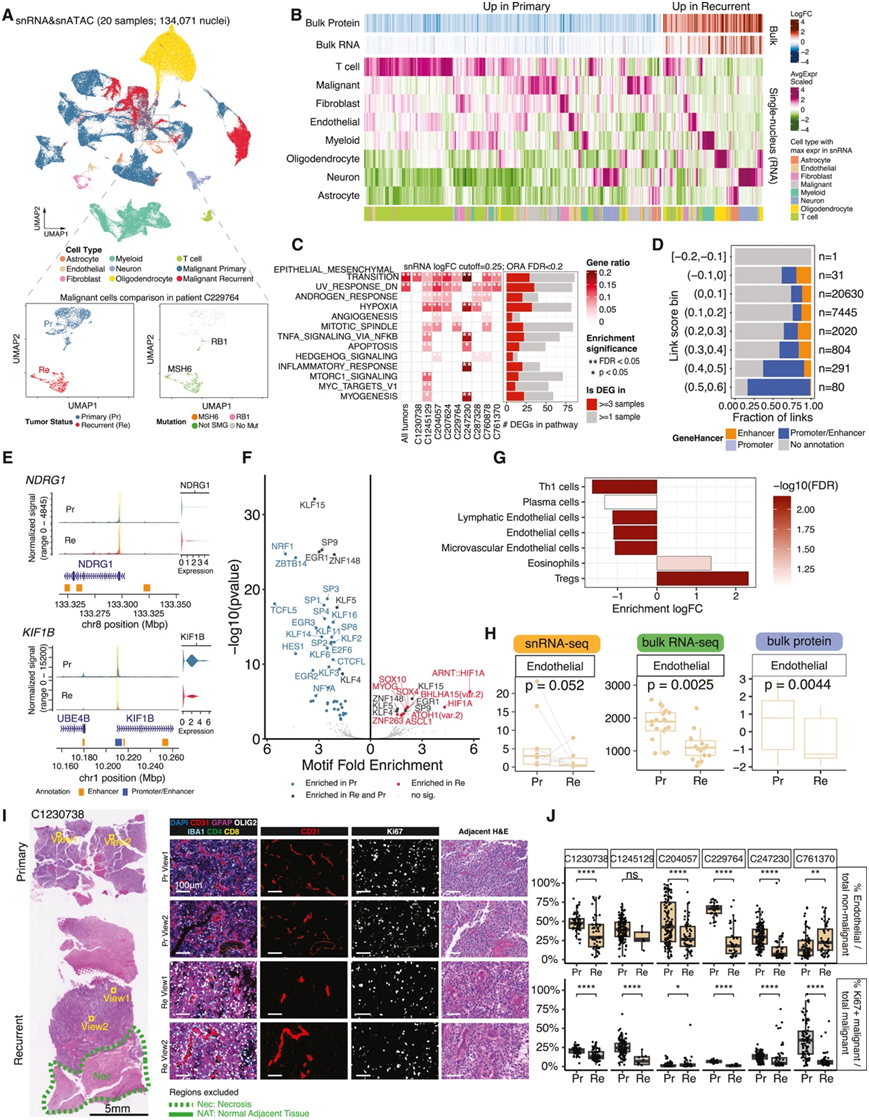
图3.复发性 4 级星形细胞瘤中的恶性细胞内在和肿瘤微环境 (TME) 相关特征。
(A)UMAP可视化。(B) 热图显示复发性肿瘤和原发性肿瘤之间差异丰度蛋白质的平均 snRNA 表达。(C) 复发性肿瘤中的恶性细胞内在失调通路。(D) 可及染色质区域 (ACR) 可及性与恶性细胞中基因表达之间的相关性分布。(E) 两个基因在原发性恶性细胞和复发性恶性细胞中的染色质可及性和。(F) 差异化 ACR 中的基序富集。(G) 复发性肿瘤和原发性肿瘤之间的 TME 细胞类型组成。(H) 复发性肿瘤中总肿瘤微环境群体的内皮细胞组成减少。 (I) 三对原发性复发性肿瘤的多重免疫荧光结果(CODEX)。(J)原发-复发匹配肿瘤切片中的内皮细胞和 Ki67+ 恶性细胞的比例。
03
基因改变对 HGG 蛋白质组学和代谢组学的影响和关联
他们在队列中发现了 13 个高度改变的驱动基因,观察到EGFR和PTPN11变异的相互排斥性(图 4 A)。在顺式分析中,肿瘤抑制基因,如ATRX和RB1,在基因改变时表现出相对较低的 RNA 和蛋白质表达,而致癌基因,如EGFR和PDGFRA则显示出其 RNA 和蛋白质水平升高(图 4 B)。PTM 分析表明,当发生改变时,ATRX 的S784 处表现出磷酸化增加,而突变体 IDH1 的K224 处表现出乙酰化降低(图 4 B)。虽然表皮生长因子受体 (EGFR) 的改变与 Y316 处磷酸化的轻微增加有关,但 N603 处的 N2H8F0S0G0 糖基化是EGFR 中最强的顺式PTM 效应(图 4 B)。他们将反式效应分为两大类,第一类包括对蛋白质和PTM的影响;第二类包括对脂质组和代谢组的影响(图4C)。在蛋白质/PTM中表现出一致性的驱动因子对,在其对脂质和代谢物的影响上也表现出相同的正相关性(图4D)。在所有研究的驱动对中,TERT和PTEN改变对蛋白质和 PTM的反式效应呈现出最强的相关性(图 4 E)。
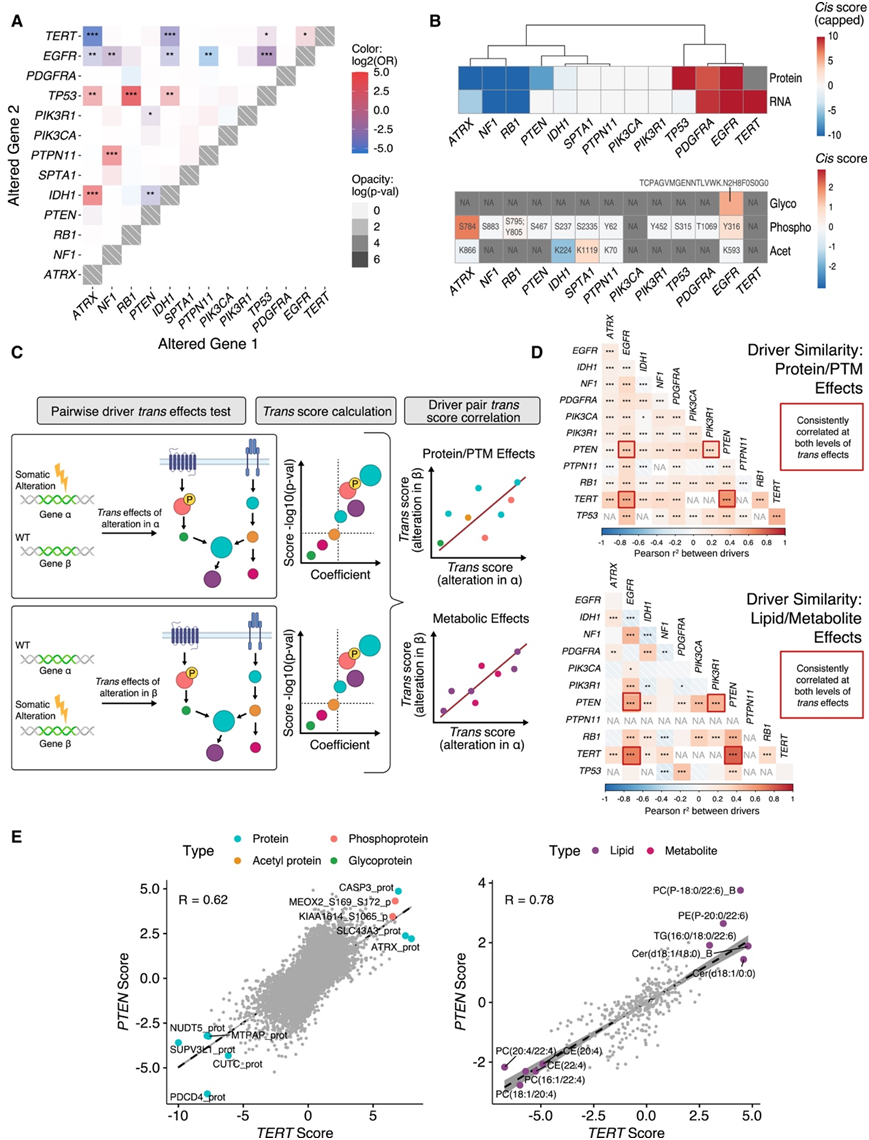
图4.不同组学水平上原发性肿瘤之间的相似性。
(A) 体细胞变异互斥性分析。(B) 13 种常见驱动因子的顺式效应,展示了基因改变如何影响其自身的 RNA 和蛋白质以及翻译后变化。 (C) 反式分析:体细胞改变基因对其他蛋白质、翻译后修饰 (PTM)、代谢物和脂质水平的影响。 (D) 在蛋白质/PTM 和脂质/代谢物水平上评估驱动基因相似性得分。(E) TERT和PTEN效应在蛋白质/PTM 水平和脂质/代谢物水平之间的反式评分的 Pearson 相关性。
04
EGFR 活性中的糖基化和磷酸化与肿瘤复发之间的关系
他们对整个队列进行了定量糖蛋白质组学分析,结果显示,与正常脑样本相比,4 级星形细胞瘤中有 671 个 N 连完整糖肽 (IGP) 上调,674 个IGP 下调(图 5 A)。大多数上调的 IGP 源自与 ECM 受体相互作用或补体和凝血级联相关的糖蛋白(图 5 A)。他们根据已鉴定糖肽的单糖组成研究了糖类型:寡甘露糖 (High-Man)、岩藻糖基化糖 (Fucose)、唾液酸化糖(Sialic) (包括仅唾液酸化和唾液酸化+岩藻糖基化糖)以及不属于前三类的糖 (Others)。大多数上调的 IGP含有 High-Man 糖,而下调的 IGP 大多是岩藻糖基化的(图 5B)。聚糖的合成和与糖蛋白的结合受糖基化酶的调控,提示异常表达的酶可能是潜在的治疗靶点。在本研究队列中,与正常组织相比,STT3A、STT3B、GANAB 和 PRKCSH 的过表达与原发性肿瘤有关(图 5C)。STT3A 和 STT3B 是 OST 复合物的催化亚基,参与将 Glc3Man9GlcNAc2 前体从脂质连接寡糖转移到新生多肽上的 NXS/T 基序。GANAB 和 PRKCSH 负责修剪前体中最内层的两个 α1,2-Glc 残基,以产生 Man9GlcNAc2,并从 ER 中释放 N 连接糖蛋白。这些糖基化酶的上调表明高级别胶质瘤中 N 连接糖基化的增加。
他们利用糖蛋白质组学数据来鉴定潜在的复发性 HGG 相关糖蛋白。与原发性肿瘤相比,复发性肿瘤中过表达的 IGP 大多是High-Man或岩藻糖聚糖,这些糖蛋白参与调节神经元投射发育和中性粒细胞介导的免疫相关通路(图 5 D)。他们鉴定出四种糖蛋白(CNTN2、NPTN、ASAH1 和 NFASC),它们的糖基化活性升高,可能与复发性肿瘤的整体表达有关。这些糖蛋白的丰度通过受试者工作特性 (ROC) 分析成功区分了复发性肿瘤和原发性肿瘤 (图 5 E)。ASAH1 和 CNTN2 组合的曲线下面积 (AUC) 为 0.83,这两种糖蛋白都与中性粒细胞介导的免疫有关。此外,他们在 IGP 水平(而非整体水平)上检测了复发性肿瘤(相对于原发性肿瘤)中糖基化活性增加的糖蛋白。三种 IGP:NRCAM-N276 (N4H5F3)、NTRK2-N254 (N5H5F3) 和 CREG1-N160 (N2H5) 可区分复发性肿瘤和原发性肿瘤(图 5 E)。
接下来,他们重点关注原发性肿瘤,利用具有三个完整糖肽聚类 (IPC 1-3) 的肿瘤的无偏糖蛋白质分组 (IPC 1–3) 定义了三种糖蛋白质亚型 (Glyco 1-3)。Glyco 1 与 IPC 2 相关,其特征是轴突发育和神经元投射引导(图 5 F)。此外,Glyco 1 中的肿瘤与原神经亚型相关。Glyco 2 与经典亚型相关,而 Glyco 3 与间充质亚型相关。Glyco 3 与 IPC 1 相关,后者主要含有唾液酸聚糖,与细胞外结构组织和急性炎症反应有关(图 5 F)。
他们分析了在这一队列中观察到的最常见的EGFR体细胞突变(A289和G598)、显著上调的磷酸化事件(Y316)以及N352和N603的糖基化之间的空间关系。EGFR 二聚体上的修饰可视化表明 Y316 残基位于两个 EGFR 分子胞外域之间的界面上(图 5G)。此外,G598 突变与 N603 糖基化共定位,两者都发生在蛋白质跨膜 α 螺旋前约 47 个氨基酸处,并且 N603 与 EGFR 的自抑制系链相互作用有关。当映射到结构上时,N352 糖基化位点距离 A289 突变有 58 个氨基酸,并且与 EGF 和西妥昔单抗 (cetuximab) 的结合位点相邻(图5G)。糖基化位点 N352 对于 EGFR 维持其功能构象以允许 EGF 结合至关重要(图 5G)。
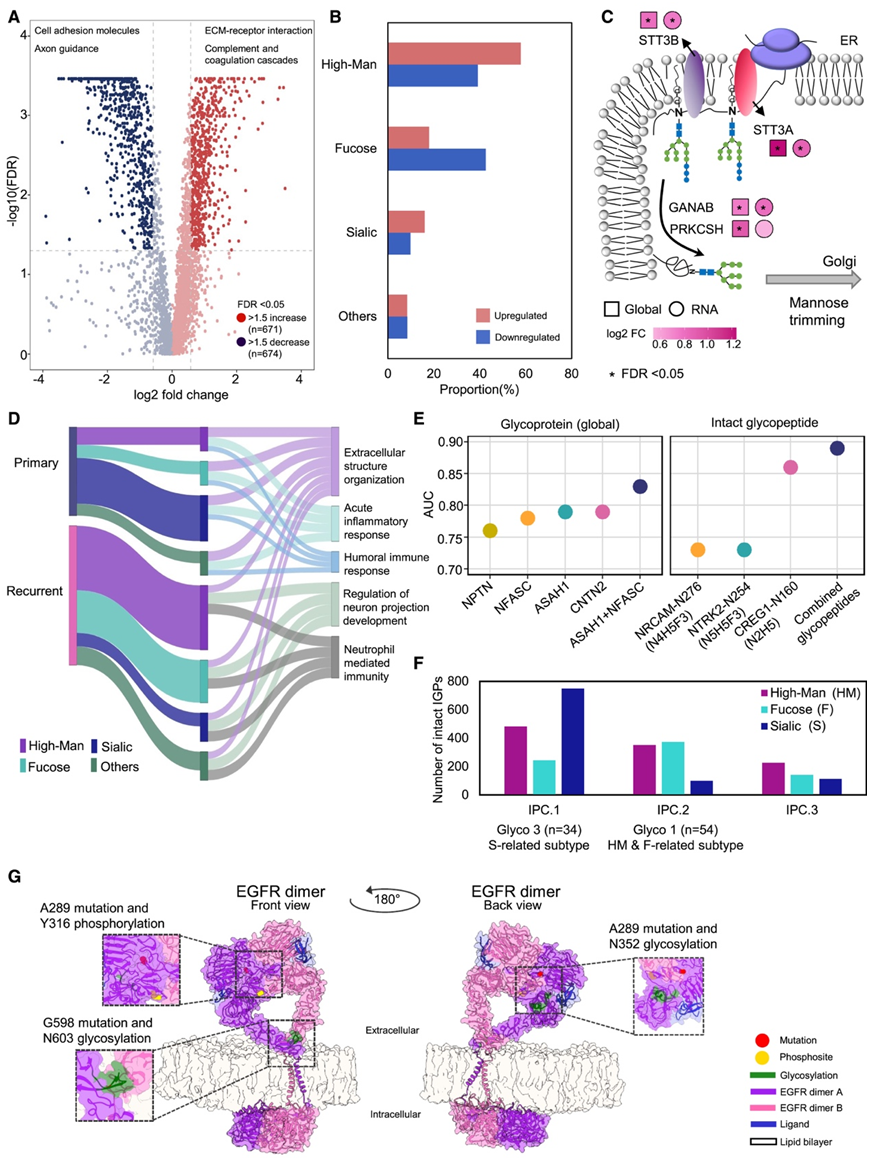
图5. 4 级星形细胞瘤中改变的糖基化程序以及 EGFR 上的体细胞突变、糖基化位点和磷酸化位点之间的拓扑关系。
(A) 4 级星形细胞瘤中改变的糖基化程序以及 EGFR 上的体细胞突变、糖基化位点和磷酸化位点之间的拓扑关系。(B) 基于原发性肿瘤(与正常脑相比)中上调/下调的完整糖肽的聚糖类型分布。(C) 基于原发性肿瘤(与正常脑相比)中上调/下调的完整糖肽的聚糖类型分布。(D) 复发性 4 级星形细胞瘤与原发性肿瘤相关的聚糖类型分布和生物过程。(E) 潜在生物标志物的糖蛋白和 IGP 的 AUC 。(F) 与糖蛋白质组亚型相关的完整糖肽聚类 (IPC) 的聚糖类型分布。(G) EGFR 二聚体,展示了体细胞突变、磷酸位点和糖基位点之间的空间关系。
05
蛋白质-蛋白质相互作用分析
接下来,他们进行了蛋白质-蛋白质相互作用(PPI)分析(图6A)。原发性肿瘤中的基线计算表明,蛋白质亚基和其他已知关联的蛋白质(例如 PIK3R1 和 PIK3CA)之间存在强烈的正相关性,而其他蛋白质(例如 PKN2 和 PDPK1)之间存在负相关性(图 6 A)。为了确定 PPI 畸变在 HGG 中的可能作用,他们检测了基因改变和 WT 原发性肿瘤编码的蛋白质之间的相关性差异,然后在匹配的原发性和复发性肿瘤中进行类似评估。总体而言,他们发现了EGFR和血小板源性生长因子受体α(PDGFRA)信号通路内许多潜在的相互作用发生中断。(图 6 B)。体细胞改变(包括突变)会破坏 PPI,进而导致致癌表型。在体细胞改变的样本中,14 种蛋白质关系表现出显著异常的相关性,其中一半涉及与 EGFR 的相互作用(图 6C)。对 RB1-MDM4 和 PTPN11-IRS1 的进一步分析表明,在原发性肿瘤中,RB1和PTPN11的变化与其相互作用的蛋白之间有很强的负相关,这表明这些蛋白质的突变会破坏它们的相互作用(图6D)。
使用类似的PPI分析,他们检测了相互作用的蛋白质在原发性和复发性样本之间是否表现出相关性的变化。重点关注涉及至少一个癌症驱动基因的PPI,他们选择了三个蛋白质相互作用组:在原发性肿瘤中相关但在复发性肿瘤中不相关的PPI,在原发性和复发性肿瘤中均相关的PPI,以及在复发性样本中相关但在原发性样本中不相关的PPI(图6E),确定了85种与复发状态相关的显著致癌相关PPI,包括在原发和复发肿瘤组中均高度相关的PPI。虽然 RB1 和 CDK2 蛋白丰度在原发性肿瘤样本中没有显著相关性,但它们在复发性肿瘤中具有强烈相关性(图 6 F)。类似地,AKT1 和 XIAP 蛋白丰度在复发性肿瘤中高度相关,但在原发性肿瘤中则不相关(图 6 F)。相比之下,其他蛋白质对,例如 TP53 和 UBE2I 或 EGFR 和 NUMBL,在原发性样本中显著相关,而在复发性肿瘤中则不存在关联。这些结果表明,复发性肿瘤可能会与其原发肿瘤有所不同,这种差异可能是由于蛋白质相互作用的变化,可能反映了治疗抗性的表型。
接下来,他们通过比较突变和野生型肿瘤中五个改变基因的磷酸化位点,研究了基因改变如何影响其自身同源蛋白以外的信号通路(图 6G)。虽然一些突变激活了类似的激酶,但探测人类激酶组的完整图谱揭示了不同突变环境下不同的激酶活性模式。例如,RB1和TP53同时突变的肿瘤表现出 PI3K-AKT 通路的激活。TP53突变型肿瘤显示细胞周期相关激酶 (CDK1-6) 的激活,而与各自的 WT 肿瘤相比,RB1突变型肿瘤显示出这些激酶的激活较少(图 6G)。PI3K-AKT 通路在EGFR改变的肿瘤中活性较低。虽然CDKN2A突变的肿瘤表现出CDK1-6和 ERK 激酶的活性较高,但EGFR突变的肿瘤表现出 ERK 激酶的活性较低(图 6 G)。当比较不同突变对细胞信号传导的影响时,可以在整个激酶组中检测到其他常见和不同的活性模式。
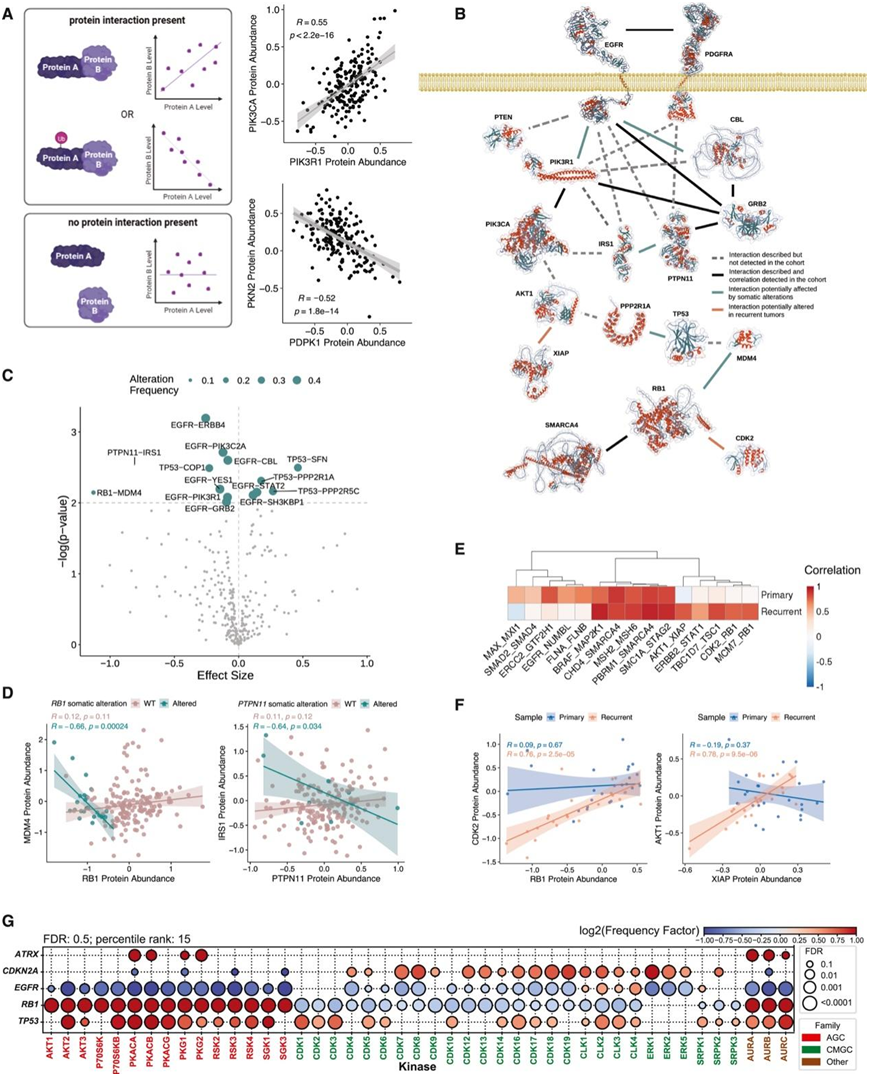
图6. 蛋白质-蛋白质相互作用 (PPI) 差异与体细胞改变和复发状态相关。
(A) 蛋白质相互作用相关性示意图和丰度相关性分析。(B) EGFR 和 PDGFRA 信号通路中的 PPI。(C) 当一个蛋白质伴侣发生体细胞改变时,原发性肿瘤中的14 种 PPI 发生显著改变。(D) 当一个蛋白质伴侣发生体细胞改变时,原发性肿瘤中的14 种 PPI 发生显著改变。(E) 原发性和复发性肿瘤中表现出相关性的蛋白质子集。(F) 复发和匹配的 4 级星形细胞瘤中的 RB1 和 CDK2 蛋白丰度 Pearson 相关性(左)。复发和原发样本中的 XIAP 和 AKT1 蛋白丰度 Pearson 相关性(右)。(G) 使用激酶库对与 WT 肿瘤相比差异丰富的磷蛋白进行分析,基因体细胞突变(y 轴)对激酶活性(x 轴)的影响。
06
PTPN11 可能作为 EGFR、PDGFRA 和 IDH1 信号传导的网络中枢
PTPN11 可能作为 EGFR、PDGFRA 和 IDH1 信号传导的网络枢纽。在本研究中,他们在 11 名患者(约 6%)中发现了PTPN11突变,在 1 名患者中发现了PTPN11扩增(图 7 A)。PTPN11突变与EGFR变异互斥(图 7 A),它们位于 N 端 src 同源性 2 (N-SH2) 和激酶磷酸酶 (PTP) 结构域(图 7 B)。Y62 磷酸位点和 A72T、E76K、R498W、G503A、G506P、T507K 和 Q510L 突变位于 PTP 和 N-SH2 结构域之间的分子内相互作用位点(图 7 B),它们可以调节 PTP 催化位点。突变可能会破坏这种相互作用,并将 PTPN11 从抑制状态转变为活性状态。此外,顺式和反式效应分析显示IDH1突变肿瘤中 PTPN11-Y546 磷酸化程度高(图 7C)。IDH 突变肿瘤表现出高 PDGFRA 蛋白丰度,而PDGFRA蛋白水平的升高与PTPN11-Y546的高磷酸化有关,从而导致IDH1突变肿瘤中PTPN11-Y546的高磷酸化,但是PTPN11的突变并不影响其Y62和Y546的磷酸化水平(图7 C)。
Y62 磷酸化与 PI3K/AKT 通路活性降低以及 ERK 激酶活性降低有关,而 Y546 与 ERK 活性密切相关,PI3K/AKT 激酶活性不强,表明 MAPK 通路存在另一种激活(图 7 D)。Y546(而非 Y62 )的磷酸化与缺氧相关激酶(AMPKA 和 AMPK 相关激酶)活性下降显著相关(图 7 D)。PTPN11-Y546 磷酸化与IDH1突变相关(图 7C),与IDH1-WT肿瘤相比,IDH1突变肿瘤表现出较少的缺氧和细胞应激反应(图 7C-F)。超过60%的高级别星形细胞瘤通过PTPN11基因突变或PTPN11磷酸化的改变,形成以PTPN11为中心的信号传导中心,这表明PTPN11不同的磷酸化位点可能在调控过程中起着不同的作用。
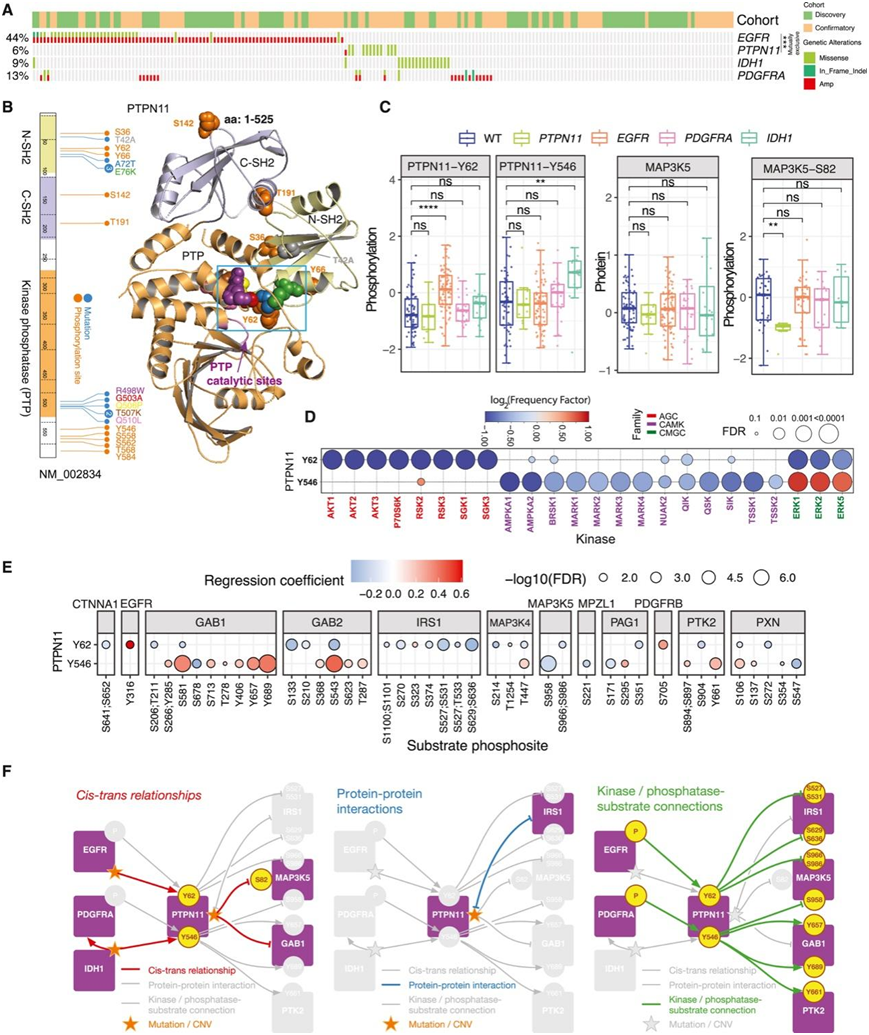
图7. 4 级星形细胞瘤中的 PTPN11 信号枢纽。
(A) 原发性 HGG 中的 PTPN11 、 EGFR 、 IDH1 和 PDGFRA 变异状态。(B) PTPN11突变和观察到的磷酸化映射到 3D 蛋白质结构上。(C) 磷酸化残基和驱动突变的顺式/反式分析。(D) 具有 PTPN11-Y62 和 PTPN11-Y546 磷酸化事件的样本中的激酶活性。(E) PTPN11-Y62 和 PTPN11-Y546 磷酸化的激酶底物分析。(F) 顺式和反式效应、PPI 和激酶/磷酸酶底物测量的分析揭示了多种可能受 PTPN11 调控的蛋白质。
07
IDH 突变型 HGG 中与 RTK 激活和失调缺氧信号相关的代谢酶/通路
他们在队列中发现了 15 个 p.R132H 和 1 个 p.R132C 突变事件(图8A)。差异甲基化和代谢物丰度分析发现,IDH 突变肿瘤中有三种代谢物丰度上调:2-羟基戊二酸 (2-HG)、3-磷酸甘油和肌醇(图 8 A)。与 GBM 相比,IDH 突变肿瘤有 7914 个甲基化位点上调,134 个甲基化位点下调(图8A)。与 GBM 相比,IDH 突变肿瘤中差异富集的蛋白质参与了众多失调通路,包括癌症相关的 RTK 和血管形态发生(缺氧)通路(图 8 A)。 RTK 信号蛋白(包括 CSF1R、MAPK1、PDGFRA、PLCB1、PRKCB、PTPN11 和 SMOC2)在 IDH 突变样本中显著上调(图 8 B)。
蛋白质组学整合显示,IDH 突变型肿瘤的缺氧特征低于 GBM(图 8C)。IDH 突变型肿瘤的缺氧特征与正常组织和正常邻近组织 (NAT) 相当。HIF1A 通路基因(包括ANXA1、COL5A1、FN1、SERPINE1、SLC13A3和VEGFA)在 IDH 突变型肿瘤中持续表现出低表达(图 8C)。利用STRING 进行蛋白质相互作用分析,发现了这些HIF1A通路成员之间的正相关性(图 8D)。HIF1A的抑制因子HIF1AN (FIH-1) ,在IDH突变型星形细胞瘤中表达上调。IDH突变星形细胞瘤和NAT切片进行了CODEX分析,发现SERPINE1在IDH-WT中高表达,但在IDH-突变肿瘤中没有(图8E)。
与 GBM 相比,IDH 突变肿瘤的 AMPKA 和 AMPK 相关激酶活性明显较低(图 8 F)。此外,IDH 突变星形细胞瘤中免疫相关激酶(TBK1 和 IKKE)的活性较低,而 TNIK 的活性较高, TNIK 是一种参与调节神经元树突延伸和神经元信号传导的激酶(图 8 F)。
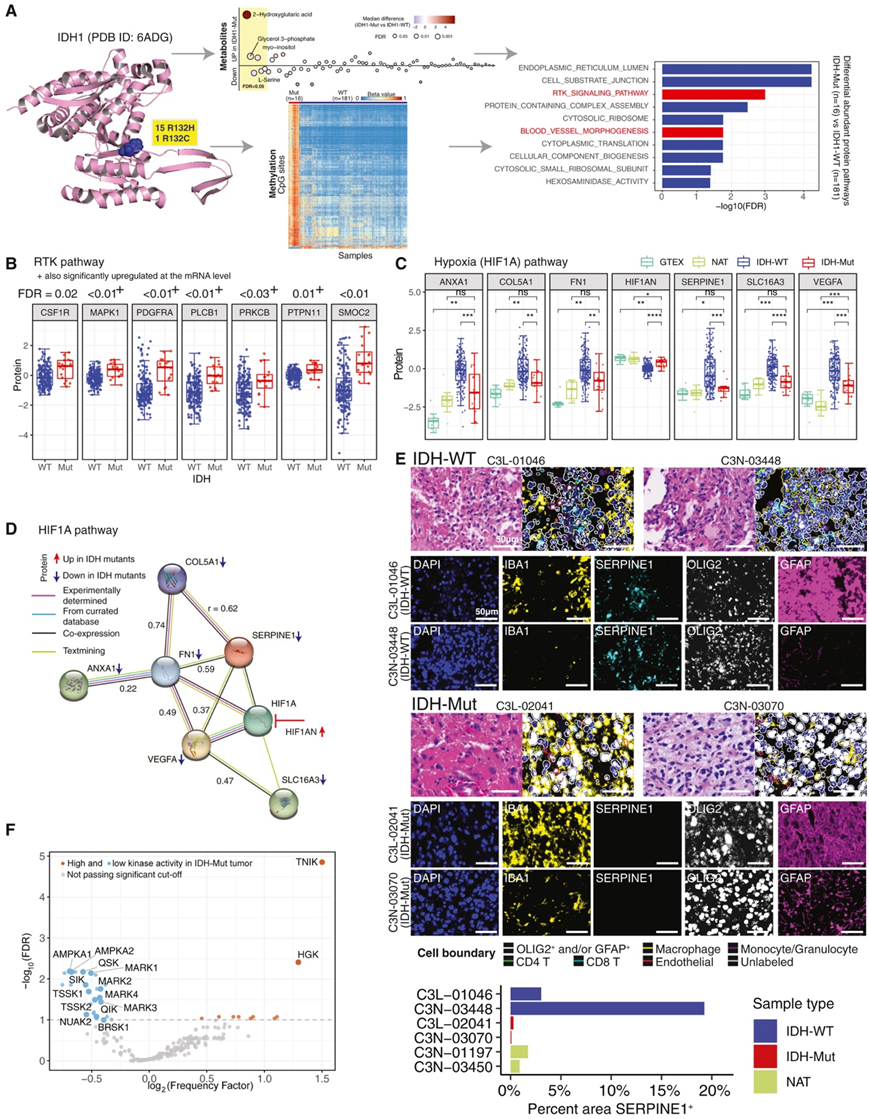
图8. 4 级IDH突变型星形细胞瘤中的失调通路。
(A) IDH1 R132H/R132C 突变导致 2-HG 产生和高甲基化表型。与 GBM 相比,蛋白质组分析确定了 IDH 突变肿瘤中失调的通路。(B) 特定 RTK 通路基因在 IDH 突变型星形细胞瘤中上调。(C) 与 GBM 相比,IDH 突变肿瘤的缺氧通路成员蛋白表达较少。(D) 在 HIF1A 通路中的PPI。(E) IDH-WT(上)和突变患者样本(中)的 CODEX 图像,SERPINE1 染色定量(下)。(F) IDH 突变星形细胞瘤和 GBM 之间的激酶活性差异。
+ + + + + + + + + + +
结 论
本项研究将蛋白质组学、代谢组学、脂质组学和翻译后修饰 (PTM) 与基因组和转录组学分析技术相结合,以揭示控制肿瘤发展和进化的多尺度调控相互作用。将 14 个蛋白质组学和代谢组学平台应用于 228 个肿瘤(212 个 GBM 和 16 个 4 级 IDH 突变星形细胞瘤),包括 28 个复发肿瘤,加上 18 个正常脑样本和 14 个脑转移瘤作为比较对象,揭示了异质性上游改变汇聚在蛋白质组学和代谢组学水平的共同下游事件,以及复发时蛋白质-蛋白质相互作用和糖基化位点的变化。PTPN11的复发性遗传改变和磷酸化事件在三维中映射到重要的调控域,表明 PTPN11 信号在高级别胶质瘤中起着核心作用。
+ + + + +



 English
English


