文献解读|Adv Sci(15.1):局部晚期宫颈鳞状细胞癌的单核转录组分析鉴定了与放疗疗效相关的神经样祖细胞程序
✦ +
+
论文ID
原名:Single-Nucleus Transcriptome Profiling of Locally Advanced Cervical Squamous Cell Cancer Identifies Neural-Like Progenitor Program Associated with the Efficacy of Radiotherapy
译名:局部晚期宫颈鳞状细胞癌的单核转录组分析鉴定了与放疗疗效相关的神经样祖细胞程序
期刊:Advanced Science
影响因子:15.1
发表时间:2023.07.09
DOI号:10.1002/advs.202300348
背 景
宫颈癌是全球女性癌症死亡的第三大原因,宫颈癌主要有两种类型,宫颈鳞状细胞癌(CSCC)几乎占病例的90%。手术、放疗和/或化疗在临床上经常使用,因为它们是宫颈癌最有效的治疗方法。然而,放疗的治疗效率远低于预期,宫颈癌特异性死亡率仍然很高,约一半的局部晚期CSCC患者在放疗后出现复发。分析不同细胞类型的分子动力学以及放射治疗暴露的 CSCC 组织中肿瘤微环境(TME) 的重塑将有助于了解这些放射治疗引起的反应的基本机制。
实验设计
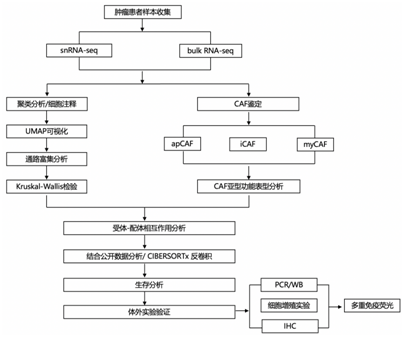
结 果
01
放疗前和放疗期间储存的冷冻人宫颈肿瘤的单细胞核转录组分析 (snRNA-seq)
研究者团队从 11 名患者中收集了 19 份 CSCC 放疗前和放疗后的样本进行 snRNA-seq(图1a),获得了高质量的snRNA-seq 图谱,其中包含来自所有样本的各种细胞类型(图 1b-e)。通过无监督聚类确定了七个主要细胞聚类(图 1c),在治疗亚组(治疗前和治疗后)中,治疗后肿瘤组织中上皮细胞比例明显降低,而B细胞比例明显升高(图1f-g)。
考虑到snRNA-seq技术比单细胞转录组分析(RNA-seq) 技术恢复了更多的实质细胞类型和较少的免疫细胞,他们在后续的分析中重点关注非免疫细胞。
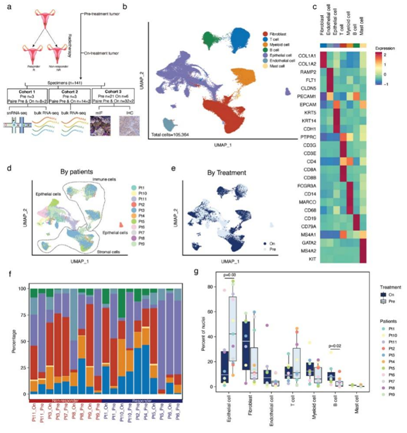
图1. 通过 snRNA-seq 分析宫颈鳞状细胞癌 (CSCC) 放疗前和放疗中的不同细胞类型。
(a) snRNA-seq 和bulk RNA-seq 的CSCC 样本采集实验工作流程。(b) 对所有患者治疗前和治疗中肿瘤的单核分布进行均匀流形逼近和投影 (UMAP) 可视化。(c) 每个细胞聚类的主要细胞类型标记基因的热图。 (d-e) 在所有肿瘤中捕获的细胞核的 UMAP。(f) 每个肿瘤中的细胞组成。(g) 通过放射治疗改变肿瘤成分。
02
放疗过程中恶性细胞的分子变化
来自不同患者的免疫细胞和基质细胞根据细胞类型形成聚类(图2a)。所有样本的 35001 个恶性细胞聚集成 16 个不同的亚聚类(图 2b-c)。他们根据已发表的snRNA-seq生成的谱系程序对单个细胞进行评分,在T9、T12和T5亚聚类中,富集了干细胞相关基因的基底细胞样 (BSL)程序的表达强烈升高。相反,富集了神经元发育/迁移/粘附相关基因的神经样祖细胞 (NRP) 程序的表达在 T14、T10 和 T8 亚聚类的细胞中升高(图 2d)。接下来,他们评估了来自MSigDB的标志基因集的表达,以确定恶性细胞的细胞状态。来自 T14、T10 和 T8 亚聚类的细胞在血管生成通路方面表达更高,从而促进肿瘤生长,而来自 T9、T12 和 T5 亚聚类的细胞与缺氧通路相关的基因表达较高,这与放射抗性有关(图2e)。
在确定了具有与肿瘤生长和放疗敏感性相关的一些特征的恶性细胞亚群后,他们接下来检测了基于暴露和对治疗的反应的基因表达差异,观察到放射治疗与谱系和细胞状态程序的表达显著差异相关(图 2f-g)。与治疗前样本相比,治疗中样本中恶性NRP程序的表达显著较高,而BSL程序的表达较低(图 2f)。然而,治疗样本中缺氧和血管生成程序的表达均较高(图 2f)。值得注意的是,四种恶性程序:BSL、NRP、缺氧和血管生成,在无反应肿瘤的恶性细胞中高度表达(图2g),这表明它们的程序在这些细胞类型中具有治疗敏感性相关性。
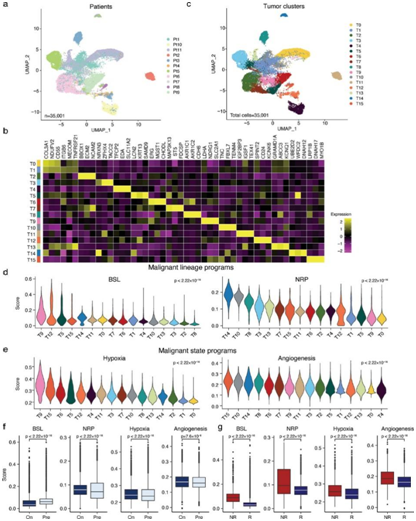
图2. 放疗对恶性细胞状态进行差异性重塑。
(a) 在所有肿瘤中捕获的恶性细胞的 UMAP。 (b) 细胞类型标记基因的缩放标准化表达的热图。(c) 所有肿瘤中捕获的恶性细胞的 UMAP 。(d) 每个恶性细胞亚群内谱系程序、基底样细胞 (BSL) 和神经样祖细胞 (NRP) 的分数分布。 (e) 在每个恶性细胞亚群中,状态程序、缺氧和血管生成的评分分布。(f-g) 使用 Kruskal-Wallis 检验来确定差异程序富集的意义。
03
放疗后的CAF亚群分析
成纤维细胞是 TME 的主要组成部分,发挥着异质的作用,包括促进肿瘤增殖和将T细胞排除在肿瘤巢外。他们从所有样本中回收了31530个癌症相关成纤维细胞(CAF),无监督聚类揭示了7个不同的细胞亚群(图 3a-b),包括一种抗原呈递CAF (apCAF)、两种炎症CAF (iCAF) 和四个肌纤维母细胞 CAF (myCAF) 亚群。有趣的是,他们观察到放疗后PI16+ iCAF的比例增加(图3c),而在对放疗反应较好的患者中,apCAF数量减少(图3d)。
他们进一步计算了四个 snRNA-seq 衍生的 CAF 程序的表达,神经营养(NRT)、免疫调节 (IMM)、肌纤维母细胞祖细胞 (MYO) 和粘附成纤维细胞 (ADH-F) 程序可用于确定这些亚群的功能表型。PI16+ iCAF NRT和IMM程序表达量最高,MYO和ADH-F程序表达量最低(图 3e),ApCAF也有相对较高的IMM程序表达(图 3e)。
与治疗前肿瘤相比,治疗后肿瘤的大多数 CAF 亚群中炎症相关通路(例如干扰素、肿瘤坏死因子和白细胞介素 6)的表达显著升高(图 3f)。此外,来自治疗中无应答肿瘤的CAF的这些通路的表达水平高于来自治疗中有应答肿瘤的CAF(图3g)。这都结果表明CAF在宫颈癌的TME中具有炎症调节作用,并且与放疗的疗效相关。
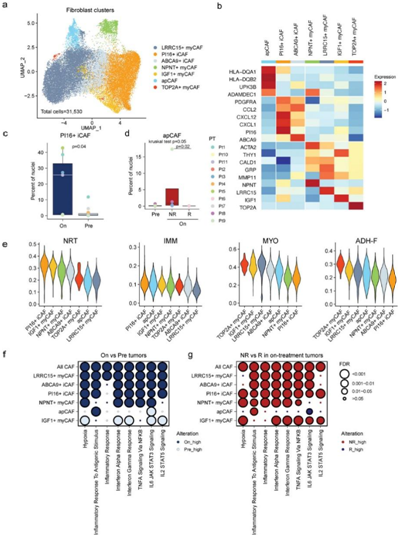
图3. 与放射治疗相关的 CAF 的分布和细胞状态。
(a) 从所有样本中分离出的 snRNA-seq CAF 的 UMAP 投影。 (b) 细胞类型标记基因的缩放标准化表达热图。(c-d) 不同组中 PI16+ iCAF和 apCAF比例的比较。(e) 每个 CAF 亚聚类内 CAF 程序、神经营养 (NRT)、免疫调节 (IMM)、肌纤维母细胞祖细胞 (MYO) 和粘附成纤维细胞 (ADH-F) 的分数分布。 (f-g) 每个 CAF 亚聚类和所有 CAF 中标志基因集的显著差异表达。
04
放疗条件下的配体-受体的相互作用分析
鉴于恶性程序的结果,例如恶性细胞中 NRP 的上调和无反应者 CAF 中炎症相关通路的上调,他们假设不同的细胞聚类可能参与复杂的细胞间相互作用。他们发现了生长因子、细胞因子和 NRP 基因方面细胞相互作用的改变,这些基因在治疗后与从个体患者获得的各自治疗前样本相比显著上调(图 4a)。与在 NR 治疗肿瘤中观察到的血管生成通路的较高表达水平一致,他们观察到这些肿瘤中血管内皮生长因子受体-配体对之间的串扰数量增加(图 4a-b)。与治疗前的肿瘤相比,他们在治疗期间观察到肿瘤中 NRP 基因的配体和受体之间有更多的肿瘤细胞和其他细胞类型相互作用(图 4a)。与应答者相比,无应答者肿瘤中 NRP 基因的相互作用也更多(图 4b)。综上所述,结果表明,CAF 和恶性细胞之间的细胞因子和 NRP 相关的细胞间相互作用可能参与放疗诱导的反应,随后这些可能会介导治疗效果。
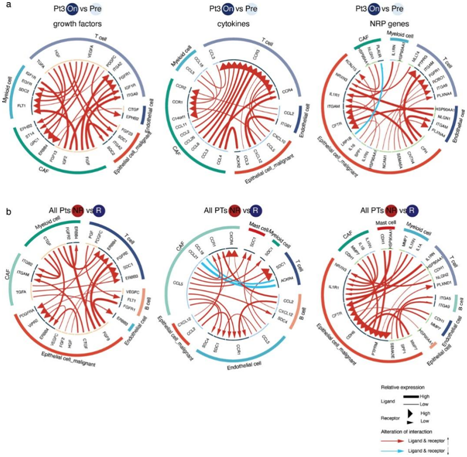
图4. 在放射治疗暴露的肿瘤和无反应者中,主要细胞类型之间丰富集的配体-受体细胞-细胞相互作用。
(a-b) 代表性circos图显示了前20个差异调节的生长因子(左),细胞因子(中)和NRP基因(右)在Pt3中与预处理样品进行比较时的配体受体对的详细信息。
05
NRP 程序表达增加与不良结果相关
接下来,他们使用 CIBERSORTx 来推断独立队列中程序的细胞丰度和表达,发现肿瘤细胞以恶性细胞为主,恶性细胞和B细胞的比例在放疗过程中发生了明显的变化(图 5a)。
他们进一步计算了 BSL 和 NRP 程序在恶性细胞中以及 CAF 中 NRT 和 IMM 程序中的表达(图 5b)。仅在两个治疗前和八个治疗后的肿瘤中成功测定了 NRP 的表达(图 5b),这表明放疗与恶性细胞中的 NRP 程序表达呈正相关(图5c)。值得注意的是,恶性细胞中 NRP 的表达和 CAF 中 IMM 的表达在无应答者的肿瘤中显著高于应答者的肿瘤(图5d)。对进展时间 (TTP) 和无病生存期 (DFS) 的 Kaplan-Meier 分析显示,NRP 和 NRP+IMM(而非 IMM)的较高表达与较短的 TTP 和 DFS 相关(图 5e-f)。
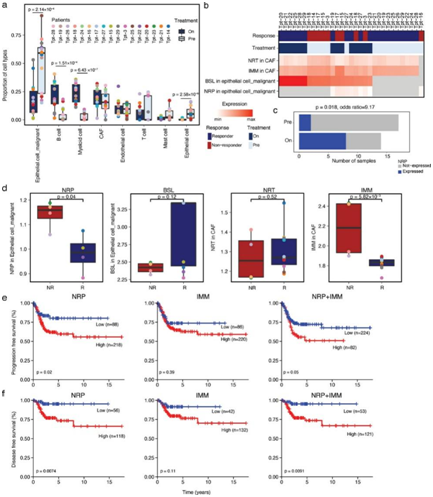
图5. 第二个独立队列和 TCGA 数据集的bulk RNA 序列分析。
(a) 根据个体治疗状态,通过 CIBERSORTx 反卷积相对细胞丰度的改变。(b) 由 CIBERSORTx 推断的 CAF 中 NRT、CAF 中 IMM 以及恶性细胞中 BSL 和 NRP 的标准化表达的热图。(c) 治疗前和治疗中肿瘤中的样本数量。(d) 放疗治疗肿瘤期间无反应者 (NR) 和反应者 (R) 之间程序表达的比较。(e-f) 按程序表达水平分层的病例无进展生存期 (e) 和无病生存期 (f)。使用Kaplan-Meier 分析进行统计分析。
06
验证NRP和IMM程序关键基因作为放射敏感性调节因子
他们使用小干扰RNA (siRNA) 来敲低CSCC细胞系SiHa中NRG1的表达(图 6a),细胞活力在NRG1敲低后显著下降,并且在放射治疗后下降幅度更大(图6b)。克隆形成测定表明,NRG1 下调后细胞克隆的数量减少,并且辐射暴露导致细胞克隆数量的更大减少(图 6c)。这些体外实验验证了NRG1在CSCC细胞增殖和放射敏感性中的重要性。通过免疫组织化学 (IHC) 测定,他们在无反应者和放射治疗后的肿瘤样本中观察到 NRG1 蛋白表达水平较高(图 6d-e)。生存分析表明,NRG1 表达水平较高的患者总体生存率和无进展生存率较差(图 6f)。
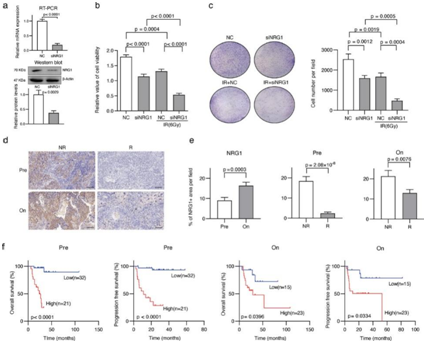
图6. 验证 NRG1(NRP 关键基因)作为放射敏感性调节剂的作用。
(a) 利用实时PCR和蛋白质印迹来确定SiHa细胞中小干扰RNA(siRNA)对NRG1的敲低效率。 (b) 通过细胞计数试剂盒-8 (CCK-8) 测定确定不同组 ( n = 6) 的细胞活力结果。(c) 不同组细胞集落的结晶紫染色。 (d) CSCC 标本中 NRG1 的代表性免疫组织化学图像。 (e) 随机选择的田野中NRG1表达阳性率的比较。(f) 按 NRG1 表达分层的病例总体生存率和无进展生存率的 Kaplan-Meier 曲线。
为了证实IER3在CAF中表达,他们使用了针对IER3和胶原III型α 1链(COL3A1,成纤维细胞的标记物)的抗体,对来自队列3的肿瘤标本进行染色(图 7a)。基于多重免疫荧光 (mIF) 染色信号,他们发现治疗组和无反应组的肿瘤样本中 IER3+ CAF 的比例较高(图 7b)。
接下来,他们采用 IHC 来确定整个队列 3 中的 IER3 表达水平,与mIF 结果一致,放疗后的肿瘤和无反应者中的 IER3 阳性率显著升高(图 7c-d)。治疗前肿瘤中较高的 IER3 表达水平与较差的总体生存率和无进展生存率相关(图 7e)。
最后,他们使用针对 NRG1(NRP 关键基因)、IER3(IMM 关键基因)、泛细胞角蛋白(上皮细胞标记)和 COL3A1(成纤维细胞标记)的抗体对 FFPE CSCC 样本进行 mIF 染色,以研究关键IMM和NRP基因空间定位的意义。他们观察到放疗后CSCC肿瘤中同时存在更多的IER3+ CAF和NRG1+恶性细胞。此外,在放疗后的肿瘤样本中,IER3+ CAF与恶性细胞之间的距离都有缩短的趋势(图7f)。
在应答者的肿瘤标本中,他们在随机选择的视野中观察到较少数量的IER3+ CAF和NRG1+恶性细胞,并且IER3+ CAF在肿瘤床内呈分散分布模式。然而,在无应答者的肿瘤标本中,更多的IER3+CAF聚集在NRG1+恶性细胞附近(图7f)。
空间分析表明,彼此相邻的 CAF 中的 IER3 表达增加和恶性细胞中的 NRG1 表达增加可能会导致细胞间相互作用的改变并诱导 CSCC 的放疗抵抗。总之,这些结果一致验证了CSCC中NRP的表达与放疗疗效相关。
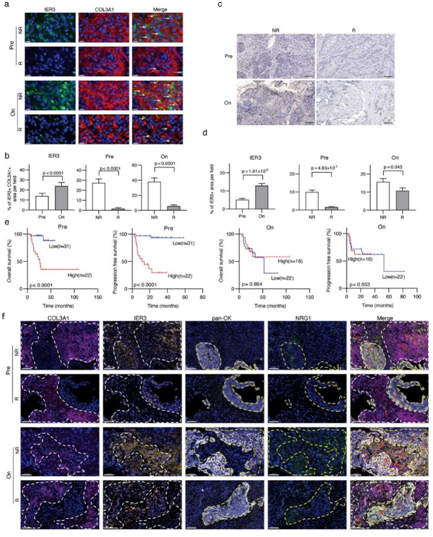
图7. IER3(IMM 关键基因)与放疗疗效的功能相关性。
(a) 不同组的 CSCC 标本的代表性多重免疫荧光图像。 (b) 通过 ImageJ 软件对随机选择的视野中的 IER3 和 COL3A1 免疫荧光信号进行定量。(c) 通过 IER3 抗体免疫组织化学 (IHC) 染色得到的 CSCC 肿瘤样本的代表性图像。(d) 通过 ImageJ 软件对随机选择的视野中的 IER3 IHC 染色信号进行定量。 (e)按 IER3 表达分层的 CSCC 患者总体生存期和无进展生存期的 Kaplan-Meier 曲线。 (f) 通过多重免疫荧光 (mIF) 对恶性细胞中的 NRG1 和 CAF 中的 IER3 进行空间分析。
+ + + + + + + + + + +
结 论
本项研究采用snRNA-seq来构建放疗前和放疗后CSCC中各种细胞类型的高分辨率分子景观,以更好地了解肿瘤微环境中放疗相关的分子反应。结果表明,放疗后肿瘤细胞中神经样祖细胞 (NRP) 程序的表达水平显著升高,并且在无反应患者的肿瘤中富集。在一个独立的队列中,NRP程序在无应答患者的肿瘤细胞中富集,并通过bulk RNA-seq分析得到验证。此外,对癌症基因组图谱数据的分析表明,NRP的表达与CSCC患者的不良预后相关。神经调节蛋白1 (NRG1)是NRP程序的关键基因,在CSCC细胞系的体外实验表明,NRG1的下调与细胞生长抑制和辐射敏感性增加有关。队列3的免疫组织化学染色验证了免疫调节程序中的关键基因NRG1和早期反应3作为放射敏感性调节因子。NRP在CSCC中的表达可用于预测放疗疗效。
+ + + + +



 English
English


