文献解读|iScience(5.8):血浆和尿液蛋白质组学以及肠道微生物群分析揭示了影响 COVID-19 疫苗接种反应的潜在因素
✦ +
+
论文ID
原名:Plasma and urine proteomics and gut microbiota analysis reveal potential factors affecting COVID-19 vaccination response
译名:血浆和尿液蛋白质组学以及肠道微生物群分析揭示了影响 COVID-19 疫苗接种反应的潜在因素
期刊:iScience
影响因子:5.8
发表时间:2024.01.08
DOI号:10.1016/j.isci.2024.108851
背 景
COVID-19 疫苗接种的功效依赖于中和抗体的诱导,而中和抗体在疫苗接种者之间可能有所不同。mRNA疫苗、病毒载体疫苗、蛋白亚单位疫苗和灭活病毒疫苗,已在人体中表现出有效的抗体反应,并经过了广泛的临床评估。然而,个体之间对疫苗接种的免疫反应差异很大,需要根据个体基线条件鉴定预测因子并阐明其生物学基础。
实验设计
结 果
01
健康BBIBP-CorV疫苗接种者的临床特征与 ACE2-RBD 抑制抗体的产生相关
研究者团队总共招募了 60 名健康个体,他们接受了两剂 BBIBP-CorV 疫苗,没有观察到明显的不良事件。为了研究临床特征与 ACE2-RBD 抑制抗体产生之间的关系,他们在三个时间点[接种后第0天(D0)、第14天(D14)和 第42 天(D42)]收集了纵向血浆和尿液样本,用于实验室检测和蛋白质组学分析(图1A)。在接种疫苗之前,所有个体的 ACE2-RBD 抑制抗体检测均为阴性,并且 93% 的疫苗接种者在 42 天时出现血清转化。抗体浓度在第14天和第42天明显增加。大多数实验室检查在第42天没有显示明显变化,包括C反应蛋白(CRP)、白细胞(WBC)计数、中性粒细胞比率、淋巴细胞比率、单核细胞比例、嗜酸性粒细胞比例、嗜碱性粒细胞比例、血红蛋白(HGB)、PLT计数、辅助T细胞比例、细胞毒性T细胞比例、淋巴细胞计数、总T细胞计数、辅助T细胞计数、细胞毒性T细胞计数,以及肿瘤坏死因子-α(图1B)。嗜酸性粒细胞和IL-6水平的比率与疫苗接种反应呈显著正相关,相关系数为0.24和0.21,而IL-8与疫苗接种反应呈负相关,相关系数为-0.37(图1C)。为了比较高反应者和低反应者,他们人为地将中和抗体水平高于队列 50% 的中和抗体水平定义为高滴度(高于中位水平 6.6 AU/mL,n = 30),而将低于 50% 的中和抗体水平定义为低滴度(低于 6.6 AU/mL,n = 30)。
基于串联质量标签 (TMT) 的蛋白质组学方法分析了第 0 天、第 14 天和第 42 天从 60 名健康志愿者收集的 180 个血浆和 180 个尿液样本。血浆和尿液的肽产量在三个不同时间点之间没有显示出显著差异,表明样品制备的稳定性(图1D)。他们重点关注 805 种血液蛋白和 3241 种尿蛋白(图 1 E)。尿液蛋白质组含有较多蛋白质,序列覆盖率相对较低(图 1 F)。在质量控制分析中,血浆和尿液变异值的中位系数分别为22.23%和14.46%(图1G)。
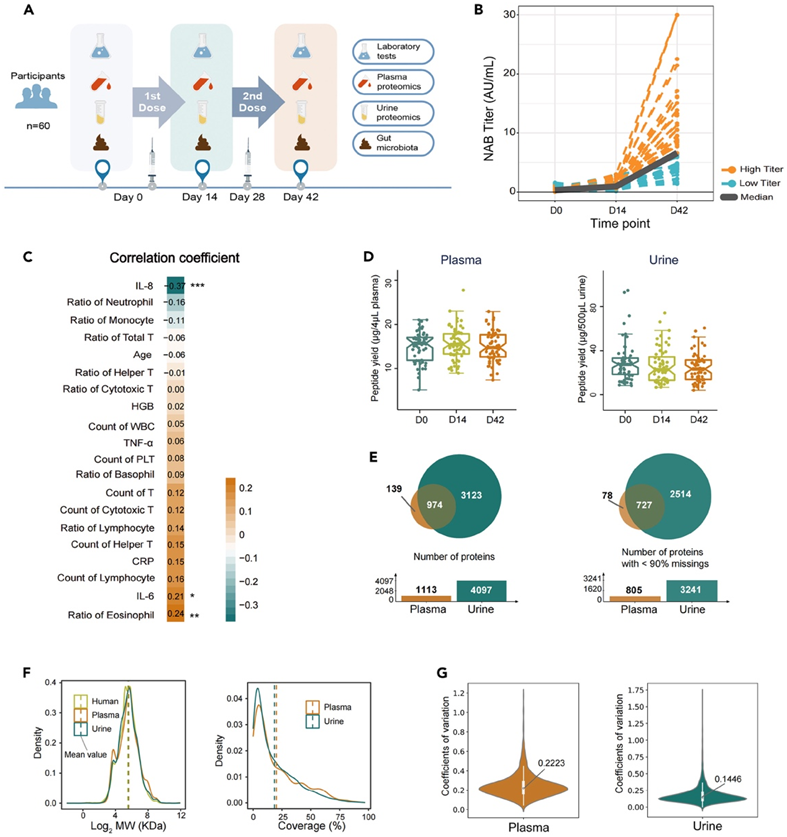
图1. 健康受试者接种了COVID-19灭活疫苗。
(A)健康受试者入组及样本采集工作流程。(B) 60名参与者接种两剂疫苗后在D0、D14和D42时ACE2-RBD-抑制抗体的变化。(C)计算第0天和第42天临床实验室指标变化与ACE2-RBD-抑制抗体水平的Pearson相关系数。(D)在D0、D14和D42时4 μL血浆和500 μL尿液的肽产量。(E)血浆和尿液中蛋白数及缺失值<90%的蛋白。(F)定量蛋白在血浆、尿液和整个人类蛋白质组中的分子量(MW)和序列覆盖率分布。(G)血浆和尿液蛋白质组学数据的变异值的中位系数。
02
疫苗接种后血浆和尿液的蛋白质组学分析动态
他们分析疫苗接种后血浆和尿蛋白的变化。 REAC和KEGG分析显示,接种疫苗后血浆中的差异表达蛋白(DEP)与糖酵解、细胞对化学应激的反应、TCA循环、活性氧的解毒有关(图2A)。Uniprot 数据库注释的血浆中的 DEP 与糖酵解、免疫细胞迁移和免疫调节相关(图2B)。有趣的是,甘露糖受体 C 型 1 (MRC1)(一种由树突状细胞和巨噬细胞群表达的内吞受体)在接种疫苗后显著增加(图 2 C)。MRC1 的功能包括在抗原交叉呈递、内源蛋白清除、病原体检测中发挥作用。此外,前血小板碱性蛋白 (PPBP)(一种有效的中性粒细胞趋化剂和激活剂)在 D42 时也有所增加。中性粒细胞会募集到炎症部位,以应对感染和炎症刺激,它们可以通过与树突状细胞相互作用或直接表达主要组织相容性复合物(MHC)来间接影响抗原呈递。
REAC 和 KEGG 分析显示尿液中的 DEP 与细胞蛋白的半桥粒组装和凋亡裂解有关(图 2D)。Uniprot 注释的尿液 DEP 与免疫细胞趋化性、糖酵解和免疫调节相关(图 2 E)。值得注意的是,精氨酸酶 1 (ARG1) 在 L-精氨酸稳态中发挥着至关重要的作用,L-精氨酸稳态是先天性和适应性免疫反应的关键调节因子,导致 T 细胞和自然杀伤 (NK) 细胞增殖和细胞因子分泌受到抑制,两次疫苗接种后ARG1显著升高(图 2 F)。接种疫苗后血浆和尿液蛋白质组学谱的动态变化表明,对 COVID-19 疫苗接种的获得性免疫反应发生了改变。
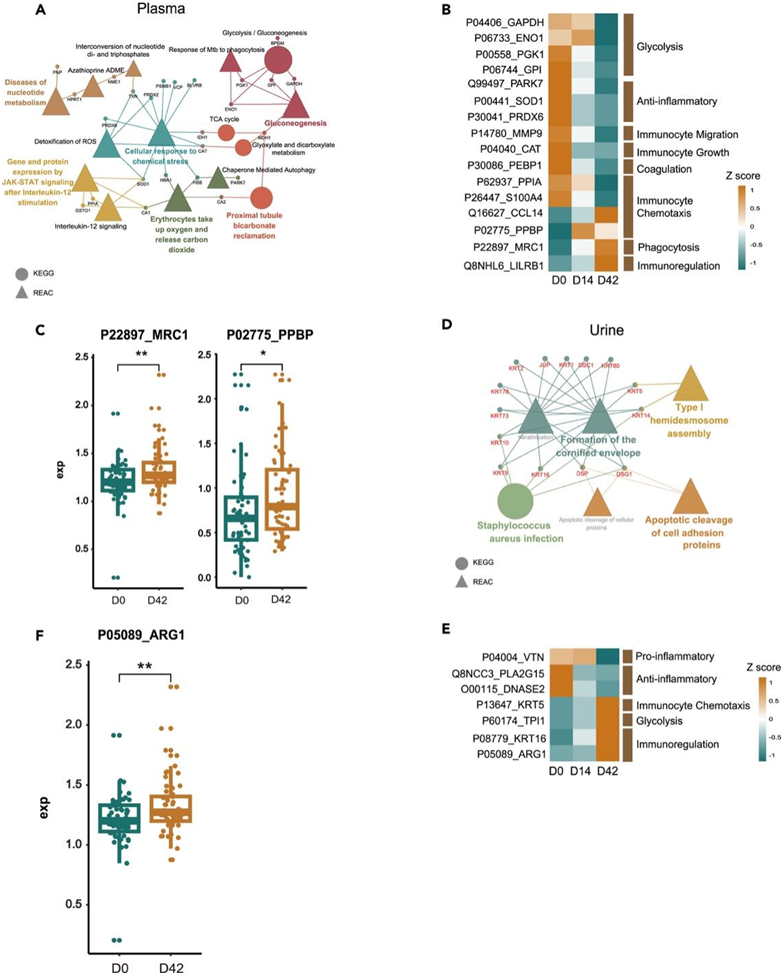
图2. 接种疫苗后血浆和尿液的蛋白质组学分析动态。
(A) 通过 Cytoscape 的 ClueGO 插件可视化疫苗接种后血浆中差异表达蛋白 (DEP) 的 REAC 和 KEGG 通路富集分析。(B) D0、D14 和 D42 时参与免疫反应的血浆 DEP 热图。(C) D0和D42时血浆中MRC1和PPBP的表达。(D)REAC 和 KEGG 分析。(E) D0、D14 和 D42 时参与免疫反应的尿液 DEP 热图。(F)D0和D42时血浆中ARG1的表达。
03
高反应者和低反应者血浆蛋白质组的差异
为了进一步表征 BBIBP-CorV 疫苗不同免疫反应的潜在分子机制,他们比较了高反应者和低反应者之间的血浆和尿液蛋白质组学特征。D0、D14 和 D42 时血浆中分别有 67、52 和 55 个失调蛋白。在D0时,差异表达的蛋白与补体和凝血级联以及血小板脱颗粒相关(图3A)。此外,IPA分析显示,不同时间点的通路在冠状病毒疾病、糖皮质激素受体信号传导、肝X受体(LXR)/类维生素A X受体(RXR)和法尼醇X受体(FXR)方面富集(图3B)。载脂蛋白L1 (APOL1)和补体C3 (C3)蛋白均参与LXR/FXR通路,在高反应组中升高(图3C)。LXR激活耗尽髓源性抑制细胞(MDSC)并引发T细胞激活。FXR 激动作用可减轻炎症驱动的免疫功能障碍,使 FXR 的免疫调节作用具有临床相关性。最后,他们使用 Mfuzz 根据其动态将高反应者和低反应者中失调的血浆蛋白分为八组。高反应组的聚类 4 显示出与中和抗体类似的增加趋势(图 3D),而 LXR 和 FXR 激活在该聚类中显著富集(图 3E)。总的来说,这些发现表明,在 LXR/FXR 激活的高反应组中存在更实质性的适应性免疫过程。
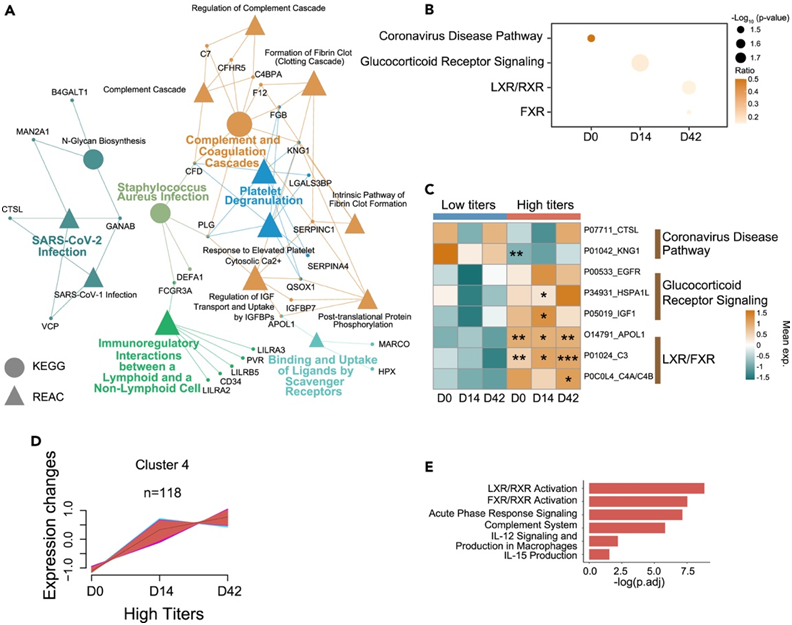
图3. 高反应者和低反应者血浆蛋白质组谱的差异。
(A)对血浆 DEP 富集高/低反应者之间的通路进行 REAC 和 KEGG 分析。(B) 在 D0、D14 和 D42 时,对血浆 DEP 富集高/低反应者之间的通路进行 IPA 分析。(C) 指定时间点血浆 DEP 的 IPA 富集分析热图。(D) 高反应组血浆蛋白动态变化的 Mfuzz 分析。(E) 聚类 4 中血浆 DEP 的 GO 分析。
04
高反应者和低反应者之间的尿蛋白调节
他们对高反应者和低反应者之间的尿液蛋白质组谱进行了比较,发现在 D0、D14 和 D42 分别有 97、184 和 157 个失调蛋白质。在接种疫苗之前,差异表达的蛋白质与活性氧的解毒和白细胞介素 10 信号传导有关(图 4 A)。此外,IPA 分析显示,Th1 和 Th2 激活在第 0 天最显著富集,而吞噬体成熟在第 14 天富集,粒细胞粘附和血细胞渗出在第 42 天富集(图4 B)。有趣的是,蛋白质表达模式表明,在高反应组的整个疫苗接种期间,参与上述通路的大多数蛋白质都以较高水平表达(图4C)。高反应组的聚类 6 显示出与中和抗体 (NAB) 产生相似的一致上升模式(图 4 D)。对于该聚类,补体系统、急性期反应信号、LXR/RXR、FXR/RXR 和 STAT3 通路得到富集,与血浆中鉴定的非常相似(图 4 E)。在高反应组的整个疫苗接种期间,大多数参与疫苗反应过程的蛋白质,包括T细胞和B细胞的激活、增殖和分化,都以较高水平表达(图4F)。这些发现表明,尿液蛋白质组的免疫反应可能与疫苗接种后中和抗体的滴度相关。
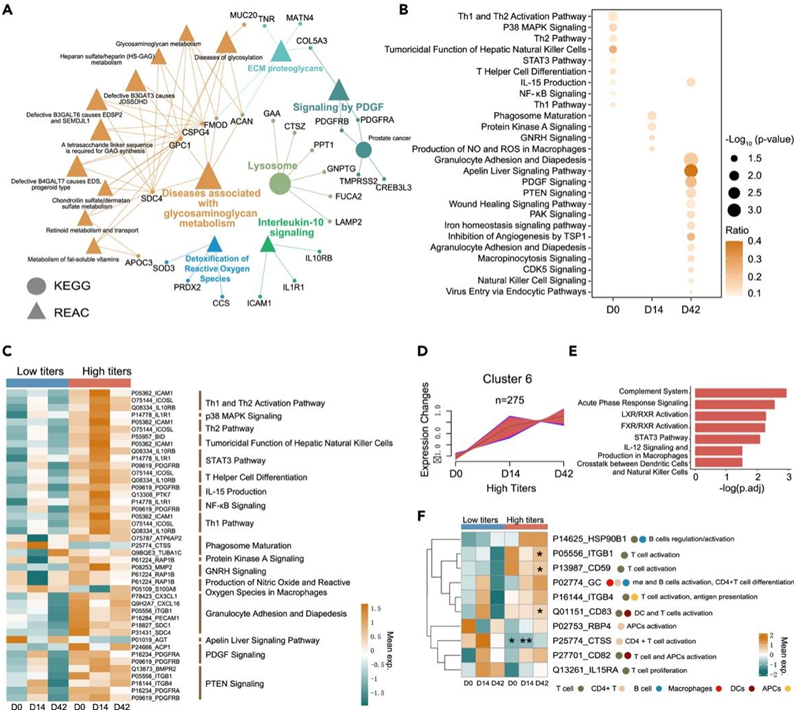
图4. 高反应者和低反应者之间尿液蛋白质组学分析的差异。
(A)对 D0 时尿液 DEP 富集高和低反应者之间的通路进行 REAC 和 KEGG 分析。 (B) 在 D0、D14 和 D42 时,对尿液 DEP 富集高反应者和低反应者之间的通路进行 IPA 分析。(C) 指定时间点尿液 DEP 的 IPA 富集分析热图。(D) 高反应组尿蛋白动态变化的 Mfuzz 分析。(E) 聚类 6 中尿液 DEP 的 GO分析。(F) 疫苗生产过程中涉及的尿蛋白热图。
05
高反应者和低反应者之间细胞因子及其受体的差异表达
血浆中共鉴定出59种细胞因子及其受体,尿液中共鉴定出218种细胞因子及其受体,分为六类,即白细胞介素、干扰素、转化生长因子-β(TGF-β)家族、肿瘤坏死因子(TNF)家族、趋化因子和其他细胞因子。他们进一步分析了这些细胞因子与不同免疫细胞的关系,并确定了血浆中高反应组和低反应组之间不同时间点的七种细胞因子和受体以及尿液中的三十九种细胞因子和受体显著失调(图5A)。其中,接种前高反应组血浆中的α-防御素1(DEFA1)显著升高(图5A)。DEFA1 是先天免疫系统的一种抗微生物肽,参与吞噬细胞介导的宿主防御,其血清水平与 COVID-19 患者的疾病严重程度相关。CC基序趋化因子配体15(CCL15)在高响应组的血浆中显著减少。CCL15 可以招募抑制性单核细胞以促进肝细胞癌的免疫逃逸和疾病进展。在尿液样本中,大多数差异表达的细胞因子,包括 PLAUR、SDC4、PDGFRA、PDGFRB、SEMA4B、CRIM1、FAM3D、IL10RB、IL1R1、ACVR1B 和 TGFBR1,在高反应组中均增加,这些从血浆和尿液中获得的细胞因子参与免疫反应的调控(图5B)。
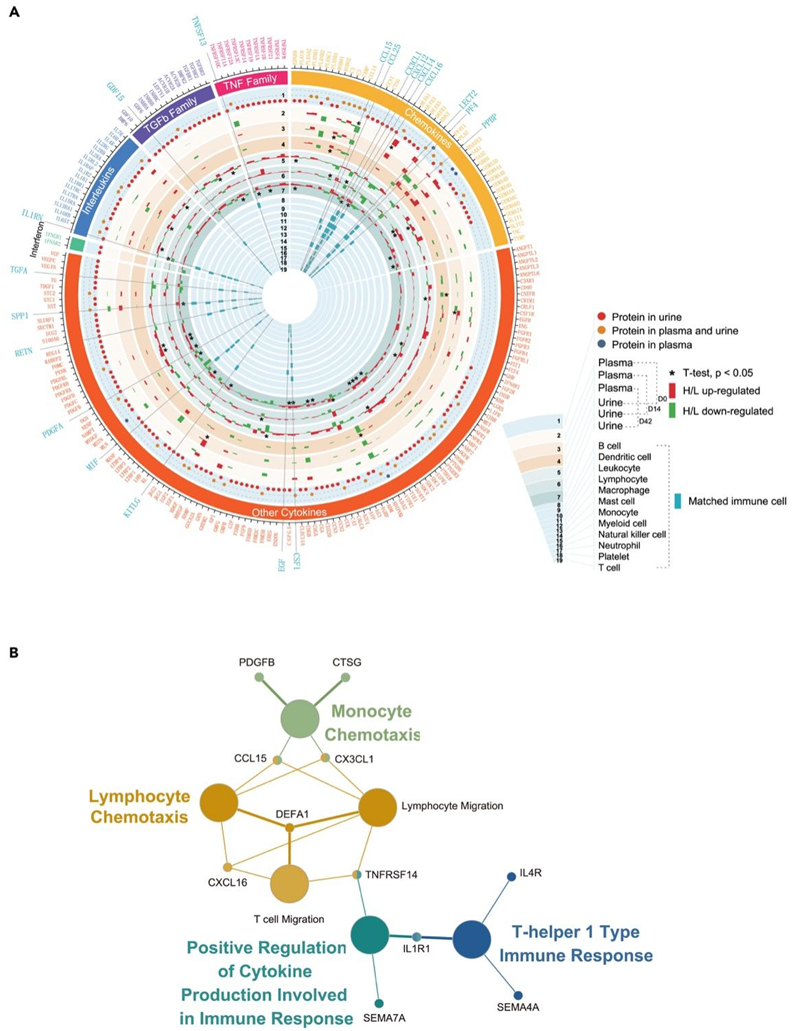
图5. 高、低反应者细胞因子及其受体的差异。
(A) D0、D14 和 D42 时高反应者和低反应者之间差异表达的血浆和尿液细胞因子及其受体。(B) GO分析。
06
基于蛋白质的疫苗接种反应预测模型
为了在疫苗接种前预测针对 SARS-CoV-2 的 ACE2-RBD 抑制抗体的产生,通过整合临床特征和第 0 天收集的蛋白质组数据,开发了一种基于蛋白质的机器学习模型。该研究利用了一个由 60 名参与者组成的发现队列,其中包括血浆和尿液蛋白质组数据,以及另外两个队列:一个由 71 名参与者组成的训练队列和一个由 71 名参与者组成的测试队列。为了进一步筛选血浆和尿液蛋白的特征进行MRM分析,获得了血浆和尿液在D0、D14和D42时的差异表达蛋白(图6A)。在分析了 Skyline 生成的 DEP 的独特肽的转变后,选择 43 种血浆蛋白和 62 种尿蛋白作为训练模型的输入(input)。根据随机森林分析的表达稳健性和重要性,选择 SERPINA1、KRT1、F10、KRT9、KLKB1、FGB、SERPINC1、LYVE1、AGT 和 ICAM1 等 10 种血浆蛋白构建分子模型,测试队列的曲线下面积 (AUC) 值为 0.74(图 6 B)。同样,选择 IGHG4、AGT、GP6、ALPL、F10、C7、CTSG、CD81、AQP1 和 GLO1 等 10 种尿液蛋白来构建另一个分子模型(图 6C)。选取辅助T细胞比例、淋巴细胞计数、IL-8、T细胞计数、TNF-α、年龄、单核细胞比例、IL-6等8个临床特征构建8个特征模型,AUC值为0.68(图6D)。此外,当血浆或尿液蛋白质组学数据与临床特征整合时,AUC分别增加至0.84或0.77(图6E-F)。值得注意的是,结合上述三个指标后,利用上述10种血浆蛋白、10种尿蛋白和8种临床特征构建了28个特征的模型,AUC值为0.85(图6G)。
总体而言,这项研究提供了一种基于蛋白质的机器学习模型,可以在疫苗接种前预测 SARS-CoV-2 ACE2-RBD 抑制抗体的产生,这可能有助于识别对疫苗接种反应不佳的个体。该模型结合了临床特征和蛋白质组数据,这些因素的整合可以提高预测性能。
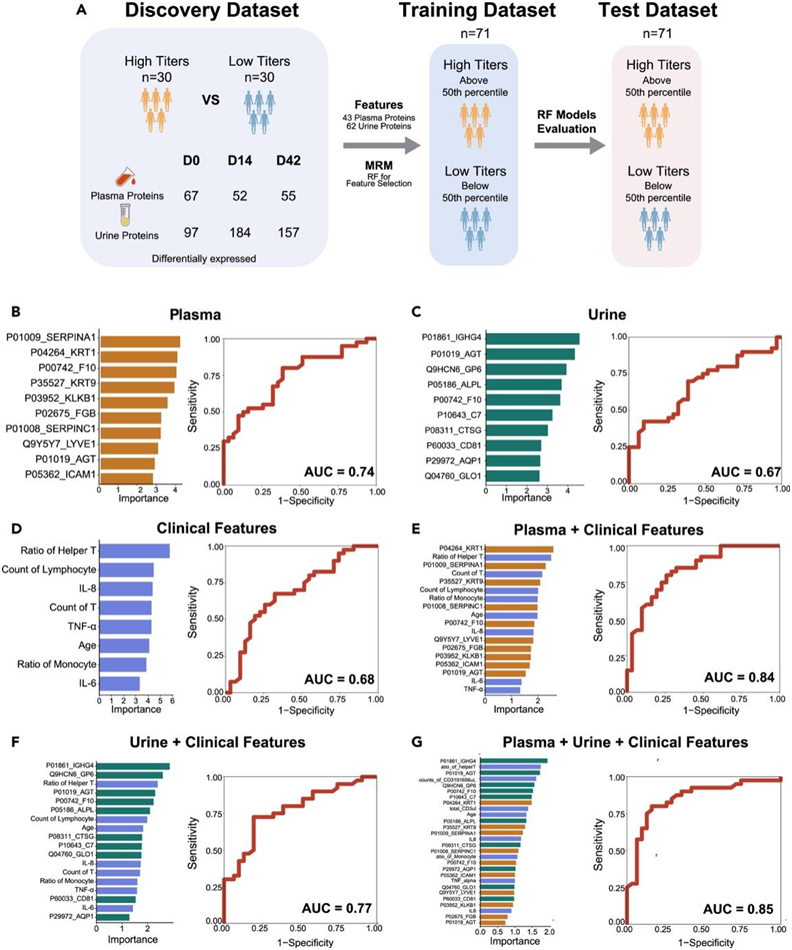
图6. 使用疫苗接种前蛋白质组数据整合的疫苗接种反应预测模型。
(A) 构建预测模型的工作流程。60 名拥有血浆和尿液蛋白质组数据的参与者视为发现队列。(B) 选择10种血浆蛋白构建分子模型,计算曲线下面积(AUC)值。(C) 选择10种尿蛋白构建分子模型,计算AUC值。(D) 选择8个临床特征构建8分子模型,并计算AUC值。(E) 结合血浆和临床特征来构建预测模型。(F) 结合尿液和临床特征构建预测模型。(G) 结合血浆、尿液和临床特征来构建预测模型。
07
肠道微生物组与 ACE2-RBD 抑制抗体相关
肠道微生物群是影响疫苗接种免疫反应的关键因素,对肠道微生物群进行分析可以深入了解影响强大和持久免疫力的因素。他们通过宏基因组测序分析了高反应组和低反应组肠道微生物群的特征,并使用基于 Bray-Curtis 距离的主坐标分析 (PCoA),观察到这两组之间肠道微生物群的显著聚类(ANOSIM)(图 S7 A)。高滴度组和低滴度组之间的 Bray-Curtis 距离等级显著不同(图 S7 B)。高反应组的主要特征是Enterococcus faecium, Prevotella bivia、Actinomyces massiliensis、Veillonella dispar、Veillonella_sp_T11011_6、Eubacterium_sp_CAG_38、Ruminococcus torques、Actinomyces odontolyticus,而Alistipes putredinis、Allisonella histaminiformans、Bacteroides clarus、Clostridium lavalense、Clostridium asparagiforme、Bacteroides eggerthii、Coprobacter fastidiosus、Sutterella parvirubra和 Blautia coccoides在低反应组中更富集(图S7C)。与低反应组相比,高反应组岩芹酸(petroselinate)生物合成通路富集(图S7 D)。接下来,他们分析了 D0 的差异物种与 D42 的 ACE2-RBD 抑制抗体滴度之间的相关性。V. dispar, A. histaminiformans、B. coccoides、A. putredinis和 C. lavalense与与疫苗应答相关(图7A,图S7E)。此外,他们进一步探讨了上述五种细菌分别与D0时血浆和尿蛋白之间的相关性。KEGG和REAC显示与A. putredinis丰度相关的蛋白主要涉及糖酵解、JAK-STAT信号传导和Interleukin-12家族信号传导通路(图7B-D)。KEGG 和 REAC 分析显示,这些蛋白与B. coccoides相关丰度以及冠状病毒疾病和选择性自噬有关(图7E)。
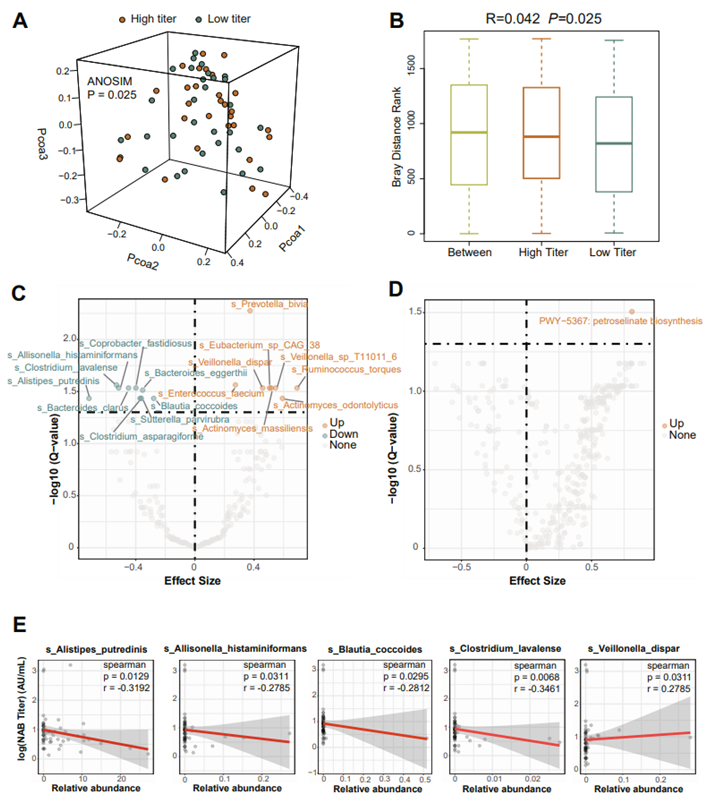
图S7. 肠道微生物组与ACE2-RBD抑制抗体相关。
(A)高反应组(n=30)和低反应组(n=30)在D0时宏基因组序列的Bray-Curtis 3D PCoA图。(B)两组个体的Bray-Curtis rank比较。(C)两组样品差异富集菌火山图。(D)高反应组和低反应组之间差异富集的MetaCyc通路。(E) D0时差异富集菌与D42时ACE2-RBD抑制抗体水平的相关性。
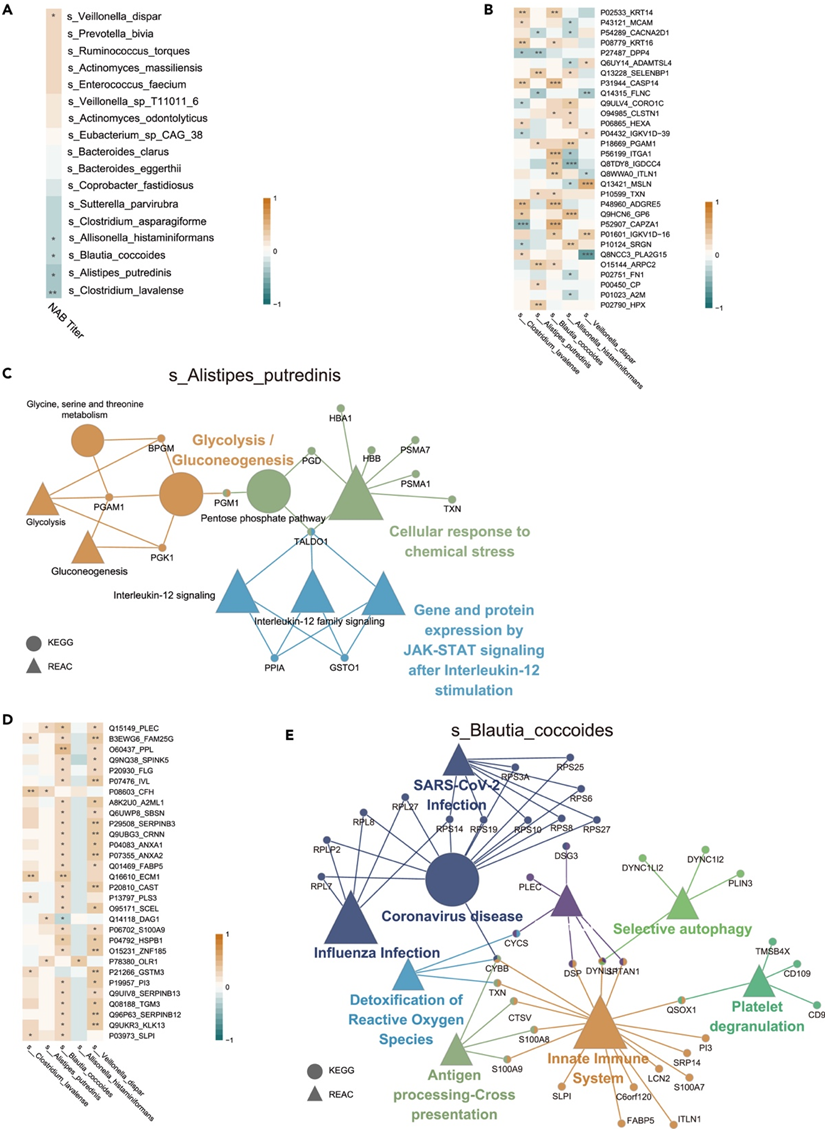
图7. 富集菌与血浆、尿蛋白的相关性。
(A) D0 时差异富集细菌与 ACE2-RBD 抑制抗体滴度的相关热图。(B) 富集细菌和血浆蛋白之间的相关性。(C) 与血浆中Alistipes putredinis丰度相关的蛋白质的 KEGG 和 REAC 分析。(D)富集菌与尿蛋白的相关性。(E)尿液样本中与Blautia coccoides丰度相关蛋白的KEGG和REAC分析。
+ + + + + + + + + + +
结 论
本项研究通过结合血浆和尿液蛋白质组学以及肠道微生物群分析,研究了影响中和抗体反应的潜在因素,发现血浆中LXR/FXR通路的激活与ACE2-RBD抑制抗体的产生相关,而与补体系统、急性期反应信号、LXR/FXR和STAT3通路相关的尿蛋白与中和抗体产生相关。此外,还观察到肠道微生物群与血浆和尿液蛋白以及疫苗接种反应之间的相关性。本项研究建立了疫苗接种反应的预测模型(AUC = 0.85)。这项研究提供了对与 ACE2-RBD 抑制抗体相关的特征血浆和尿液蛋白以及肠道微生物群的见解,这可能有助于了解宿主对 COVID-19 疫苗接种的反应。
+ + + + +



 English
English


