文献解读|Nat Metab(20.8):雄性小鼠骨骼肌耐力训练适应的分子控制
✦ +
+
论文ID
原名:Molecular control of endurance training adaptation in male mouse skeletal muscle
译名:雄性小鼠骨骼肌耐力训练适应的分子控制
期刊:Nature Metabolism
影响因子:20.8
发表时间:2023.09.11
DOI号:10.1038/s42255-023-00891-y
背 景
骨骼肌具有巨大的可塑性潜力,可以适应各种外部和内部扰动。骨骼肌的主要任务是为不同类型的收缩活动产生力量,包括力量、耐力、精细运动控制、姿势和呼吸。目前尚不清楚训练状态如何影响对剧烈运动的分子反应,以及基因表达的变化如何最终与蛋白质水平、细胞器功能和组织可塑性的持续调节相关。
实验设计

结 果
01
训练肌肉的基因数量极少
为了研究未经训练和耐力训练的肌肉之间的差异(在本研究中,肌肉是指股四头肌),小鼠每周在跑步机上跑步 5 天,持续 1 小时。4 周后,观察到跑步表现显著改善,蛋白质组学分析还表明骨骼肌发生了实质性重塑(图1a)。例如,参与线粒体呼吸、脂质代谢、氧运输或应激恢复的蛋白质在训练肌肉中比在未训练肌肉中富集程度更高(图1a-b)。相反,与蛋白酶体降解相关的分解代谢过程相关的蛋白质水平通过耐力训练得到减少(图1a),耐力训练与分子伴侣的诱导一起表明了蛋白质稳态的改变。与训练引起的蛋白质丰度变化相反,训练对稳态磷酸化蛋白质组的影响非常小(仅在 54 种蛋白质中观察到磷酸化差异)。
研究者团队评估了训练过的肌肉的转录组景观。有趣的是,在受过训练的肌肉中,<2% 的检测到的基因发生了显著变化,大多数转录本都发生下调(图1c)。总的来说,这些基因定义了长期的细胞变化,例如与纤维类型转换、脂质代谢过程或炎症减少相关的变化(图1d)。与这些观察结果一致,基序活动响应分析集成系统(ISMARA)揭示了仅22个转录因子(TF)的活性的调节,例如,Esrrb_Esrra的较高活性和Rela_Rel_Nfkb1基序的较低活性(图1e)。
于是,他们提出一个假设:急性最大运动引起的扰动是否会激活编码在受过训练的肌肉中观察到的生物程序的转录网络?
为了检验这一假设,他们将未经训练的小鼠在跑步机上跑步至力竭,并在力竭后 0、4、6 和 8 小时评估肌肉转录组。在未经训练的肌肉急性最大运动的背景下发现了大量基因调控事件,在力竭后 6 小时达到峰值(图1f)。这些急性变化的一部分与受过训练的肌肉中蛋白质的积累相关,而这些蛋白质大多上调并主要参与线粒体呼吸。急性调节的基因与受过训练的肌肉中持续的转录组变化很少重叠,因为在未受干扰的受过训练的肌肉中,只有 21% 的基因在未经训练的肌肉中也受到强烈调节(图1g-h)。事实上,一些基因表现出相反的调控(图1h),例如,与炎症相关的转录本中(在运动后急剧上升,在训练后肌肉中下降)。
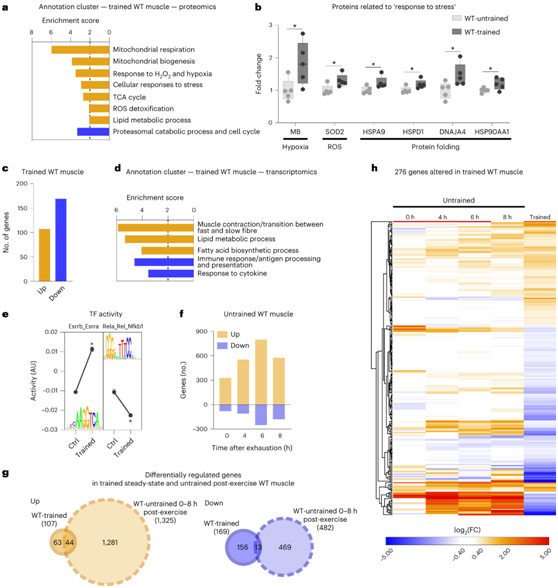
图1. 少量差异表达基因 (DEG) 定义了经过训练的 WT 肌肉。
(a) 训练过的肌肉中富集分数 >2 的上调(橙色)和下调(蓝色)蛋白质的所有功能注释聚类。(b) 未训练的久坐肌肉(浅灰色)和未受干扰的训练肌肉(深灰色)参与压力反应的蛋白质示例。(c) 在未受干扰的训练肌肉中差异表达的基因数量。(d) 训练肌肉中富集分数 >2 的上调(橙色)和下调(蓝色)基因的所有功能注释聚类。(e) 来自 ISMARA 的转录因子的基序,其中活性最高和最低。(f) 急性疲劳运动后上调(橙色)和下调(蓝色)的基因数量。(g) 维恩图显示在不受干扰的训练肌肉中发生变化的所有基因(橙色上调,蓝色下调)和在剧烈的最大运动后受到调节的基因。(h) 在未受干扰的训练肌肉中差异表达的所有基因的热图。
02
对运动的急性反应取决于训练状态
由于未经训练的肌肉的急性最大运动反应不能预测训练适应,因此他们接下来研究了受过训练的肌肉在相同的四个时间点对急性最大耐力运动的反应(图2a),训练了 4 周的小鼠进行了一次力竭的跑步机跑步(图2a)。未经训练和训练过的肌肉对急性最大耐力运动的转录组反应在质量和数量上都有明显不同,后者在振幅(变化程度,即减弱或加剧)和阶段(时间调节,即在不同时间点诱导基因表达)(图2b-c)。首先,不到一半的上调基因在这两种条件下重叠,下调转录本的比例甚至更小,其中更多的转录本在训练条件下发生了改变(图2c)。在功能上,未经训练的肌肉中有许多受到急性调控的基因,它们调控转录和应激反应、损伤、轴突引导和细胞外基质(ECM)组织的各个方面(图2d)。引人注目的是,在ECM重塑和轴突引导方面,训练肌肉的急性反应的功能预测与未训练肌肉的完全相反(图2d-e)。
重叠的77 个基序中有 18 个在幅度上存在显著差异。此外,在77个基序中的另外 22 个基序中,活性曲线指向相反的方向。例如,Wrnip1_Mta3_Rcor1基序活性在未训练的肌肉中较高,而在训练的肌肉中较低,并且基于与胶原蛋白形成的关联,可能有助于ECM重塑的不同模式(图2f)。
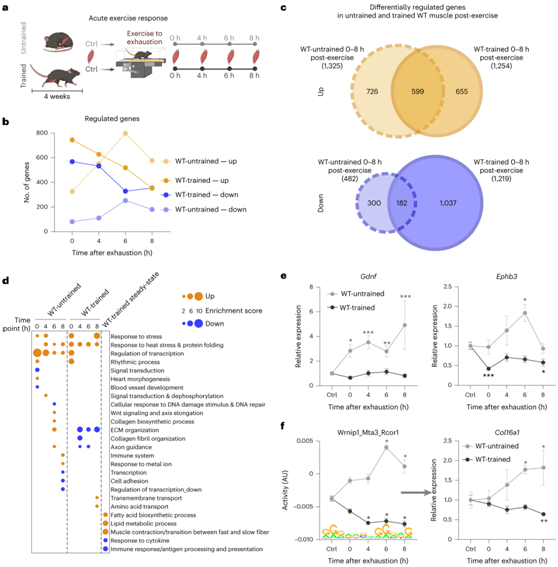
图2. 对运动的定性转录反应取决于训练状态。
(a) 实验设置的示意图。(b) 在未训练和训练过的肌肉中,急性疲劳运动后立即(0小时)、4小时、6小时和8小时差异表达的基因数量。(c) 维恩图显示未训练和训练肌肉中所有显著上调和下调基因。(d) 未训练和训练后肌肉运动后上调和下调基因的所有功能注释聚类的点图。(e) 参与轴突引导的未训练和训练肌肉的基因轨迹示例。(f) ISMARA 的基序活性和预测靶基因的表达变化,在未训练和训练的肌肉中显示出相反的调节。
除了未训练和训练肌肉之间功能基因聚类的差异外,还观察到急性扰动诱导的一些常见过程的定量特化,例如,转录调节或以训练状态依赖的方式对热应激的反应(图2d)。例如,调节轴血清反应因子-早期生长应答因子1的调节表明在训练肌肉中立即早期应激反应的减轻(图3a)。相反,其他转录调节因子(例如PGC-1α)的表达加剧,突出了未经训练和训练过的肌肉中基因调控事件的特异性(图3b)。有趣的是,与训练肌肉的减弱反应相反,大多数常见调控基因的最大峰值表达幅度在未训练和训练肌肉中非常相似,特别是73%的共同上调基因和近90%的共同下调基因(图3c)。然而,观察到时间轨迹的显著变化。例如,在受过训练的肌肉中,0小时的时候大量常见调控基因已经升高(图3d)。与训练模型导致基因表达普遍衰减的模型相反,这些结果显示了一个更复杂的情况:在急性最大运动后,未训练或训练肌肉的衰减、增加和选择性的基因表达变化,且基因表达的随时间转移(图3e)。
接下来,他们进行了简化代表性亚硫酸氢盐测序(RRBS),以对训练肌肉中的 DNA 甲基化事件进行分类(图3f)。在未受干扰的训练肌肉中,极少数差异甲基化区域 (DMR) 与基因表达变化相关。有趣的是,这些 DMR 的一个子集位于一组基因的基因组附近,这些基因在受过训练的肌肉中进行急性最大运动后受到调节(图 3g)。因此,这些表观遗传调节可能与未受干扰的训练肌肉中持续的基因表达模式无关,但更有可能有助于启动转录调控以引发急性运动。有趣的是,这些基因富集了与转录调节、Wnt 信号传导和轴突引导信号传导效应器相关的功能(图3g-h)。例如,核受体4A3 (Nr4a3)的诱导与训练肌肉DMR相关,它不仅在训练肌肉中比在未训练肌肉中大大加剧,而且在运动后立即表现出向峰值的移动(图3h)。
因此,表观遗传修饰可能导致受过训练的肌肉的不同基因表达发生急性扰动,主要影响调节基因,随后的下游后果与 DNA 甲基化变化无关。
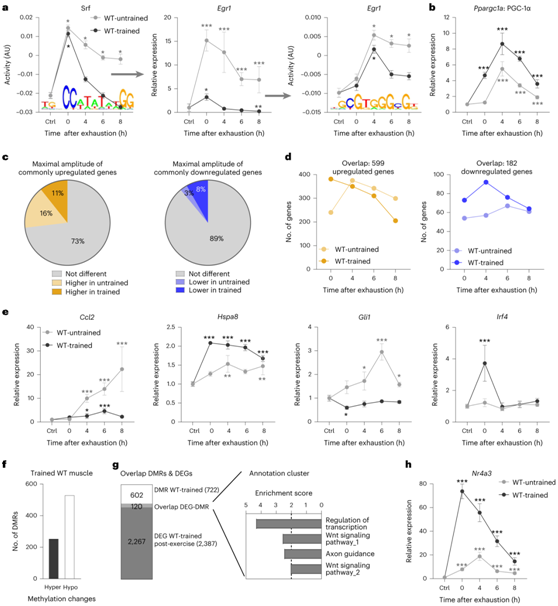
图3. 经过一轮力竭运动后,受过训练的 WT 肌肉的转录反应更快。
(a) 转录级联示例图。包括 ISMARA 预测的转录因子和下游靶标之一(基因表达和基序活性)。(b) 未训练(浅灰色)和训练(深灰色)肌肉中具有不同轨迹的转录调节因子。(c) 具有相同最大振幅(灰色)、未训练肌肉中较高振幅(浅色)或训练肌肉中较高振幅(深色)的共同调控基因的比例。 (d) 未训练(浅色)和训练(深色)肌肉中常见调节基因的时间轨迹可视化。(e) 在一次急性最大运动后,未训练和训练过的肌肉中不同基因轨迹的例子。(f) 与未受训练的静坐 WT 肌肉相比,训练肌肉中的 DMR 数量。(g) DEG分析和富集分数。(h) 转录因子在训练过的肌肉中发生差异甲基化,并且与未训练过的肌肉相比,训练后的肌肉在运动后表达更高。
03
PGC-1α对于正常训练适应必不可少
值得注意的是,许多转录调节因子在急性最大运动后早期强烈参与,在第一回合(未训练肌肉)和一段时间训练后表现出多样化,包括PGC-1α(图3b)。这种共调节蛋白通过整合各种信号通路,随后影响许多转录因子的活性,从而控制复杂的转录网络,从而参与急性反应。为了获得训练中肌肉PGC-1α的全面信息,他们用肌肉特异性PGC-1α敲除(mKO)小鼠重复了运动研究(图4a)。mKO 小鼠表现出耐力能力降低,比野生型 (WT) 对照小鼠减少约 40%(图4b)。PGC-1α功能丧失动物在训练4周后,在相对和绝对方面都显著提高了最大性能,达到了未经训练的WT小鼠的水平,但仍然明显低于经过训练的WT小鼠(图4b)。mKO 中的最大耗氧量 ( VO2max ) 未能改善(图4c),这暗示这些小鼠的耐力能力发生了另一种适应。与久坐的 WT 动物相比,久坐的 mKO 动物中已经发现许多参与线粒体呼吸、脂质代谢过程和 TCA 循环的训练调节蛋白的水平较低(图 4d-f)。
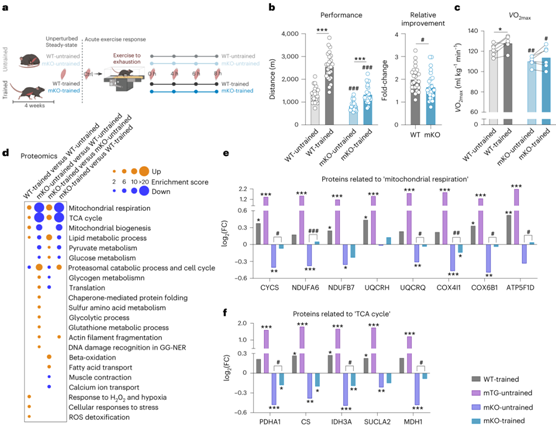
图4. PGC-1α对于长期训练的正常生理反应是必不可少的。
(a) 实验示意图。 (b) 未训练(浅色)和训练(深色)WT(灰色)和 mKO(蓝色)动物的表现的量化。(c) 训练前(浅色)和训练后(深色)VO2max的变化。(d) 富集分数>2的显著改变的蛋白质的所有功能注释聚类的点图。 (e-f) 参与线粒体呼吸和 TCA 循环的蛋白质表达分析。
接下来,他们研究了缺乏 PGC-1α 的训练肌肉的表型和蛋白质组适应的改变如何反映在转录组中。在久坐的小鼠中,PGC-1α的缺乏导致参与脂质代谢过程的基因明显转录抑制,在PGC-1α缺失的情况下通过训练调节的肌肉中的相关基因表达也显著减少(图5a)。值得注意的是,90%的上调转录事件和87%的下调转录事件依赖于WT肌肉中PGC-1α的存在(图5a),其中许多基因编码脂质代谢和快至慢肌纤维转变的蛋白质(图5b)。ISMARA 分析显示,Esrrb_Esrra 基序活性(雌激素相关受体-α 的结合位点)与训练相关的显著增加现象,在 mKO 小鼠中完全减弱(图 5c)。与此一致,该基序的活性在肌肉特异性PGC-1α功能获得转基因小鼠(mTG)中显著增加(图 5c)。因此,表型、蛋白质组和转录组数据强烈表明,PGC-1α 对于正常的生理训练反应是不可或缺的,尽管该因素仅在急性运动中短暂发挥作用。
接下来,他们试图验证PGC-1α对于长期训练反应的重要性(图4a)。首先,运动后(0小时),WT和mKO动物的反应在差异表达基因(DEG)数量以及基因表达幅度方面相对相似(图5d-e)。然而,在未训练的mKO肌肉中,在较晚的时间点(运动后4-8小时)发现转录诱导过程的大量钝化(图5d-f)。基因表达出现了实质性的质的差异,56%的基因上调和65%的基因下调依赖于PGC-1α的存在(图5g)。功能注释显示,这些基因中有许多编码参与ECM组织、信号转导、细胞周期/增殖等过程的蛋白质(图5h-i)。
最后,不同的转录组反应与实质性的调节重组有关:52%与未经训练的WT肌肉的急性最大运动反应相关的基序活性在mKO中消失(例如与ECM重塑相关的Wrnip1_Meta3_Rco1)(图5j)。
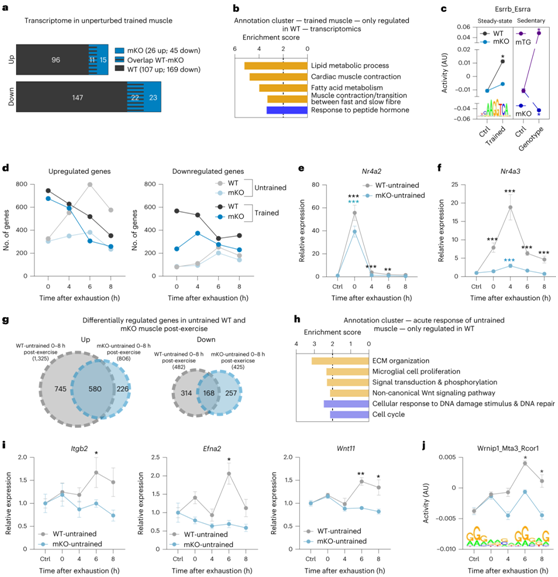
图5. PGC-1α 对于急性最大运动的正常转录反应是不可或缺的。
(a) WT(灰色)和 mKO(蓝色)肌肉中基因改变的 Bar Venn 图。(b) 上调(橙色)和下调(蓝色)的基因的所有功能注释聚类。(c) 转录因子活性分析。(d) 上调和下调的基因数量。(e-f)基因表达分析。 (g) WT(浅灰色)和mKO(浅蓝色)小鼠剧烈运动后所有上调和下调基因的维恩图。 (h) 上调(橙色)和下调(蓝色)基因的所有功能注释聚类。(i)基因的相对表达分析。(j) 使用ISMARA预测基序的活性。
04
PGC-1α 调控运动相关的 DNA 甲基化过程
接下来,他们比较了训练过的 mKO 肌肉和训练过的 WT 肌肉的急性运动反应。首先,在WT和mKO肌肉中观察到基因表达向0小时的时间转变(图5d)。尽管在训练肌肉中只有39%上调基因依赖于PGC-1α,但在训练肌肉中常见的PGC-1α依赖性下调基因的比例与未训练肌肉中的比例相似(图6a)。功能上,这些基因编码参与转录、脂质和碳水化合物代谢以及ECM重塑的蛋白质(图6b)。有趣的是,在未训练和训练的WT肌肉的急性最大运动中,ECM重构的增加和减少似乎都依赖于这种共调节因子的存在(图5h,图6b-d)。值得注意的是,WT和mKO肌肉在运动后(0小时)的基因数量有显著差异(图5d)。在训练过的肌肉中,急性运动显示39%的TF活性在mKO肌肉中显著下降,例如调节炎症相关基因的Irf3和Irf2_Irf1_Irf8_Irf9_Irf7(图6e)。
在未受干扰的训练肌肉中,发现高甲基化区域的比例明显更高,与WT股四头肌中以低甲基化为特征的DMR几乎没有重叠(图 6f)。然而,尽管未经训练的WT和mKO肌肉在0小时急性最大运动后的绝对事件数量相当,但大多数dmr-基因关联是不同的。此外,运动后4小时mKO肌肉的DMR绝对数量明显少于WT肌肉,同样没有什么共性(图6g-h)。尽管WT和mKO肌肉之间存在所有这些差异,但只要差异影响的DMR可能与相应基因相关,就会在两种表型中出现强大的功能聚类“转录”,表明这些短暂的DNA甲基化事件与急性转录调节密切相关(图6i)。
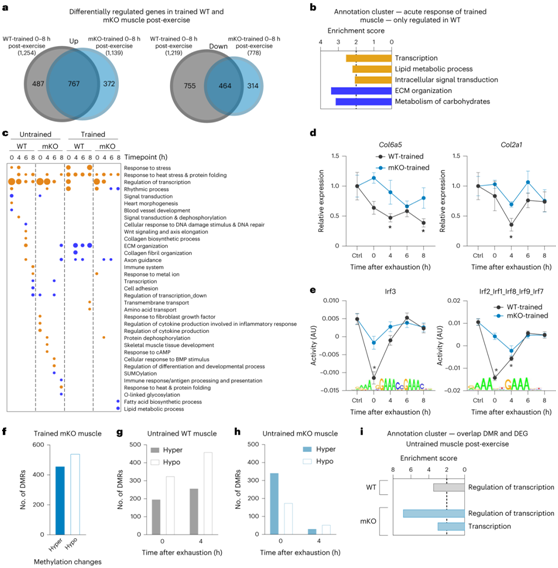
图6. PGC-1α 控制运动相关的 DNA 甲基化事件。
(a) WT(深灰色)和mKO(深蓝色)小鼠在剧烈的最大运动后所有上调和下调基因的维恩图。(b) 上调(橙色)和下调(蓝色)基因的所有功能注释聚类。(c) 上调(橙色)和下调(蓝色)基因的所有功能注释聚类的点图。(d)基因的相对表达分析。 (e) 使用 ISMARA 预测仅在 WT 肌肉中发生变化并与炎症相关的基序活性。 (f) DMR 数量分析。(g-h) 高甲基化(实心条)和低甲基化(空心条)区域的数量分析。(i) 基因的所有功能注释聚类均发生差异甲基化和转录调节。
+ + + + + + + + + + +
结 论
本项研究基于对表观遗传、转录组、蛋白质组和磷酸蛋白质组变化,系统、全面地研究了小鼠肌肉的急性最大耐力运动和慢性训练反应。结果表明,尽管在基线时定义训练肌肉的基因数量出乎意料地少,但训练状态在数量和质量上都会极大地影响对急性运动的转录反应,部分与表观遗传修饰有关。最后,PGC-1α等短暂激活因子对于正常训练适应是必不可少的。总之,这些结果提供了时间和训练状态依赖性运动反应的分子机制,为理解训练中的肌肉可塑性提供了新的见解。
+ + + + +



 English
English


