文献解读|Nat Microbiol(28.3):409 个细菌-药物对的高通量转录组学揭示了肠道微生物群扰动的驱动因素
✦ +
+
论文ID
原名:High-throughput transcriptomics of 409 bacteria–drug pairs reveals drivers of gut microbiota perturbation
译名:409 个细菌-药物对的高通量转录组学揭示了肠道微生物群扰动的驱动因素
期刊:Nature Microbiology
影响因子:28.3
发表时间:2024.01.17
DOI号:10.1038/s41564-023-01581-x
背 景
许多药物会扰乱肠道微生物群,可能导致负面健康后果。然而,大多数微生物-药物反应的机制尚未在基因水平上得到阐明。
实验设计
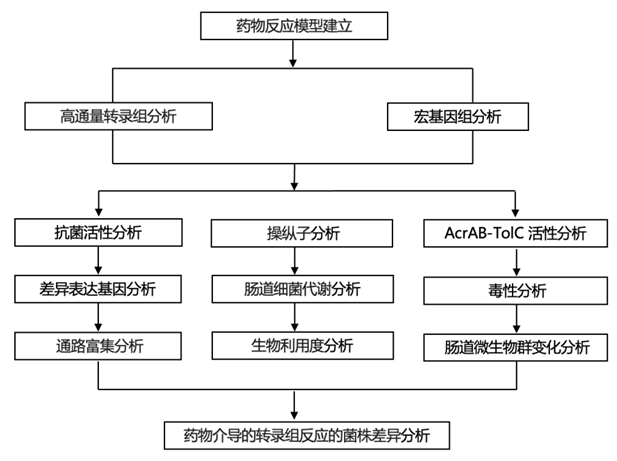
结 果
01
微生物对药物反应的转录组图
在当今最常用的 200 种药物中,83% 是口服药物,预计会直接与肠道微生物相互作用。他们实施和优化了多重RNA测序(RNA-seq)技术,用于非模式肠道细菌的高通量转录组学(图1a)。根据美国医疗保健研究和质量署(Agency for Healthcare Research and Quality)的数据,他们组成了一个由14个代表性和高度流行的人类肠道分离株组成的小组,这些分离株涵盖拟杆菌门、厚壁菌门、放线菌门和变形菌门,以及来自2017年处方量最高的19种口服药物。他们首先评估了所选药物对细菌小组的抗菌活性(图1b)。选择的药物浓度跨越小肠和大肠内的药物浓度中值,估计分别接近20和100µM。在100µM时,19株菌株中有18株在24 h内至少有一种药物抑制生长(图1b)。值得注意的是,长双歧杆菌在任何药物条件下都没有表现出生长缺陷。辛伐他汀、氨氯地平和一部分精神治疗药物(即舍曲林、帕罗西汀、度洛西汀和氟西汀)具有广谱抗菌活性,这与以前的报告一致。有趣的是,他们在拟杆菌中观察到最大程度的药物诱导生长缺陷,这表明这些物种更容易受到药物毒性的影响。
由于明显的生长抑制会干扰转录测定,他们在20µM进行了所有后续的转录组分析,该浓度合理地接近肠道药物浓度,用于检测药物反应,同时最大限度地减少药物毒性。总体而言,在药物类别和细菌门中观察到大量且一致的转录反应。他们通过计算每个基因组的差异表达基因(DEG)与总基因计数的比值(他们称之为DEG比值或DEGR),将总体转录反应的大小作为常用替代指标(图1c)。辛伐他汀(0.014)、舍曲林(0.010)、左甲状腺素(0.006)和帕罗西汀(0.004)的总DEGR最大(图1c)。值得注意的是,在许多情况下,引起大的整体转录变化的药物在生长筛选中也表现出广谱毒性(图1b-c)。
较大的转录变化通常与整体调节因子和转录因子(TF)的表达变化有关。产生大而广泛的基因表达变化的药物-微生物暴露通常与药物毒性相关,而引起特定转录反应的药物-微生物暴露则可能不相关(图1b-c)。
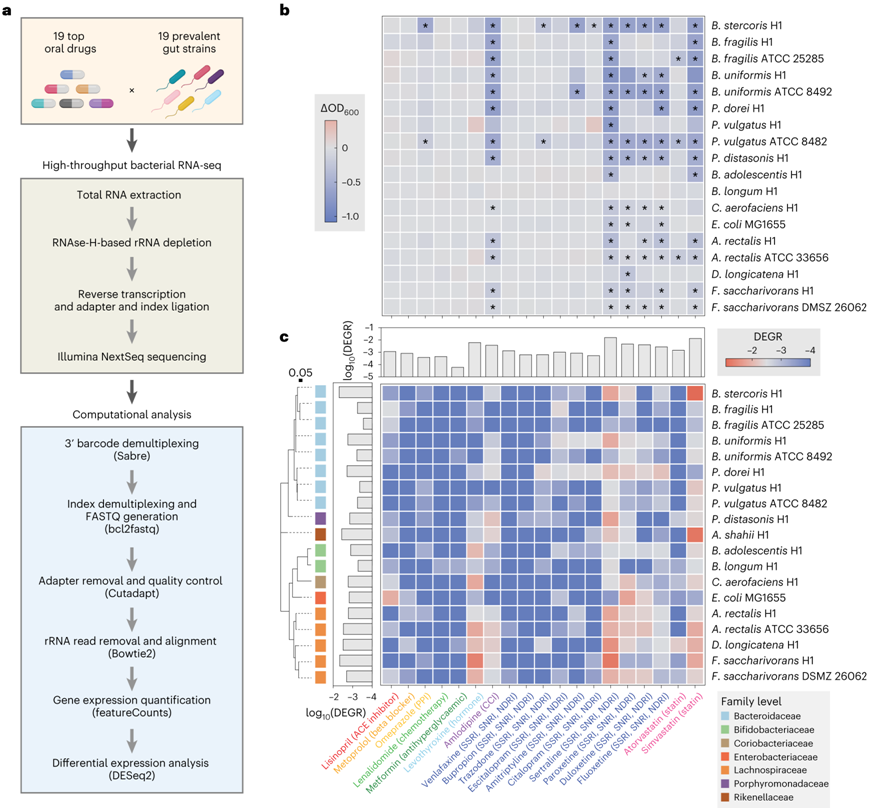
图1. 处方药物可引发常见肠道细菌物种的转录组。
(a) 非模型肠道微生物高通量转录组流程示意图。 (b) 热图颜色表示与同体积溶剂对照相比,在添加了 100 µM 不同药物的 mGAM 中细菌菌株生长 48 小时时的平均 OD 值。 (c) 差异表达基因分析。
为了了解不同暴露对肠道微生物群的功能影响,他们使用京都基因和基因组百科全书 (KEGG) 数据库进行了通路富集分析,以对整个药物组中的 DEG 进行分类(图2)。大多数差异调节模块与抗生素耐药机制相关(图2a)。具体来说,与多药耐药、转运和双组分系统相关的途径发生富集。辛伐他汀、舍曲林和氨氯地平——在生长筛选中显示出最广泛毒性的药物——强烈上调了与外排转运体相关的多药耐药途径。此外,曲唑酮和左甲状腺素在拟杆菌门、厚壁菌门和放线菌门中引起差异表达,但不影响生长(图1b-c),显示出类似的富集途径,产生毒性更强的筛选化合物(图2a)。
虽然在曲唑酮和左甲状腺素处理的培养物中,在最大浓度下未检测到生长缺陷,但这一结果表明,当浓度超过100µM时,这些化合物可能在体内表现出毒性。
接下来,他们研究了在不同药物条件下表现出最大程度差异调节的通路中的功能同源物(图2b)。在前7个上调最多的同源物中,6个与保守的多药物外排泵相对应(图2b)。在这些同源物中,最前面的4个(HAE1、AcrA、mexK和oprM)属于耐药-结瘤-分裂渗透酶超家族,这是一个药物和重金属外排系统,其上调与革兰氏阴性细菌的抗生素耐药性有关。第5和第6个同源物(bcrB和ABCB-BAC)属于ATP结合盒(ABC)超家族,在各种药物条件下,这两个同源物在下调最多的同源物中也有很高的代表性(图2b)。
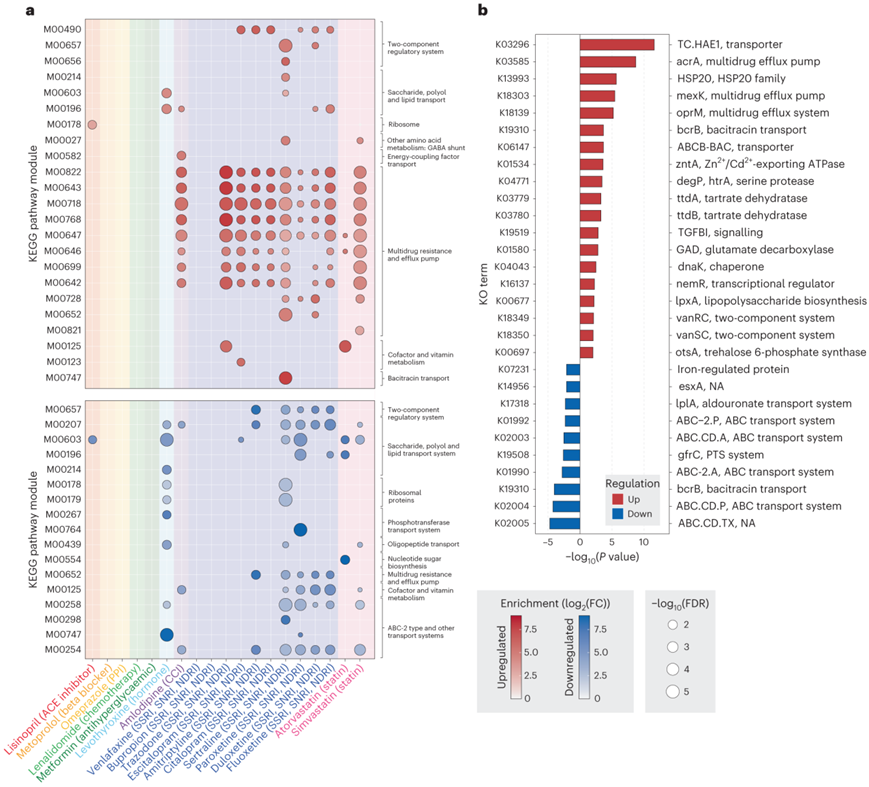
图2. 通路富集分析揭示了药物化合物对保守外排通路的调节。
(a) 基于 DEG 数据集的通路分析的具有显著富集的 KEGG 模块。(b) DEG 数据集中跨药物的前 19 个上调和前 10 个下调功能直系同源物。
02
药物影响肠道的生物利用度、生物合成和毒性
为了探索生理相关的细菌-外源性相互作用的多样性,他们选择了与药物代谢、维生素生物合成和毒性减轻相关的三个代表性操纵子进行进一步分析(图3a-d)。
首先,他们观察到酒石酸美托洛尔(一种用于治疗高血压的 β 受体阻滞剂)处理后的大肠杆菌、直肠杆菌和D. longicatena中酒石酸脱水酶(ttd)操纵子的上调(图3a)。对于细菌来说,通过ttd操纵子的酒石酸盐代谢为胃肠道提供了另一种碳源。本项研究结果表明,某些肠道微生物可以代谢即刻释放的美托洛尔的酒石酸盐,这可能导致患者群体中药物生物利用度的波动。
利用已发表的T2D患者的临床宏基因组微生物组数据,他们进行了额外的分析,以探索服用美托洛尔的T2D患者中ttd基因的分布。与未服用美托洛尔的患者和健康对照相比,服用美托洛尔的T2D患者的肠道宏基因组中ttd操纵子的丰度增加(图3b)。
接下来,他们确定了几种药物对D. longicatena核黄素生物合成(rib)操纵子的差异调节(图3c)。肠道微生物群是人体核黄素(维生素B2)的重要来源。核黄素是细菌产生核黄素的重要途径,下游代谢产物黄素单核苷酸和黄素腺嘌呤二核苷酸是氧化酶、还原酶和脱氢酶的辅酶。在革兰氏阳性细菌中,核黄素的生物合成受到黄素单核苷酸反应核糖开关(riboswitch)的下调,该开关也对玫瑰黄素作出反应。
最后,他们观察到在所有测试的拟杆菌属菌株(脆弱拟杆菌、粪类杆菌、均匀拟杆菌、P. dorei、P. vulgatus、Parabacteroides distasonis、A. shahii)中,他汀类药物介导的编码 AcrAB-TolC 外排泵的基因均出现强烈上调(图3 d)。AcrAB-TolC 泵与多种抗生素以及非抗生素口服药物(包括甲氨蝶呤和他莫昔芬)的耐药性有关。
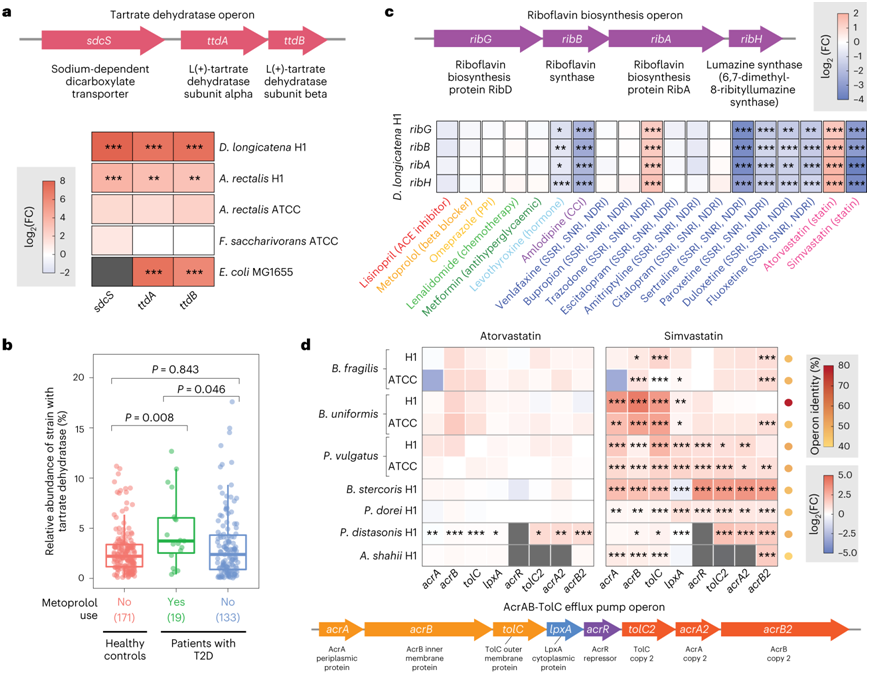
图3. 药物化合物影响肠道细菌代谢、维生素生成和有毒代谢物的缓解。
(a) 大肠杆菌中酒石酸脱水酶 (ttd) 操纵子的组成部分。(b) 含有ttd操纵子的细菌分离株的相对丰度。 (c) D. longicatena H1 中核黄素生物合成 (rib) 操纵子的组成部分。热图颜色表示 TPM 表达式中的 log 2 (FC)。(d) 阿托伐他汀和辛伐他汀对拟杆菌目分离株内acrAB-tolC的调节。
03
他汀类药物调节肠道微生物中的 AcrAB-TolC 活性
在本项研究的转录组筛选中,他们发现辛伐他汀在多个拟杆菌目菌株中强烈上调acrAB-tolC基因,而阿托伐他汀仅在P. distasonis中显著上调acrAB-tolC基因(图3d)。有趣的是,这些转录谱分别与辛伐他汀和阿托伐他汀在生长筛选中表现出的强毒性和中度毒性相关(图1b),这激发了进一步探索AcrAB-TolC在肠道微生物和抗菌化合物之间相互作用中的作用。
然后,他们用视黄醇处理四种拟杆菌属菌株(P. distasonis H1、P. dorei H1、P. vulgatus H1和P. vulgatus ATCC 8482),在存在或不存在他汀类药物和其他药物(舍曲林,曲唑酮,氨氯地平)的情况下观察到可以上调acrAB-tolC操纵子(图4a)。在20µM时,辛伐他汀增强了所有拟杆菌菌株对视黄醇的敏感性,其中以P. distasonis和P. vulgatus的敏感性最强(图4a)。舍曲林适度提高了所有拟杆菌属菌株的视黄醇敏感性,氨氯地平对四种菌株中的两种(P. vulgatus H1和P. dorei H1)有相似的作用,阿托伐他汀适度降低了P. distasonis的视黄醇最低抑菌浓度(MIC),曲唑酮对所有菌株的视黄醇MIC均无显著影响(图4a)。
脱氧胆酸(DCA)是一种次生胆汁酸,其毒性也由AcrAB-TolC调节。因此,他们分析了辛伐他汀是否增强了diasonis的DCA毒性。与DCA共孵育时,20 μM辛伐他汀显著限制了P. distasonis的生长(图4b)。
在确定了辛伐他汀显著上调拟杆菌属AcrAB-TolC,并且这种暴露增加了拟杆菌属对视黄醇和DCA的敏感性之后,他们下一步试图证实AcrAB-TolC上调直接增加了对饮食代谢物的敏感性。为了确定AcrAB-TolC上调与拟杆菌属物种对视黄醇的侧支敏感性增加之间的因果关系,他们设计了一种普通假杆菌H1分离物,使其过表达不同拷贝的AcrAB-TolC或对照物,并检测了暴露于辛他汀或DMSO的工程分离物的视黄醇MIC(图4c)。与对照质粒过表达相比,AcrAB-TolC的任何一个拷贝过表达均增加了侧支循环对维生素A的敏感性,这证实了外排泵过表达直接增加了侧支循环对维生素A的敏感性。值得注意的是,虽然在对照菌株中质粒过表达与最小的毒性相关,但AcrAB-TolC的表达也增加了20µM浓度的辛伐他汀的毒性。
辛伐他汀通常作为内酯前药给药,而阿托伐他汀以活性化合物形式给药(图4d)。鉴于内酯部分在许多抗生素中的作用,他们想知道辛伐他汀对AcrAB-TolC外排泵的转录调节是否与其内酯部分的毒性有关。为了检测辛伐他汀中的内酯环是否诱导毒性,他们用内酯前药(辛伐他汀)、非内酯活化化合物(替尼伐他汀)和阿托伐他汀孵育辛伐他汀敏感的P. distasonis和P. vulgatus菌株(图4e)。有趣的是,不含内酯环的替尼伐他汀对两种测试菌株都没有表现出毒性。值得注意的是,AcrAB-TolC优先结合疏水底物(例如亲脂内酯侧链)。
为了确定膳食代谢物对细菌抑制的 AcrAB-TolC 调节是否取决于有毒辛伐他汀内酯部分的存在,他们将 P. distasonis菌株暴露于存在或不存在 20 µM 辛伐他汀或替尼伐他汀的不同浓度的视黄醇中(图 4f)。替尼伐他汀不会降低视黄醇的 MIC,这表明未代谢前药辛伐他汀的完整内酯环对于增强细菌视黄醇敏感性是必要的。
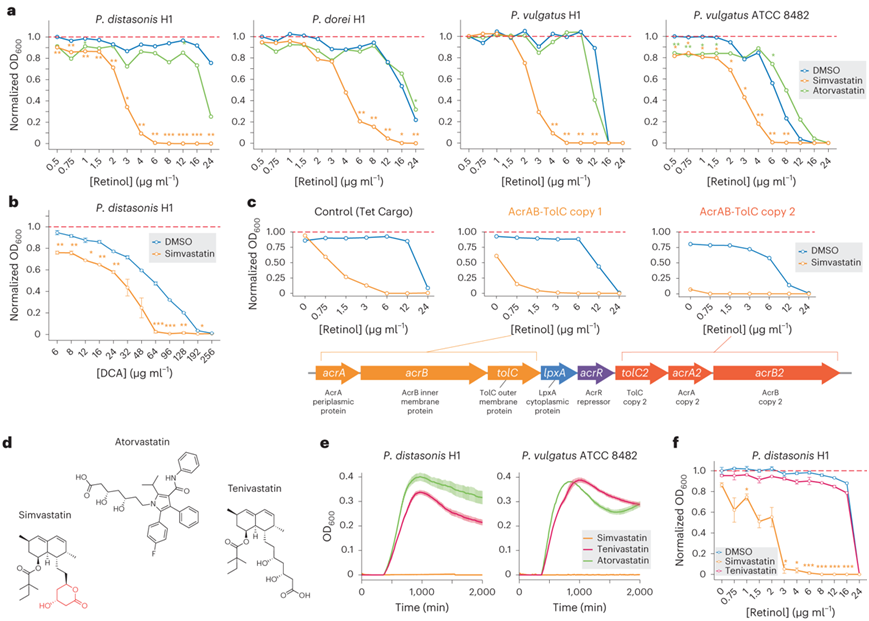
图4. 他汀类药物暴露通过 AcrAB-TolC 外排泵改变拟杆菌对常见膳食代谢物的敏感性。
(a) 在 20 µM 辛伐他汀(橙色线)、阿托伐他汀(绿线)或载体对照(蓝线)存在下,暴露于不同浓度视黄醇的拟杆菌菌株。 (b) P. distasonis H1 在 20 µm 辛伐他汀(橙线)或载体对照(蓝线)存在下暴露于不同 DCA 浓度。(c) P. vulgatus H1过表达不同拷贝的AcrAB-TolC(见示意图)或在20 μM辛伐他汀存在下暴露于不同浓度视黄醇的质粒对照。 (d) 阿托伐他汀、辛伐他汀和替尼伐他汀(辛伐他汀-羟基酸)的结构。辛伐他汀的内酯环显示为红色。(e) P. distasonis H1和P. vulgatus ATCC8482在添加了辛伐他汀、替尼伐他汀或阿托伐他汀的100µM浓度的mGAM液体中生长。(f) P. distasonis H1视黄醇MIC曲线。
接下来,为了更好地了解AcrAB-TolC在人类肠道微生物组中的流行情况,他们评估了来自健康人类微生物组的4930个具有代表性的宏基因组组装基因组(MAG)的频率(图5a)。共有106个MAG含有完整的AcrAB-TolC同源序列,其中59.4%与拟杆菌科相关联。AcrAB-TolC在拟杆菌科的高流行率表明,拟杆菌科为主的个体可能特别容易受到辛伐他汀介导的微生物群变化的影响。
为了探索辛伐他汀诱导的acrAB-tolC操纵子上调的临床相关性,他们接下来量化了来自体重指数谱(BMIS)队列的粪便样本中该操纵子同源物的宏基因组丰度(图5b-d)。值得注意的是,AcrAB-TolC泵在BMIS队列的粪便宏基因组中非常普遍,91.6%的研究参与者在治疗组中显示AcrAB-TolC的中位相对丰度>20%(图5b)。此外,他们观察到接受辛伐他汀治疗的患者肠道微生物组中AcrAB-TolC操纵子的相对丰度显著降低(图5b)。相比之下,在接受阿托伐他汀、氟伐他汀、普伐他汀或瑞舒伐他汀治疗的患者中,acrAB-tolC基因丰度未发生变化。相应地,接受辛伐他汀治疗的患者也显示出拟杆菌属的显著减少,以及Alistipes和未分类的厚壁菌门的增加(图5c)。此外,与未接受辛伐他汀治疗的对照组相比,在接受辛伐他汀治疗的队列中,拟杆菌和其他含有完整AcrAB-TolC同源物的细菌显著减少,而缺少该操纵子的细菌则没有减少(图5d)。
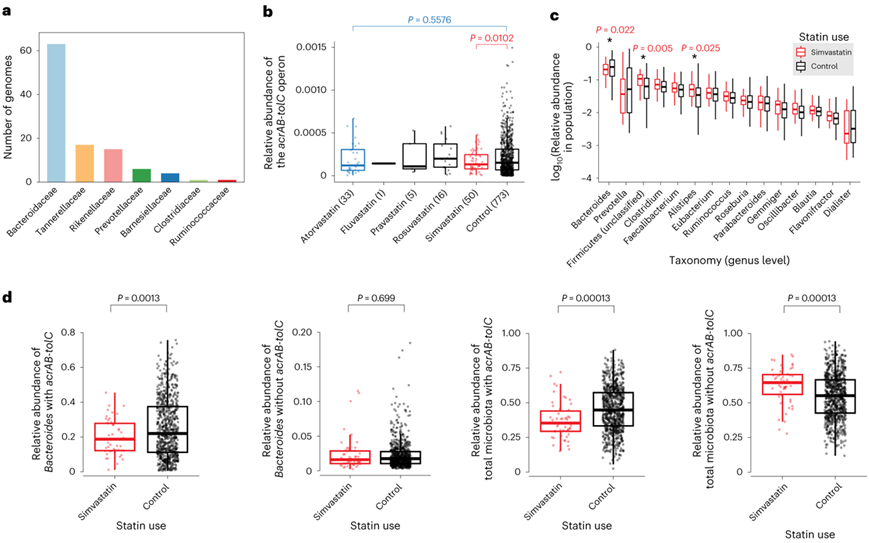
图5. AcrAB-TolC 与他汀类药物治疗患者群体的肠道微生物群变化有关。
(a) 基于参考文献包含acrAB-tolC类似物的基因组数量。(b) BMIS 队列的治疗组内acrAB-tolC的相对丰度以箱线图显示。 (c) BMIS数据集中细菌种类的相对丰度。 (d) BMIS队列中接受辛伐他汀治疗和未接受辛伐他汀处理的个体中拟杆菌种类(左两个组)或所有肠道细菌(右两个组)的相对丰度。
04
药物介导的转录组反应的菌株差异
最后,他们试图探索药物-微生物转录反应在这些菌株之间有何不同。首先,他们通过主坐标分析(PCoA)评估了所有药物的DEGR,以量化菌株全球转录组谱的相似性。有趣的是,发现微生物对药物的反应在家族水平上显著聚集(图6a),这表明密切相关的细菌可能对不同的药物有相似的反应。然而,同种菌株的详细比较揭示了更可变的反应模式。例如,虽然直肠单胞杆菌菌株(H1与ATCC 33656)表现出高度一致的药物反应,但均匀单胞杆菌菌株(H1与ATCC 8492)对药物的反应更为异质性(图6a)。
为了进一步描述药物反应的菌株特异性,他们接下来量化了不同拟杆菌科菌株对之间的平均核苷酸相似性(ANI),并将其与菌株之间的全局转录组反应(DEGR值)的相关性进行了比较(图6b)。在ANI值最大的配对之间,总体药物应答的相关性较高,这表明细菌基因组越相似,不同药物条件下的总体转录组应答越相似(图6b)。为了更密切地比较同种菌株的转录组反应,他们接下来对所有同种菌株的基因组进行了比对。
接下来他们试图在操纵子水平上研究菌株水平的药物反应。值得注意的是,他们发现了同种菌株之间两种常见的转录差异:(1)一个分离株中缺乏操纵子;(2)分离株之间共有操纵子的差异调节,这两种差异都可能产生功能影响。例如,舍曲林上调了直肠放线菌H1中含有IV型分泌系统机制的可移动元件,而直肠放线菌ATCC 33656中不存在这种移动元件(图6c)。类似地,舍曲林和帕罗西汀上调了B. Uniformis H1 中的 BepE 外排机制,而 ATCC 8492 中不存在这种机制(图6c)。另一方面,一些药物(舍曲林,帕罗西汀,左甲状腺素,辛伐他汀)下调了直肠不动杆菌H1中一个公认的L-阿拉伯糖利用操纵子,但同一操纵子在直肠不动杆菌33656中没有差异表达(图6c)。相反,这些化合物仅下调了A. rectalis 33656中一个共同的转酮醇酶操纵子(图6c)。有趣的是,除了分离株之间共有操纵子表达的差异外,他们还观察到相同药物扰动对不同基因拷贝的差异调节(图6c)。例如,在F. saccharivorans DSMZ 26062中,左旋甲状腺素、舍曲林、辛伐他汀和帕罗西汀暴露会同时引发araQ不同拷贝的上调和下调,araQ是一种与L-阿拉伯糖运输相关的渗透酶蛋白(图6c)。菌株水平的高度功能多样性可以解释临床药物研究中经常观察到的大量微生物组组成差异。
总之,这些结果强调了利用基因组信息在菌株水平评估细菌药物反应的重要性,以及将传统微生物药物筛选扩展到多个同种菌株以捕获药物反应的完整菌株内多样性的重要性。
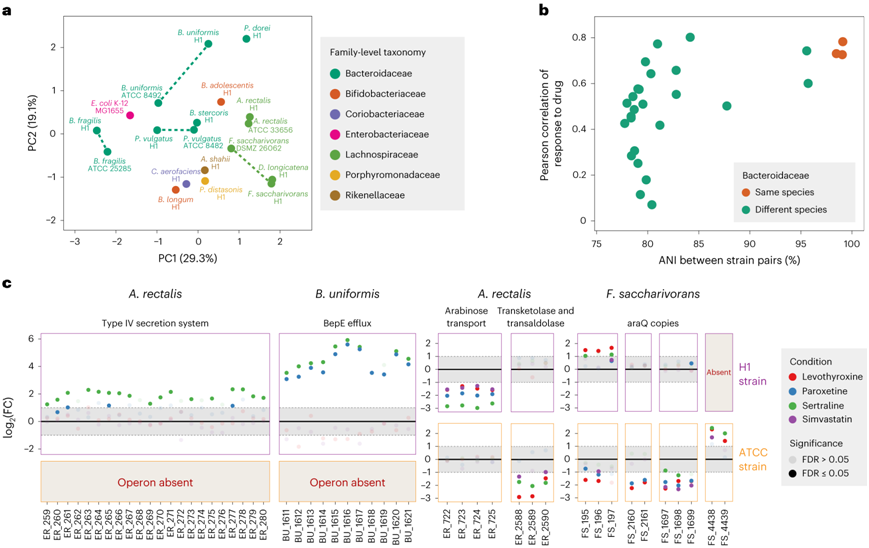
图6. 同种细菌分离株之间转录反应的不同模式。
(a) PCoA 结果图,比较测试的肠道细菌分离株与药物化合物的转录组反应,使用每种药物条件下的 DEGR 作为特征。 (b) 对于每对可能的拟杆菌科菌株,显示了 ANI(显示在x轴上)和所有药物条件下 DEGR 的 Spearman 相关性。 (c) 辛伐他汀、舍曲林、帕罗西汀和左甲状腺素对不同菌株操纵子的不同调控。
+ + + + + + + + + + +
结 论
本项研究利用高通量细菌转录组学系统地表征了暴露于最常用口服药物的常见人类肠道细菌的基因表达谱。在超过 400 个药物-微生物对中,观察到显著且可重复的转录反应,包括涉及多药耐药性、代谢物转运、酒石酸代谢和核黄素生物合成的途径。重要的是,他们发现他汀类药物介导的拟杆菌属 AcrAB-TolC 外排泵的上调可增强微生物对维生素 A 和次级胆汁酸的敏感性。此外,服用辛伐他汀的患者具有acrAB-tolC基因的肠道细菌发生耗竭,这表明药物流出相互作用会产生附带毒性,从而耗尽患者微生物组中含有泵的微生物。这项研究为进一步了解药物介导的微生物群变化的驱动因素提供了新的理论依据,以便更好地进行临床干预。
+ + + + +



 English
English


