文献解读|iScience(5.8):通过定量蛋白质组学研究 HMGB1 作为早期糖尿病肾病监测的潜在血清生物标志物
✦ +
+
论文ID
原名:Investigating HMGB1 as a potential serum biomarker for early diabetic nephropathy monitoring by quantitative proteomics
译名:通过定量蛋白质组学研究 HMGB1 作为早期糖尿病肾病监测的潜在血清生物标志物
期刊:iScience
影响因子:5.8
发表时间:2024.01.08
DOI号:10.1016/j.isci.2024.108834
背 景
糖尿病(DM)是一种以胰岛素分泌或利用受损引起的慢性高血糖为特征的慢性代谢性疾病。全球有超过 4.15 亿人患有糖尿病,预计到 2045 年将有 6.93 亿人诊断出患有糖尿病。糖尿病肾病(DN)是DM主要的微血管并发症之一,大约30-40%的DM患者会发展为DN。目前DN的诊断方法缺乏精确性,特别是在早期阶段和监测进展情况。
实验设计
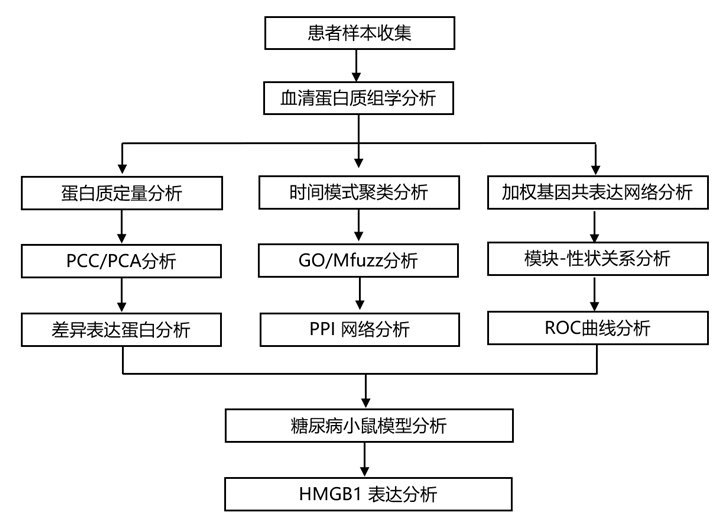
结 果
01
血清蛋白质组分析的参与者特征和评估
本项研究共招募96名患者,包括健康对照(NC)、糖尿病(DM)和糖尿病肾病(DN),根据肾脏疾病改善整体结局(KDIGO)的慢性肾脏疾病(CKD)的eGFR分类,将患者进一步分为四组(图1A):健康对照(NC)、糖尿病组(DM)、早期中期(DN-EM),晚期(DN-L),每组6例。四组参与者之间的性别和尿酸水平没有发现显著差异。DM、DNEM、DNL组血糖水平显著高于NC组。DN-L组血清肌酐、胱抑素C水平显著升高,血尿素氮与血清肌酐比值显著低于NC组和DM组,而血尿素氮水平显著高于NC组和DM组。
血清中的不同蛋白质水平范围很大,并且与组织或细胞样品相比非常异质。为了获得更全面、有用的与DN发病相关的蛋白质。随后,通过 LC/MS 鉴定了 1602 个蛋白质,其中 1402 个蛋白质可以定量(图 1 B)。大部分肽段分布在7-20个氨基酸之间,与酶解和质谱裂解模式的一般规律一致,表明质谱鉴定的肽段长度分布符合质量控制标准(图1C)。
为了确保血清样本和检测技术的可靠性,并确认定量结果的统计一致性,采取了综合方法。这涉及到使用各种方法,包括皮尔逊相关系数 (PCC)、主成分分析 (PCA) 和相对标准偏差 (RSD) 评估。PCC分析表明,所有样本之间存在较高的相关性,相关系数普遍高于0.9(图1D)。通过 PCA 对这些蛋白质的进一步分析表明,可以成功地区分四个组,特别是在 NC 和 DM 组中,每组内的重现性都很高(图 1 E)。值得强调的是,与其他阶段相比,DN-EM 和 DN-L 组表现出最明显的差异,这表明 DN 阶段蛋白质表达谱发生了显著变化(图 1 F)。
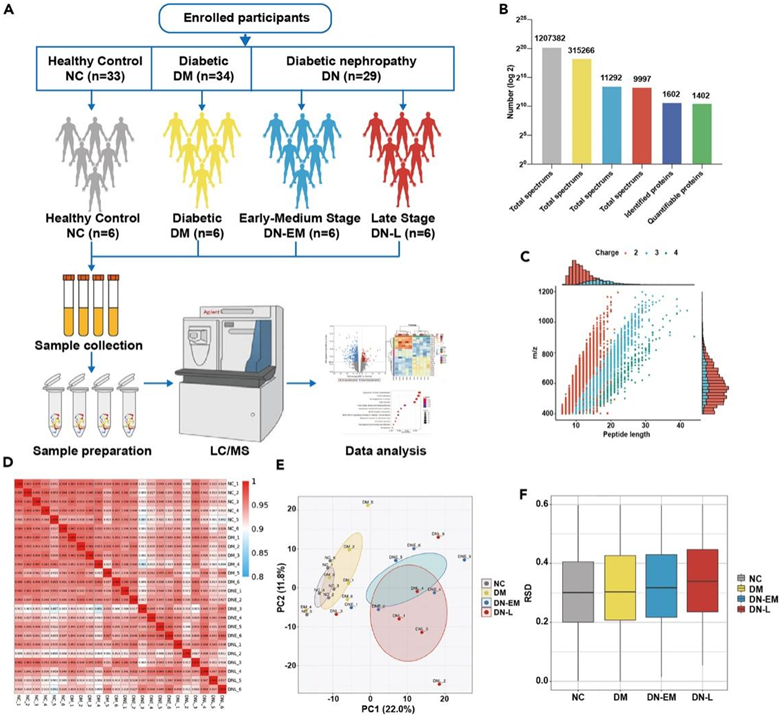
图1. DN患者血清蛋白质组学设计及质量控制。
(A)实验流程分析。(B) LC-MS/MS分析鉴定的蛋白数量分析。(C) LC-MS/MS分析中可识别肽长度的分布。(D) NC、DM、DN-EM和DN-L组蛋白质组学数据的Pearson相关系数(PCC)分析。(E)蛋白质组学数据的主成分分析(PCA)显示NC、DM、DN-EM和DN-L组之间存在差异。(F)蛋白质组学数据的相对标准偏差(RSD)显示NC、DM、DN-EM和DN-L组内数据的可重复性。
02
糖尿病肾病患者血清蛋白质组分析
综合观察DN发病相关的蛋白质组变化,他们对血清蛋白质组定量结果进行差异表达蛋白(DEP)分析,热图总共显示了 484 个差异蛋白(图 2 A)。在聚类热图中,大多数 NC 和 DM 组具有相同的差异表达蛋白模式,而 DN-EM 和 DN-L 组具有相同的模式。此外,他们分析了 NC、DM、DN-EM 和 DN-L 组之间成对比较的火山图,以可视化差异表达的蛋白质(图 2B -G)。在组间成对比较的背景下,他们鉴定出了差异表达的蛋白质(图2H)。仔细观察两个 DN 组与 NC 和 DM 组相比,差异表达的蛋白质更多,并且与 DN-EM 和 DN-L 相比,NC 组的差异表达蛋白质尤其最多。然后,他们从组间成对比较中选择所有差异表达蛋白,并绘制它们的 UpSet 图,其中暗示 DN-EM 与 NC、DN-L 与 NC、DN-EM 与 DM 中 40 个常见上调蛋白和 23 个常见下调蛋白,以及 DN-L 与 DM(图 2 I-J)
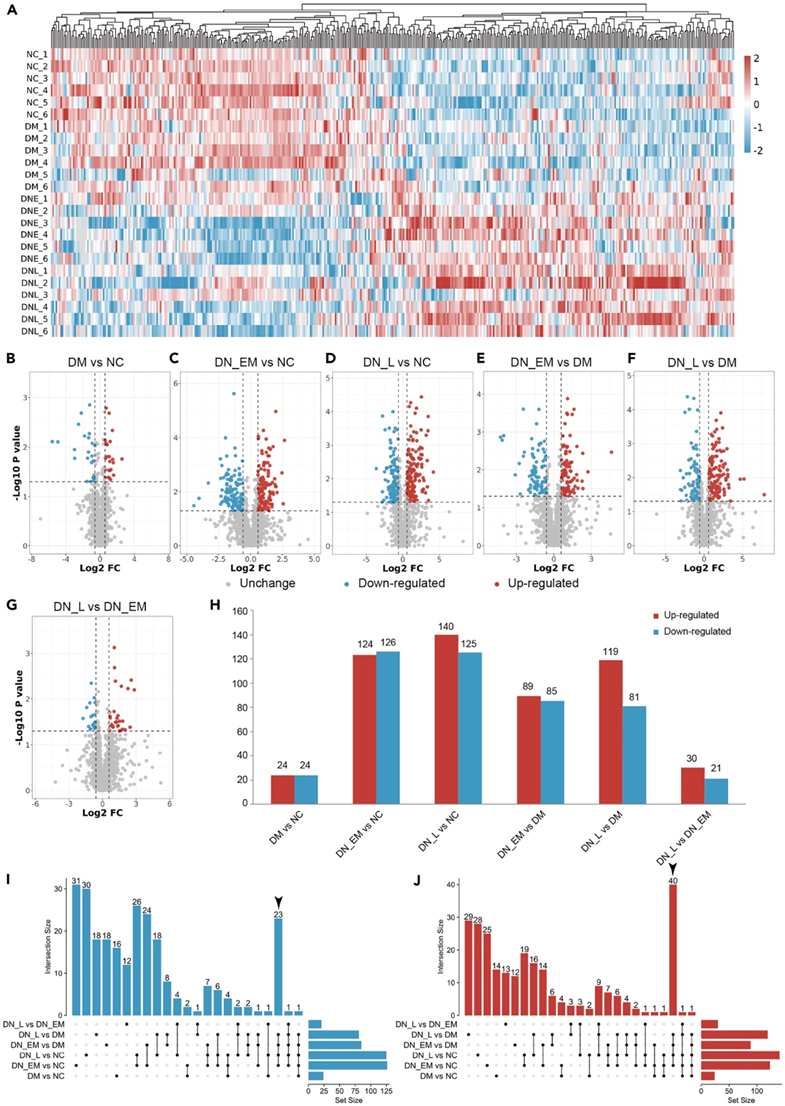
图2. DN患者血清蛋白质组分析。
(A) NC、DM、DN-EM 和 DN-L 组蛋白质组数据中差异表达蛋白 (DEP) 的热图。(B–G) 每个成对比较的蛋白质组数据中的 DEP 火山图。(H) 每个成对比较的蛋白质组数据中增加和减少的 DEP 的概述。(I-J) UpSet 图显示了每次配对比较的蛋白质组数据中 DEP 之间的交叉点。
03
血清蛋白质组学揭示糖尿病肾病的进展
他们进行了模糊 c 均值算法19对循环中 DN 进展和发病的潜在蛋白质决定因素进行聚类。它可以对相关的蛋白质表达模式进行聚类,同一聚类中的蛋白质表现出相似的表达变化趋势。总共观察到 5 个不同的时间模式聚类,代表不同的调节蛋白(图 3)。在这些聚类中,聚类1 代表下调的蛋白质,聚类2 和 5 代表上调的蛋白质,聚类3 和 4 代表双峰表达的蛋白质。
GO分析表明,上调的蛋白质往往执行多种功能,包括细胞外基质(ECM)结构成分、细胞粘附分子结合、ECM、内质网腔和生物粘附(聚类2),可能与 DN 中的细胞生长、极性、形状、迁移和代谢活动有关。聚类2中富集的通路主要与蛋白质消化和吸收、PI3K-Akt信号通路、人乳头瘤病毒感染、ECM-受体相互作用以及内质网中的蛋白质加工有关(图3)。
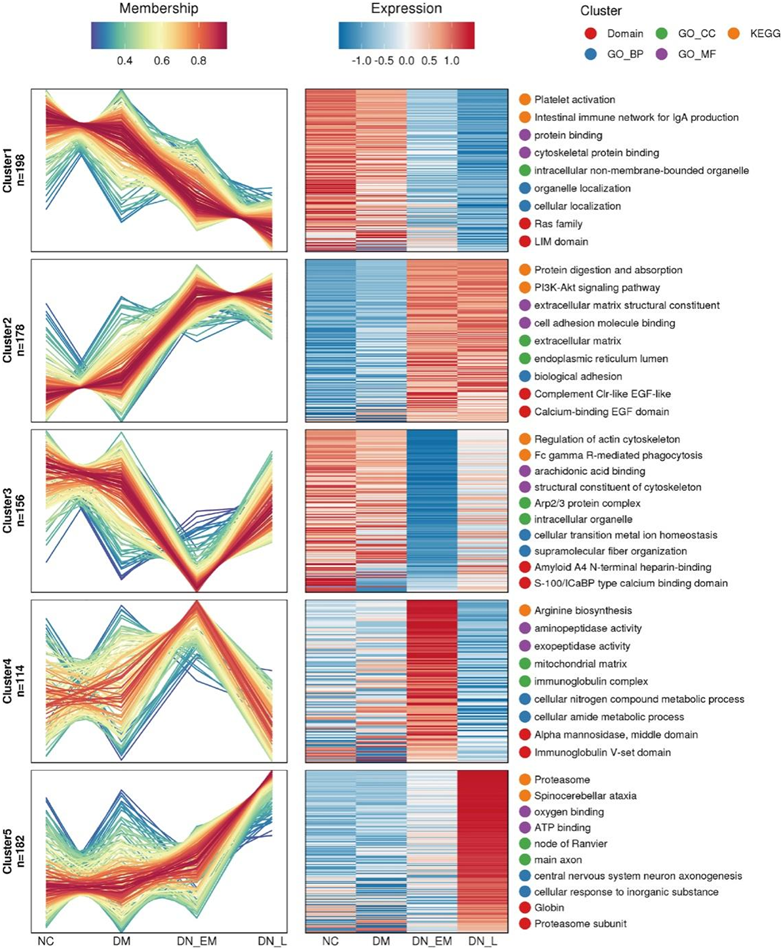
图3. Mfuzz分析揭示了DN进展中蛋白质的不同表达模式。
左侧显示蛋白质表达线图,中间显示热图,右侧显示前 2 个富集分析类型。
为了获得可靠的 DN 诊断指标,他们分析了聚类的成员资格、组内的 RSD 以及聚类 2 中独特肽的数量。总共 16 个肽符合条件,源自不同的 15 个蛋白质,包括 ADAMDEC1、ADAMTSL4、AMBP、APOA4 、AZGP1、CD44、COL18A1、COL6A3、EEA1、FBLN1、FBN1、HMGB1、MAN1A1、OAF 和 PTPRG。比较了所有四组中每种肽的表达水平(图 4A),FBLN1、AZGP1、CD44、ADAMDEC1、ADAMTSL4 和 HMGB1 的表达水平具有显著差异。为了研究DN进展的机制,通过将15个蛋白质输入STRING数据库构建PPI网络数据,然后上传到Cytoscape,并使用Cytohubba插件根据降序选择前21个核心蛋白质(图4B) 。根据最高得分,CD44、HMGB1 和 AMBP 可能在 DN 进展中发挥至关重要的作用。这15个蛋白还进行了GO和KEGG的富集分析,其功能主要与ECM结构和受体相互作用有关,ECM沉积在DN发展中起着重要作用(图4C)。
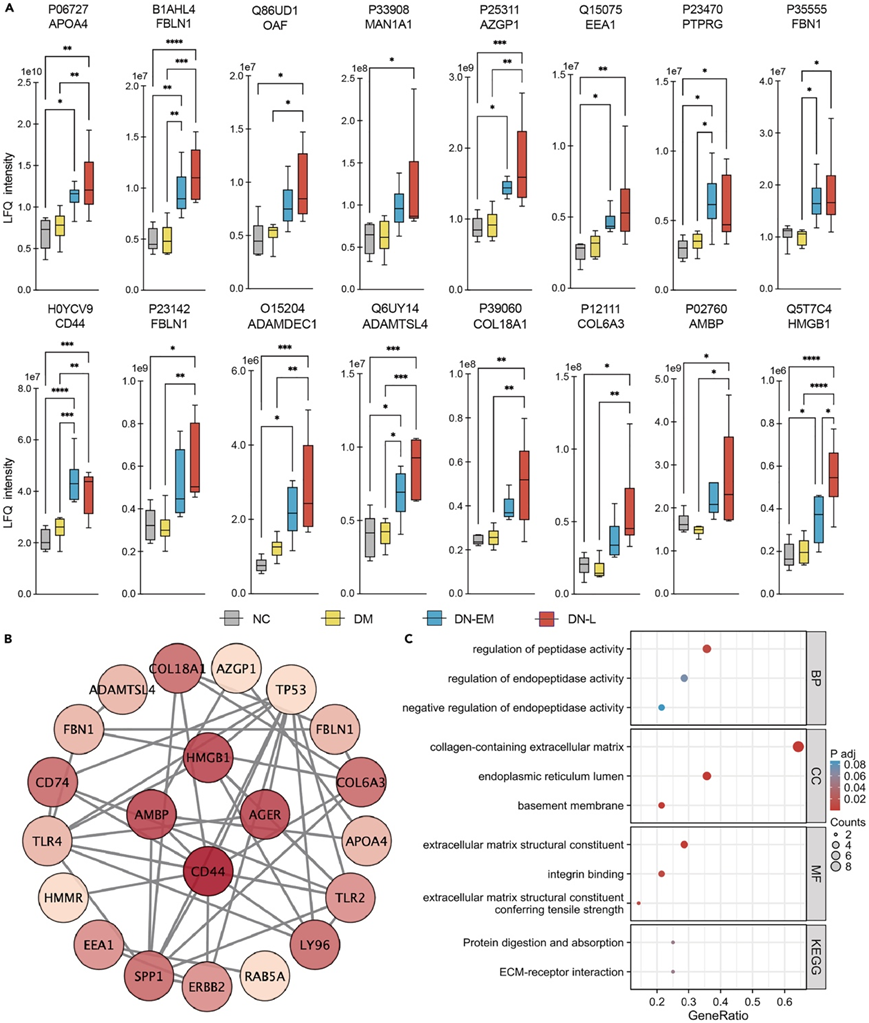
图4. 一组与 DN 进展密切相关的蛋白质。
(A)箱线图直观地表示APOA4、FBLN1、OAF、MAN1A1、AZGP1、EEA1、PTPRG、FBN1、CD44、ADAMDEC1、ADAMTSL4、COL18A1、COL6A3、AMBP和HMGB1在血清中LFQ强度值的分布。(B)显示15种蛋白相互作用的PPI网络。(C) 15个蛋白的基因富集分析(BP: GO-BP, CC: GO-CC, MM: GO-MF, KEGG)。
04
高迁移率族蛋白 B1 是监测糖尿病肾病的生物标志物
他们进行了加权基因共表达网络分析 (WGCNA),产生五个不同颜色的不同模块(图5A)。使用具有各种模块分配和蛋白质树状图的热图对 DN 后蛋白质的拓扑重叠矩阵 (TOM) 进行初步可视化(图 5 B)。在此基础上,研究了模块特征基因E和性状DN之间的模块性状关系,DN组包含DM、DN-EM和DN-L组的所有蛋白质(图5C)。有趣的是,只有蓝色模块与性状 NC和 DN最显著相关。最后,他们用维恩图探索了蓝色模块和聚类2 中蛋白质的重叠(图 5 D)。
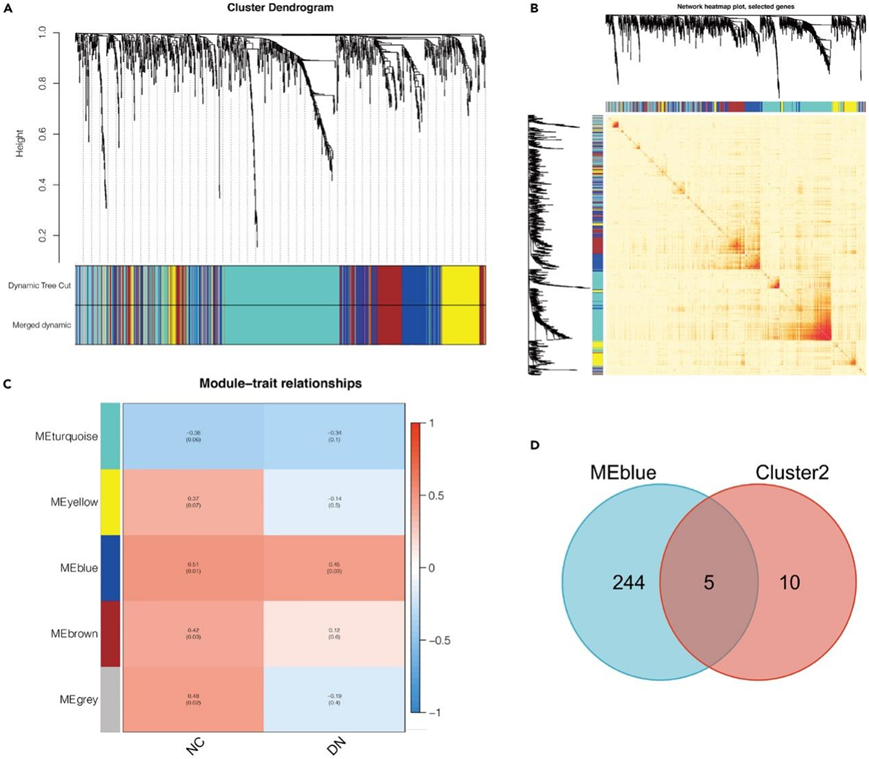
图5. WGCNA获得的与DN进展相关的新生物标志物。
(A)蛋白质之间拓扑重叠的聚类状树突图。(B)蛋白质之间拓扑重叠的树状图和网络热图。(C)模块特征基因E与性状DN之间的模性状关系热图。(D)蓝色模块中DEP和15个蛋白的维恩图。
05
HMGB1在DN进展中的诊断价值
血清蛋白高迁移率族蛋白 B1 (HMGB1) 与 DN 的发展之间存在显著联系。他们检测了 HMGB1 区分患有 DN 和未患 DN 的患者的能力。基于ROC曲线分析,他们发现HMGB1是区分DN-EM与NC、DN-L与NC、DN-EM与DM,以及 DN-L 与 DM(图 6 A)。此外,HMGB1 的强度与 eGFR以及血液尿素氮与血清肌酐比呈负相关(图6B-F)。这些发现表明,HMGB1,特别是当涉及到DN的早期和晚期个体时,可以准确地监测疾病的状态。

图6. HMGB1在DN进展中的诊断价值。
(A)每两两比较HMGB1的受试者工作特征(ROC)曲线。(B-F) HMGB1强度与eGFR、血尿素氮/血清肌酐比(BUN/Scr)、血尿素氮、血肌酐、胱抑素c的Pearson相关性。
06
高迁移率族蛋白B1在糖尿病肾病模型中的研究
尽管血清蛋白质组分析方法不需要检测特定的蛋白质表位,但需要进一步研究以确定它们的生物反应是否可以跨物种和来源应用。他们利用糖尿病小鼠来确定 HMGB1 在改善 DN 发展中的作用。
与 20 周时的糖尿病小鼠相比,28 周时的糖尿病小鼠在肾脏中观察到严重的病理生理学改变。随着糖尿病的进展,肾组织损伤不断加重,胶原沉积,基底膜不规则增厚,表明糖尿病小鼠模型是可行的(图7A)。与对照组相比,20周和28周注射STZ的小鼠血糖水平显著升高(图7B),最重要的是,其血清肌酐(图7C)、尿素氮(图7D)和尿微量白蛋白显著升高。肌酐比值(ACR)(图7E)水平反映了肾功能的变化,随着糖尿病的发生而逐渐升高。
HMGB1 是一种与人血清中 DN 相关的生物标志物,随着糖尿病小鼠的肾组织进展,HMGB1 也表现出显著的上调。免疫荧光(图7F)和免疫印迹分析(图7G)显示,患有肾损伤的糖尿病小鼠的肾组织中HMGB1水平较高,并且该水平随着糖尿病病程的延长而增加。有趣的是,对照小鼠肾组织中HMGB1的表达随着年龄的增长而增加,尽管没有统计学意义(图7G)。此外,他们建立了DN肾小管上皮细胞(HK2细胞)的体外模型。随着上皮-间质转化 (EMT) 变化的加剧,HK2 细胞在高葡萄糖培养基 (30 mM) 中增加了 HMGB1 蛋白水平(图 7 H)。通过免疫荧光观察处理后的HK2细胞的HMGB1表达,显示高糖刺激HK2细胞后细胞核和细胞质中HMGB1的表达增加(图7I)。这些数据表明 HMGB1 是一个新发现的标记物,可以将其评估为监测 DN 进展的潜在标记物。
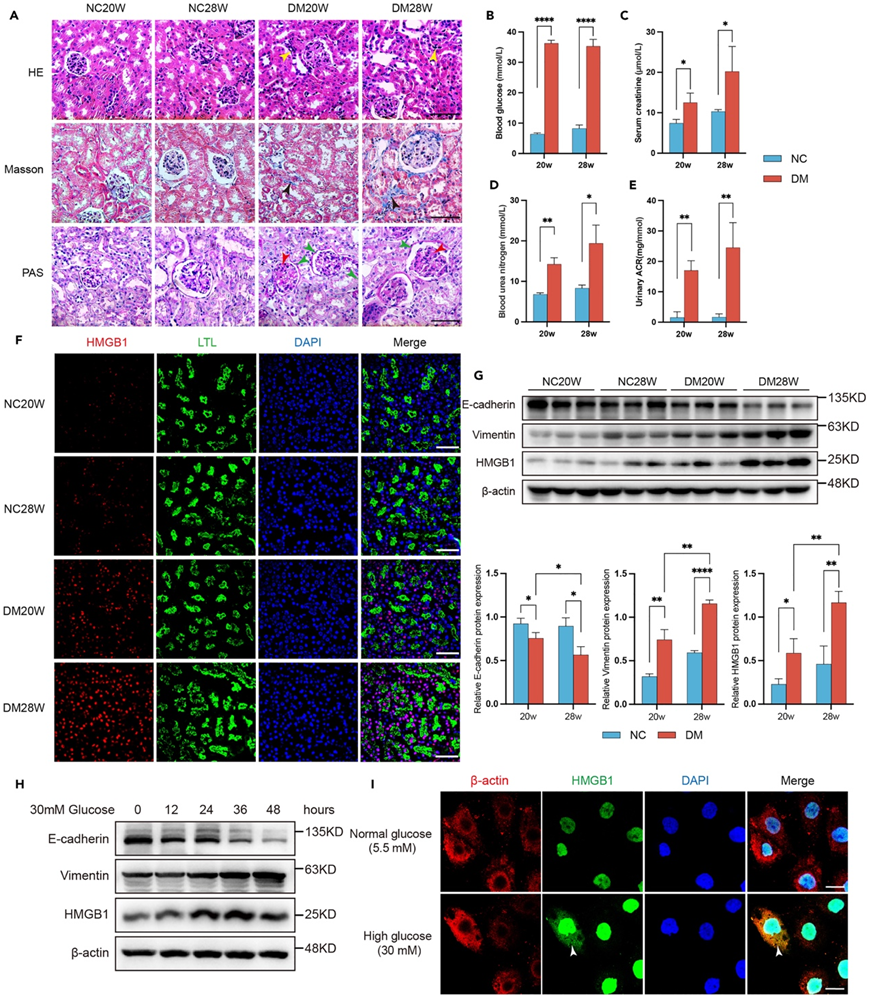
图7. HMGB1在DN模型中的验证。
(A)苏木精和伊红染色(HE)、Masson三色染色和高碘酸-希夫染色(PAS)染色显示糖尿病小鼠典型的DN变化。(B-E) 正常小鼠(蓝色)和糖尿病小鼠(红色)的血糖、血清肌酐、血尿素氮水平以及尿白蛋白与肌酐比。(F)免疫荧光分析。(G-H)免疫印迹分析。(I)免疫荧光分析。
+ + + + + + + + + + +
结 论
本项研究采用定量蛋白质组学和 Mfuzz 聚类分析揭示了 15 种蛋白质,显示DN 进展期间表达增加,暗示其生物标志物潜力。将 Mfuzz 聚类与加权基因共表达网络分析 (WGCNA) 相结合,突出显示了 5 个候选基因(HMGB1、CD44、FBLN1、PTPRG 和 ADAMTSL4)。HMGB1 成为一种潜在的生物标志物,与肾功能变化密切相关。实验验证支持 HMGB1 在高葡萄糖条件下上调,增强了其作为 DN 早期检测生物标志物的潜力。这项研究促进了对 DN 的理解,并确定了五种潜在的生物标志物,特别是 HMGB1,作为有前途的早期监测目标,这些发现为未来 DN 的临床诊断应用奠定了基础。
+ + + + +



 English
English


