文献解读|Bone Res(13.362):在单细胞水平表征肿瘤微环境揭示了骨肉瘤中一种新的免疫逃避机制
✦ +
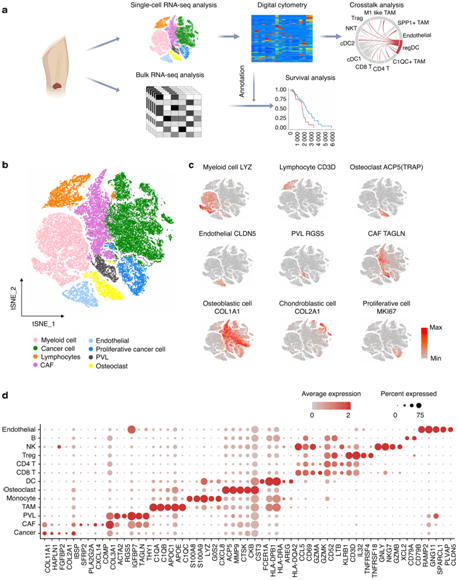
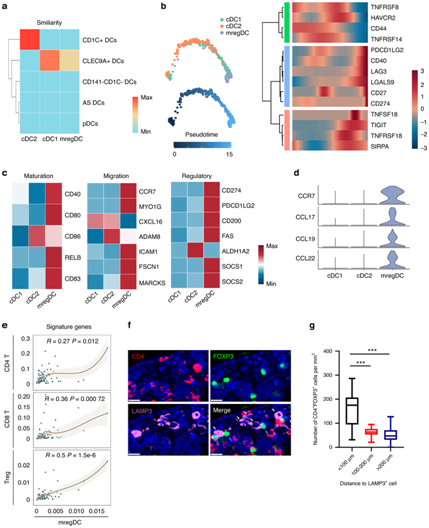
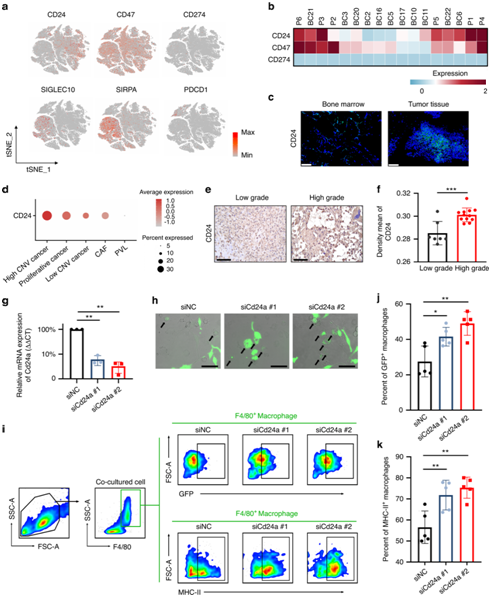
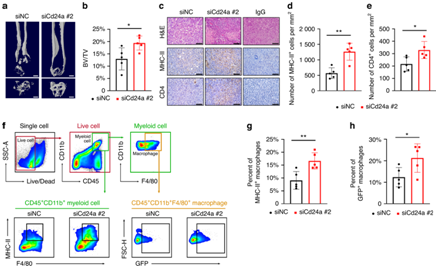
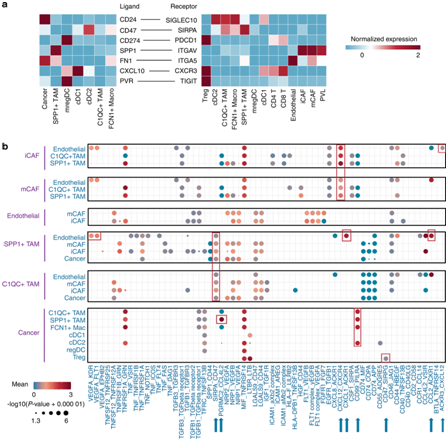
+ 论文ID 原名:Characterizing the tumor microenvironment at the single-cell level reveals a novel immune evasion mechanism in osteosarcoma 译名:在单细胞水平表征肿瘤微环境揭示了骨肉瘤中一种新的免疫逃避机制 期刊:Bone Research 影响因子:13.362 发表时间:2023.1.3 DOI号:10.1038/s41413-022-00237-6 背 景 骨肉瘤 (OS) 是一种常见的原发性恶性骨肿瘤,主要发生在儿童和青少年。在 OS 中,癌细胞与免疫细胞和基质细胞相互作用,形成免疫抑制性肿瘤微环境 (TME),从而增强癌细胞的免疫逃逸。瘤间异质性也是 OS 的一个重要特征,导致患者的治疗耐药性和不同的治疗结果。了解癌细胞异质性以及动态肿瘤免疫微环境可以为治疗 OS 提供新的治疗靶点。 实验设计 结 果 01 单细胞分辨率下骨肉瘤肿瘤微环境 在已发表的单细胞数据集 (GSE152048) 中,有七个原发性肿瘤病变、两个复发性肿瘤病变和两个肺转移灶。单细胞RNA测序 (scRNA-seq) 数据包含在本研究中,并与来自 85 名患者的肿瘤组织的批量RNA-seq 数据相结合(图1a)。研究者团队鉴定了八个细胞聚类,包括骨髓细胞 (LYZ+)、淋巴细胞 (CD3D+)、破骨细胞 (ACP5+)、内皮细胞 (CLDN5+)、血管周围样细胞 (PVL) (RGS5+ TAGLNhigh)、癌症相关成纤维细胞 (CAF)(TAGLNlowACTA2+)和增殖细胞(MKI67+)(图1b-c)。在骨髓细胞群中,他们对巨噬细胞 (APOE+ CD68+)、单核细胞 (S100A8+S100A9+) 和 树突细胞(DC) (HLA-DQA1highCD14- ) 进行了注释。他们将淋巴细胞分为 CD4 T 细胞 (IL7R+)、CD8 T 细胞 (CD8A+)、调节性 T 细胞 (Treg) (TNFRSF4+)、自然杀伤细胞 (NK) (GNLY+ GZMB+)和 B 细胞 (CD79A+ JCHAIN+)。 他们将PDGFRA+ CXCL12+ CAF 注释为炎症性 CAF (iCAF),肌成纤维细胞样 CAF 的特征是 ACTA2 高表达但PDGFRA-阴性表达(图1d)。 图1. 单细胞分辨率的骨肉瘤肿瘤微环境概述 02 肿瘤相关DC通过募集Treg促进肿瘤免疫耐受 三个 DC 子集在 OS 中具有特征,包括常规 1 类 DC (cDC1) (XCR1+ CLEC9A+) 和常规 2 类 DC (cDC2) (CD1C+ CLEC10A+)(图2a-b)。此外,在 OS 中发现了 CD83+ CCR7+ LAMP3+ DC聚类,可称为成熟调节性 DC (mregDC)(图2a-c)。为了研究这些 mregDC 是否具有肿瘤特异性,他们通过从正常外周血单核细胞 (PBMC) (GSE94820) 和两个 OS 队列(GSE152048 和 GSE162454)中收集了 DC(图2d)。他们发现 mregDC优先存在于两个独立的 OS 队列中,但在正常 PBMC 中几乎不存在,表明 mregDC可能是肿瘤相关的 DC 群体(图2d-e)。此外,OS 中 CD83+ CCR7+ LAMP3+ DC 的数量高于正常骨髓,这些结果一起表明在 OS 中存在一组肿瘤特异性 DC(图2f-g)。 图2. 将成熟的调节性树突状细胞 (mregDC) 表现为肿瘤相关 DC 群体 在 DC 重新聚类后,他们发现mregDC 和 cDC1 聚类之间存在相似性(图3a)。为了检查 mregDC 与其他 DC 群体的谱系关系,他们对 OS 中的 DC 聚类进行了 Monocle2 分析,结果表明 OS 中的 mregDC可能起源于 cDC1(图3b)。此外,共抑制剂 CD274、LAG3、LGALS9、SIRPA、TIGIT 和 PDCD1LG2 沿着伪时间轨迹上调(图3b)。与cDC1和cDC2相比,mregDC表现出具有更高迁移能力和免疫调节能力的“激活”表型,表明该可变DC亚群是成熟的调节性DC(图3c)。更重要的是,mregDC特异性表达CCR7、CCL17、CCL19和CCL22,可以募集多种类型的浸润性T细胞(图3d)。 由于目前的单细胞 RNA-Seq 数据集仅包含 11 名患者,他们计算了 TARGET 网站上 85 名 OS 患者的 mregDC 特征与 T 细胞特征之间的相关性,以扩大样本量,结果显示 mregDC和 Treg之间有很强的相关性(图3e)。有趣的是,肿瘤切片的染色进一步证实了 mregDC 的存在,并揭示了 mregDC 和 Treg 的共存(图3f)。此外,100 μm以内的Treg数量明显高于远处区域(图3g)。这些结果表明 mregDC可能通过在 OS TME 中募集 Treg 来促进肿瘤免疫耐受。 图3. 成熟的调节性树突状细胞 (mregDC) 促进肿瘤免疫耐受 03 癌细胞免疫原性的异质性 拷贝数变异 (CNV) 已是鉴定更具侵袭性的癌细胞克隆的有效策略,他们接下来整合了基质细胞并通过 inferCNV 包估计了每个细胞的 CNV(图4a-b),结果表明,癌细胞比成纤维细胞积累了更多的 CNV。基因本体 (GO) 分析和基因集变异分析(GSVA)显示,低CNV癌细胞中干扰素-γ反应相对富集(图4c-d)。主要组织相容性复合物 I 类 (MHC-I) 的转录下调是影响IFN-γ信号抗肿瘤作用的重要因素之一,他们随后检测了 MHC-I 分子在 mRNA 水平上的表达,发现 CNV 水平较高的癌细胞显示出较低水平的 MHC-I 基因(HLA-A、HLA-B 和 HLA-E)和 B2M 基因,表明这些癌细胞的免疫原性较低(图4e)。 为了进一步检测 MHC-I 的下调是否可以在骨肉瘤中普遍存在,他们通过免疫组织化学 (IHC) 染色评估了 OS 患者切片中 MHC-I 和 B2M 的表达,结果表明,高级别 OS 下调了 MHC-I 和 B2M 的表达(图4f-g)。基于这些发现,他们认为高级别 OS 中干扰素信号通路和 MHC I 类分子的下调可能导致免疫逃避。 图4. 癌细胞免疫原性的异质性 04 CD24 信号调节巨噬细胞介导的对 OS 的免疫反应 癌细胞通过过度表达抗吞噬细胞表面蛋白(包括 CD47 和程序性细胞死亡配体 1(由 CD274 编码))来逃避免疫细胞的清除。CD24 是一种新型“别吃我”信号,可抑制 Toll 样受体介导的炎症和巨噬细胞吞噬细胞。CD24 和 CD47 的表达强于 CD274,表明巨噬细胞介导的免疫逃逸而非 T 细胞介导的免疫逃逸在 OS 中的作用(图 5a-b)。在单细胞分辨率下,他们发现几乎所有细胞类型都高表达 CD47,而 OS 细胞优先表达 CD24(图5a)。CD24 在 OS 组织中表现出比来自相同患者的正常骨髓中更高的 mRNA 表达,如荧光原位杂交 (FISH) 所示(图5c)。此外,发现高 CNV 癌细胞比低 CNV 癌细胞和成纤维细胞表达更高的 CD24(图5d)。免疫组化 (IHC) 染色还表明 CD24 在高级 OS 中的表达更强(图5e-f)。这些结果共同说明 CD24 是 OS 中潜在的免疫治疗靶点。 为了研究 CD24 在调节 OS 中巨噬细胞介导的免疫反应中的作用,他们用 IL-4 处理骨髓来源的巨噬细胞 (BMDM) 以产生 M2 样巨噬细胞,并将这些吞噬能力较低的巨噬细胞与 GFP+ K7M2 骨肉瘤细胞系共培养 36 小时。他们发现,通过活细胞显微镜测量,干扰 K7M2 细胞系中的 Cd24a 会增强吞噬作用(图5g-h)。此外,与Cd24a敲低癌细胞共培养的BMDM具有更强的炎症表型(图5i-k)。 图5. CD24 保护 OS 细胞免受巨噬细胞攻击 为了研究下调CD24对吞噬的保护作用是否可以在体内重现,他们用胆固醇修饰的Cd24a siRNA或scramble siRNA治疗患有骨膜骨肉瘤的小鼠,每两天通过肿瘤内注射剂量为1 OD。植入后三周,他们观察到 Cd24a siRNA 组的肿瘤致瘤性与 scramble siRNA 组相比显著降低(图6a-b)。此外,如 IHC 染色所示,在 Cd24a siRNA 组中观察到明显增加的 MHC-II+细胞和浸润性 CD4 T 细胞(图6c-e)。流式细胞术 (FACS) 分析还显示吞噬作用增加以及抗原呈递表型(图6f-h)。总之,这些结果表明 OS 细胞通过 CD24 信号逃避巨噬细胞介导的免疫反应。 图6. 干扰 Cd24a 的表达可促进体内巨噬细胞的吞噬作用和 M1 样表型 05 细胞间相互作用分析 癌细胞和多个巨噬细胞亚群之间 CD24-SIGLEC10 LR 对的富集揭示了 CD24 在 OS 中的免疫调节作用。此外,SPP1+ TAM 和 CAF 中 SPP1 和 ITGAV 的强烈表达表明 SPP1+ TAM 可能通过排列 CAF 中的纤连蛋白来促进癌细胞的定向迁移(图7a)。 接下来,他们专注于 DC 亚群的异源细胞-细胞相互作用,发现 cDC1 具有通过 CXCL10-CXCR3 诱导多个 T 细胞浸润的强大能力,而 mregDC通过 CD274-PDCD1 和 PVR-TIGHT 与 Treg的相互作用显示出最高的免疫抑制效力(图7a)。此外,他们发现 CAF 和 SPP1+ TAM 通过 ACKR3-CXCL12 和 CCL2/CXCL1-ACKR1 轴与内皮细胞相互作用(图7b)。值得注意的是,OS 样本由来自原发性、复发性和转移性病变的成骨细胞性骨肉瘤和软骨母细胞性骨肉瘤组成。在这些情况下,细胞无法相互作用,因为它们不在同一个 TME 中。因此,他们分别预测了不同病变中的细胞-细胞相互作用,这些结果揭示了不同OS中不同的细胞-细胞相互作用模式,这可能需要精确的个性化治疗。总体而言,scRNA-seq 数据的分析表明,骨髓细胞通过与 OS 中的免疫细胞和基质细胞相互作用,在 TME 中发挥作用。 图7. OS TME 中预测的细胞间相互作用网络 + + + + + + + + + + + 结 论 本项研究通过分析以单细胞分辨率表征转录状态的scRNA-seq数据,生成了 OS 中免疫微环境的图谱。结果表明,DC可能通过募集调节性 T 细胞来塑造 OS 中的免疫抑制微环境。他们还发现MHC-I分子在癌细胞中下调,OS 中肿瘤免疫原性的降低,这可能是肿瘤免疫逃逸的潜在机制。值得注意的是,CD24 是一种新的“别吃我”信号,有助于 OS 细胞的免疫逃避。总而言之,这项研究结果提供了对 OS 免疫景观的见解,表明骨髓靶向免疫疗法可能是治疗 OS 的一种有前途的方法。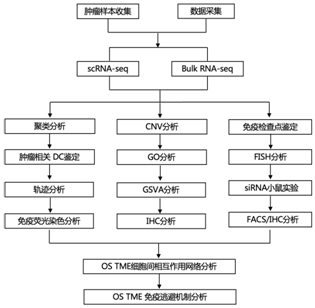




 English
English


