文献解读|Cell Discov(13.0):壶腹部腺癌的综合蛋白质组学表征
✦ +
+
论文ID
原名:Integrated proteogenomic characterization of ampullary adenocarcinoma
译名:壶腹部腺癌的综合蛋白质组学表征
期刊:Cell Discovery
影响因子:13.0
发表时间:2025.01.07
DOI号:10.1038/s41421-024-00742-4
背 景
壶腹部腺癌 (AMPAC) 是一种罕见的恶性肿瘤,发生在壶腹部。AMPAC 的发病率约为每百万人出现4-7 例,约占所有壶腹部癌症的 7% 和胃肠道癌症的 0.2%。根据癌症进展的不同阶段,5 年生存率为 20%-75%。根据组织学类型,AMPAC 分为肠型、胰胆型或混合型,肠型患者的预后优于胰胆型患者。壶腹部腺癌因病因不明、发病率极低、解剖结构复杂等特点,长期以来一直是临床、病理研究和多组学队列研究的难题。
实验设计
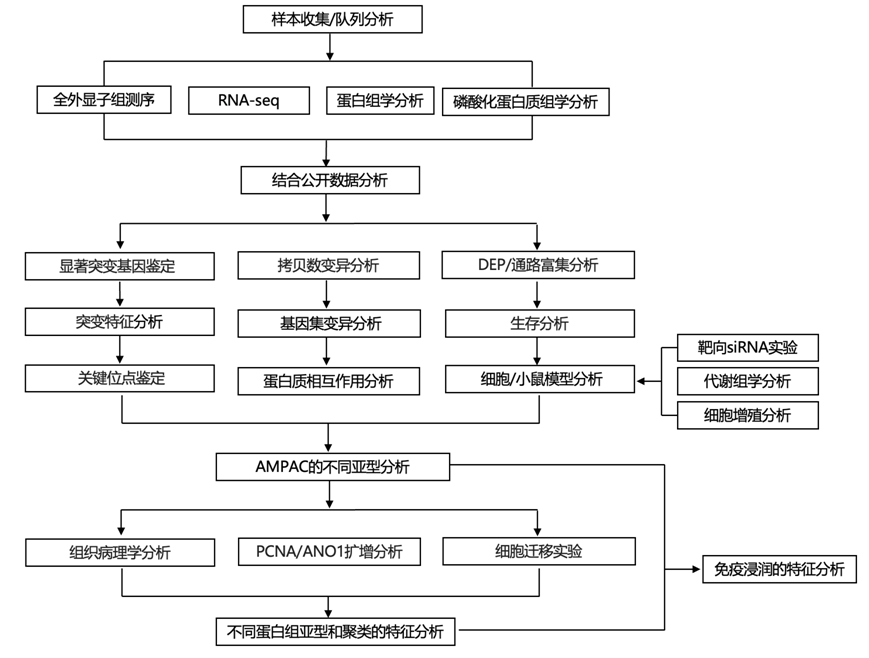
结 果
01
AMPAC 样品的全面蛋白质组学表征
本研究在整体范围内为 AMPAC 建立了广泛的多组学研究队列(复旦队列)。为了系统地定义 AMPAC 的蛋白质组学景观,研究团队收集了 2008 年至 2017 年期间 186 名 AMPAC 患者和 12 名 DAC 患者的福尔马林固定石蜡包埋 (FFPE) 肿瘤样本和配对正常邻近组织 (NAT)。总共 186 名 AMPAC 患者包括 96 名肠型患者、82 名胰胆型患者和 8 名混合型患者(图1a)。HE 染色切片的检查和评估由两位经验丰富的病理学家独立进行,他们提供有关肿瘤组织学亚型、分化程度和 TNM 分期的详细信息。从人口统计学上看,本研究的所有患者均来自亚洲。本研究还通过随访收集了与患者预后相关的其他风险因素和信息。对 133 个肿瘤样本和 133 个 NAT 样本进行了全外显子组测序 (WES) 分析。对 67 个肿瘤样本和 65 个 NAT 样本进行转录组分析 (RNA-seq)。对于所有 198 对肿瘤和 NAT 样本,进行了基于质谱 (MS) 的蛋白质组学分析。此外,使用 Fe-NTA 磷酸肽富集策略对 96 个肿瘤样本和 90 个 NAT 样本进行了磷酸化蛋白质组学分析(图1a)。
WES 的平均靶标覆盖率为 110 倍,并鉴定出 9108 个突变基因,包括 14233 个非沉默点突变和 1599 个小插入或缺失。总共有 14150 个体细胞突变,中位数率为每兆碱基 15.85 个编码突变。使用 MutSigCV 鉴定了显著突变基因 (SMG)。在 133 名患者中,他们观察到几种 SMG,包括KRAS(65%)、TP53(53%)、APC(26%)、ARID2(14%)、SMAD4(12%)、CTTNB1(12%)、ATM(9%)、ACVR2A(8%)、ARID1A ( 8%)、SOX9(7%)、ELF3(5%)、PBRM1(5%)和CTTND1(5%)(图1b)。在这些SMG中,肠型患者的APC突变频率较高,胰胆型患者的KRAS突变频率明显较高。使用Yachida和Gingras研究中的突变频率进行相关性分析(图1c),Spearman相关性反映三个队列之间的突变谱相似(图1d)。先前的研究还揭示了AMPAC中WNT信号、RTK / RAS信号和TGF-β信号通路的改变,它们在本研究的数据中具有相似的改变频率。此外,复旦队列和Gingras队列之间的TMB相似(图1e)。
使用非负矩阵分解 (NMF) 评估突变三核苷酸序列基序的频率。通过 Sigminer 确定了五个突变特征。这 5 个特征对应于已知的 COSMIC(癌症体细胞突变目录)特征:SBS30(由于 NTHL1 突变导致的 DNA 碱基切除修复缺陷)、SBS20(同时发生的 POLD1 突变和 DNA 错配修复缺陷)、SBS6(DNA 错配修复缺陷)、SBS2(胞苷脱氨酶 APOBEC 家族的活性)和 SBS18(活性氧物质造成的损伤)。单核苷酸变异 (SNV) 的总体比例与其他队列中观察到的相似,胞嘧啶到胸腺嘧啶 (C > T) 转换是最常见的 SNV。RNA-seq确定了 15328 个基因,其每百万个片段映射的转录本千碱基片段数 (FPKM) 值 > 1。在肿瘤和 NAT 样本中分别鉴定出 15196 个和 14847 个转录本。
对于蛋白质组学分析,使用来自人胚胎肾的 HEK293T 细胞的全细胞提取物作为对照以确保数据质量。此外,蛋白质组学分析总共鉴定出 15363 种蛋白质,在肿瘤和 NAT 样品中分别鉴定出 14280 种和 13447 种蛋白质。然后,他们对整个蛋白质组学数据应用了质量控制,并过滤了 FDR 小于 1% 的蛋白质。结果,13092 种蛋白质用于进一步分析。
磷酸化蛋白质组学分析鉴定出28714个磷酸位点,包括丝氨酸21088个(73.4%),苏氨酸6836个(23.8%),酪氨酸790个(2.8%);从96个肿瘤样本中的5964个磷酸蛋白中鉴定出22776个磷酸位点,包括丝氨酸16721个(73.4%),苏氨酸5421个(23.8%),酪氨酸634个(2.8%)。本研究中的S/T/Y比例与CRC队列(丝氨酸:76.2%,苏氨酸:19.9%,酪氨酸:3.9%)、GC队列(丝氨酸:74.0%,苏氨酸:20.9%,酪氨酸:5.1%)、HCC队列(丝氨酸:77.8%,苏氨酸:16.9%,酪氨酸:5.3%)、PDAC队列(丝氨酸:73.2%,苏氨酸:23.7%,酪氨酸:3.1%)中的磷酸化位点S/Y/T分布相似,表明AMPAC中的S/T/Y比例是可比的。总之,本研究研究在多组学水平上展示了AMPAC的系统分子特征。
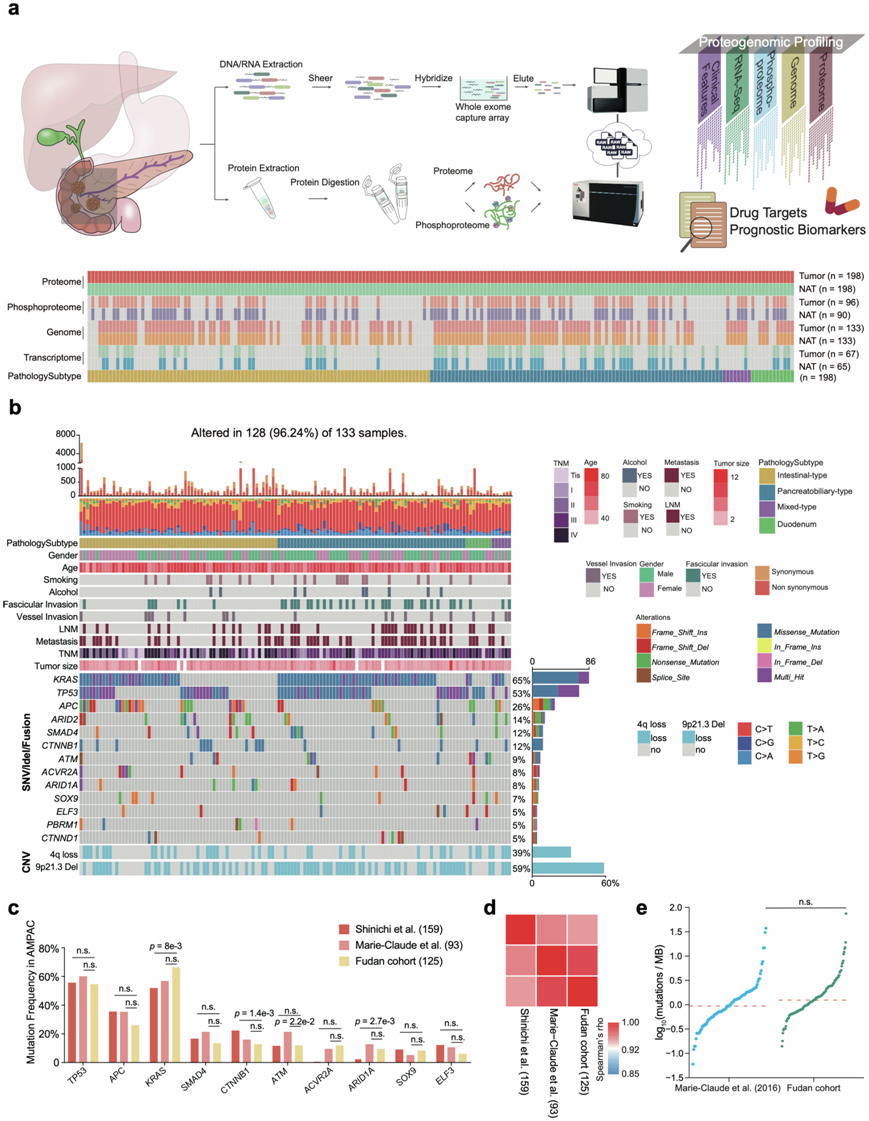
图1. AMPAC 的蛋白质组学景观。
(a) 实验流程。(b) AMPAC患者的显著突变基因 (SMG) 概况和相关临床特征。(c) 复旦队列和之前发表的队列中前 10 个突变基因的突变频率比较。(d) 复旦队列中观察到的突变频率与之前发表的队列相比的相关性图。(e) 不同队列中肿瘤的 TMB 比较。
02
AMPAC 复旦队列中体细胞拷贝数变异的影响
本项研究描述了拷贝数变异 (CNV) 在顺式和反式模式下对 mRNA、蛋白质和磷蛋白丰度的影响(图2a)。在 mRNA、蛋白质和磷蛋白中分别观察到4928、1980 和 573 个显著相关性(顺式效应)。 GO 通路分析表明,受 CNV 影响的 1114 个 mRNA 和蛋白质富集的通路之间存在一致性,这些通路在与紧密连接、黏附连接、细胞间粘附脂肪酸 β-氧化和细胞周期相关的通路中富集(图2b-c)。 这些反映了 CNV 对信号通路的影响。他们通过顺式或反式效应研究了 CNV 对 593 个癌症相关基因 (CAG)的 mRNA、蛋白质和磷蛋白丰度的影响。分析发现,CNV 对 52 个 CAG 的 mRNA 和蛋白质丰度均有顺式效应,也对 6 个 CAG(ERBB2、EP300、MYH9、MKL1、DACH1和MACF1)的三个组学水平的丰度有顺式效应(图2d),这 6 个 CAG 的注释如图2e所示。此外,根据 STRING 数据库,这 6 个 CAG 之前已证明彼此之间存在直接或间接的相互作用,主要影响粘着斑和细胞周期途径(图2f-g)。利用基因集变异分析(GSVA)来分析这些富集的通路,肠型中细胞周期显著上调,胰胆型中粘着斑高度富集(图2h)。结果表明,两种组织学亚型中不同的 CNV 会影响通路差异。
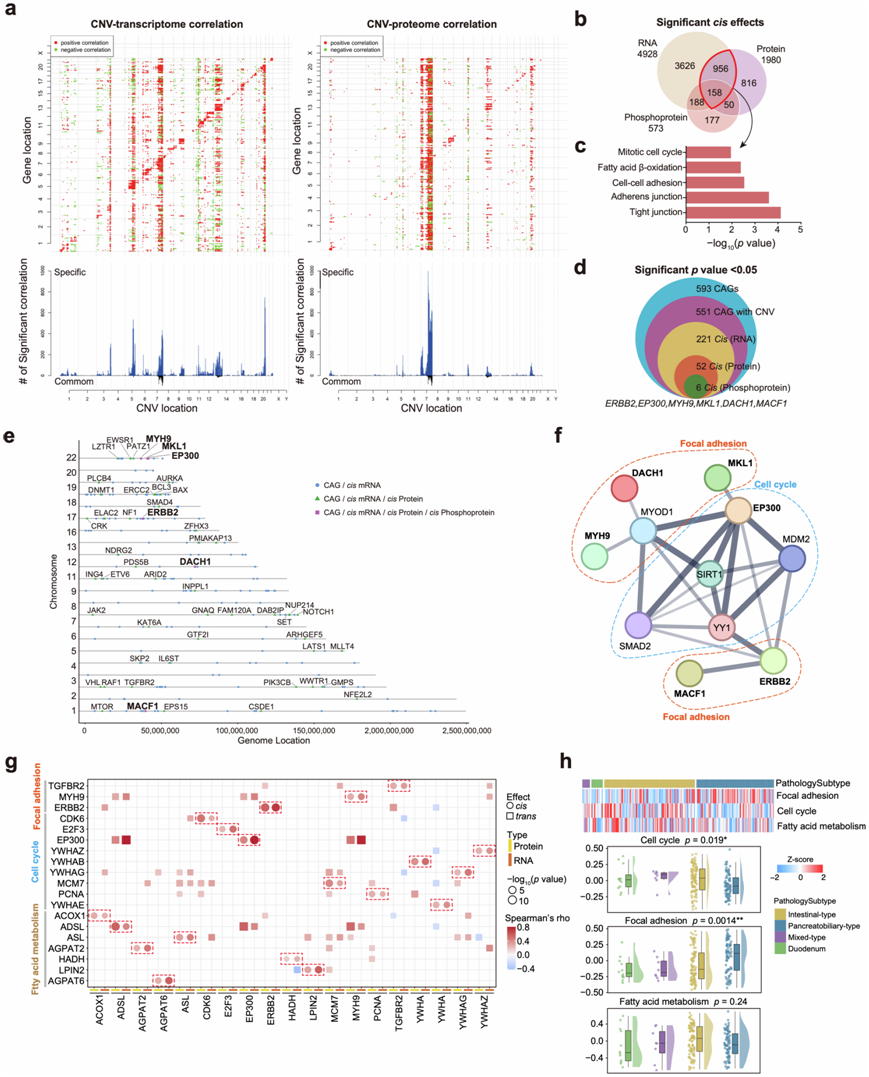
图2. AMPAC 复旦队列中体细胞拷贝数变异的影响。
(a) CNV 对 mRNA 和蛋白质的功能性影响。(b) 维恩图通过转录组、蛋白质组和磷酸化蛋白质组分析描绘了 CNV 的级联效应和顺式事件之间的重叠。(c) 1114个显著顺式效应基因富集的通路与转录组和蛋白质组重叠。(d) 通过多组学数据分析显示具有显著 CNV顺式效应的 CAG 的维恩图。(e) 具有级联拷贝数顺式调控其同源 mRNA、蛋白质和磷蛋白水平的 CAG 的位置。(f) 由6 种 CAG 构建的蛋白质-蛋白质相互作用网络。(g) 来自粘着斑、细胞周期和脂肪酸代谢途径的显著顺式效应基因的顺式和反式效应。(h) 不同病理亚型中粘着斑、细胞周期和脂肪酸代谢通路的 GSVA 评分的热图和箱线图。
03
4q 缺失引起的脂肪酸代谢紊乱促进细胞增殖
值得注意的是,4q 染色体缺失是染色体臂水平上唯一与总体生存率呈负相关的事件(图3a)。为了研究4q 缺失的顺式效应,在 mRNA 和蛋白质水平上对 4q 缺失组和 WT 组的差异表达蛋白 (DEP) 进行了 KEGG 通路富集分析。 4q缺失组中共有231种蛋白质和188种mRNA上调,在蛋白质和mRNA水平上均富集于细胞周期,而4q缺失组中有156种蛋白质和109种mRNA下调,在蛋白质水平上富集于脂肪酸代谢和脂肪酸降解,在mRNA水平上富集于代谢通路(图3b)。他们还发现参与脂肪酸代谢的基因(如ACSL1、ACADS、HADH和ADH1C)在4q缺失组中下调,这表明AMPAC中脂肪酸β-氧化能力减弱(图3c)。为了探讨脂肪酸代谢对AMPAC患者预后的影响,他们根据脂肪酸代谢的GSVA评分进行了生存分析,结果显示GSVA评分较低的患者预后较差。
为了探究4q缺失对脂肪酸代谢的影响,他们检测了位于4q缺失位置上所有在蛋白质和mRNA水平上具有顺式效应的基因,发现HADH的拷贝数与其mRNA和蛋白质表达丰度呈显著正相关(图3d)。这意味着随着4q缺失导致拷贝数的改变,HADH也经历了拷贝数的缺失,HADH蛋白质和mRNA表达丰度也呈相应的下降趋势。此外,他们发现HADH是唯一一种低表达丰度与AMPAC预后较差相关的蛋白质(图3e),并且与WT组相比,4q缺失组显示出下调。HADH编码羟酰基辅酶A脱氢酶,其通过参与脂肪酸降解/β-氧化途径在脂肪酸代谢中发挥作用,发现它在肝细胞癌(HCC)和肾肾透明细胞癌(KIRC)中下调,与脂肪酸β-氧化通路的下调相一致。在本研究的队列中,HADH 表达与脂肪酸代谢的 GSVA 评分在蛋白质和 mRNA 水平上也呈显著正相关(图3f-g),这些发现表明脂肪酸代谢的下调是 HADH 下调的结果。
为了进一步阐明由 HADH 下调导致的长链脂肪酸积累的影响,他们用HADH siRNA(SNU-478-HADH -KD、SNU-869- HADH -KD)和siRNA(SNU-478-Si-Vector、SNU-869-Si-Vector 作为对照)转染了 AMPAC 细胞系 SNU-478 和 SNU-869,然后进行了比较蛋白质组学分析。SNU -478- HADH -KD 组的HADH mRNA 水平显著下调。他们还评估了 SNU-478- HADH -KD 和 SNU-869- HADH -KD 细胞中代谢物的浓度,并对这些代谢物进行了途径富集分析。在 SNU-478- HADH -KD 细胞中积累的脂质代谢物与线粒体长链饱和脂肪酸的β-氧化,缬氨酸、亮氨酸和异亮氨酸的降解以及丙酮酸代谢通路(图3h);在SNU-869- HADH -KD细胞中检测到的脂质代谢物参与脂肪酸生物合成、脂肪酸降解和不饱和脂肪酸生物合成通路(图3i)。值得注意的是,脂肪酸β-氧化的初始底物棕榈醛在SNU-478- HADH -KD细胞中大量积累(图3j);在SNU-869- HADH -KD细胞中检测到高水平的棕榈酸(图3k)。这些结果表明HADH的下调抑制了脂肪酸β-氧化,导致长链脂肪酸在AMPAC中积累。因此,长链脂肪酸(棕榈酸/棕榈醛)的积累可能是 4q 缺失 AMPAC 患者的特征。
前期研究表明,HADH介导的胃癌中β-氧化减慢,导致脂肪酸的积累,激活PI3K-Akt信号通路,而PI3K-Akt信号通路往往会促进恶性肿瘤的生长。他们试图研究HADH下调是否激活AMPAC肿瘤细胞中的PI3K-Akt信号通路。为了探索这一点,对HADH蛋白表达和PI3K-Akt信号通路的GSVA评分进行了相关性分析。HADH表达与PI3K-Akt信号通路的GSVA评分呈正相关(图3l)。此外,利用基于MS的蛋白质组学分析来探究参与PI3K-Akt信号通路的蛋白质,并在SNU-478- HADH -KD和SNU-869- HADH -KD细胞和对照组细胞中进行差异分析。结果显示,与对照组相比, SNU-478- HADH -KD 组和 SNU-869- HADH -KD 组 PI3K-Akt 信号通路上调(图3m-n)。这说明在 AMPAC 中,HADH 下调伴随 PI3K-Akt 信号通路升高。先前的研究表明,激活 PI3K-Akt 信号通路可促进肿瘤增殖。鉴于4q 缺失组细胞周期出现上调,因此 HADH 下调可能诱导长链脂肪酸的积累,并可能激活 PI3K-Akt 信号通路,从而促进 AMPAC 细胞增殖。
为了验证HADH下调是否能促进肿瘤细胞生长,他们对SNU-478- HADH -KD和SNU-869 - HADH -KD细胞进行了细胞生长能力评估。结果显示,与对照组相比, SNU-478- HADH -KD和SNU-869- HADH -KD细胞的增殖能力显著提高(图3o-p)。添加棕榈酸后,SNU-478-HADH-KD和SNU-869- HADH -KD组的增殖能力提高,且提高幅度明显高于对照组(图3o-p)。这表明棕榈酸可以促进SNU-478- HADH -KD和SNU-869- HADH -KD组的增殖能力,进一步证明HADH下调导致脂肪酸的积累,从而促进HADH -KD细胞的增殖能力。他们进一步以HADH-KD和对照组细胞构建异种移植瘤小鼠模型,进行小鼠皮下肿瘤实验,发现HADH下调较对照组显著促进异种移植瘤生长(图3q-r)。这些结果进一步证实了HADH低表达导致的长链脂肪酸积累促进了肿瘤细胞的增殖。
综上所述,在AMPAC肿瘤细胞中,4q缺失引起的顺式效应导致HADH表达下调,扰乱了长链脂肪酸的代谢,而累积的长链脂肪酸作为信号刺激物激活PI3K-Akt信号通路,最终引发细胞增殖(图3s)。
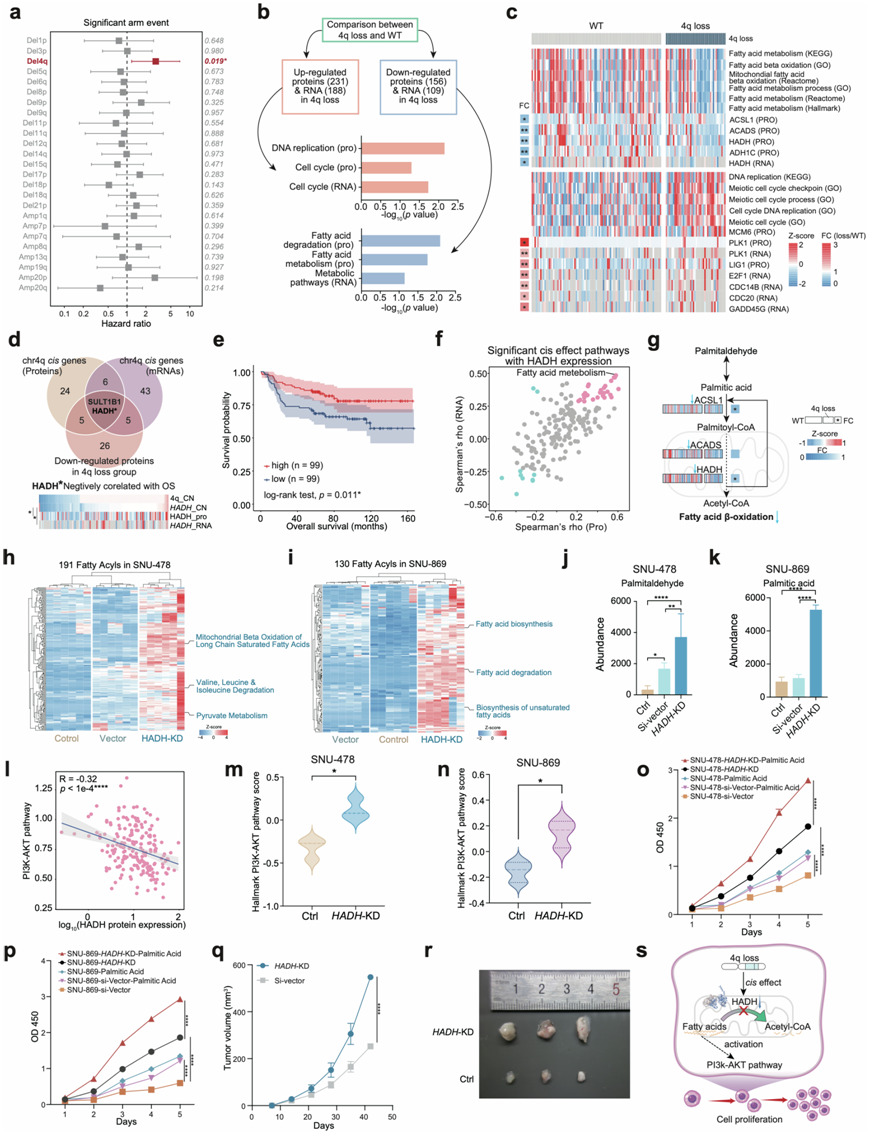
图3. 4q缺失引起脂肪酸代谢紊乱促进细胞增殖。
(a) 森林图显示显著臂事件的风险比。(b) 4q缺失组与 WT 组的比较。(c) 差异表达基因富集的通路的 GSVA 评分热图。(d)上:根据 4q 缺失组与 WT 组的表达水平选择 4q 上的候选顺式基因并与总体生存率相关。下:热图显示 HADH 拷贝数、蛋白质表达和 mRNA 丰度。(e) 基于 HADH 蛋白表达的总生存率的 Kaplan-Meier 曲线。(f) 散点图显示 KEGG 通路的 GSVA 评分与 HADH 在蛋白质和 mRNA 水平上的表达之间的相关性。(g) AMPAC中脂肪酸代谢通路 4q 缺失组与 WT 组比较示意图。(h) SNU-478 细胞中基于 MS 的 191 种脂肪酰基的热图以及 191 种代谢物的通路富集情况。(i) 基于 MS 的 SNU-869 细胞中 130 种脂肪酰基的热图和这 130 种代谢物的通路富集情况。(j) 条形图根据基于 MS 的非靶向代谢组学结果显示了 SNU-478 中对照组、空载体组和 HADH-KD 组中棕榈醛(palmitaldehyde)的丰度。(k) 棕榈酸(palmitic acid)的丰度分析。(l) 散点图描述了 HADH 蛋白表达与 PI3K-AKT 通路的 GSVA 评分之间的相关性。(m) SNU-478对照组和HADH-KD组的Hallmark PI3K-AKT通路GSVA评分的小提琴图。(n) SNU-869对照组和HADH-KD组的Hallmark PI3K-AKT通路GSVA评分的小提琴图。(o-p)细胞增殖分析。(q) 异种移植肿瘤体积分析。(r) 注射到裸鼠皮下后的 SNU-478 细胞异种移植肿瘤图像。(s) 系统图总结了由于 4q 缺失导致的脂肪酸代谢失调促进细胞增殖的影响。
04
肠型特征伴有 PCNA 扩增,胰胆型特征伴有 ANO1 扩增
根据AJCC 2017年第八版分期系统,AMPAC分为肠型、胰胆型和混合型。本研究队列包含12例DAC患者和186例AMPAC患者,其中包括92例肠型患者、86例胰胆型患者和8例混合型患者。在组织学分级方面,与肠型相比,胰胆型具有更高的级别、低分化和高淋巴结转移率,具有最差的总生存率和无进展生存率(图4a-b)。进行差异分析以揭示四种亚型之间的分子差异。KEGG通路富集分析显示肠型参与RNA降解和核苷酸切除修复,胰胆型以粘着斑为特征,混合型主要参与DNA复制,DAC富集PPAR信号通路(图4a)。
在复旦队列中,他们观察到肠型肿瘤多于胰胆型(图4c)。胰胆型患者的转移率高于肠型患者。为了进一步研究这两种亚型中这些表型的本质原因,他们检测了所有突变和顺式效应基因在所有亚型中的积累。PCNA扩增(amp)在肠型中比胰胆型更常见,ANO1扩增在胰胆型中比肠型更常见。4q缺失组的多基因增殖评分(MGPS)高于 WT 组,同时4q缺失在肠型中比在胰胆型中更常见。
基于PCNA扩增的顺式效应,PCNA表达水平在肠型中上调(图4d)。如图4e、g所示,很明显,与胰胆型患者相比,肠型患者的PCNA表达水平更高。H-Score箱线图也验证了这一发现(图4i)。然而,仍然不知道肠型中PCNA的高表达水平是由于PCNA扩增还是由于两种组织学亚型不同形态的影响。为了解决这个问题,他们进行了IHC分析,以比较胰胆型和肠型的PCNA扩增和WT样本中PCNA表达的丰度。在PCNA amp的肠型样本中,PCNA的表达丰度较高,H-score的箱线图也说明了存在PCNA amp的肠型样本PCNA的表达丰度高于WT(图4e-f)。同时,在PCNA amp的胰胆型样本中,PCNA的表达丰度也较高,H-score的比较显示存在PCNA amp的胰胆型样本PCNA的表达丰度高于WT(图4g-h)。因此,肠型样本的高表达确实是由于PCNA amp造成的。
生存分析表明PCNA表达水平越高,预后越差(图4j)。PCNA与MGPS的Spearman相关性分析显示其呈显著正相关(图4k)。接下来,利用PCNA表达与GSVA评分的相关性分析与PCNA相关的最显著通路(图4l-m),这些通路的特点是RNA降解、DNA复制、细胞周期和核苷酸切除修复。以上结果表明,PCNA扩增促进肠型患者肿瘤细胞增殖。
考虑到4q缺失中HADH的顺式作用会促进脂肪酸的积累,进一步诱导细胞增殖,如前所述。为了探索4q缺失和PCNA扩增的叠加效应,他们对4q缺失和PCNA扩增进行了Fisher精确概率法检验(图4n),结果显示4q缺失和PCNA扩增之间没有共现或排斥关系。他们分析了不同组中肿瘤大小的差异。结果显示,PCNA扩增 4q缺失组患者的肿瘤大小最大。4q缺失组患者的平均肿瘤大小大于PCNA扩增组患者,WT组患者的平均肿瘤大小最小(图4o)。综上所述,PCNA amp的顺式作用可增加PCNA蛋白表达,诱导细胞增殖,导致肠型肿瘤增大。同时,由于肠型中4q的频繁缺失,这一过程进一步加剧。HADH的顺式作用可降低其蛋白丰度,导致脂肪酸的积累,从而通过PI3K-Akt信号通路促进肿瘤生长(图4p)。
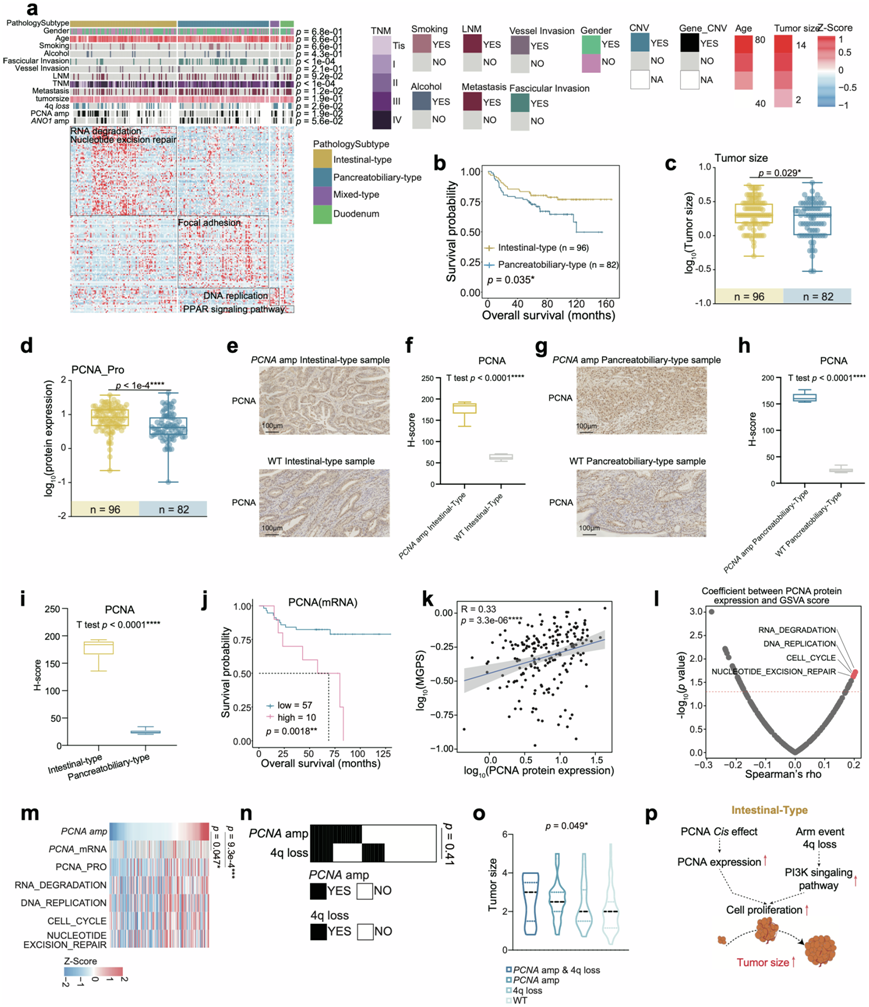
图4. 具有 PCNA 扩增的肠型特征。
(a) 热图说明了四种病理亚型的特征。(b) 基于病理亚型的总生存率的 Kaplan-Meier 曲线。(c) PCNA扩增状态。(d) 箱线图显示肠型(黄色)和胰胆型(蓝色)之间的肿瘤大小。(e) IHC染色图像显示有和没有PCNA 扩增的肠型样本之间的 PCNA 表达。(f) 箱线图显示肠型样本中 PCNA IHC 图像的 H 分数。(g) IHC染色图像显示有和没有PCNA 扩增的胰胆型样本之间的 PCNA 表达。(h) 箱线图显示胰胆型样本中 PCNA IHC 图像的 H 分数。(i) 箱线图显示肠型和胰胆型样本中 PCNA IHC 图像的 H 分数。(j) 基于PCNA mRNA 表达的总体生存率的 Kaplan-Meier 曲线。(k) PCNA丰度与多基因增殖评分 (MGPS) 的 Spearman 相关性。(l) PCNA 蛋白丰度与 GSVA 评分的 Spearman 相关性。(m) 热图显示了PCNA扩增、PCNA 的 mRNA/蛋白质丰度和 GSVA 评分。(n) 热图显示PCNA扩增和 4q 缺失的 CNV 状态。(o) 小提琴图显示四组肿瘤大小的比较。(p) 说明PCNA扩增的调节作用。
05
ANO1 amp 的胰胆型特征分析
对于胰胆型患者,ANO1扩增是唯一在胰胆型患者中比肠型患者更频繁发生的体细胞拷贝数变异(SCNA),并且ANO1扩增是AMPAC的危险因素(图5a)。ANO1的顺式效应对其表达水平有影响,胰胆型的表达水平高于肠型(图5b)。IHC染色显示ΑΝΟ1在胰胆型中高表达,H-Score也显示胰胆型样本中ANO1的高表达(图5d-e)。生存分析表明ANO1表达水平与总体生存率呈负相关(图5c)。如前所述,胰胆型伴有更高的转移率。在转移组中也发现ANO1 amp经常发生,并且ANO1蛋白表达也较高。上述结果促使他们研究ANO1 amp是否与胰胆型患者的转移过程有关。
为了进一步验证假设,使用Spearman相关性检验ANO1拷贝数(CN)与GSVA评分的相关性,发现ANO1 CN与紧密连接的GSVA评分显著相关(图5f)。Spearman相关性分析应用于ANO1拷贝数和紧密连接途径中的蛋白质,在这些基因中与ANO1拷贝数最显著正相关的是PRKCI(图5g),它编码蛋白激酶C家族的丝氨酸/苏氨酸蛋白激酶成员。还发现PRKCI在胰胆型和转移组中高表达,这通过IHC染色和H评分得到证实(图5h-j)。此外,PRKCI蛋白丰度与总体预后呈负相关(图5k)。他们研究了PRKCI激酶活性与其表达丰度之间的关系。 结果,PRKCI蛋白表达与其激酶活性呈正相关(图5m),并且胰胆型PRKCI激酶活性也较高(图5n)。 为了进一步探索PRKCI的功能性磷酸化底物,他们从数据库中筛选了参考的激酶底物对并进行相关性分析。 结果显示,最相关的底物参与了黏附连接和细胞迁移,这与转移过程有关(图5o-p),这表明PRKCI蛋白表达上调与转移过程之间存在联系。因此,他们假设ANO1的顺式效应提高了ANO1蛋白丰度并与PRKCI相互作用调节细胞粘附,从而促进胰胆型患者的转移。
为了验证上述结果,他们构建了ANO1过表达和PRKCI过表达的SNU-478和SNU-869细胞系(SNU-478- ANO1- OE、SNU-869- ANO1 -OE、SNU-478- PRKCI -OE、SNU-869- PRKCI -OE),并以空载体转染SNU-478和SNU-869作为对照(SNU-478-载体、SNU-869-载体)。与对照相比,ANO1和PRKCI的相对mRNA水平升高。他们进行了transwell迁移实验,以进一步评估ANO1过表达和PRKCI过表达SNU-478细胞的迁移能力。结果显示,在SNU-478和SNU-869细胞系中过表达ANO1和PRKCI后细胞迁移能力增强(图5q-t)。这些结果均表明ANO1高表达和PRKCI高表达可促进细胞迁移能力。为了进一步证实ANO1、PRKCI与转移之间的因果关系,他们利用抗ANO1抗体在对照组细胞和ANO1过表达细胞中进行了IP-MS研究ANO1相互作用蛋白。与对照组相比,他们在ANO1过表达组细胞中鉴定了34种与ANO1特异相互作用的蛋白质。GO富集分析显示,ANO1相互作用蛋白最显著富集的主要通路是细胞迁移、细胞粘附、阳离子转运和血管生成(图5l)。IP-MS结果表明,在ANO1过表达细胞中,ANO1可以与PRKCI相互作用,且与PRKCI表现出较强的相互作用。
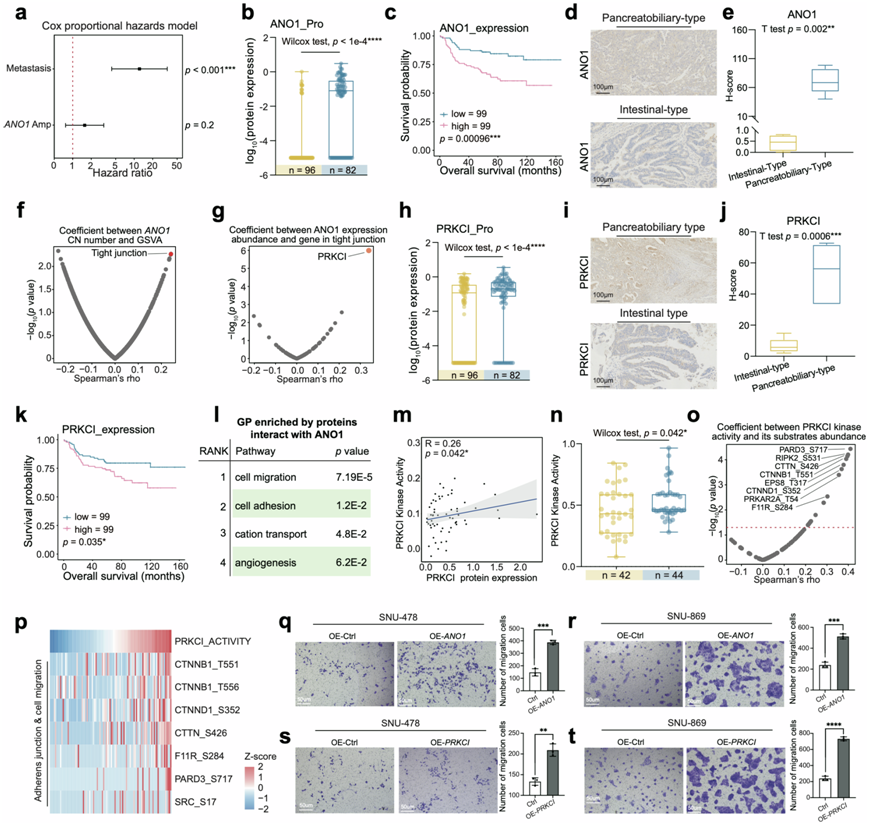
图5. 具有 ANO1 扩增的胰胆型特征
(a) 风险比分析。(b) 肠型 (左:黄色)和胰胆型(右:蓝色)中的ANO1扩增状态。(c)生存分析。(d-e) 肠型和胰胆型样本中 ANO1 IHC 图像和H 分数。 (f) ANO1 蛋白丰度与 GSVA 评分的Spearman相关性。(g) 紧密连接途径中 ANO1 蛋白丰度和基因的 Spearman 相关性。(h) 箱线图显示肠型(黄色)和胰胆型(蓝色)中的 PRKCI 蛋白表达。(i) IHC染色显示与肠型样本相比,PRKCI 在胰胆型样本中高度表达。(j)箱线图显示肠型和胰胆型样本中 PRKCI IHC 图像的 H 分数。(k)生存分析。(l) 蛋白质富集通路与 ANO1 相互作用。(m) PRKCI 蛋白丰度与 PRKCI 激酶活性的 Spearman 相关性。(n) 箱线图显示肠型(黄色)和胰胆型(蓝色)之间的 PRKCI 激酶活性。(o) PRKCI 激酶活性与 PRKCI 底物的 Spearman 相关性。(p) 热图显示 PRKCI 激酶活性与 PRKCI 底物的丰度。(q-t) Transwell实验。
06
AMPAC 患者的蛋白质组聚类
目前AMPAC的病理分期系统无法准确预测预后或提供有效的治疗指征。因此,为了系统地研究病理亚型的恶性细胞异质性,他们根据肿瘤样本中的蛋白质表达等级采用共识聚类方法,在198例患者中识别出3个聚类(C-FAM:n = 53;C-AD:n = 78;C-CC:n = 67)(图6a)。他们发现这三个亚组在总生存期(OS)方面存在明显差异(图6b)。此外,不同蛋白质组学聚类之间的组织学亚型分布也存在差异。
C-FAM聚类具有最好的预后特征;KEGG分析表明脂肪酸代谢在C-FAM中显著富集,参与脂肪酸代谢的关键分子如ACLY、FASN、ELOVL5、LDLR和ACLS在C-FAM聚类中表现出高表达(图6a)。IHC染色进一步证明ACLY和FASN在C-FAM聚类中高表达, H-Score表明ACLY和FASN在C-CC聚类中的表达高于其他两个聚类。考虑到4q缺失与脂肪酸代谢相关的CNV事件,他们研究了其在C-FAM聚类中的分布,发现C-FAM聚类在三个蛋白质组聚类中4q缺失的比例较低。这些结果间接证实了顺式作用对 4q 缺失确实调节了脂肪酸代谢。C-FAM 聚类的 4q 缺失发生率较低,且以脂肪酸代谢上调为特征。
C-AD 聚类与最差的预后相关,并且在粘着斑中富集(图6a)。此外,C-AD 聚类显示胰胆型样本的比例最大(55.1%)(图6c),淋巴结转移(LNM)比例最高,束状侵袭发生率最高,转移率最高。ANO1 amp的顺式效应可以与PRKCI相互作用并促进与转移相关的过程。他们观察到ANO1 amp 在 C-AD 聚类中显示出略高的富集水平。上述说明了肿瘤的异质性,以及ANO1 amp 在促进转移中的作用。
C-CC 聚类的总生存率优于 C-AD 聚类,但优于以细胞周期为特征的 C-FAM 聚类(图6a)。C-CC 聚类中肠型样本比例最大(64.2%)(图6c)。肠型样本以细胞增殖为特征,受PCNA扩增和 4q缺失的影响。因此,他们检测了PCNA扩增和 4q 缺失的分布,观察到 C-CC 聚类中这两个 CNV 事件的积累更多。根据基因组分析结果,基因组变异会对蛋白质组产生影响,强调了多组学分析对于深入全面了解肿瘤分子机制的重要性。虽然这些与不良预后相关的基因组变异在三个聚类中呈现出不同的分布,但在分布上没有统计学上的显著差异。他们推测三个聚类之间蛋白质和磷蛋白的区分是导致预后结果差异的关键。
因此,他们在蛋白质和磷蛋白水平上对蛋白质组聚类进行了差异分析。发现PDGFRB蛋白表达水平和RNA表达水平在C-AD聚类中最高,并且与OS呈负相关(图6d-g)。他们发现PDGFRB激酶活性与其表达呈显著正相关,且高于其他两个聚类(图6e-f)。PDGFRB激酶活性与GSVA评分之间的Spearman相关性分析表明,最显著的相关通路是上皮间质转化(EMT)和血管生成(图6h)。然后,他们筛选了参与EMT通路的PDGFRB底物,其在C-AD聚类中表达最高。他们鉴定了一个转录因子 (TF) FOXC2,它由 PDGFRB 在 Ser 240 处磷酸化。该磷酸化位点的丰度与 PDGFRB 激酶活性呈正相关(图6i)。FOXC2 是属于叉头家族的 TF,在血管生成、淋巴管生成和脂肪生成等多种过程中发挥着至关重要的作用。他们发现 FOXC2 TF 活性与 FOXC2/S240 丰度呈正相关(图6j),也与 PDGFRB 激酶活性呈正相关。这些结果表明 FOXC2 的 TF 活性主要由磷酸化 FOXC2 贡献。此外,还发现 FOXC2 TF 活性与OS呈负相关。
为了深入了解 FOXC2 TF 活性影响预后的机制,他们使用 GSVA 算法根据其靶基因 (TG) 的 mRNA 表达推断了 FOXC2 TF 活性。ANGPT2 (血管生成素 2)是 FOXC2 的唯一 TG,它影响血管生成并在肿瘤发生过程中调节内皮细胞的粘附、迁移和生长。转录调控模式在 mRNA 水平上遗传,通过 ANGPT2 mRNA 表达丰度和 FOXC2 TF 活性之间的正相关性得到验证(图6k)。上述发现表明 PDGFRB 在 C-AD 聚类中高度表达,显著影响与血管生成和 EMT 相关的下游调控网络。
为了进一步验证PDGFRB的嵌合,他们通过IHC染色证实了C-AD聚类中PDGFRB的高表达,并且通过IHC染色验证了血管生成标志物CD34在C-AD聚类中高表达(图6l)。此外,H-Score验证了与其他两个聚类相比,C-AD聚类中PDGFRB和CD34的表达较高(图6m)。然后他们用PDGFRB过表达质粒转染SNU-478和SNU-869细胞系,构建PDGFRB过表达细胞(SNU-478- PDGFRB -OE,SNU-869- PDGFRB -OE)。RT-PCR分析表明,在PDGFRB过表达细胞中PDGFRB mRNA水平显著增加。然后他们使用transwell分析评估细胞迁移率。结果,transwell迁移实验证实了在SNU-478和SNU-869细胞系中过表达PDGFRB后细胞迁移能力增强(图6n),条形图也显示了过表达PDGFRB的细胞中细胞迁移能力增强(图6n)。
这些结果不仅反映了基因组改变(包括 4q 缺失、PCNA扩增、ANO1扩增),还揭示了蛋白质和磷蛋白谱对分析蛋白质组聚类的重要作用。他们总结了三个聚类的特点并提出了潜在的治疗靶点。以脂肪酸代谢为特征的 C-FAM 可以通过使用脂质合成抑制剂来抑制肿瘤发展。C-AD 最重要的作用包括血管生成信号传导。在这种情况下,针对 PDGFRB 的抑制剂可能用于抑制表现出此聚类特征的患者的肿瘤进展。以细胞周期为特征的亚型理论上可以通过使用 PRKDC 抑制剂来抑制肿瘤细胞增殖(图6o)。
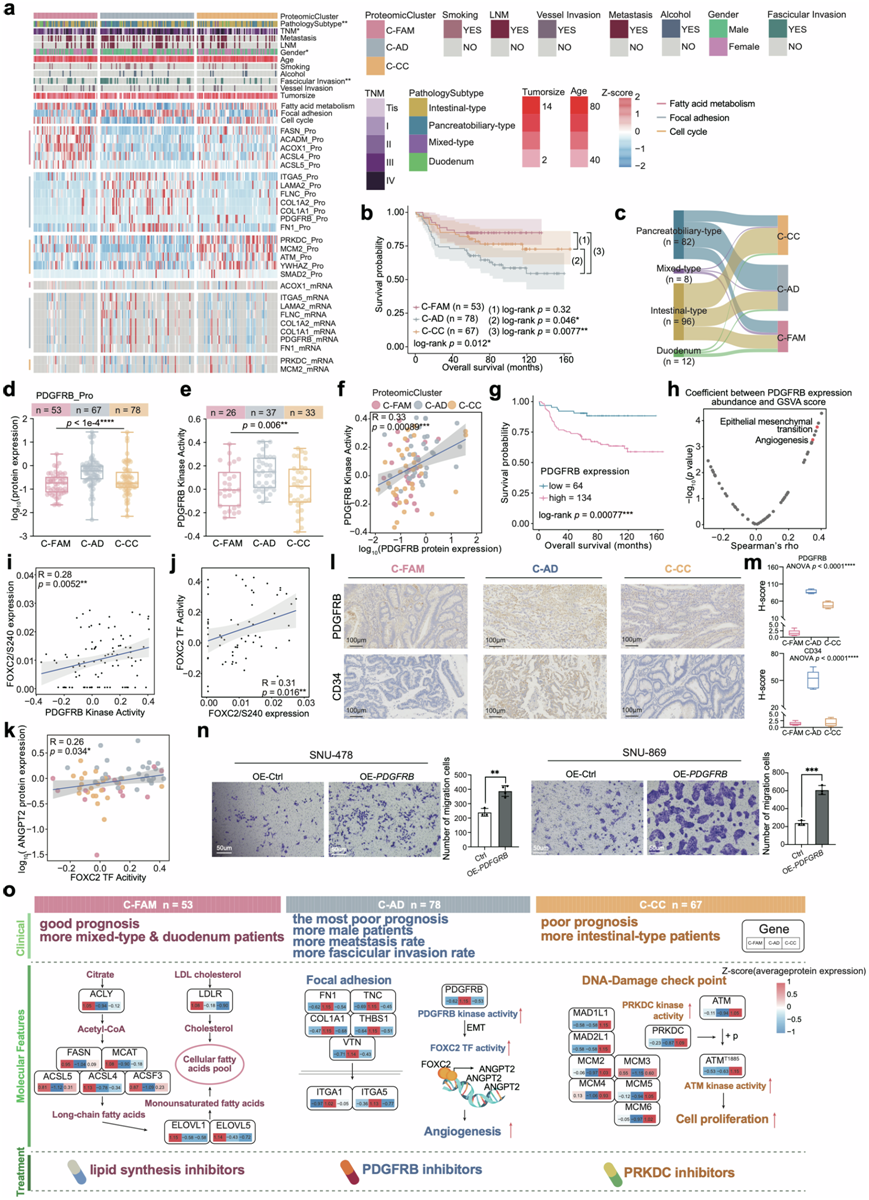
图6. AMPAC 患者的蛋白质组亚型。
(a) 热图显示了三个蛋白质组聚类的特征。(b) 基于蛋白质组聚类的总体生存率的 Kaplan-Meier 曲线。(c) 桑基图揭示了蛋白质组聚类和病理亚型之间的关联。(d) PDGFRB 蛋白表达分析。(f) PDGFRB 蛋白表达与 PDGFRB 激酶活性的 Spearman 相关性。(g) 基于PDGFRB 蛋白表达的总体生存率的 Kaplan-Meier 曲线。(h) 散点图描述了 PDGFRB 蛋白表达与 GSVA 评分之间的相关性。(i) PDGFRB 激酶活性与 FOXC2/S240 丰度的 Spearman 相关性。(j) FOXC2 /S240 表达与 FOXC2 TF 活性的 Spearman 相关性。(k) FOXC2 TF 活性与 ANGPT2 蛋白表达的 Spearman 相关性。(l) IHC染色分析。(m) 箱线图显示蛋白质组聚类中 PDGFRB IHC 图像的 H 分数。(n) Transwell 分析表明,与对照组相比,SNU-478-PDGFRB-OE 组细胞和 SNU-869-PDGFRB-OE 组细胞具有更高的迁移能力。(o) 三个蛋白质组学聚类的分子特征示意图总结。
07
AMPAC 中免疫浸润的表征
免疫疗法已用于治疗多种癌症。为了探索AMPAC的免疫微环境特征,他们利用基于蛋白质组学数据的xCell分析来推断肿瘤微环境中不同细胞类型的相对丰度(图7a)。随后,基于推断的细胞比例的共识聚类确定了三组具有明显临床特征和免疫细胞类型的肿瘤:巨噬细胞浸润聚类(M1:n = 92),CD4 + T细胞浸润聚类(M2:n = 52)和DC细胞浸润聚类(M3:n = 54)(图7a)。生存分析显示,免疫聚类在OS方面存在显著差异,这表明不同的免疫细胞浸润聚类可能导致不同的预后结果。其中,CD4 + T细胞浸润聚类的预后结果最好,DC细胞浸润聚类的预后结果最差(图7c)。
巨噬细胞浸润聚类以巨噬细胞、巨噬细胞 M2、单核细胞和中性粒细胞为特征,免疫评分最高(图7d)。此外,巨噬细胞浸润聚类显示干扰素 γ 反应、T 细胞受体信号通路、toll 样受体信号通路和趋化因子信号通路的上调(图7a-b)。CD4 + T 细胞浸润聚类免疫评分最低,以 CD4 + T 细胞、CD4 + Tcm 和 CD4 +记忆 T 细胞为特征(图7d)。GSVA 分析表明,CD4 + T 细胞浸润聚类内脂肪酸代谢、细胞周期和酪氨酸代谢等几种通路均升高(图7a-b)。DC 细胞浸润聚类在反卷积分析中主要显示 NKT、Treg、DC、aDC 和 cDC 的浸润(图7a-b)。与 CD4+ T 细胞浸润聚类相比,DC 细胞浸润聚类具有更高的免疫评分(图7d)。 DC 细胞浸润聚类中的 KEGG 通路富集分析显示,血管生成、上皮间质转化、通过 NFκB 的 TNFα 信号传导、补体和凝血级联、粘着斑、JAK-STAT 信号通路显著富集(图7a-b)。发现三个免疫聚类之间的免疫评分有所不同(图7d),生存分析显示免疫评分与OS之间存在负相关(图7e)。此外,三个聚类之间预后结果的差异似乎与每个免疫聚类中不同的免疫评分有关,这促使他们探索导致免疫评分与总体生存率之间负相关的因素。
免疫评分由所有免疫细胞和基质细胞类型的总和计算得出。因此,在研究导致免疫评分与总体生存率负相关的因素之前,有必要检查哪种细胞类型主要对免疫评分有贡献。采用 Spearman 相关性分析来检查细胞类型富集评分与免疫评分之间的关系。巨噬细胞、aDC、巨噬细胞 M2 和单核细胞与免疫评分显著相关(图7f)。有趣的是,发现免疫评分与总体生存率呈负相关。利用 CNV 来探索高免疫评分与不良预后相关的内部机制。
为了探究导致高免疫评分预后不良的原因,他们采用Spearman相关性分析探讨CNV与免疫评分的相关性。发现5q22.1的拷贝数与免疫评分呈显著正相关(图7g)。本研究的GISTIC分析结果将拷贝数变异5q22.1确定为缺失事件。因此,5q22.1缺失多发生在免疫评分较低的患者中。为了研究5q22.1影响AMPAC免疫评分的潜在机制,将重点关注位于5q22.1上的基因拷贝数与其mRNA或蛋白质表达丰度之间呈显著正相关的基因。 CAMK4 的拷贝数与蛋白表达丰度呈最显著的正相关(图7h-i)。由于 CAMK4 位于 5q22.1 上,5q22.1 缺失导致 CAMK 的拷贝数缺失。此外,CAMK4 的拷贝数与其表达丰度呈显著的正相关。换言之,5q22.1 缺失伴随着 CAMK4 拷贝数较低,导致 CAMK4 的表达丰度较低(图7i)。因此,免疫评分高的患者 5q22.1 的拷贝数较高,CAMK4 的拷贝数和表达丰度也较高(图7i)。 CAMK4 编码属于丝氨酸/苏氨酸蛋白激酶家族的蛋白质,在本研究中与OS(图7j)呈负相关。CAMK4 的激酶活性与其蛋白质表达丰度呈正相关。这表明 CAMK4 的高拷贝数提高了其蛋白质表达并上调了其激酶活性。为了探索 CAMK4 的下游信号网络,他们使用 Spearman 相关性检验对 CAMK4 的底物表达丰度和 CAMK4 激酶活性进行了相关性分析。CAMK4 激酶活性显示 CREB1/S142 磷酸化最显著的升高(图7k)。 CREB1 是一种调节多条信号通路的 TF。然后,他们使用GSVA算法根据TG的mRNA表达推断CREB1 TF活性。推断的CREB1 TF活性与CREB1/S142的丰度显示出高度相关性(图7l)。CREB1,IL-6的所有TG均与CREB1 TF活性显示出最高的相关性(图7m)并且与mRNA水平的总体预后呈负相关(图7n)。
总体而言,免疫评分与5q22.1拷贝数呈显著正相关。因此,在免疫评分低的患者中,5q22.1的拷贝数较低。这些个体携带5q22.1缺失,导致位于5q22.1上的基因CAMK4拷贝数较低。因此,CAMK4的蛋白表达水平也很低,从而导致CAMK4激酶活性降低。这种降低阻止了CREB1的磷酸化和随后的IL-6转录激活,导致IL-6/JAK/STAT信号通路下调,从而带来较好的预后。相反,没有5q22.1缺失的患者由于CREB1转录活性高导致IL-6/JAK/STAT信号通路上调,导致预后不良(图7o)。
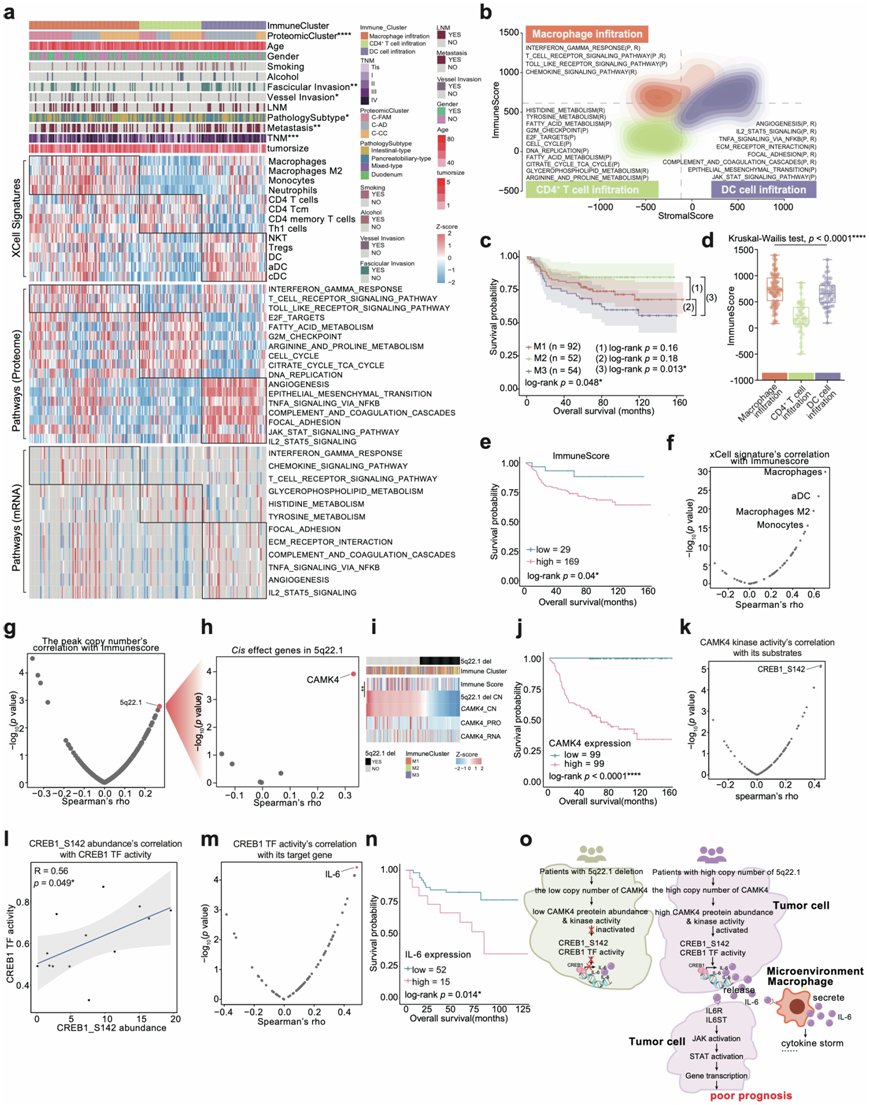
图7. AMPAC免疫浸润的表征。
(a) 热图说明了三个免疫聚类的特征。(b) 基于不同免疫聚类的免疫评分(y轴)和基质评分(x轴)的二维密度等高线图。(c) 基于免疫聚类的总生存率的 Kaplan-Meier 曲线。(d) 箱线图显示三个免疫聚类之间的免疫评分。(e) 基于免疫评分的总生存率的 Kaplan-Meier 曲线。(f) 散点图描述了免疫评分与 xCell 特征之间的相关性。(g) 散点图描述了免疫评分与所有病灶事件拷贝数之间的相关性。(h) 火山图显示5q22.1 上的顺式效应基因。(i) 上:5q22.1 缺失焦点事件分布,中:免疫聚类分布;下:热图显示免疫评分、5q22.1 拷贝数、CAMK4 拷贝数、CAMK4 蛋白表达丰度和 CAMK4 mRNA 丰度。(j) 基于CAMK4 蛋白表达的总生存率的 Kaplan-Meier 曲线。(k) 散点图描述了 CAMK4 激酶活性与 CAMK4 底物之间的相关性。(l) CREB1 TF 活性与 CREB1/S142 表达的 Spearman 相关性。(m) 散点图描述了 CAMK4 TF 活性与 CAMK4 靶基因之间的相关性。(n) 基于 IL-6 mRNA 表达的总生存率的 Kaplan-Meier曲线。(o) 示意图总结了CAMK4 顺式效应改变了其下游信号传导,并导致免疫微环境的改变,这与患者预后较差有关。
+ + + + + + + + + + +
结 论
本研究对来自中国 AMPAC 患者和十二指肠患者的 198 个样本进行了全面的多组学分析。基因组数据表明 4q 缺失会导致脂肪酸积累和细胞增殖。蛋白质组学分析揭示了三个不同的聚类(C-FAM、C-AD、C-CC),其中最具侵袭性的聚类C-AD 与最差的预后相关,并以粘着斑为特征。免疫聚类确定了三个免疫聚类,并揭示了免疫聚类 M1 (巨噬细胞浸润聚类)和 M3(DC 细胞浸润聚类)与M2(CD4+ T 细胞浸润聚类)相比表现出更高的免疫评分,由于肿瘤细胞可能分泌 IL-6 及其后续影响,与不良预后相关。本研究提供了全面的蛋白质组学分析,以寻求更好地了解和潜在的 AMPAC 治疗方法。
+ + + + +



 English
English


