文献解读|Cell Rep(8.8):胃百科全书:结合单细胞和空间转录组学揭示人胃的细胞多样性和稳态调节
✦ +
+
论文ID
原名:Stomach encyclopedia: Combined single-cell and spatial transcriptomics reveal cell diversity and homeostatic regulation of human stomach
译名:胃百科全书:结合单细胞和空间转录组学揭示人胃的细胞多样性和稳态调节
期刊:Cell Reports
影响因子:8.8
发表时间:2023.10.10
DOI号:10.1016/j.celrep.2023.113236
背 景
胃是重要的消化器官,具有多种生物学功能。然而,由于其细胞和腺体组成的复杂性,其精确的细胞生物学尚未阐明。
实验设计

结 果
01
正常和肠化生(IM)胃黏膜的单细胞图谱
研究者团队收集了 15 名在东京大学医院接受胃切除术的患者的胃组织进行了单细胞转录组分析(scRNA-seq),获得了137610 个细胞(图1A),通过无监督聚类鉴定了 35 个聚类,随后根据差异表达基因将其合并为七个主要细胞谱系(图1B-C): 39169 个上皮细胞(以KRT19、TFF1和PGA4为特征)、71360 个B 细胞和浆细胞(B 细胞:MS4A1;浆细胞:IGHG1、IGHA1、IGKC和JCHAIN)、15778 个 T 细胞(CD3D)、2002 个骨髓细胞(FCGR3A和ITGAM)、5225 个成纤维细胞(COL1A1、COL3A1和ACTA2), 3071 个内皮细胞(PECAM1和VWF)和 1005 个肥大细胞(TPSAB1)。
接下来,他们将39169 个上皮细胞分为 11 个聚类,包括小凹 (F) 亚型细胞(以MUC5AC、GKN1、GKN2、TFF1、TFF2和ADH1C为特征)、幽门腺(PG)/颈部细胞(MUC6、PGC和TFF2)、主细胞(PGA4、PGC和LIPF)、壁细胞(ATP4A、ATP4B和CKB)、肠上皮细胞(FABP1、FABP2和 CDH17)、杯状细胞(MUC2、TFF3和SPINK4)、神经内分泌(NE)细胞(GAST、SST、GHRL、CHGA、MAOB和CHGB)和增殖细胞(MKI67、HMGB2和STMN1)(图 1D-F)。图1G显示了各亚群细胞的比例以及肠上皮化生的严重程度,这表明在重度IM样本中肠上皮细胞和杯状细胞的数量增加。
首先,他们关注 NE 细胞的特征,因为它们可能代表每个胃和化生腺的更明确可解释的标记基因。一部分 NE 细胞表达REG4,这是化生黏膜的特异性标志物。一些REG4 + NE 细胞还表达GCG和PYY,它们是肠神经内分泌细胞特有的。值得注意的是,肠化生的严重程度(图1G)与REG4 + NE细胞的频率相关,表明胃肠化生包含具有结肠肠神经内分泌细胞内分泌特征的NE细胞。
F细胞是表面黏液细胞,具有胃黏膜和化生黏膜之间的生物学特性;这些细胞可分为两个不同的群体:胃因子 (GKN) + F 细胞和 ADH1 + GKN1− F 细胞(图1D-F)。GKN1是一种胃特异性蛋白质,具有多种功能,包括调节细胞周期进程、细胞增殖以及抗生素、抗炎和抗凋亡作用。
胃底腺和 PG 由 F 上皮、峡部和腺基组成(图 1 D)。他们使用集成的 scRNA-seq 数据集来识别不同的细胞群,包括胃腺颈部区域的细胞群,将其称为 PG/颈部细胞(图1D-1F)。他们鉴定了两种不同的 PG/neck 细胞群:PG/neck1 和 PG/neck2 细胞(图 1E-F)。PG/neck2 细胞高度表达MUC6和/或TFF2,表明存在幽门以及胃底黏液腺细胞。PG/neck2 群体包括表达CLDN2和TFF3的细胞,分别是肠细胞和杯状细胞的已知标记。

图1. 胃黏膜主要细胞和上皮细胞聚集。
(A) UMAP 显示通过 scRNA-seq 鉴定的 7 种主要细胞类型。(B) 代表性的主要细胞标记基因。(C) 主要细胞类型的比例。(D) PG、胃底腺和化生黏膜的上皮细胞类型。(E) UMAP 显示通过 scRNA-seq 鉴定的上皮细胞亚聚类。(F) 代表性上皮细胞标记基因。(G) 根据肠化生状态的上皮细胞类型的比例。(H) PG/neck1 和 neck2 的干性评分。
02
转录熵和轨迹分析揭示 LEFTY1 +细胞群作为潜在的干细胞聚类
为了研究胃腺中可能的干细胞,他们进行了转录熵分析,以根据每个细胞表达基因的数量计算干性评分。干性评分表明每个细胞的分化状态,较高的熵表明更不成熟的状态。PG/neck2 细胞的干性评分显著高于 PG/neck1 细胞(图 1 H),表明 PG/neck2 聚类可能包含可能的干细胞。
他们进行了无监督轨迹分析探索胃上皮细胞中的干细胞群及其发育路径,可视化基因表达的分化动态(图2A)。该分析揭示了两个谱系,即正常胃谱系和 IM 谱系,其特征分别为SOX2和CDX2富集(图 2 B)。他们在 PG/neck2 细胞中发现了一小群细胞,将其称为“连接细胞”,位于胃和肠途径之间(图 2C)。这些细胞是潜在的干细胞,因为它们表达高水平的干相关标记物(例如AQP5、SMOC2、ASCL2、TNFRSF19、EPHB2、CD44和PROM1)。伪时间分析显示了从“连接细胞”群体到胃上皮细胞各种路径的时间轨迹(图2D)。在 PG/neck2 细胞中,他们将LEFTY1、OLFM4和CLDN4确定为差异表达基因中“连接细胞”的候选特异性标记(图 2 E)。尽管OLFM4和CLDN4也在肠细胞和杯状细胞中表达,但LEFTY1在“连接细胞”中高度富集(图 2 F)。LGR5 是一种代表性干细胞标记物,也在“连接细胞”中表达(图 2F)。综上所述,与其他干细胞标志物相比,LEFTY1 在该群体中表达水平更高、特异性更高。
LEFTY1是一种分泌蛋白,是转化生长因子 β (TGF-β) 超家族的成员,在发育过程中决定左右不对称性中发挥作用。在本研究中,LEFTY1在一些 ADH1 + GKN1 − F 细胞中表达,特别是在化生谱系中(图 2 F)。为了研究LEFTY1作为干细胞标记物在胃黏膜稳态中的潜在作用,将 PG/neck2 和 ADH1+ GKN1- F 细胞分为LEFTY1 +和LEFTY1 -聚类。
LEFTY1+细胞在 PG/neck2 和 ADH1+ GKN1− F 细胞群中表现出显著更高的干性评分(图 2 G)。IHC 显示 LEFTY1 +细胞以低频率存在于胃幽门和胃底腺中,并且似乎位于峡部区域周围和内部(图2 H),这与将这些区域视为干细胞区的考虑相一致。相比之下,在 IM 黏膜中,LEFTY1 +细胞的观察频率要高得多,并且在空间上位于隐窝底部(图 2 H),已知肠干细胞就驻留在此处。LEFTY1 +细胞频率在化生腺中最高,其次是 PG 和胃底腺(图 2 H)。
他们对LEFTY1和LGR5进行RNA原位杂交(RNA-ISH)(图2I),发现一部分LGR5+细胞在幽门和化生黏膜中共表达LEFTY1 。此外,免疫荧光 (IF) 染色显示 CD44 +和/或 EPHB2 +可能的干细胞亚群共表达 LEFTY1(图 2 J)。其他干标记阳性细胞相比,LEFTY1+细胞的频率较低。在对人胃组织的空间分析中,LEFTY1 与其他干细胞标记物的共定位表明 LEFTY1 是实际的候选干细胞标记物。根据轨迹和伪时间分析,LEFTY1+细胞是胃和化生腺中的常见干细胞;然而,他们发现EPHB2仅在化生黏膜中的LEFTY1+细胞中表达,而在正常胃黏膜中不表达(图2J)。他们假设,在肠化生期间,正常胃腺中的LEFTY1+干细胞发生表型变化,并且它们通过获得EPHB2 +表型而获得肠干细胞的独特特性。
为了研究 Lefty1 细胞在小鼠中的功能,他们建立了Lefty1-CreERT2:Rosa26- tdTomato小鼠模型,并进行谱系追踪分析(图 2 K)。注射他莫昔芬后第 7 天,观察到很少的 tdTomato +细胞(图2 L),表明Lefty1 +细胞相对静止。然而,经过诱导壁细胞损伤的 DMP-777 治疗后,在胃底腺黏膜中观察到tdTomato +细胞的增殖及其在表面方向的替换,但在PG黏膜中未观察到(图2L)。这些结果表明,Lefty1 +细胞在成人胃中充当静止干细胞,并在急性胃黏膜损伤期间提供祖细胞。
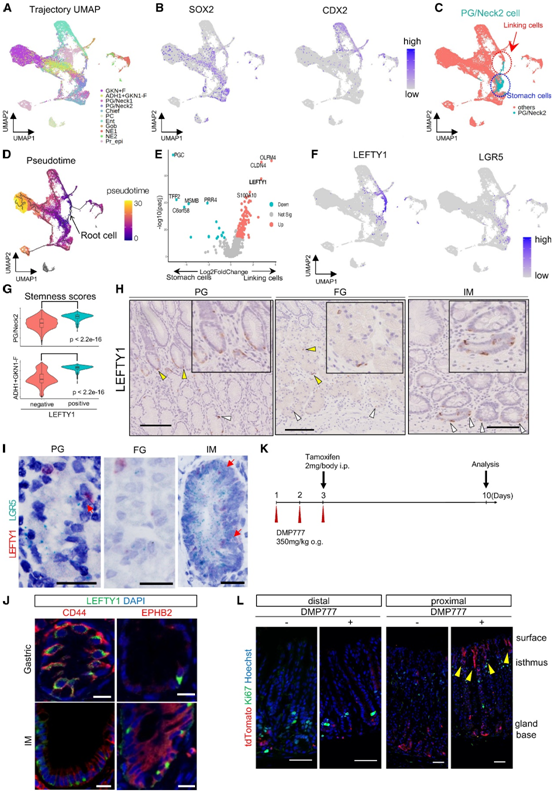
图2. Epi细胞的轨迹分析将LEFTY1确定为可能的新型干细胞标记物。
(A) UMAP 显示图 1 E 中所示的每个亚聚类。(B)表层细胞中的谱系相关基因表达(分别为胃谱系的SOX2和化生谱系的CDX2)。(C) UMAP 显示 PG/neck2 细胞的分布。(D) UMAP 图上显示的伪时间轨迹分析。(E) 火山图显示 (C) 中所示的两个 PG/neck2 细胞组之间差异最大的基因(“连接细胞”和“胃细胞”)。(F) Epi 细胞中 LEFTY1 和 LGR5 的表达。(G)每个 PG/neck2 细胞聚类和 ADH1+ GKN– F细胞聚类中 LEFTY1+ 和 LEFTY1– 细胞的干细胞评分。(H) 人胃中 LEFTY1 的 IHC分析。(I) LEFTY1(红色)和 LGR5(绿色)的 RNA-ISH。(J) 肠化生和胃黏膜中 LEFTY1(绿色)和 CD44/EPHB2(红色)的 IF。(K) 他莫昔芬和 DMP-777 的治疗方案。(L)小鼠的近端胃和远端胃进行 IF 染色。
03
胃成纤维细胞与肠上皮化生的发展相关
在本研究中,他们鉴定了 5225 个成纤维细胞,分为 6 个亚群:Kruppel 样因子 (KLF)+细胞( KLF4、SFRP1、SFRP2和PI16的特征表达)、CCL11 +细胞(CCL11、ABCA8、APOE、和ADAM28)、血小板衍生生长因子受体 (PDGFR) +细胞(PLAT、POSTN、PDGFRA、BMP4和WNT5A)、FibSmos(表达成纤维细胞和平滑肌标记物的成纤维细胞53(HHIP、MYLK和ACTG2)、周细胞(RGS5 和 CD3654)和 pericyte_SM(具有平滑肌标记的周细胞)(RERGL、ADIRF、MYH11 和TAGLN)(图 3 A-B)。
接下来,他们对骨形态发生蛋白4 (BMP4) (PDGFR +成纤维细胞中的标志基因之一)和 noggin (NOG)(一种内在的 BMP 拮抗剂)进行了 RNA-ISH。在 IM 黏膜中,与胃黏膜相比,在表面区域的化生上皮细胞周围更常见BMP4 +成纤维细胞(图 3 C)。在化生附近的正常胃黏膜中也检测到存在大量的BMP4 +成纤维细胞(图3C)。然而,在远离肠化生的正常胃黏膜中,很少发现BMP4 +成纤维细胞(图3C),这表明在肠化生过程中,特异性成纤维细胞群的组成变化比上皮细胞的变化发生得更早。在ISH分析中,胃化生黏膜成纤维细胞中BMP4的表达水平与正常结肠黏膜相当,这表明BMP4相关组织稳态的生理在化生胃腺和结直肠隐窝中相似(图3D)。他们观察到BMP4从正常胃黏膜到化生和结肠黏膜增加(图3E),表明成纤维细胞中BMP4的增加先于甚至可能诱导肠化生。
接下来,他们对成纤维细胞进行了基因调控网络分析(图3F),发现叉头盒转录因子在其生物学中发挥作用。具体来说,FOXF1、FOXF2和FOXL1的转录活性在PDGFR成纤维细胞和FibSmo细胞中上调。在小鼠结肠成纤维细胞中,FOXF1、FOXF2和BMP4表达之间以及FOXL1和WNT表达之间具有相关性。因此,表达FOXF1/2和FOXL1的PDGFR+成纤维细胞(FB)和FibSmos在调节胃稳态和化生转化中显然很重要。
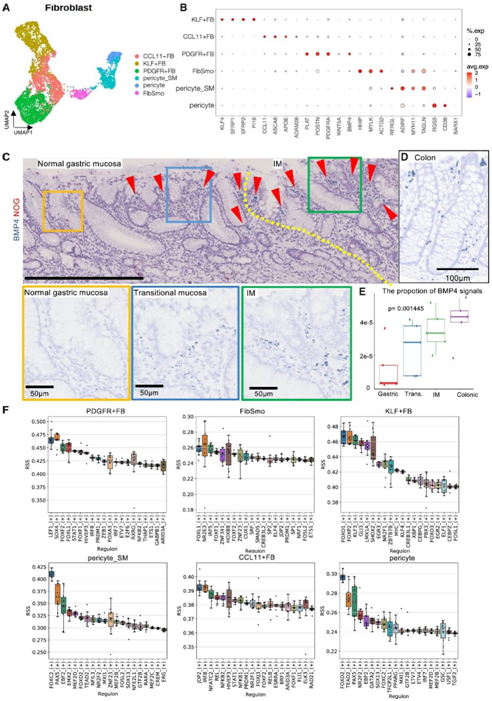
图3. 胃黏膜FB的表征。
(A) UMAP 显示 FB 亚聚类。(B) FB 亚聚类的代表性标记基因。(C) 正常胃黏膜和肌内黏膜(包括它们之间的移行黏膜)中 BMP4 的 RNA-ISH。(D)结肠黏膜中BMP4的RNA-ISH。(E) 每个腺体黏膜表面基质区域中 BMP4 绿色信号的比例。(F) 箱线图显示每个 FB 聚类中基因调控网络分析的结果。
04
胃和肠FB的比较
他们比较了肠道细胞图谱中胃 FB 和肠 FB 的转录谱,其中不包含胃 FB。本研究中的样本和公共数据集中的 FB 分布几乎相等,特别是在周细胞聚类中(图 4 A-B)。然而,胃和小肠具有特定或富集的 FB(图 4 C)。比较胃和肠道细胞图谱之间的差异表达基因,他们发现胃 FB 中 BARX1 和 TRPA1(一种疼痛受体)的表达有限(图4D)。BARX1 是胃 FB 特异性转录因子参与胃的正常发育,BARX1基因敲除小鼠没有发育出正常的胃。因此,BARX1 +胃FB可能在正常胃发育中发挥关键作用。他们发现 FibSmo 细胞表达最高水平的BARX1(图 3A-B)和高水平的刺猬相互作用蛋白(HHIP)(图 3B)。他们利用RNA-ISH证实了BARX1的胃特异性表达以及BARX1 + FB中HHIP的共表达,FB中的BARX1表达发生在幽门和胃底腺黏膜的固有层,表明BARX1通过其下游与上皮细胞相互作用基因(图4E)。相比之下,在结肠和小肠黏膜中未观察到BARX1 + FB(图 4 E)。然而,在胃的IM黏膜中,BARX1+FB得以保留,并且它们的频率与在胃黏膜中检测到的频率相当(图4E)。他们还在部分胃FB中发现了BARX1和HHIP的明显共表达,在FB中检测到BARX1表达比HHIP表达更广泛(图4E)。
BARX1 可诱导分泌型卷曲相关蛋白 (SFRP) 的表达,该蛋白通过在发育阶段阻断局部 WNT 信号传导来促进胃上皮细胞的分化。BARX1在本研究样本中的所有 FB 亚型中均以发生表达,但 SFRP 表达主要限于 scRNA -seq 数据集中的KLF+ FB(图 3 B)。RNA-ISH显示SFRP1和BARX1在胃FB中未发生共表达,这表明与发育阶段不同,BARX1不会在成人胃FB中诱导SFRP1(图4F)。此外,SFRP + FB 仅在胃黏膜下层中观察到,这与结肠黏膜不同,在结肠黏膜中,SFRP 由黏膜层中的 FB 表达(图4 G)。
本项研究的 scRNA-seq 分析证实,胃 FB 的某些部分是调节 WNT 或 Hedgehog 信号传导的细胞因子的主要来源。具体而言,PDGFR + FB 和 FibSmo 细胞分别表达WNT5A(一种非经典 WNT 配体)和HHIP(图 3 B)。FB 的物理分布和由此产生的局部细胞因子环境对于消化器官的正常发育至关重要。因此,他们推测特定胃FB亚型的空间分布在胃黏膜和化生黏膜的组织结构中发挥重要作用。对胃和结肠组织中WNT5A的 ISH 分析显示, WNT5A在胃和化生黏膜中表达,主要在表面区域,与之前的结肠黏膜研究一致(图4H)。化生区域中的WNT5A表达水平高于幽门或胃底黏膜,与BMP4表达一致(图 4 H)。在整个胃黏膜中经常观察到紧邻上皮细胞后面的WNT5A+ FB的紧密排列(图 4H),这表明 WNT5A + FB 可能与上皮细胞相互作用。相反,HHIP + FB 分布在距上皮细胞层一定距离的基质空间中(图 4 H)。
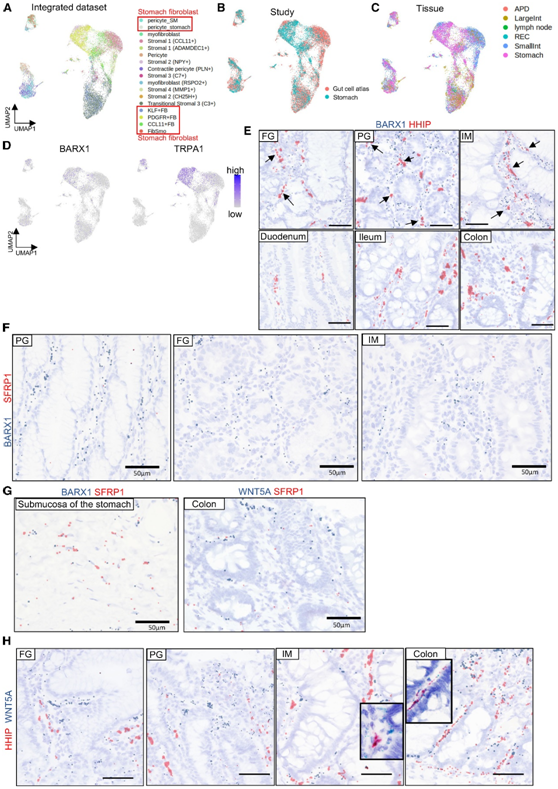
图4. 胃FB细胞图谱与肠FB细胞图谱的比较。
(A) FB 亚聚类基于胃 FB 和 肠FB细胞的组合数据集。(B-C) UMAP 中每个数据集的分布。(D) FB 中 BARX1 和 TRPA1 的表达。(E-H) RNA-ISH分析。
05
亚细胞水平空间转录组分析证实了通过 scRNA-seq 识别的细胞分布
为了创建包含空间信息的综合人类胃细胞图谱,他们采用了空间单细胞成像分析(CosMx)。该技术能够以亚细胞分辨率对约1000 个 RNA 靶标进行分析。
为了阐明所有胃细胞类型的空间分布,他们分析了包含幽门腺和胃底腺的标本,其中都包括 IM 区域(图5A)。与相同样本的scRNA-seq相比,空间数据集捕获了更多的FB(图5B)。在基底腺中捕获了更多的上皮细胞,可能是因为壁细胞产生的胃酸的存在,这可能会影响scRNA-seq实验中活细胞的降解(图5B)。
正如在scRNA-seq分析中,他们将空间转录组数据中的每个细胞的表达水平标准化,并应用UMAP可视化,这说明了每个主要细胞聚类中不同的标记基因表达(图5C)。然后,他们使用上皮细胞和FB的scRNA-seq数据集和免疫细胞的公共数据集中的标记细胞,对空间转录组数据进行了半监督聚类,这些数据进一步集成了免疫荧光(IF)强度、细胞大小和细胞纵横比(图5D-E)。他们使用标记基因和附加信息对聚类结果进行了细化,得到了39个聚类,分析了代表性聚类的空间分布和相应的H&E染色(图5D-E)。PDGFR + FB、FibSmos 和 KLF + FB的空间分布与 RNA-ISH 的空间分布明显相似(图3C和图4 E-H)。
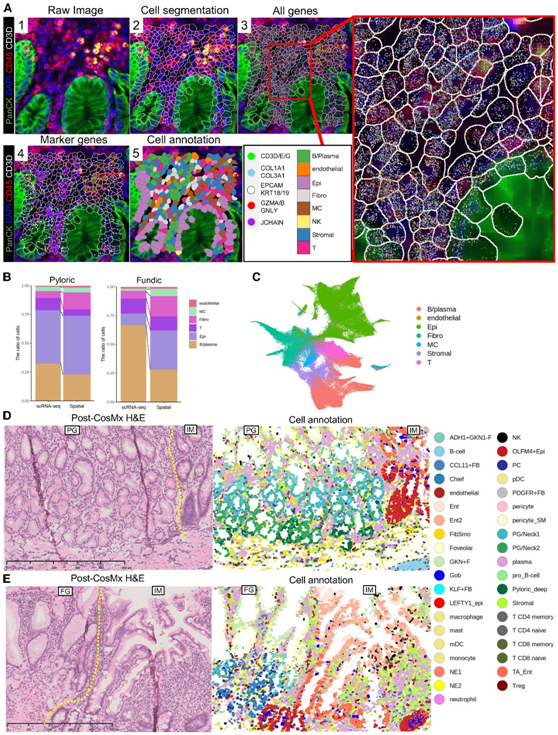
图5. 空间转录组分析概述。
(A) 代表性空间转录组数据集。(B) 空间转录组学和 scRNA-seq 数据集之间的细胞组成比较。(C) UMAP 显示标记基因识别的主要细胞聚类。(D-E) H&E 染色(左)和空间转录组注释的相应 FOV(右)。
06
正常和化生胃黏膜的空间动力学
他们确认了 LEFTY1 表达,与 IHC 和 RNA-ISH 一致(图2H-I),但也在幽门和胃底标本中发现了 LEFTY1+细胞扩增的黏膜区域(图 6 A-C)。这个局部LEFTY1+在视觉上识别为化生上皮,定位于幽门上皮和化生上皮之间的区域,Ki67+阳性细胞更多地出现在表面(图6A-C)。
在注释了空间转录组数据集中所有可能的细胞类型后,他们进行了细胞邻近分析,该分析根据连接每个细胞与其最近的 10 个相邻细胞的空间网络计算每个细胞聚类之间的空间距离(图 6D)。然后计算每个聚类之间的邻近度分数,并显示与组织学区域的关系,例如浅表黏膜、深层黏膜、化生、黏膜下层、淋巴聚集体或小淋巴滤泡和基质(图6E)。他们确认了 PDGFR + FB 与上皮细胞之间的接近度得分较高(图 6E-F),其中 PDGFR+ (BMP4+) FB 是更频繁地浸润到 IM 黏膜内部和周围。此外,与 FB和其他上皮细胞相比,自然杀伤 (NK) 细胞和肠上皮细胞之间的接近度分数更高(图 6E-H)。
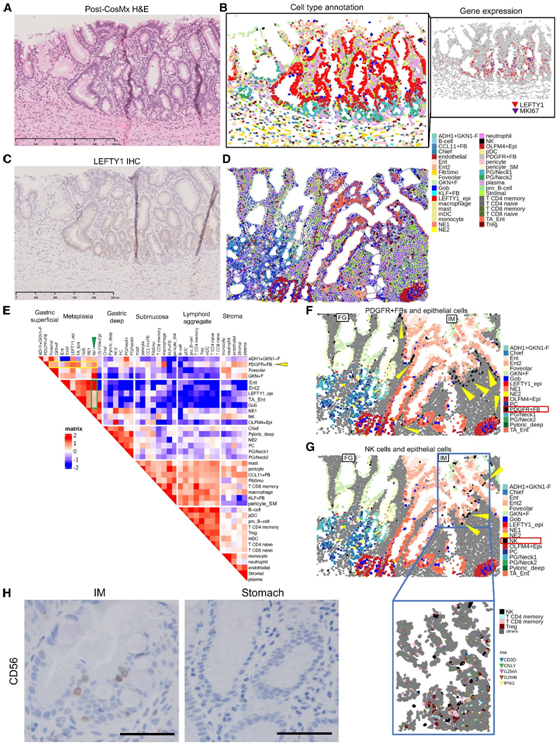
图6. 正常胃黏膜和化生胃黏膜的空间动态。
(A–C) 具有局灶性增殖特征的从胃到肠化生的代表性过渡黏膜。(D) 胃黏膜中的代表性空间网络。(E) 使用 (D) 中所示的空间网络的细胞邻近度得分热图。(F-G) Epi 细胞与 PDGFR +FB和NK细胞之间的接近度。(H) 胃黏膜和肌内黏膜上 CD56 的 免疫组织化学(IHC)。
细胞间通讯(CCC)分析显示,PDGFR+FB 主动向上皮细胞分泌多种信号分子,例如 ncWNT(非经典 WNT)和神经调节蛋白 (NRG) 信号分子(图 7A),WNT 和 ncWNT 通路在胃黏膜发育中发挥重要作用。虽然 WNT 信号传导包括各种细胞谱系之间复杂的细胞相互作用,但 ncWNT 信号传导以 PDGFR + FB 为主,表明 PDGFR + FB 在组织稳态和发育中发挥重要作用在肠化生中(图7B)。PDGFR+FB 和上皮细胞之间的 WNT5A-FZD5 相互作用清晰可见(图 7C)。
他们重点关注 PDGFR + FB 的另一种代表性配体,称为 NRG 信号网络;该网络显示出与 ncWNT 信号传导相似的相互作用网络(图 7D),突出了 PDGFR+ FB 在胃中的重要作用。NRG1-ERBB2/ERBB3 信号传导已知可对抗细胞凋亡,以保持人类滋养细胞的分化。NRG1驱动肠道干细胞在受损的上皮细胞中增殖和再生。NRG1 信号传导在 PDGFR+FB 和上皮细胞之间表现最为强烈。因此,NRG1 信号传导可能在化生黏膜的发育和/或维持中很重要。值得注意的是,ERBB3 表达在肠化生中明显受到限制(图 7E),这突出了 NRG1-ERBB3 信号在肠化生中的重要性。
他们发现血小板源性生长因子 (PDGF) 受体信号传导受到在各种上皮细胞中高度表达的 PDGFRA 配体的刺激。巨噬细胞和上皮细胞也分别表达PDGFC和PDGFB配体(图7F)。然而,PDGFR信号如何与肠化生中的其他细胞谱系协同发挥作用尚不确定,需要进一步研究以阐明其生物学机制。
上皮细胞对基质细胞的表达有显著影响,反之则没有(图7G-H)。有趣的是,聚焦于PDGFR+FB,他们发现当化生上皮而不是其他胃型上皮进入邻居区域时,BMP的表达由特异性诱导(图7I),这与BMP4 RNA-ISH分析一致。在化生黏膜附近,NRG1和WNT5A的表达水平也特异性升高,表明化生上皮细胞与FB之间存在积极的相互作用(图7I)。
目前认为,上皮细胞响应外界刺激和其他因素(如幽门螺杆菌感染)而分泌的细胞因子诱导基质细胞发生变化(图3C-E),最终导致永久性上皮化生性变化。
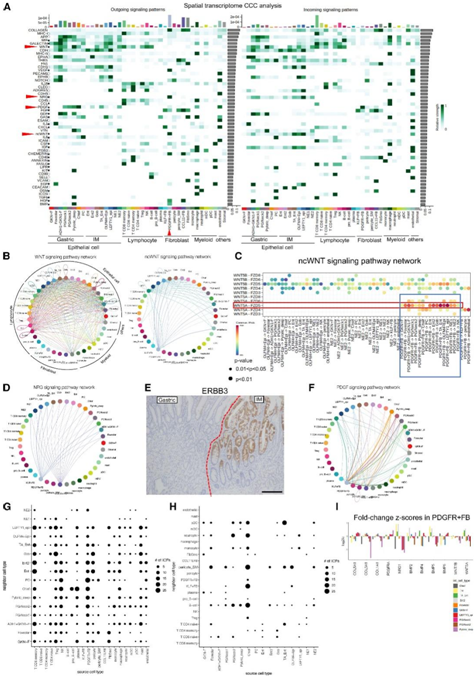
图7. 基于空间转录组数据集的各细胞聚类之间的细胞间相互作用。
(A) 基于空间转录组数据集的每种细胞类型之间细胞间相互作用的整体视图。(B、D、F) 通过 CCC 分析确定的代表性特征交互网络。(C) ncWNT 信号通路网络的详细信息。(E) 正常胃黏膜和肌内黏膜边界的 ERBB3 的 IHC。(G-H)点图显示了相互作用改变基因(ICG)的总数,定义为在“源细胞”中表达的基因数量,这些基因根据与“邻近细胞”的空间距离的变化而变化。(I) PDGFR+ FB 中相对于各种邻近外延细胞类型的基因表达水平的变化。
+ + + + + + + + + + +
结 论
本项研究对人胃进行了scRNA-seq和亚细胞水平的空间转录组学分析,并构建了迄今为止最大的数据集:胃百科全书。该数据集由来自 scRNA-seq 和空间转录组的约 380000 个细胞组成,能够对胃细胞和化生细胞的转录和空间信息进行综合分析。该分析将LEFTY1鉴定为从未表征过的干细胞标记物,并通过谱系追踪分析得到证实。上皮细胞和基质细胞之间的多种细胞间相互作用,包括 PDGFRA + BMP4 + WNT5A +成纤维细胞,在肠化生的发育转换中具有重要作用。
+ + + + +



 English
English


