文献解读| Cancer Cell(50.3):肿瘤内乳杆菌通过乳酸诱导的代谢重组赋予放化疗抗性
✦ +
+
论文ID
原名:Tumor-resident Lactobacillus iners confer chemoradiation resistance through lactate-induced metabolic rewiring
译名:肿瘤内乳杆菌通过乳酸诱导的代谢重组赋予放化疗抗性
期刊:Cancer cell
影响因子:50.3
发表时间:2023.10.16
作者/通讯作者:Lauren E Colbert/Ann H Klopp
单位:德克萨斯大学 MD 安德森癌症中心放射肿瘤科
DOI号:10.1016/j.ccell.2023.09.012
背 景
肿瘤,即使在所谓的无菌器官中,也具有独特的微生物群,可以改变治疗反应和生存。而肠道微生物群通过系统机制间接影响肿瘤反应,包括无数的免疫和代谢介导通路,肿瘤内的细菌可能直接影响肿瘤的生长、存活和功能。
目前,仍然缺乏对肿瘤微生物组的深入机制研究。
实验设计
结 果
01
肿瘤惰性乳杆菌与 CRT 无反应和无复发生存率降低相关
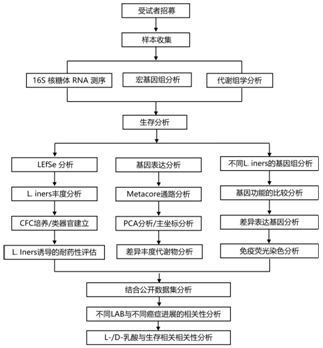
本项研究共纳入101名新诊断的局部晚期宫颈癌患者,收集了其中的96名患者在标准治疗(CRT)前的样本(图1A-B),并进行16S核糖体RNA基因测序(16S)、shotgun宏基因组测序(SMS)和代谢组学分析。在治疗期间和治疗后(RT 1、3 和 5 周以及 12 周随访)还收集了 244 个宫颈癌拭子。
他们首先在 43 名患者的队列中使用16S进行线性判别分析(LDA) 效应大小 (LEfSe),以了解与放化疗反应。惰性乳杆菌与 CRT 无反应显著相关,而变形菌门(门)、γ 变形菌门(类)和放线菌门(门)与 CRT 反应相关(图 1C)。肿瘤内惰性乳酸杆菌(L. iners)相对数量的增加与无复发生存(RFS) 降低显著相关。
为了验证L. iners与 RFS的关联,他们另外招募了 58 名患者。基线时任何肿瘤内的L. iners的数量仍然与 CRT 无反应显著相关。在所有患者中,46% 的样本中存在肿瘤L. iners (图 1 D),并且L. iners的数量仍然与 RFS 降低相关(图 1 E)。在基线样本的所有患者的单因素分析中,基线时L. iners相对数量也与较低的RFS和较低的总生存率(OS)显著相关。
L. iners的相对数量和总体肿瘤微生物组多样性、均匀度和总体丰富度在 CRT 期间或之后没有显著变化(图1F)。小肿瘤患者与大肿瘤患者基于L. iners相对计数的RFS无差异(图1H)。在这些患者中,肿瘤L. iners的存在仍然预示着显著较短的RFS。由于OS事件数较少,因此对L. iners进行了肠道微生物组多样性和均匀性调整,构建了L. iners的独立模型,并且L. iners在两个模型中都保持显著性(图1G)。
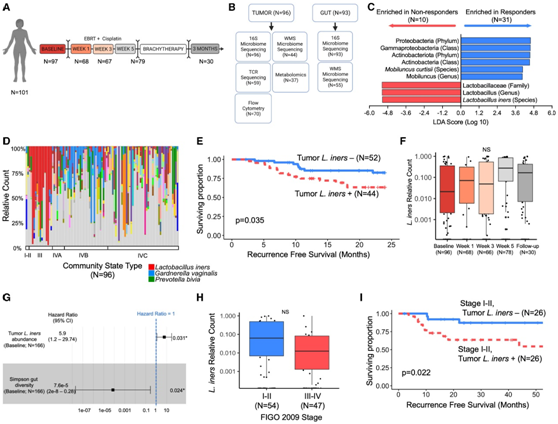
图1. 肿瘤内的惰性乳杆菌与宫颈癌患者的无复发生存率和总生存率降低相关。
(A) 研究患者的研究设计。(B) 收集并可用于基线(治疗前)每次分析的样本类型。(C) 在一个试点队列中,对来自宫颈肿瘤拭子的16S数据进行线性判别-效应大小(LEfSe)分析,以确定对辐射无反应者中富集的细菌。(D) 基线时所有患者的宫颈肿瘤拭子的 16S 成分堆积条形图。(E) Kaplan-Meier 无复发生存 (RFS) 曲线分析。(F) CRT 期间收集的宫颈肿瘤拭子中惰性乳酸杆菌的相对数量。(G) 总生存期 (OS) 的多变量 Cox 比例风险分析。(H) 按肿瘤大小分层的乳酸杆菌基线相对计数。(I) FIGO 2009 I-II期肿瘤患者的Kaplan-Meier RFS曲线,根据肿瘤L.iners的数量进行分层。
02
L. iners诱导宫颈癌细胞系对放化疗产生耐药性
为了检测来自宫颈癌的惰性乳杆菌是否能够直接引起独立于免疫效应的辐射抗性,他们培养、分离和表征了来自宫颈肿瘤的惰性乳杆菌菌株,然后过滤细菌上清液以获得无细胞上清液(CFS)。他们利用 HPV16+ 宫颈鳞状细胞癌 (CSCC) 细胞系 CaSki进行了系列稀释测定,并生成了宫颈癌患者来源的类器官系(PDO)(B1188),该类器官具有致密的 3D 形态,表现出与 CSCC 一致的免疫荧光特征(图 2 A-B),并且对电离辐射(IR) 和顺铂治疗敏感。经过几次传代后产生了基因组稳定的原代细胞系(B1188原代细胞)。
在用 IR、顺铂 (CIS)、吉西他滨(GEM) 或 5-氟尿嘧啶 (5FU) 或联合处理之前,他们将B1188 PDO分别与两种癌源L. iners菌株(CC-L.iners)的CFS、非癌症相关的L. iners菌株(NC- L.iners)的CFS和对照组(CTRL,NYC肉汤培养基处理)的CFS孵育两周。与CTRL相比,使用 CC-L.iners CFS 培养的 PDO 比 CTRL 表现出更积极的生长和抵抗力,具有更高的类器官数量、更大的类器官尺寸(图 2C-D),并且IR 后细胞活力增加(图 2E)。CC-L.iners和NC-L.CFS还导致B1188原代细胞活力增加(图2F)。在所有剂量的照射下,HeLa、SiHa和CaSki细胞均表现出显著增加的细胞活力(图2G-I)。CC-L. iners处理的B1188细胞对GEM有耐药性(图2J),但它对CIS或5FU没有产生耐药性(图2K-L)。但在IR后,它们表现出对GEM-IR、CIS-IR和5FU-IR的抗性(图2m-O)。他们观察到紫外线杀灭(UV-killed)、pbs洗涤(PBS-washed)的乳杆菌没有辐射致敏(图2P),这表明介导辐射抗性的因素是乳杆菌分泌的,而不是细菌细胞壁成分的作用。
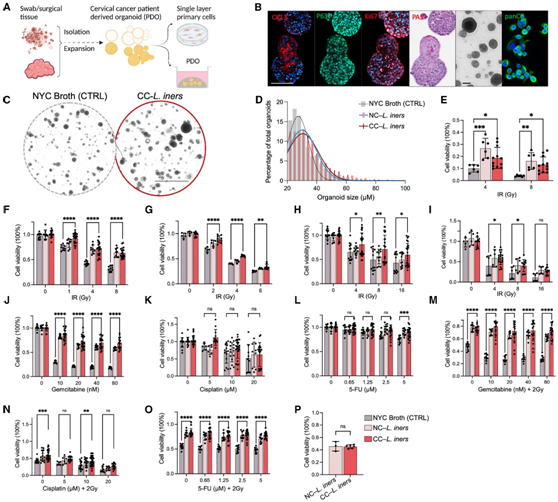
图2. 惰性乳酸杆菌在体外诱导治疗耐药性。
(A) 建立和患者来源的类器官(PDO)和B188原代细胞模型的流程。(B) 抗P63和抗Ki67抗体对PDO B1188的阳性染色,以及抗CK13抗体和PAS的分化标记物染色的表达降低,证实了鳞状细胞癌的起源。(C)用PDO B1188预处理癌源性乳酸杆菌(CC-L.iners)的清晰图像。(D)类器官大小和计数直方图(占总计数的百分比)。(E-P)辐照后的细胞活力。
03
L. iners改变乳酸信号通路中的基因表达
接下来,为了探究L. iners CFS 如何改变癌细胞对 IR 的敏感性,他们对预处理的 B1188 细胞进行了转录组分析(RNA-seq),并提出了L. iners对癌细胞代谢影响的机制(图 3 A)。用L. iners CFS 处理的细胞与 NYC 肉汤对照相比,基因表达显著改变(图 3 B)。Metacore通路分析揭示了与乳酸信号传导和乳酸脱氢酶(LDH) 活性密切相关的多个通路的富集,包括活性氧(ROS)诱导的细胞信号传导和缺氧诱导因子1(HIF-1) 转录靶标、FGFR 信号转导、Her2/ERBB2 信号转导,和p53 / p73依赖性细胞凋亡(图3C)。基因集富集分析(GSEA) 和Hallmark通路分析证实了氧化应激/ ros诱导的细胞信号和HIF-1a转录靶点的富集,以及骨骼肌基因相关的通路也受到乳酸盐的高度调控。
所有乳酸菌在碳水化合物利用后通过 LDH 活性产生乳酸作为发酵的最终产物。与有益的乳酸菌相比,L. iners的显著特征之一是其较小的基因组不含D-LDH基因,使其成为专性l -乳酸生产者。l -乳酸也是哺乳动物细胞和肿瘤中主要的对映体。虽然癌细胞可以通过甲基乙二醛途径产生d -乳酸,但这对代谢的影响可能可以忽略不计。
CC- L. iners在体外仅产生 L-乳酸(图3D),而癌症来源和非癌症来源的卷曲乳杆菌主要产生 D-乳酸(图3E);所有源自癌症的L. iners基因组均不含 D-LDH。他们使用定量L和d -乳酸离子色谱-质谱分析验证了这一点。CC-L. iners和NC-L.iners的l -乳酸水平明显高于对照组(图3F)。在宫颈肿瘤样本中,l -乳酸水平是d -乳酸水平的1000倍(图3G)。
对来自 NC-L. iners 和 CC-L. iners和L. Crispatus菌株的 CFS 进行非靶向代谢分析,揭示了糖酵解、磷酸戊糖通路以及 CC-L 氧化还原平衡调节方面的明显代谢网络变化,所有这些都与致癌乳酸代谢有关(图 3H-I)。
为了确定单独的 L-乳酸是否可以诱导类似于L. iners CFS 的化疗和 IR 耐药性,他们在化疗或 IR 处理前两周,用四种乳酸亚型(L-乳酸、D-乳酸、L-乳酸钠和 D-乳酸钠)预处理宫颈癌细胞系。培养基中的 L-乳酸(而非其他异构体)一致地反映了所有细胞系中宫颈癌细胞对 IR 和 GEM 的治疗耐药性,并观察到CIS和5FU处理后的不同效果(图 3 J-K)。
有趣的是, L. iners + 肿瘤中的 L-乳酸水平(不是 D-乳酸水平)从基线到 CRT 结束急剧增加,到第 5 周几乎翻倍(图3L-M)。与肉汤对照 (CTRL) 或单独的L. iners相比,经过辐照的L. iners处理的 B1188 细胞还表现出显著增加的 L-乳酸产量,并且在糖酵解、TCA 循环、氧化还原平衡和核苷酸以及短链脂肪酸代谢方面表现出显著的上调,特别是辐射处理后(图3N-O)。
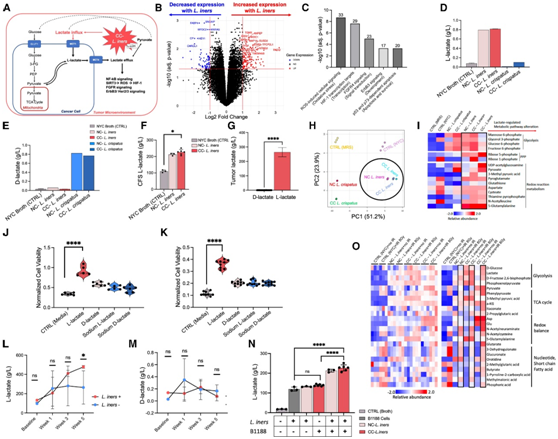
图3. 乳酸杆菌通过增加肿瘤微环境中L-乳酸的产生而引起治疗耐药性。
(A) 乳酸杆酸在肿瘤微环境中产生 L-乳酸的假设示意图。(B) B1188细胞用乳酸杆菌处理后的RNA-seq。(C)显著改变基因的Metacore通路分析。(D)细菌培养中l -乳酸的产生。(E)细菌培养中d -乳酸的产生。(F) 对照组、NC- L. iners或 CC- L. iners中的 L-乳酸水平。(G) 宫颈肿瘤 Cytobrush 样品的 L-乳酸和 D-乳酸相对水平。(H) 代谢物的主成分分析 (PCA)。(I) 最差异丰度代谢物的无监督层次聚类。(J) 用 20 mM 乳酸亚型(L-乳酸盐、D-乳酸盐、L-乳酸钠、D-乳酸钠、培养基对照)预处理的 B1188 细胞在照射(4 Gy)后的细胞活力。(K) GEM 后用 20 mM 乳酸亚型预处理的 B1188 细胞的细胞活力。(L)宫颈肿瘤样本中的 L-乳酸水平。(M)宫颈肿瘤细胞刷样本中d -乳酸水平。(N) l-乳酸水平分析。(6)原代细胞B1188 中存在差异富集的代谢物。
04
与L. iners – 肿瘤相比, L. iners + 肿瘤的糖酵解上调
L. iners是兼性厌氧菌,可以通过有氧呼吸产生ATP,也可以在无氧条件下转为发酵,高效生产乳酸。因此,他们假设在患者的缺氧肿瘤微环境中,乳酸生成和代谢重组可能会发生放大。非靶向代谢组学的主成分分析证实了L. iners +和L. iners – 肿瘤(图 4 A)的不同代谢物谱,L. iners+肿瘤中特征代谢物显著富集(图4B),总体表明代谢活性较高。监督聚类证实了L. iners+和L. iners -肿瘤中代谢物的差异富集聚类(图4C)。L. iners+肿瘤中显著富集的代谢物是丙酮酸,表明糖酵解活性、ATP和NADH增加,这也表明TCA循环和下游电子传递链以及脱氧鸟苷三磷酸和脱氧尿苷一磷酸的活性上调,它们都是DNA合成增加的前体,可由过量的ATP驱动。半乳糖酸在L. iners+肿瘤中也显著富集(半乳糖酸是乳酸菌发酵和乳酸产量增加的指标)。L. iners+肿瘤中上调最多的代谢通路是Warburg效应、糖酵解、谷氨酸代谢和半乳糖代谢通路(图4D)。
这些结果表明,L. iners在肿瘤微环境中对能量产生和DNA合成起着重要作用。
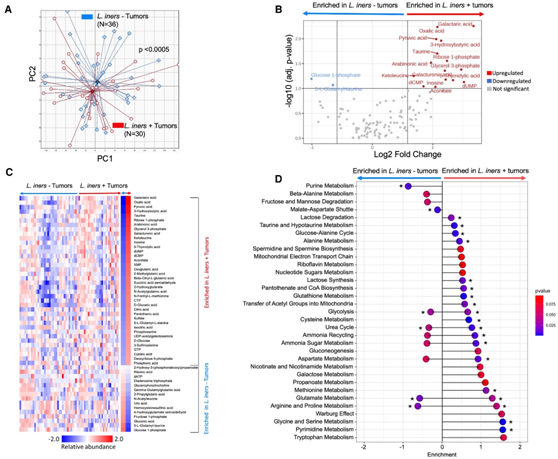
图4.与L. iners阴性肿瘤相比,L. iners阳性肿瘤具有代谢改变。
(A)肿瘤代谢物相对丰度的主坐标分析。(B) 差异丰度代谢物的火山图。(C) 差异丰度代谢物的监督层次聚类。(D) Lollipop图显示差异富集代谢物的通路。
05
肿瘤来源的L. iners获得了额外的乳酸生成基因
L. iners是健康宫颈阴道微生物群中的常见生物,并定期进行水平基因转移(horizontal gene transfer)以逃避抗生素并适应不断变化的营养,pH和氧合条件。为了确定 CC- L. iners特有的潜在功能,他们对两个 CC -L. iners分离株和两个 NC- L. iners分离株的完整基因组进行了测序。CC- L. iners和 NC- L. iners共有593 个基因。120 个基因是 CC- L. iners特有的,而 NC- L. iners仅包含 18 个特有基因(图 5 A-B)。总体而言,与发育异常相关的L. iners和 CC- L. iners之间较高的遗传共性表明这些基因是在癌发生之前或期间获得的,而不是在癌症发生之后获得的。
他们还进行了基因、功能和通路分析,以确定 CC- L. iners获得的、NC- L. iners中不存在的基因的功能。对 CC- L. iners和 NC -L. iners特有且共有的基因、功能和通路的完整比较分析显示,虽然所有的L. iners菌株都含有lacA、lacD和lacR基因,这些基因参与将半乳糖转化为d -甘油醛-3- p和果糖-6- p,但只有CC- L. iners还含有额外的lacG基因,该基因编码将乳糖转化为半乳糖-6- 磷酸和葡萄糖的6-P- β -半乳糖苷酶(图5C)。所有患者样本的L. iners +和L. iners分离株仅含有 L-LDH,而不含有 D-LDH 基因。CC- L.iners和 NC- L.iners分离株的非靶向代谢组学显示,CC- L.iners与 NC- L.iners中唯一上调的通路是半乳糖代谢,与基因组研究结果一致(图 5D) 。
它们还研究了 CC- L. iners和 NC- L. iners处理的细胞的内在 DNA 敏感性和DNA修复。虽然所有L. iners的基因表达涉及乳酸信号通路(图3),但未照射的 CC- L. iners处理细胞与 NC- L. iners处理细胞的基因表达也存在显著差异(图5E-F),几个DNA损伤反应通路、DNA复制和起始、G2/M和s期检查点以及E2F转录靶点显著下调。
他们评估了8 Gy辐照后不同时间点(2 h至24 h)的γ-H2AX动力学。所有细胞在IR后2 h表达最强的病灶强度,随着时间的推移强度降低,表明DNA损伤修复。与NC- L.iners相比,CC- L.iners表现出较少的初始病灶产生。与CTRL相比,两者都表现出更多的初始病灶形成(图5G-H)。
他们还注意到S期和G2/M检查点调节基因的表达改变(图4E-F),以及L. iners处理的细胞中EdU标记有增加的趋势(图5I),这表明S期检查点功能失调,CC-L.iners与NC-L.iners的氧化还原反应代谢略有不同。CC-L.iners中的乳糖通过lacG基因降解产生葡萄糖作为副产物(图5D),这也可以诱导Cdk1/CyclinB复合物阻滞G2/M检查点,并在DNA损伤的情况下提高照射后肿瘤的存活率。
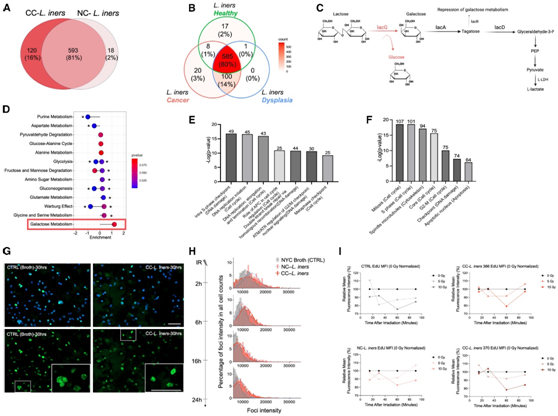
图5. 肿瘤来源的L. iners获得了更多的乳酸生成基因。在涉及内在辐射敏感性的通路中调控和改变癌细胞基因表达。
(A)比较基因组分析中的重叠和独特基因。(B)比较基因组分析中的重叠基因。(C) 在比较基因组分析中,CC- L. iners和 CC- L. iners共有且 CC- L. iners独有的通路中的序列基因。(D) Lollipop图显示差异富集代谢物的通路。(E) B1188 细胞的前 7 个差异表达的核心通路。(F) B1188 细胞中前 7 个差异表达的核心过程。(G)免疫荧光染色。(H) 在每种 CFS 条件下用 8 Gy 处理的原代细胞 B1188 的 γ-H2AX 动力学。(I) 对预处理的 B1188 原代细胞进行抗辐射 EdU DNA 合成测定。
06
惰性乳杆菌和类似的乳酸菌与其他癌症类型相关
他们还在 MDACC 分析了来自肛门癌、阴道癌和外阴癌的肿瘤样本的微生物组组成。L. iners在肛门癌、阴道癌、外阴癌、结直肠癌和肺癌都存在,因为L. iners是一种阴道共生微生物,并且L. iners与 RFS 降低密切相关(图6A)。
尽管惰性乳杆菌几乎完全是宫颈阴道微生物,但乳酸菌(LAB) 在身体各个部位都普遍存在。他们假设功能相似的 LAB 可能会影响不同的肿瘤。他们鉴定了 92 个细菌物种,其基因组包含在CC- L. iners中发现的lacA、lacG、lacD和lacR基因(图 6B -6D)。这些细菌中的 40%与其他癌症的 RFS 和/或 OS 降低有关(图 6D)。在所有四种癌症(NSCLC、COAD、HNSCC和SKIN)中,所有肿瘤lacGDRA细菌都与较低的RFS显著相关(图6E-G)。这些细菌包括粪肠球菌(COAD)、副干酪乳球菌(HNSCC)、约翰氏乳球菌(HNSCC, NSCLC)、、头葡萄球菌(NSCLC)、人链球菌(COAD, NSCLC)、lugdunensis (SKIN)、溶糖链球菌(NSCLC)、瓦尔纳氏链球菌(COAD)、血管链球菌(COAD)和螨虫链球菌(COAD)。
30%的专性l -乳酸产生基因(有L-LDH基因但没有D-LDH基因)与患者生存差相关,而5种专性d -乳酸产生基因均与患者生存差无关(图6D);40%的d-乳酸产生物与RFS和OS的增加有关,即肠道微生物群中产生d -乳酸的LAB具有保护作用。
在头颈鳞状细胞癌(HNSCC)样本中,只有专性d -乳酸产生物的患者具有较好的RFS和OS(图6H-I),而具有的l-乳酸产生物的LAB患者的中位时间为13个月,这表明d-乳酸可以在肿瘤细胞中与l-乳酸竞争单羧酸转运体(mct)。虽然L. iners是一种共生的宫颈阴道微生物,但它的功能可能与其他癌症有关。
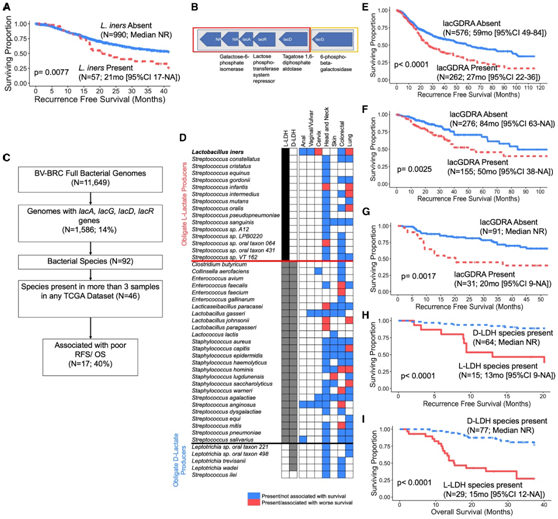
图6. L. iners和基因组相似的共生 L-乳酸产生菌 (LAB) 预示着各种癌症类型的预后不良。
(A)非小细胞肺癌 (NSCLC) TCGA 数据集中原发肿瘤样本中存在或不存在L. iners的无复发生存率 (RFS) 。(B) 通过比较基因组分析,在L. iners分离株和基因组中发现连续操纵子。(C) TCGA 数据集中鉴定遗传相似的 LAB 物种的流程图。(D) MDACC和TCGA数据集中与L. iners基因组相似的lacGDRA细菌的频率。(E-I) 不同癌症患者的RFS分析。
+ + + + + + + + + + +
结 论
本项研究采用深度微生物组测序、靶向细菌培养和体外测定的组合方法,探索影响宫颈癌患者放化疗反应的和肠道微生物组特征。在肿瘤中发现的专性产生 L-乳酸的乳酸菌,即惰性乳杆菌,与患者生存率降低有关,诱导宫颈癌细胞对化疗和放疗产生耐药性,并导致代谢重组或多种代谢通路的改变。基因组相似的、与身体其他部位共生的产生 L-乳酸的乳酸菌也与结直肠癌、肺癌、头颈癌和皮肤癌的生存显著相关。本项研究结果表明,肿瘤微环境中的乳酸菌可以改变肿瘤代谢和乳酸信号通路。乳酸菌可能成为跨癌症类型的有希望的治疗靶点。
+ + + + +



 English
English


