文献解读|Cell Rep Med(14.3):胆道癌患者来源类器官的个性化药物筛选及其临床应用
✦ +
+
论文ID
原名:Personalized drug screening in patient-derived organoids of biliary tract cancer and its clinical application
译名:胆道癌患者来源类器官的个性化药物筛选及其临床应用
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2023.11.21
DOI号:10.1016/j.xcrm.2023.101277
背 景
胆道癌(BTC)是人类最致命的恶性肿瘤之一,是指一系列浸润性腺癌,包括肝内胆管癌(ICC)、肝外胆管癌(ECC)和胆囊癌(GBC)。BTC患者对化疗表现出不同的反应,并且没有有效的方法来预测化疗反应。患者来源的类器官(PDO)是一种从癌细胞中分离和培养的三维(3D)结构的培养系统,据报道可以准确地再现结肠癌、胰腺癌和肝癌等实体瘤的组织结构。但是,目前对BTC PDO进行药物筛选研究的样本量相对较小,并且基于PDO的药物敏感性与化学敏感性相关的基因表达特征仍然很大程度上未知。
实验设计

结 果
01
建立活体BTC类器官生物库
为了建立活的 BTC 类器官生物库,研究者团队从 72 名 BTC 患者中获取了 82 个原发肿瘤和恶性腹水样本(图 1 A),其中包括 57 个 ICC、15 个 ECC 和 10 个 GBC(图 1 B)。他们从解离的 BTC 组织中建立了 61 个PDO,成功率为 74.4%,其中包括 44 个 ICC、13 个 ECC 和 4 个 GBC(图 1 B)。每个 PDO 均通过人工基底膜中的原代培养形成不规则形状的囊肿样结构,然后传代一次以确认活力(图 1 C)。该类器官生物库涵盖了 BTC 的不同解剖亚型以及不同的临床肿瘤阶段(图 1 B),表明可以从 BTC 的不同亚型建立类器官。
为了评估 BTC 类器官的组织学特征,他们进行了苏木精和伊红 (H&E) 染色(图 1 C)和免疫组织化学 (IHC)(图 1 D)。BTC类器官表现出不规则形状的囊肿样结构和腺体形状,与类器官最初来源的肿瘤组织的H&E染色结果相似(图1C)。细胞角蛋白 19 (CK19) 和细胞角蛋白 7 (CK7) 的蛋白表达模式与 PDO 和组织相匹配(图1D,图S1A)。
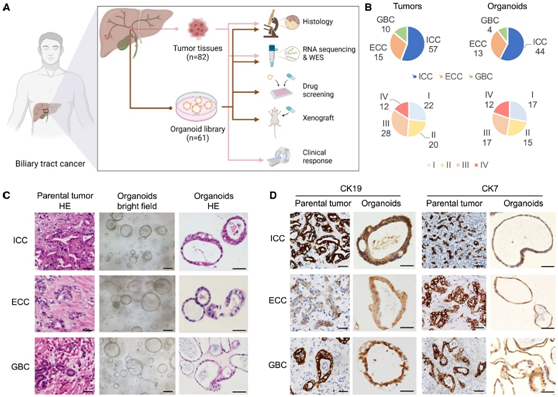
图1. BTC患者建立的PDO。
(A) 实验设计。(B) 饼图根据组织学类型(上)和肿瘤淋巴结转移 (TNM) 分期(下)比较所有肿瘤与所有衍生类器官的分层。(C) 患者来源的 BTC 类器官和来自三种主要组织学亚型的匹配原发性肿瘤的代表性 H&E 和明场显微镜图像。(D) 对亲本肿瘤和类器官的 BTC 标记物(CK19 和 CK7)进行 IHC 分析。
此外,通过全外显子组测序,类器官及其相应的亲本肿瘤具有相似的突变谱,一致性率大于51%(图S1B)。重要的是,类器官的反复突变(图S1C)和拷贝数改变(图S1D)都再现了人类BTC的基因组改变。他们进一步分别建立原位模型和皮下模型。异种移植的类器官在体内生长健壮(图S1E)。H&E 染色和 CK19 染色的 IHC 显示,异种移植类器官的肿瘤再现了从 BTC 患者获得的原发肿瘤的组织病理学特征(图 S1 F)。总之,研究者团队建立了一个活的 BTC 类器官生物库,其中这些 BTC 类器官再现并保留了其原始肿瘤组织的组织学和遗传特征。
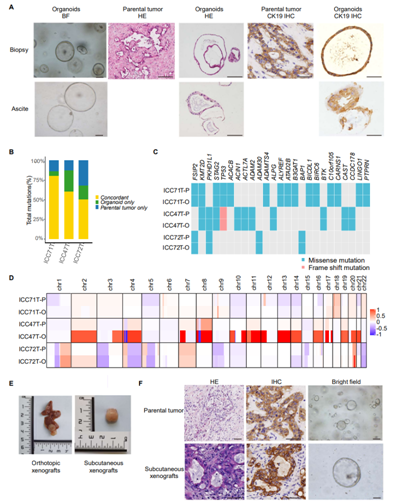
图S1. 为BTC生物库建立的患者来源类器官。
(A)患者来源的BTC类器官和活检和腹水中匹配的原发肿瘤的代表性亮场、HE和IHC显微镜图像。(B)亲代肿瘤和相应的类器官系中检测到的突变的一致性。(C)通过WES在亲代肿瘤和相应的类器官系中发现的复发突变。(D)代表性匹配原发肿瘤标本和相应pdo的拷贝数分析。(E)由患者来源的BTC类器官产生的原位肿瘤异种移植物和皮下肿瘤异种移植物的代表性图像。(F)患者来源的BTC类器官异种移植具有代表性的HE、IHC和明场显微镜图像。
02
BTC 类器官模型的临床和分子特征
为了表征成功类器官培养的肿瘤组织的特征,他们将其临床特征和表达谱与未能建立类器官培养的肿瘤组织进行了比较。所有晚期的BTC组织(TNM IV期)都可以成功培养类器官(图2A)。H&E染色评估的原始组织的肿瘤含量也与PDO衍生性呈正相关(图2A,图S2A)。
接下来,他们进行 RNA 测序以比较 BTC 组织与成功或失败的类器官培养物之间的表达谱。典型的干性和增殖基因包括GRAMD1B、DLGAP1、PIGR和GNMT在类器官培养成功的肿瘤组织中高表达,而肿瘤抑制基因和抗增殖基因如CRYM-AS1、kcnq10t1、PLAT和DHRS9在类器官培养失败的肿瘤组织中表达上调(图S2B)。他们发现干细胞相关基因ANPEP、PIGR、APOD和增殖基因CHRDL1、FXYD2、THBS4、LEFTY1、NAT8L高表达,而抑制肿瘤生长的基因FAT2、GJB2、BNIPL、GRHL3、KRT15在成功的类器官中显著下调(图2B,图S2C)。与此一致的是,基因集富集分析(GSEA)证实,在类器官培养成功的肿瘤组织中,增殖和干细胞相关通路显著富集(图2C)。免疫组化分析显示,在成功的类器官培养中,干细胞相关基因PIGR和APOD以及增殖相关基因NAT8L和THBS4的蛋白表达水平显著升高(图2D)。
这些结果表明,具有TNM IV期特征、肿瘤纯度高、干性和增殖性基因表达增强的BTC更容易成功生成类器官。
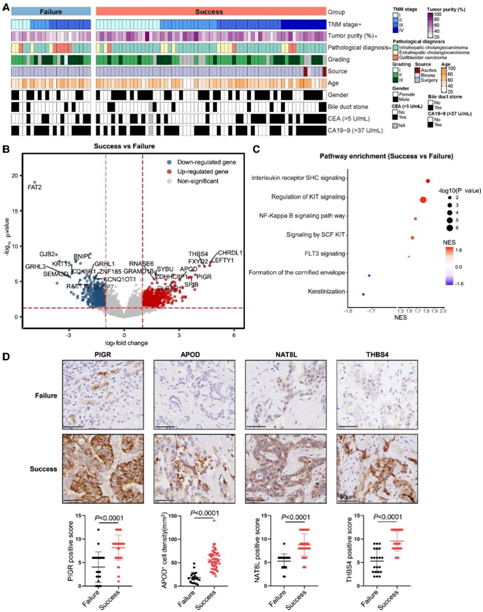
图2. 成功类器官培养组织的特点。
(A) 成功的类器官培养组织的临床特征。(B) 火山图显示成功的类器官培养组织和失败的类器官培养组织的差异表达基因(DEG)。(C) 成功和失败的类器官培养组织中富集的通路。(D) 属于两组的福尔马林固定石蜡包埋 BTC 样品的代表性 IHC 图像。
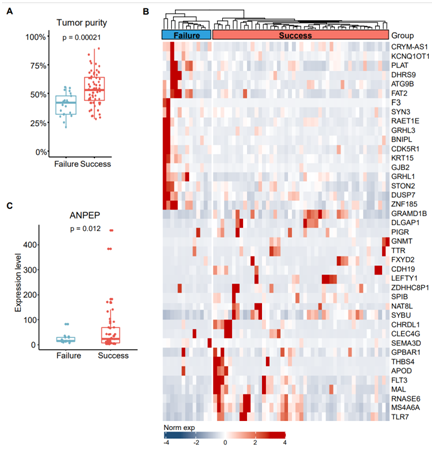
图S2. 类器官成功培养组织的干性标记。
(A) H&E染色评价类器官培养成功组织和失败组织的肿瘤纯度。(B)成功和失败的类器官培养组织之间差异表达基因的表达水平。(C)类器官培养成功组织和类器官培养失败组织之间ANPEP的表达水平。
03
在已建立的 BTC PDO 中对常规化疗药物进行药物筛选
他们观察到不同 BTC 患者产生的类器官对化疗药物的反应有所不同(图 3 A)。对于每种化疗药物,BTC PDO 可分为三个亚组:耐药、敏感和中间反应。根据剂量-反应曲线和相应的曲线下面积(AUC)评估,BTC PDO的药物敏感性显示出患者对单一化疗药物[包括吉西他滨、顺铂、5-氟尿嘧啶(5-FU)、奥沙利铂、SN-38(伊立替康的活性代谢物)、丝裂霉素C和紫杉醇]的应答存在显著的差异(图3B)。例如,5-FU 作为 BTC 治愈性切除后推荐的辅助剂指南,在类器官药物测试中显示出异质反应(图 3 C)。因此,BTC PDO 是药物筛选的潜在有效工具,对不同的传统化疗药物具有不同的反应。

图3. 离体BTC 类器官对化疗的临床相关反应。
(A) 热图由 47 种 BTC 类器官的化学敏感性反应组成。(B) 47 种 BTC 类器官离体对吉西他滨、顺铂、5-FU 和奥沙利铂的化学敏感性反应总结。(C) 使用类器官形成测定对化疗药物的活力的影响。
04
在 BTC PDO 中观察到的药物反应状态在 PDOX 小鼠和相应的随访患者中得到验证
为了验证 BTC PDO 的药物筛选结果,他们建立了PDO异种移植物(PDOX)小鼠模型。将 BTC 类器官 ICC47T-PDO、ICC46T-PDO或ICC62T-PDO 的任一系皮下移植到NOD-Prkdc em26Cd52 Il2rg em26Cd22 /Nju (NCG) 小鼠中。一旦肿瘤达到 50-100 mm 3,小鼠腹腔内注射化疗药物或载体,每周两次(图4A)(图4A)。根据ICC47T-PDO、ICC46T-PDO、ICC62T-PDO的体外药物检测结果,他们选择吉西他滨作为敏感药物,奥沙利铂作为耐药药物(图4B)。正如预期的那样,他们观察到吉西他滨治疗组对肿瘤生长有明显的抑制作用,而奥沙利铂治疗组对ICC47T-PDOX、ICC46T-PDOX和ICC62T-PDOX的小鼠没有反应(图4C)。与奥沙利铂组和对照组相比,吉西他滨组的肿瘤重量和肿瘤体积均明显减轻(图4D-E)。H&E染色和CK19阳性染色均证实ICC的病理诊断(图4F)。与此一致,在接受吉西他滨治疗的PDOX的肿瘤组织中,与未接受治疗的PDOX相比,细胞增殖显著降低(图4G),而细胞凋亡显著增加(图4H),而在接受奥沙利铂治疗的PDOX中,未观察到差异。
综上所述,这些结果表明在BTC PDO中鉴定的药物筛选结果在PDOX小鼠中得到了验证。

图4. 体内BTC 类器官对化疗的临床相关反应。
(A) 实验设计。(B) PDO 灵敏度曲线。(C) NCG 小鼠中 PDO 皮下异种移植物的生长曲线。(D) 用奥沙利铂、吉西他滨或载体治疗 14 天后收获的肿瘤异种移植物的代表性图像。(E)小鼠的肿瘤重量和体积。(F) 通过 H&E 和 CK19 评估小鼠异种移植物起源的组织学分析。(G)化疗治疗后评估PDO异种移植物上肿瘤增殖的组织学分析。(H)化疗治疗后评估PDO异种移植物抗肿瘤功效的组织学分析。
他们进一步通过实际临床治疗和结果验证了 BTC 患者 PDO 的药物筛选结果(图 5 A)。除了单一化疗药物外,他们还测试了PDO对不同药物联合治疗的反应,与相应的BTC患者方案相同(图5B)。一致的是,联合疗法在类器官药物测试中显示出与 BTC 患者中观察到的反应不同的反应(图 5C)。对 13 名接受化疗并在其衍生类器官中进行药物筛选的 BTC 患者进行了 4 至 26 个月的随访。将术后17.5个月内复发的患者定义为临床上对辅助治疗反应不佳的患者,7名患者术后接受了辅助治疗。在这些患者中,病例ECC1T、ICC65T和ECC27T是临床敏感反应者,这与其衍生的PDO中的药物反应一致(图5A)。患者 ECC21T 在手术后 22 个月内保持无病状态,因此是对 5-FU 的临床敏感反应者,其 PDO 对 5-FU 显示出中等反应。其余三名患者对辅助化疗耐药,其中两名患者(ECC8T 和 ICC49T)与其 PDO 中的药物反应一致(图 5 A)。
此外,六名晚期 BTC 患者接受了姑息化疗。基于实体瘤疗效评估标准(1.1 版),四名患者(ECC20T、ICC69T、ICC71T 和 ECC17T)表现出部分缓解或疾病稳定。例如,ECC20T患者的肝脏或腹膜后淋巴结转移结节明显缩小。因此,PDO药物筛选显示化疗敏感(图5D)。
总的来说, 92.3%的BTC 患者表现出与他们衍生的 PDO 一致的药物反应结果,这些结果表明 PDO 是药物筛选和预测 BTC 患者药物反应的有用工具。

图5. 药物治疗患者与其对应的癌症类器官的药物反应比较。
(A) 热图总结了 13 个 PDO 的结果和相应的患者药物反应。(B)以剂量反应曲线的形式显示了 13 个 BTC 类器官对联合化疗或 5-FU 的离体化学敏感性。(C) 使用类器官形成测定对吉西他滨加顺铂 (GemCis) 治疗的可行性的影响。(D) 患者 ECC20T 在吉西他滨加奥沙利铂治疗前和治疗后 3 个月的 CT 扫描。
05
BTC PDO 的转录特征与化疗反应相关
为了研究 PDO 的转录特征是否可以预测 BTC 患者对化疗的治疗反应,他们使用 19 个 BTC 类器官进行转录组分析(RNA-seq),并根据它们对每种药物的反应分为三个亚组:耐药、敏感和中间层。5-FU是卡培他滨的活性代谢产物,是BTC术后的一线辅助治疗药物。他们在 5-FU 敏感组和 5-FU 中间组之间确定了 1174 个差异表达基因(DEG)(图 6 A-B)。与 5-FU 中间类器官相比,在 5-FU 敏感组中发现了与肿瘤细胞凋亡和化疗敏感性相关的显著上调基因,包括PSMC3IP、FANCA、MCM2、CDT1和CDKN2C(图 6 A)。同时,一些耐药相关基因,如IGFBP1、FAM129A、TFF2和DHRS9,在5-FU中间组中显著上调(图6A)。其中,5-FU敏感组的PDO高表达凋亡调节因子TP73和CDT1,以及高表达促化疗敏感因子MCM和抗肿瘤因子AIF1L(图6B)。另一方面,在5- FU中间体组的PDO中,促耐药因子CST1和ABCB11以及促干性因子IGFBP1和TFF2的蛋白表达显著上调(图6B)。通过免疫组化(IHC)验证了这些耐药相关基因在类器官和BTC患者中的蛋白表达特征(图6C-D)。接下来,他们进行了GSEA以识别潜在的调节通路。法南尼贫血(Fanconi anemia)通路可以调节肿瘤对化疗的超敏反应,该通路在5- FU敏感组中上调(图6E)。在5- FU敏感组中,ATR通路也发生激活以响应停滞的DNA复制叉,以促进抗肿瘤活性(图6E)。
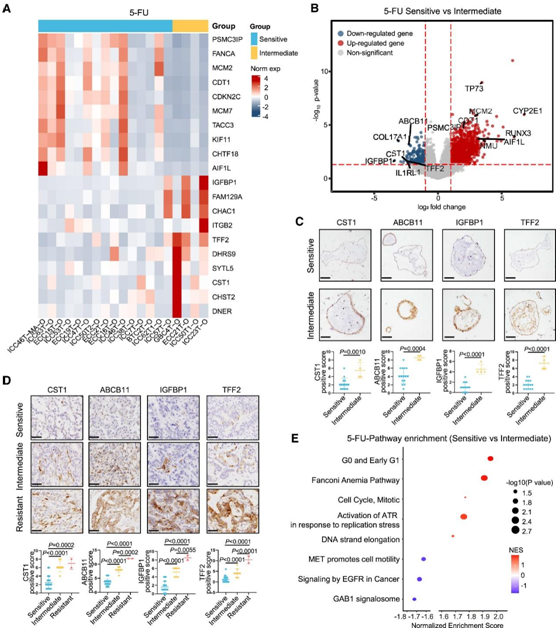
图6. 5-FU敏感组转录特征。
(A) 5-FU敏感组和5-FU中间组之间差异表达基因表达水平的热图。(B) 显示 5-FU 敏感组和 5-FU 中间组差异表达基因的火山图。(C) 衍生类器官中 5-FU 抗性标记物的 IHC 染色。(D) 整个队列的肿瘤标本中 5-FU 耐药标记物的 IHC 染色。(E) 5-FU 敏感组和 5-FU 中间组中富集的通路。
06
基于BTC类器官药物敏感性的药物反应预测模型
接下来,他们探索了肿瘤组织的基因表达生物标志物,分别区分对5-FU和顺铂敏感的PDO和不敏感的PDO(包括中间和耐药)(图7A-B)。与 5-FU 不敏感的 PDO 相比,在 5-FU 敏感的 PDO 中鉴定出包含 13 个基因的组(图7 A)。他们利用这 13 个基因构建支持向量模型 (SVM) 和朴素贝叶斯 (NB) 模型。计算受试者工作特征曲线(ROC)和AUC来评价模型质量。该基因表达生物标志物面板可以区分5- FU敏感患者和非敏感患者,SVM模型的AUC为93.9%[95%置信区间(CI): 83.9%-99.9%], NB模型的AUC为93.9% [95% CI: 86.7%-99.9%](图7C-D)。
这些结果表明,BTC 类器官的基因表达生物标志物组可以区分对 5-FU 和顺铂化疗敏感的患者与不敏感的患者。
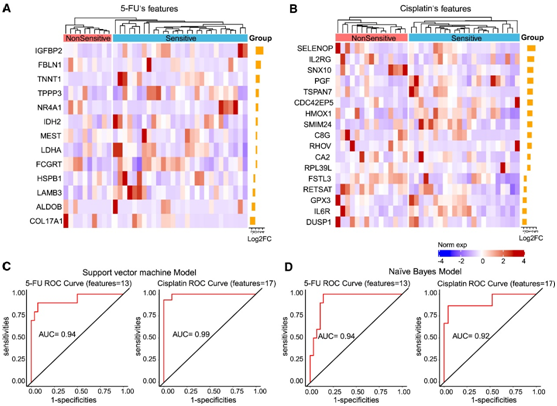
图7. 基于BTC类器官药物敏感性的预测模型。
(A-B) 热图显示从 5-FU (A) 和顺铂 (B) 敏感组和非敏感组之间的 DEG 中选择药物反应特征。(C)基于5-FU和顺铂药敏的SVM模型的ROC曲线。(D)基于5-FU和顺铂药敏的NB预测模型的ROC曲线。
+ + + + + + + + + + +
结 论
本项研究从 82 个肿瘤中生成了 61 个 BTC 患者来源的类器官 (PDO),它们表现出与相应的原发 BTC 组织相似的组织学和遗传特征。通过RNA测序鉴定,BTC肿瘤组织的干性和增殖相关基因表达增强,更容易形成类器官。正如预期的那样,BTC PDO 对吉西他滨、顺铂、5-氟尿嘧啶、奥沙利铂等化疗表现出不同的反应。PDO 中的药物筛选结果在基于 PDO 的异种移植物中得到进一步验证。此外,本项研究还确定了具有不同药物反应的 BTC PDO 的基因表达特征,并建立了基因表达组来预测 BTC 患者的化疗反应。总之,BTC PDO 是一种很有前景的用于 BTC 患者抗癌治疗的精准医疗工具。
+ + + + +



 English
English


