文献解读|Cell Rep Med(14.3):肠道菌群对组氨酸分解代谢对患有病态肥胖的 NAFLD 患者的潜在治疗意义
✦ +
+
论文ID
原名:Potential therapeutic implications of histidine catabolism by the gut microbiota in NAFLD patients with morbid obesity
译名:肠道菌群对组氨酸分解代谢对患有病态肥胖的 NAFLD 患者的潜在治疗意义
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2023.12.19
DOI号:10.1016/j.xcrm.2023.101341
背 景
肠道微生物群有助于非酒精性脂肪肝(NAFLD)的病理生理学。组氨酸是微生物群的关键能量来源,可从宿主中清除它,但它在 NAFLD 中的作用鲜为人知。
实验设计
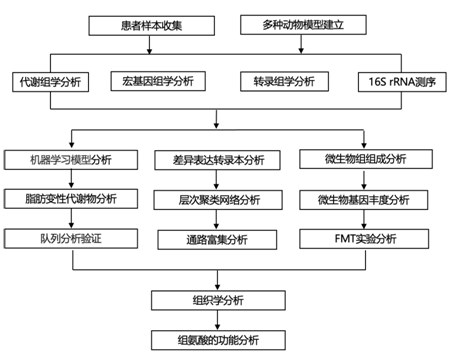
结 果
01
不同队列中的循环组氨酸水平取决于脂肪变性的程度
研究者团队分析了来自意大利和西班牙发现队列的 117 名非糖尿病肥胖患者的血浆代谢组。然后,他们应用机器学习 (ML) 变量选择策略控制年龄、BMI、性别和国家,以识别与肝脏活检评估的肝脏脂肪变性等级相关的代谢物(图 1 A)。他们还计算了所选代谢物的确切Shapley加性解释(SHAP)分数,以便用模型解释结果显示,组氨酸是预测能力最高的代谢物,与脂肪变性程度呈负相关(图1B)。其他与脂肪变性程度负相关的代谢物包括醋酸酯、甘油和三甲胺n -氧化物(TMAO),而葡萄糖则呈正相关(图1A-B)。NAFLD和糖尿病通常共存并协同作用,增加不良后果的风险。虽然发现队列中的患者是非糖尿病患者,但他们发现循环组氨酸水平与空腹血糖水平呈负相关。他们还使用超声评估肝脏脂肪变性的等级,结果显示组氨酸与超声脂肪变性分级的相关性最强(图1D)。同样,他们还发现醋酸盐与葡萄糖呈负相关而葡萄糖呈正相关(图1E)。
接下来,他们试图在肥胖患者的验证队列(BMI >30 kg/m2)[来自意大利和西班牙(验证队列1)],另一个验证队列包括仅来自西班牙的肥胖患者(验证队列2),通过超声测量肝脏脂肪变性等级。同样,在验证队列1和验证队列2中,组氨酸是与脂肪变性等级最强烈且负相关的代谢物(图1G-K)。仔细观察组氨酸水平(根据年龄、BMI、性别和国家进行调整)强调,所有队列中组氨酸水平的主要差异是在没有(<5%)和有(>5%)脂肪变性的肥胖患者之间(图1C-L)。
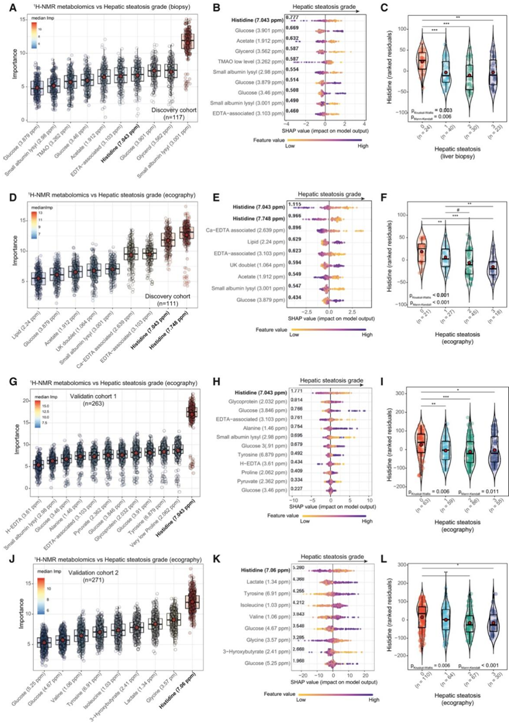
图1. 血浆代谢组与脂肪变性等级的关联。
(A,D,G,J) 在控制发现队列中的年龄、BMI、性别和国家后,与肝脏脂肪变性等级相关的代谢物的标准化置换变量重要性测量 (VIM) 的箱线图。(B, E, H, K)分别在发现(活检和超声)、验证1(超声)和验证2(超声)队列中,由Boruta算法选择的与肝脂肪变性分级相关的代谢物的SHAP汇总图。(C,F,I,L) 小提琴图,显示根据发现队列中肝活检评估的脂肪变性程度。
02
与组氨酸循环水平相关的人类肝脏基因的微阵列分析
他们接下来的目标是鉴定与血浆组氨酸水平相关的肝脏转录组特征,在发现队列中的一部分患者 (n = 88) 中拟合了稳健的线性回归模型,并使用肝转录组来识别显著基因(图2A)。痕量胺相关受体 1 (TAAR1) 是与血浆组氨酸水平最显著相关的肝脏基因转录物之一。包括与组氨酸相关的其他潜在混杂因素,例如高敏 C 反应蛋白 (hs-CRP) 和甘油三酯 (TG) 水平也不会改变结果。为了确定组氨酸对肝脏脂肪变性影响的潜在机制,他们将基因-基因相互作用网络与 93 个组氨酸相关基因转录本的通路过度表征分析相结合。在 Reactome 数据库中,最重要的聚类包括 G α (s)和嗅觉信号通路(图 2 B-C)。
其他重要的聚类涉及胰岛素生长因子(IGF)的调节;激活成纤维细胞生长因子受体(FGFR)、炎症调节通路和胰岛素信号通路,如磷脂酰肌醇3-激酶(PI3K)-AKT通路和脂肪酰基辅酶A (CoA)的生物合成通路(图 2 B-C)。
基于KEGG的分析还鉴定了脂肪酸生物合成、PI3K-AKT 信号传导、炎症和免疫调节和嗅觉转导等与循环组氨酸水平相关的相关通路(图2D)。
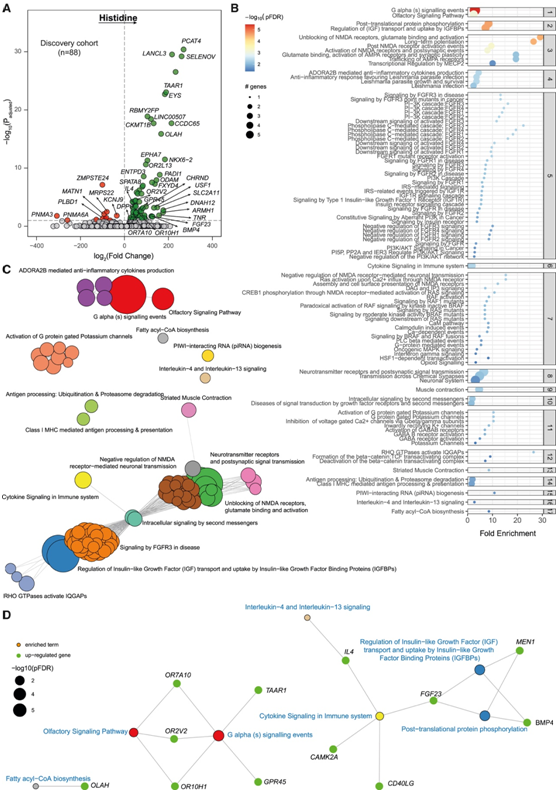
图2. 肝脏转录组基因表达与循环组氨酸水平的关联。
(A)肝脏转录组基因表达与循环组氨酸水平的关联。(B)在层次聚类分组的活性网络上进行的基于reactome的过度表征分析结果的点图。(C)富集图显示相互关联的重要路径。(D) 基因概念网络描述了参与选定聚类的富集途径的重要基因。
03
补充组氨酸可调节人原代肝细胞的NAFLD
为了阐明组氨酸在NAFLD中的作用和潜在机制,他们用组氨酸、棕榈酸(PA:一种已知会引发人类原代肝细胞肝脂肪变性的游离脂肪酸)和组氨酸处理人类原代细胞。然后,他们评估了脂肪变性和肝脏新生脂肪生成、β氧化、线粒体功能、脂肪酸运输和炎症相关基因的表达。PA诱导脂质代谢基因(ACSL1、SCD1、FASN和SREBF1)的表达(图3A),而PA和组氨酸联合处理与单独处理相比,SCD1和FASN的表达均较低,表明肝脏新生脂肪生成减少(图3A)。与单独处理PA相比,PA和组氨酸联合处理时,参与线粒体功能和脂肪酸运输的基因,如PPARa、TFAM、FABP4、FABP5、FATP5和CD36的表达增加(图3A)。此外,PA 和组氨酸联合处理促进了抗炎细胞因子IL10表达的强烈上调(图 3 A)。与人肝脏微阵列的结果一致,PA和组氨酸共同处理后TAAR1的表达显著上调(图3B)。
通路富集分析确定 PI3K-AKT 信号传导是与血浆组氨酸水平最相关的通路之一。因此,他们接下来通过监测 Akt S473磷酸化来研究胰岛素信号传导(图 3 C)。PA 处理显著降低了 Akt S473磷酸化,表明 PA 降低了对胰岛素的反应,而组氨酸处理则增加了磷酸化(图 3C)。值得注意的是,用特定的小干扰 RNA (siRNA) 敲低TAAR1表达可诱导 Akt S473磷酸化减少,与 PA 处理后观察到的情况类似(图 3 C)。
为了进一步阐明组氨酸在 NAFLD 发展中的作用,他们给喂食高果糖和高脂肪饮食的小鼠补充了 HAA(组氨酸、丝氨酸、肌肽和半胱氨酸)(图3D-E),该模型会诱发 NAFLD。组氨酸是必须从饮食中获取的必需氨基酸。此外,补充含组氨酸的二肽肌肽可能会增加组氨酸水平,而半胱氨酸是组氨酸氨裂解酶(HAL)的抑制剂,它将组氨酸分解代谢为尿苯丙酸,其水平受其前体丝氨酸调节。与对照组相比,补充HAA并没有增加血清组氨酸水平(图3F),但它增加了肝脏组氨酸水平(图3G)。补充HAA对谷丙转氨酶(ALT)水平没有影响(图3H),但改善了一些与nafld相关的特征,如天冬氨酸转氨酶(AST)水平(图3I)、AST/ALT比值(图3J)、肝脏重量(图3K)和TG水平(图3L)。与宏观(图3N)和微观改善(图3O)平行,肝总脂质水平也有所下降(图3M)。他们在组织病理学分析中也观察到改善(图3P)。这种改善从非酒精性脂肪性肝炎(NASH)诊断转化为补充HAA的动物的NAFLD诊断(图3P),同时脂滴定量减少(图3Q)。接下来,他们分析了一些参与新生脂肪生成、脂质转运和炎症的基因的肝脏表达(图3R)。他们没有发现补充HAA后参与脂质转运的基因(Fapb4和Cd36)或新生脂质生物合成的基因(Acc1除外)发生显著变化,但可降低炎症标志物(F4/80、IL10和TNFa)的表达水平(图3R)。与人体研究结果一致,HAA增加了Taar1的肝脏表达(图3S)。为了评估补充HAA对胰岛素信号传导的影响,他们进行了腹腔注射胰岛素。与NAFLD+对照小鼠相比,NAFLD+HAA小鼠在胰岛素注射后有更高pAktS473磷酸化的趋势,这表明补充HAA可以改善胰岛素敏感性(图3T)。
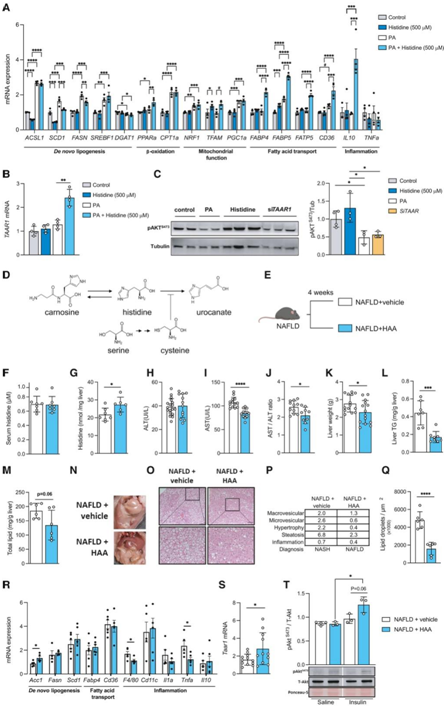
图3. 氨酸补充调节人原代肝细胞和小鼠的NAFLD 。
(A) 使用或未使用组氨酸(500 μM)和PA处理的人原代肝细胞基因的mRNA表达,这些基因涉及从头脂肪生成(ACSL1、SCD1、FASN、SREBF1和DGAT1)、β-氧化(PPARa和CPT1a)、线粒体功能(NRF1、TFAM和PGC1a)、脂肪酸转运(FABP4、FABP5、FATP5和CD36)和炎症(IL10和TNFa)。(B)组氨酸(500 μM)和PA处理或不处理的人原代肝细胞中TAAR1 mRNA的表达。(C)免疫印迹分析。(D)组氨酸代谢通路示意图。(E)动物模型示意图诱导NAFLD后,用HAA(组氨酸、丝氨酸、肌氨酸和半胱氨酸)联合处理4周。 (F-M)组氨酸氨基酸治疗对动物模型的影响。(N)具有代表性的肝脏宏观外观。(O)苏木精和伊红(H&E)染色的肝脏组织病理学分析。(P) NAFLD/NASH 评分表。(Q) 脂滴计数。(R) 与从头脂肪生成(Acc1、Fasn和Scd1)、脂质转运(Cd36和Fabp4)和炎症(F4/80、Cd11c、Il1a、Tnfa和Il10)相关的基因的肝脏 mRNA 表达。(S) Taar1的肝脏 mRNA 表达。(T)上:Akt活化(pAktS473)、Akt总蛋白水平(T-Akt)和Ponceau-S膜染色蛋白负载的代表性分析。下:pAktS473的密度和总Akt比。
04
动物模型的验证
目前尚无完善的 NAFLD 动物模型。因此,他们在另外两个 NAFLD 模型中进行了额外的实验:(1)遗传瘦素缺陷的ob/ob小鼠;(2)卵巢切除(OVX)的大鼠。在ob/ob模型中,添加HAA诱导了明显的宏观和微观改善(图4A-B)、脂滴数量相似(图4C),但脂质表面减少(图4 d)。这些特征伴有肝脏总脂质含量降低的趋势和参与从头脂肪生成的基因表达降低(图4E-F)。在OVX模型中,补充HAA的OVX大鼠的肝脏重量减少(图4G),同时显微镜特征改善(图4H),有减少脂滴的趋势(图4I),并且脂质表面和肝脏总脂质含量显著减少(图4J-K)。此外,补充HAA降低了参与脂质代谢(图4L)炎症(Il1b)的基因表达水平(图4L)。
最后,他们使用替代模型黑腹果蝇进一步证实组氨酸在改善 NAFLD 表型中的作用。与小鼠模型类似,给予果蝇高脂肪饮食(HFD)会导致类似 NAFLD 的表型,促进 TG 的积累,刺激从头脂肪生成和脂肪酸转运,并降低对胰岛素的反应。膳食补充 HFD + 8 g/L 组氨酸可显著降低果蝇中 TG 的积累(图4M)。在基因表达水平上,喂食高脂饲料并补充组氨酸的果蝇,与从头脂肪生成相关的基因,如ACC、Desat2、FASN1、SERPB和myd的表达显著降低。组氨酸补充还导致PPARa的功能同源物Eip75b的表达显著增加,而人类CPT1的同源物whd的表达显著降低。组氨酸补充还降低了参与脂滴稳定的基因的表达,并有下调果蝇胰岛素受体的趋势,从而抵消了HFD诱导的效应(图4N)。
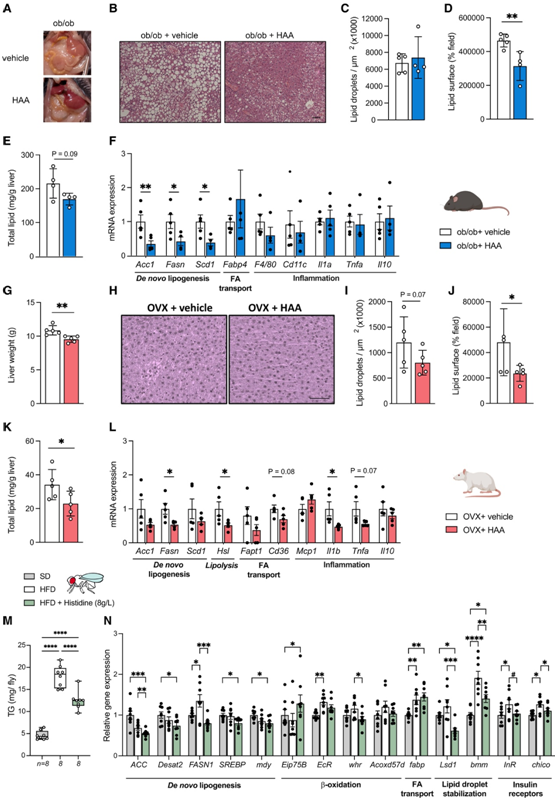
图4. 组氨酸补充减轻不同动物模型的肝脏脂肪变性。
(A) 肝脏的代表性宏观外观。(B) H&E 染色的代表性肝脏显微照片。(C) 脂滴计数。(D)脂滴表面场。(E)肝总脂质含量。(F)肝脏新生脂肪生成(Acc1、Fasn和Scd1)、脂质转运(Fabp4)和炎症(F4/80、Cd11c、Il1a、Tnfa和Il10)相关基因的mRNA表达。(G)肝脏重量。(H) H&E染色有代表性的肝脏显微照片。(I)脂滴计数。(J)脂滴表面场。(K)肝总脂质含量。(L)肝脏新生脂肪生成(Acc1、Fasn和Scd1)、脂肪分解(Hsl)、脂质转运(Fapt1和Cd36)和炎症(Mcp1、Il1b、Tnfa和Il10)相关基因的mRNA表达。(M)箱形图表示每只果蝇的TG含量。(N)肝脏新生脂肪生成(ACC、Desat2、FASN1、SREBP和mdy)、β氧化(Eip75B、EcR、whr和Acoxd57d)、脂质转运(Fabp)、脂肪酸动员(Lsd1和bmm)和胰岛素受体(InR和chico)相关基因的RT-qPCR结果。
05
循环组氨酸水平与变形菌负相关
接下来,他们通过对发现队列中患者的 73 份粪便样本进行宏基因组学分析,评估了肠道微生物群在调节血浆组氨酸水平中的潜在作用。
在科和属水平上,他们发现组氨酸水平与变形菌门成员之间存在很强的负相关性(图 5 A)。变形菌门(Proteobacteria)的16个科和属也与肝脂肪变性程度强相关(图5B)。循环组氨酸水平也与Cyanobacteria、放线菌和Marinilabiliales呈强正相关(图5A)。
组氨酸是变形杆菌中重要的碳氮源,可转化为谷氨酸。组氨酸利用(hut)操纵子涉及四个酶编码基因:hutH、hutU、hutI和hutG(图5C)。因此,他们接下来评估了这四种微生物功能与脂肪变性程度的关系。值得注意的是,与肝脂肪变性程度小于33%的患者相比,肝脏脂肪变性大于 33% 的患者具有更高的中心对数比(clr)转化微生物基因,涉及组氨酸转化为尿刊酸盐,尿刊酸盐水合为丙酸咪唑,以及咪唑环裂解得到甲亚氨基谷氨酸等过程(图5D-G)。
16S rRNA扩增子测序结果显示,补充HAA导致Cyanobacteria数量大幅增加,同时Actinobacteria 和Marinifilaceae的水平较高(图5H)。补充组氨酸还导致促进健康的细菌(如乳杆菌科和Christensenellaceae)水平增加(图5H)。在NAFLD小鼠模型中补充HAA有降低Roseburia属水平和增加Akkermansia属水平的趋势(图5J),而随着人类肝脂肪变性的发生,这一水平降低(图5B)。
值得注意的是,他们发现细菌组氨酸利用基因(hutH和hutG)的表达在NAFLD患者中升高,在NAFLD诱导小鼠中补充HAA后,与对照组相比,其表达降低(图5K)。
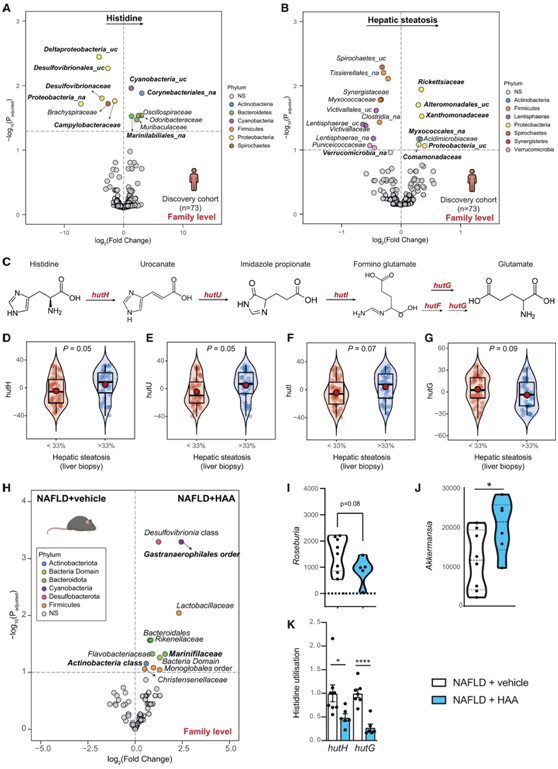
图5. 血浆组氨酸和脂肪变性程度与肠道菌群和Hut基因的关联。
(A-B) 发现队列中与循环组氨酸水平和肝脂肪变性相关的差异细菌家族的火山图。(C) 组氨酸利用通路。(D-G)脂肪变性程度低于或高于 33% 的受试者中参与组氨酸利用的中心对数比转化微生物基因(分别为hutH、hutU、hutI和hutG)的小提琴图。(D-G)脂肪变性程度低于或高于 33% 的受试者中参与组氨酸利用的中心对数比转化微生物基因(分别为hutH、hutU、hutI和hutG)的小提琴图。(I–K) Roseburia和Akkermansia的属水平以及参与组氨酸利用的微生物基因表达的 qPCR。
06
低组氨酸供体的肠道微生物群促进肝脏 TG 积累
为了深入了解微生物群通过改变组氨酸代谢在 NAFLD 进展中的潜在作用,他们进行了粪便微生物群移植 (FMT) 实验(图6A)。人类供体循环组氨酸水平与受体小鼠血浆组氨酸之间存在正相关性(图6B)。与接受来自低组氨酸供体的微生物群的小鼠相比,来自高组氨酸供体的微生物群转移还导致受体小鼠的肝脏TG较低(图6C)。
此外,他们使用 16S rRNA 基因扩增子测序来分析受体小鼠的肠道微生物群(图6D)。与接受低组氨酸供体微生物群的小鼠相比,来自高组氨酸供体的微生物群转移也导致受体小鼠肝脏TG降低(图6C)。
此外,他们使用16S rRNA基因扩增子测序来分析受体小鼠的肠道微生物群(图6D)。与在人类中的观察到的结果一致(图5A),接受低组氨酸供体微生物群的小鼠具有更高水平的Desulfovibrionaceae(图6D)。接受高组氨酸供体微生物群的小鼠具有更高水平的放线菌门(双歧杆菌)和Verrucomicrobia (Akkermansia)以及短链脂肪酸(SCFA)产生的菌(图6D)。
最后,他们还检测了多种基因表达,这些基因参与脂肪酸和胆固醇从头生物合成(Acsl1、Srebf1、Dgat1、Prkaa2和Acadsb)、 β-氧化(Ppara和Cpt1a)、线粒体功能(Nrf1、Tfam、和Pgc1a)和葡萄糖代谢(Insr和Slc2a2),发现了剂量反应效应,即供体组氨酸水平较高的受体小鼠中这些基因的肝脏表达降低(图 6 E)。
为了进一步探讨变形菌通过组氨酸分解代谢在 NAFLD 进展中的因果作用,他们使用了模型生物黑腹果蝇,以专门研究单一微生物对其宿主的影响(图 6 F)。HFD在果蝇中诱导了NAFLD样表型,其特征是TG积累增加(图6G)和较高的AST活性(图6H),与E. cloacae单相关的果蝇中TG积累显著增加(图6G)。相反,只有当喂食果蝇SD并由E. cloacae定殖时,ALT水平才会升高(图6I)。
他们观察到SREB 和myd 的趋势相同。虽然没有发现与β-氧化或胰岛素受体相关的基因(分别为InR和chico)有显著的结果,但与HFD喂养的E. cloacae定植的果蝇相比,HFD喂养的苍蝇中与脂滴稳定相关的基因(Lsd1和bmm)显著上调(图6J)。
由于SD喂养的果蝇与E. cloacae的单一关联而产生NAFLD样表型的同时,果蝇每克组织的组氨酸水平显著降低(图6K-L)。在饲喂SD的果蝇中,组氨酸剂量对TG积累没有影响,而组氨酸浓度的增加逐渐降低了E. cloacae定植果蝇的TG积累(图6M)。在HFD诱导的NAFLD表型情况下,组氨酸浓度的增加促进E. cloacae和果蝇内TG积累的逐渐减少(图6N)。
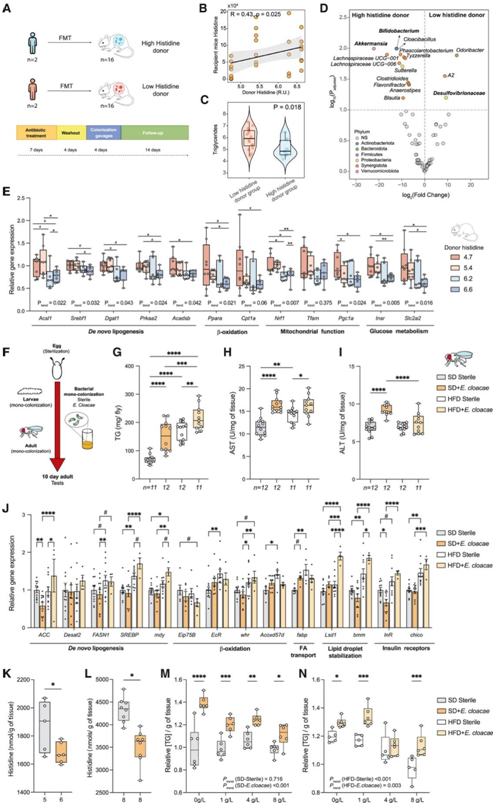
图6. 小鼠FMT和E. cloacae定植果蝇对NAFLD特征和组氨酸的影响。
(A) 血浆组氨酸水平高和低的患者对小鼠进行 FMT 的示意图。(B) 人类供体和受体小鼠血浆组氨酸水平之间的 Spearman 相关性。(C) 低组氨酸供体组和高组氨酸供体组中受体小鼠肝脏 TG 含量。(D) 使用 ANCOM-BC 识别的受体小鼠微生物群火山图,用于比较高组氨酸供体组与低组氨酸供体组之间的差异。(E)肝脏新生脂肪生成相关基因(Acsl1、Srebf1、Dgat1、Prkaa2和Acadsb)、β氧化(Ppara和Cpt1a)、线粒体功能(Nfr1、Tfam和Pgc1a)和葡萄糖代谢(Insr和Slc2a2)的相对基因表达。 (F)在无菌或单定殖条件下产生野生型果蝇的实验方案。(G)箱形图表示每只果蝇的TG含量。(H-I)箱形图表示10日龄果蝇的ALT和AST酶活性。(J) RT-qPCR结果。(K-L)箱形图表示每克组织中L-组氨酸的含量。(M-N)箱形图表示每克组织中L-组氨酸的含量。
+ + + + + + + + + + +
结 论
在三个人类队列中进行血浆代谢组学、肝脏转录组学和粪便宏基因组学以及肝细胞、啮齿动物和果蝇模型。机器学习分析发现,血浆组氨酸与脂肪变性呈强烈负相关,并与涉及胰岛素信号传导、炎症和微量胺相关受体 1 的肝脏转录组特征相关。循环组氨酸与变形菌呈负相关,与缺乏组氨酸利用的细菌呈正相关。补充组氨酸可改善不同动物模型中的 NAFLD进展并减少从头脂肪生成。来自低组氨酸供体的FMT和E. cloacae对果蝇的单定植增加了TG的积累并降低了组氨酸含量。微生物群、组氨酸分解代谢和 NAFLD 之间的相互作用开辟了治疗机会。
+ + + + +



 English
English


