文献解读|Nat Metab(20.8):脂肪细胞通过将葡萄糖转向3-磷酸甘油来重新编程癌细胞代谢,从而促进转移
✦ +
+
论文ID
原名:Adipocytes reprogram cancer cell metabolism by diverting glucose towards glycerol-3-phosphate thereby promoting metastasis
译名:脂肪细胞通过将葡萄糖转向3-磷酸甘油来重新编程癌细胞代谢,从而促进转移
期刊:Nature Metabolism
影响因子:20.8
发表时间:2023.08.31
DOI号:10.1038/s42255-023-00879-8
背 景
在上皮 OvCa 中,网膜脂肪细胞通过分泌脂肪因子来促进癌细胞的选择性趋向。在与网膜脂肪细胞相互作用后,OvCa 细胞将它们转化为“癌症相关脂肪细胞”。为了满足能量需求,OvCa 细胞促进脂肪细胞中的脂肪分解,并通过脂肪酸受体 CD36 摄取脂质,随后氧化这些细胞内脂质。然而,尚不清楚脂肪细胞与癌细胞的相互作用是否会导致脂肪细胞和癌细胞的额外代谢变化。
实验设计
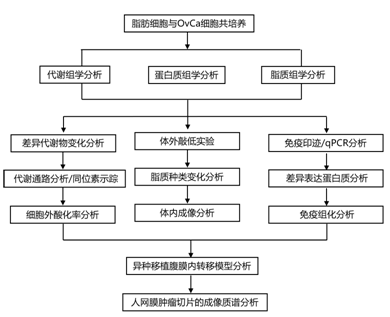
结 果
01
脂肪细胞与癌细胞相互作用的多组学分析
研究者团队采用多组学方法来系统地研究脂肪细胞和 OvCa 细胞之间的代谢相互作用,分离来自良性人网膜的脂肪细胞并与OvCa细胞共培养(图1a)。共培养(18小时)后,收集培养基,并将每种细胞类型分离成细胞沉淀。使用三种不同的代谢组学平台对细胞沉淀和培养基进行分析,以检测复杂脂质、初级碳代谢物和氧脂素(图1b)。癌细胞和脂肪细胞的共培养改变了癌细胞中的134种代谢物和脂肪细胞中的34种代谢物(图1c),证明了癌细胞利用脂肪细胞中的脂肪酸来产生能量,他们发现癌细胞中的三酰甘油(TG)积累增加(图1c)。共培养后癌细胞中最显著的变化是甘油磷脂(GPL)的增加,其中磷脂酰胆碱(PC)是变化最大的代谢物,其次是磷脂酰乙醇胺(PE)(图1c)。GPL 是重要的细胞膜成分,通过将脂肪酸结合到甘油主链上合成,其中 PC 是最丰富的磷脂。分泌组分析表明,脂肪细胞与 OvCa 细胞的共培养改变了培养基中的代谢水平。
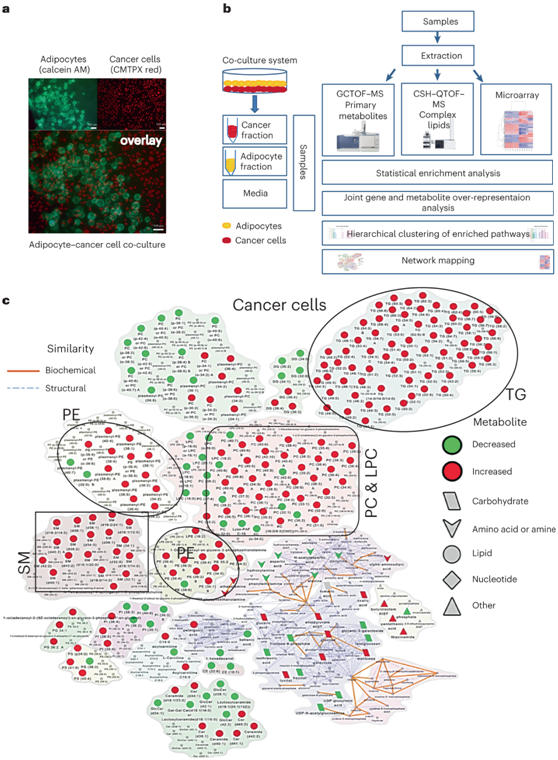
图1. 脂肪细胞增加 OvCa 细胞中的葡萄糖代谢和 GPL。
(a) 荧光 (CMTPX) 标记的 OvCa 细胞(红色)与钙黄绿素 AM 标记的原代人网膜脂肪细胞(绿色)共培养。(b) 共培养脂肪细胞和 OvCa 细胞的多组学分析示意图。(c) 网络图显示脂肪细胞共培养时 SKOV3ip1 细胞中代谢物水平的改变(红色,增加;绿色,减少)。
02
葡萄糖衍生的碳用于转移性 OvCa 中 3-磷酸甘油 (G3P)的生物合成
代谢组学数据表明,PC 丰度的增加是脂肪细胞共培养癌细胞的主要变化。整合的基因表达/代谢物分析还表明,与脂肪细胞共培养的癌细胞中糖酵解活性增加。脂肪细胞源性条件培养基 (Adi CM) 增加了两种 OvCa 细胞系的细胞外酸化率 (ECAR),显示糖酵解率显著增加(图 2a)。为了追踪脂肪 TME 中肿瘤组织中葡萄糖衍生碳的流动,他们对从三名晚期高级别浆液性 OvCa 患者获得的人网膜外植体进行了稳定同位素示踪分析。将邻近脂肪细胞的癌组织在含有[U-13C]-葡萄糖的培养基中离体培养24小时,并分析中心碳代谢物的13C富集谱(图2b)。他们发现在三羧酸循环(TCA)循环中间体中,m + 6果糖-6-磷酸和m + 3乳酸具有高标记性,而(m + 2同位素)具有低标记性。在TCA循环中间体中未检测到同位素标记,表明葡萄糖衍生碳在三羧酸循环中不存在。因此, OvCa细胞减少了葡萄糖衍生的碳进入TCA循环(图2b)。然而,肿瘤外植体在 G3P 中具有大量标记的同位素,G3P 是 TG 和 GPL 的主干(图2b)。他们观察到溶血磷酸胆碱 18:1 中的m + 3 标记升高,而其他同位素异构体(m + 4 至m + 26)中几乎没有检测到标记。
这些结果表明,在邻近脂肪细胞的癌组织中,葡萄糖部分用于 G3P 的生物合成。
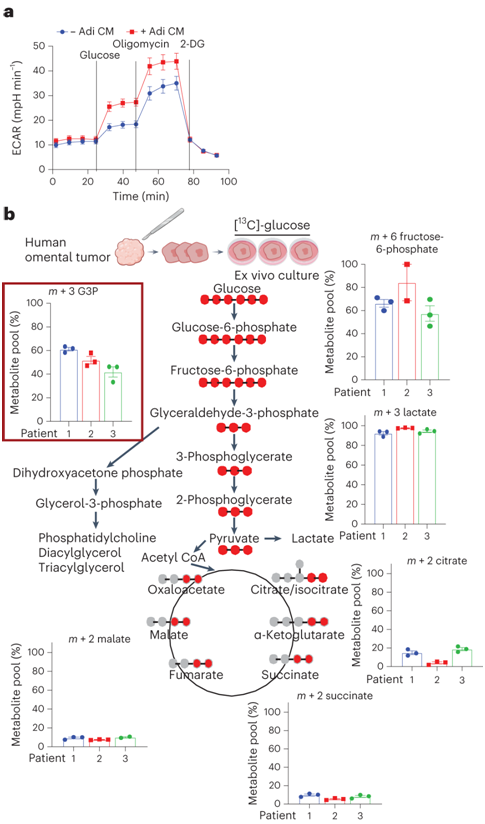
图2. 脂肪细胞增加 OvCa 细胞中的糖酵解,但不增加氧化磷酸化。
(a) SKOV3ip1细胞用Adi CM处理18小时,然后使用Seahorse XFe 96分析仪测量ECAR 。(b) [ 13C]-葡萄糖稳定同位素示踪。将新鲜的网膜肿瘤切片与[ 13C]-葡萄糖一起孵育24小时,然后通过MS检测糖酵解途径和TCA循环的[ 13C]-碳富集。
03
GPAT3 调节脂肪细胞诱导的 GPL 合成
GPAT3是GPL和TG合成上游的酶,将G3P转化为溶血磷脂酸(图3a)。与体外脂肪细胞-癌细胞共培养对 GPAT3 的调节一致,他们发现 GPAT3 蛋白在来自高级别浆液性 OvCa 的人网膜转移瘤中表达,在OvCa细胞中检测到较高的GPAT3表达(图3b),并且在基质和脂肪细胞中检测到较低的表达。
他们使用液相色谱(LC)-质谱(MS)进行脂质组学分析,与脂肪细胞共培养的OvCa细胞中的GPAT3敲低导致GPL和TG减少,表明脂肪细胞促进GPAT3依赖性GPL合成(图3c)。GPAT3的缺失减少了体内网膜转移肿瘤的负担(图3d),表明癌细胞中的GPL合成是有效的网膜转移所必需的。
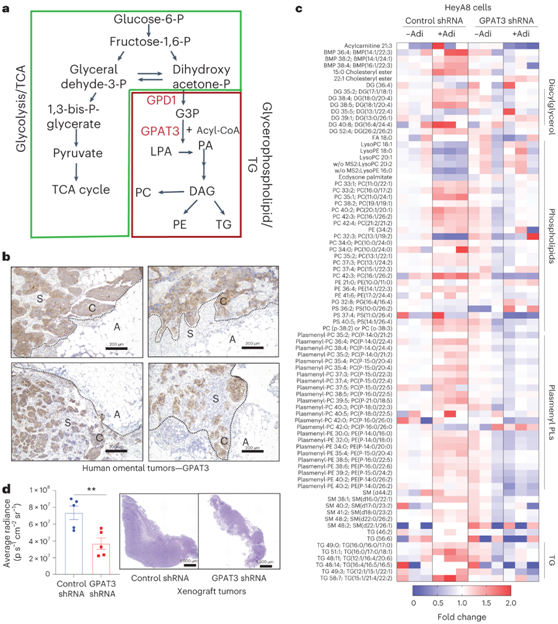
图3. GPAT3 调节 GPL 合成。
(a) 示意图:GPAT3 催化 GPL 和 TG 合成的初始步骤。 (b) 高级别浆液性OvCa转移性网膜肿瘤患者连续切片中的GPAT3表达。(c) 对照和GPAT3 shRNA OvCa细胞与网膜脂肪细胞共培养18小时的脂质组学分析。(d) 左:将具有稳定对照或 GPAT3 敲低的 HeyA8-荧光素酶 OvCa 细胞腹腔注射到裸鼠中,随后使用 IVIS 光谱体内成像系统进行成像。右:整个网膜肿瘤的 H&E 染色切片。
04
脂肪细胞诱导的 HIF1α 将葡萄糖衍生的碳引导至 GPL 合成
在常氧条件下,脂肪细胞共培养增加了多种 OvCa 细胞系中的 HIF1α 蛋白表达(图4a)。HIF1α 在有氧的情况下会发生脯氨酰羟化和蛋白酶体降解,这解释了为什么 HIF1α 蛋白在常氧条件下含量较低。为了确定脂肪细胞是否有助于稳定 HIF1α 蛋白,他们使用了替代荧光素酶报告质粒,其中荧光素酶表达/活性由 HIF1α 的氧依赖性降解结构域 (ODD)调节。。ODD-荧光素酶质粒的稳定转染,随后进行Adi CM处理,增加了荧光素酶活性,表明脂肪细胞稳定了HIF1α(图4b)。
蛋白质组学分析表明,HIF1α 敲低改变了 OvCa 细胞脂肪细胞诱导的蛋白质组成分,减少了 82 种蛋白质,增加了 22 种蛋白质。HIF1α敲低降低了HK2和乳酸/丙酮酸转运蛋白SLC16A3(也称为MCT4)的蛋白表达(图4c)。与蛋白质组数据一致,脂肪细胞共培养诱导OvCa细胞中HK2 mRNA和蛋白质水平,依赖于HIF1α表达(图4d)。
他们还发现网膜转移患者邻近脂肪细胞的上皮肿瘤区室中 HIF1α 和 HK2 表达增加(图4e)。通过脂肪细胞共培养,HIF1α敲低减少了糖酵解中间体(图4f)并增加了TCA循环代谢物(图4g),这表明脂肪细胞诱导“假性缺氧”。
HIF1α 敲低阻断了大多数脂肪细胞诱导的三酰甘油、P和醚连接的 P,以及其他膜脂,如鞘磷脂和神经酰胺(图S6)。因此,脂肪细胞诱导的 HIF1α 驱动的转录程序调节癌细胞中 GPL 和 TG 合成的葡萄糖利用。
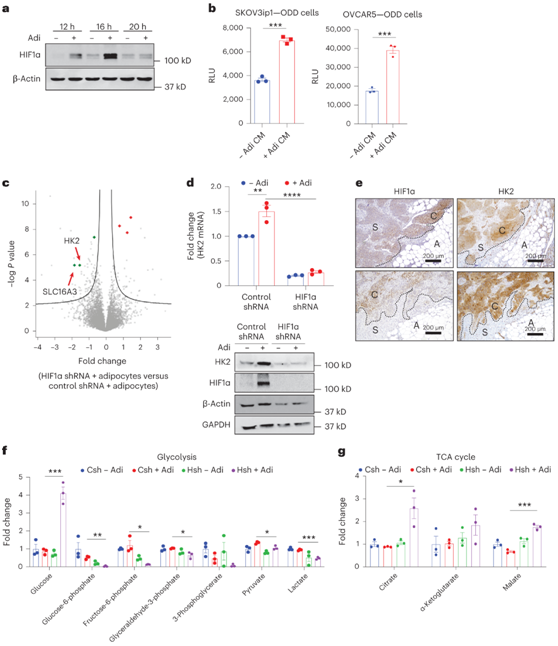
图4. 脂肪细胞介导的 HIF1α 表达调节癌细胞中的葡萄糖利用。
(a) 与原代人脂肪细胞(Adi)共培养指定时间的 SKOV3ip1 细胞中 HIF1α 的免疫印迹。(b) 荧光素酶活性检测。(c) 火山图显示受脂肪细胞诱导的 HIF1α 表达调节的蛋白质。(d) 脂肪细胞共培养 16 小时后 SKOV3ip1 HIF1α 敲低细胞中 HIF1α 和 HK2 的 qPCR(上)和免疫印迹(下)。(e) 使用来自高级别浆液性 OvCa 患者的人网膜肿瘤的连续切片对 HIF1α 和 HK2 进行免疫组织化学分析。(f-g) 代谢组学分析,条形图显示糖酵解途径和 TCA 循环代谢物的差异倍数。
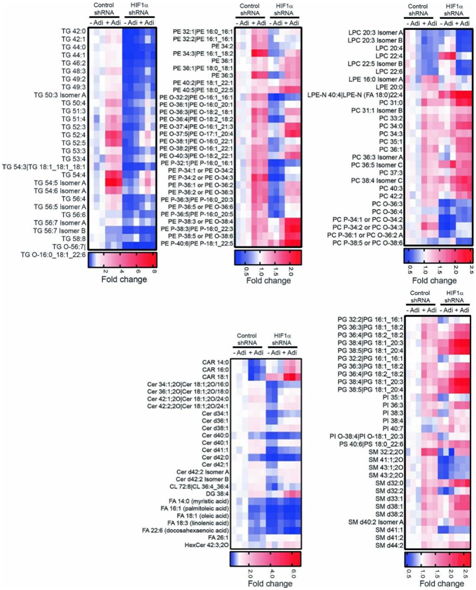
图S6. 脂肪细胞诱导的 HIF1α 改变卵巢癌细胞的脂质组。
05
HIF1α表达减少抑制网膜转移
他们使用异种移植小鼠模型来确定 HIF1α 失调对 OvCa 转移的影响,腹腔注射稳定的 HIF1α 敲低 OvCa 细胞的小鼠的网膜转移灶要小得多(图5a)。HIF1α敲低的肿瘤细胞凋亡水平没有变化,增殖也没有任何差异(图5b)。使用4-羟基壬烯醛(4-HNE)加合物作为脂质过氧化的读数,他们发现HIF1α敲低肿瘤中的染色强度增加(图5b)。与体内数据一致,与脂肪细胞共培养的HIF1α敲低细胞癌细胞显示出显著更高含量的丙二醛(MDA),这是脂质(多不饱和脂肪酸)过氧化的标志物(图5c)。他们在使用 Adi CM 的对照短发夹 RNA (shRNA) 细胞中观察到脂质活性氧 (ROS) 水平增加,并且HIF1α 的敲低加剧了该水平(图 5d)。GPX4 是负责去除膜脂质过氧化物的主要酶,在Adi CM存在的情况下,HIF1α敲低细胞对GPX4的抑制敏感(图5e)。此外,铁他汀(一种铁死亡抑制剂)而非 zVAD-FMK(一种泛半胱天冬酶抑制剂)可逆转细胞活力,表明 HIF1α 敲低细胞会经历铁死亡(图5e)。
为了评估 HIF1α 敲低对体内葡萄糖利用的影响,他们给荷瘤小鼠(对照/ HIF1α shRNA组)注入 [U-13C]-葡萄糖。HIF1α敲低减少了葡萄糖进入糖酵解(乳酸m + 3和3-磷酸甘油酸m + 3)的通量,并显著减少了 G3P的m + 3标记(图5f-g)。这些结果证明体内 HIF1α 将葡萄糖转向 G3P 合成。
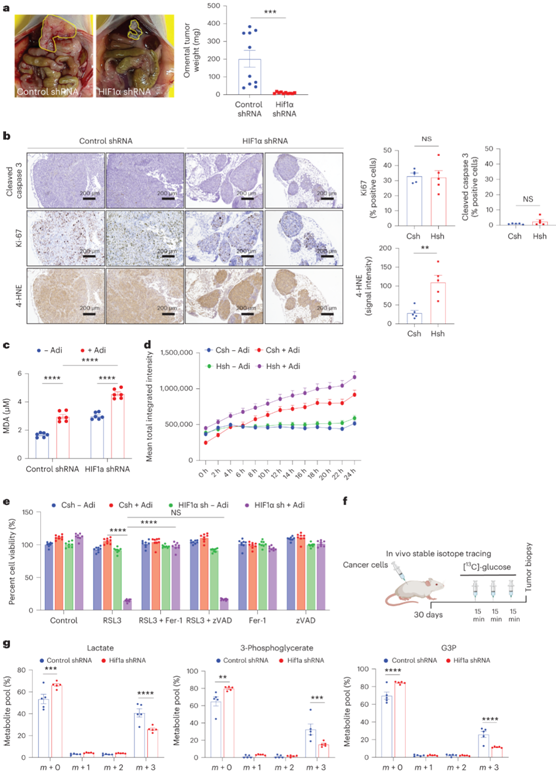
图5. HIF1a 表达的减少抑制网膜转移。
(a) 左:腹膜内注射 SKOV3ip1 HIF1α shRNA 细胞,肿瘤负荷显示为左侧为 sh control,右侧为 shHIF1α。右:肿瘤负荷测量为网膜转移重量。 (b) 连续切片中的裂解半胱天冬酶3、Ki-67和4-HNE染色。 (c) 脂质过氧化:对照细胞和HIF1α敲低细胞与脂肪细胞共培养18小时,并测定细胞内MDA水平。(d-e) 量化脂质 ROS 的产生,并进行MTT测定以确定用所示小分子化合物处理后癌细胞的活力。(f) HIF1α 敲低癌细胞的荷瘤小鼠中的稳定同位素示踪。(g) [13C]-葡萄糖衍生的G3P和糖酵解中间体的标记。
06
人网膜转移瘤中 GPL 的空间分布
为了临床验证脂肪细胞对 GPL 合成的影响,他们对人网膜肿瘤切片进行了成像质谱 (IMS) 分析。使用基质辅助激光解吸/电离(MALDI)对代谢物(离子范围在150和2000 m/z之间)进行成像分析(图6a),并将脂肪细胞附近癌细胞的代谢物与更远的癌细胞进行比较(图6b-c)。分析显示,靠近脂肪细胞的癌细胞pc丰度更高,而距离较远的癌细胞则有更多的磷脂酰肌醇(PI)(图6d-e),这证实了癌细胞附近的脂肪细胞增加了肿瘤细胞中的PC。
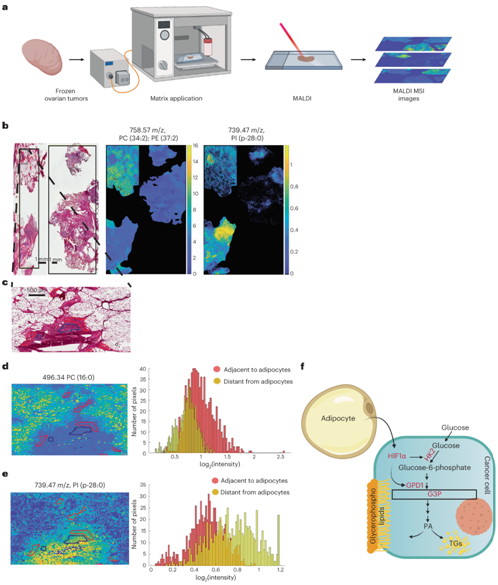
图6. 与脂肪细胞相邻的癌细胞 PC 增加。
(a) 卵巢高级浆液性肿瘤样本的 IMS 分析示意图。(b-e) 冰冻大网膜肿瘤切片的组织学和 MALDI IMS 分析。(f) 脂肪细胞-OvCa 细胞相互作用导致 OvCa 细胞中葡萄糖利用率改变的图示。
+ + + + + + + + + + +
结 论
本项研究使用多平台代谢组学、成像质谱、同位素示踪和基因表达分析系统地表征了原代人类脂肪细胞和卵巢癌(OvCa)细胞之间的双向相互作用。在与脂肪细胞共培养的 OvCa 细胞和转移性肿瘤中,糖酵解产生的部分葡萄糖用于生物合成 3-磷酸甘油 (G3P)。常氧 HIF1α 蛋白调节癌细胞中葡萄糖衍生碳的流动改变,导致甘油磷脂和三酰甘油合成增加。HIF1α 或 G3P 酰基转移酶 3(甘油磷脂合成的调节酶)的敲低可减少 OvCa 异种移植模型中的转移。这些研究证明,在富含脂肪的肿瘤微环境中,癌细胞产生 G3P 作为关键膜和信号成分的前体,从而促进转移。针对富含脂肪的肿瘤微环境的生物合成过程可能是对抗转移的有效策略。
+ + + + +



 English
English


