文献解读|Sci Transl Med(19.31):饮食诱导的肥胖通过损害真皮层脂肪组织中脂肪祖细胞的天然抗菌防御功能促进感染
✦ +
+
论文ID
原名:Diet-induced obesity promotes infection by impairment of the innate antimicrobial defense function of dermal adipocyte progenitors
译名:饮食诱导的肥胖通过损害真皮层脂肪组织中脂肪祖细胞的天然抗菌防御功能促进感染
影响因子:19.31
发表期刊:Science Translational Medicine
发表时间:2021.1
DOI号:10.1126/scitranslmed.abb5280
背 景
肥胖可以通过驱动全身炎症来促进心血管疾病、癌症和延迟皮肤伤口愈合,同时肥胖也是导致皮肤感染细菌的重要风险因素。对抗感染的一个关键机制是通过生产抗菌肽(antimicrobial peptides,AMPs)消灭细菌。皮肤感染后,一部分真皮成纤维细胞(dermal fibroblasts, dFBs)会被诱导分化为脂肪细胞,从而扩大真皮白色脂肪组织(dermal white adipose tissue,dWAT),与此同时dFBs激活分化为脂肪细胞的过程是AMPs的一个重要来源。dWAT位于真皮层的最深处,是皮肤组织抵抗感染的最后一道防御屏障,通过dFBs分化为脂肪细胞进而产生AMPs的这一过程,是皮肤抵御金黄色葡萄球菌感染的重要机制。除了防御感染外,dWAT还有其他几个重要的非代谢功能,如参与毛发循环、伤口修复、皮肤纤维化等。但目前,肥胖导致皮肤抵御微生物能力受损的背后机制尚不清楚,此外,肥胖是否以及如何改变皮肤脂肪组织的功能?肥胖对皮肤脂肪细胞与脂肪细胞祖细胞(adipocyte progenitor,AP)群体的影响?以上问题同样亟待解决。更好地了解肥胖对皮下脂肪组织的影响将有助于我们深入了解肥胖人群中皮肤易感率的增加和其他与肥胖相关的皮肤并发症,如伤口愈合缺陷和脱发的背后原因。
实验设计

结 果
01

饮食诱导的肥胖增加了皮肤对金黄色葡萄球菌的易感性并抑制了皮下脂肪细胞的脂肪生成
首先作者想探究的是:肥胖是如何影响皮肤抵抗细菌感染能力这一科学问题。为了研究这一问题,作者将金黄色葡萄球菌分别注射到高脂饲喂的肥胖小鼠和正常饲喂的小鼠背部皮下,以诱导皮肤感染模型。结果发现,与正常小鼠相比,肥胖小鼠感染后皮肤表面病变区域面积显著增加(图1A-B),并且肥胖小鼠皮肤感染部位细菌更多(图1C)。作者为了研究这一表型背后的机制,利用流式细胞术分析两组小鼠皮肤感染部位的细胞组成发现,CD11B+ly6G+双阳性的中心粒细胞在两组小鼠中没有差异(图1D),而以THY1+SCa1+为标志的PDGFRA+dFBs细胞数量则在肥胖小鼠中显著减少(图1E、F)。除此之外,其他早期成脂的标志,如脂肪前体细胞的分化标志pC/EBPβ和Ⅳ型胶原含量的表达(图1G),以及抗菌肽含量(图1H)、前体脂肪细胞(preadipocytes ,pADs)的标志Pdgfra和Sca1的表达在肥胖小鼠的dWAT中显著降低。与此同时,肥胖也导致小鼠皮肤中促纤维化标志基因SPP1的表达显著增加(图1I)。总之,这些结果表明肥胖导致小鼠的真皮中pADs数量的降低,并抑制了pADs的脂肪生成和表达抗菌肽的能力。
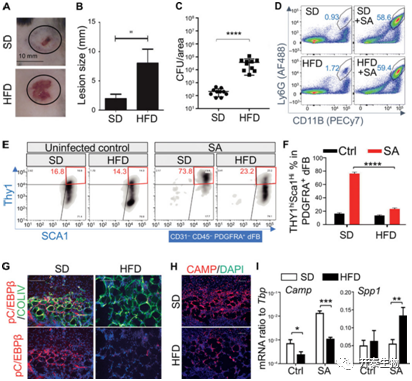
图1
02

单细胞转录组测序表明肥胖小鼠皮下脂肪细胞祖细胞的激活过程存在缺陷
为进一步探究肥胖如何影响皮下组织的免疫应答过程,对肥胖小鼠和正常小鼠皮下注射金黄色葡萄球菌后的整块皮肤组织进行单细胞测序(图2 A)发现,与前期流式结果一致的是Ptprc/Cd45+Cd11b+S100a8+的中性粒细胞数量在两组中没有差异,而Pdgfra+的dFBs在肥胖小鼠中显著减少(图2 B)。随后作者将该群细胞细分(图2 C-D),并进一步分析了这10个亚群细胞在两组之间的差异。结果发现,前八个主要的细胞亚群(即C1-C8,图2C)占到所有dFBs细胞的97%左右。进一步分析发现,在正常小鼠组织中,三个网状间质(reticular interstitial, RI)细胞亚群的细胞数量(C2、C5和C6)在感染后显著减少,而reticular pAD (即C1)亚群细胞的数量则在感染后有略微的上升。与正常小鼠相反的是,肥胖小鼠中几乎所有的dFBs亚群细胞,包括reticular pAD亚群,在感染后数量都显著下降(图2 E-F)。随后作者锚定到了reticular pAD这群细胞开展进一步研究发现。金黄色葡萄球菌感染会促进正常小鼠reticular pAD一系列促进成脂基因的表达,例如pAD markers Pdgfra and Thy1、adipocyte markers Mest and Plin2等,与此同时,其抗菌肽基因的表达也会显著增加。但肥胖小鼠感染金黄色葡萄球菌后的reticular pAD中以上这些基因的表达均未出现显著变化。反而是一些促进纤维化的基因如Tgfb1, Mmp3等表达被显著促进(图2 G)。随后,为了进一步深究小鼠reticular pAD亚群细胞在肥胖和正常情况下为何抗菌肽的分泌/表达会出现差别,作者将reticular pAD(即C1)亚群更进一步细分为了六个亚群,即sC1-sC6(图2 H),并发现只有sC4亚群抗菌肽的表达在两组中存在差异(图2 I),且这一亚群的特征在于:正常条件下,其成脂标志基因以及先天免疫相关基因相较于其他五个亚群高表达(图2 I)。以上结果说明感染后肥胖小鼠皮下脂肪细胞祖细胞的激活过程和成脂分化过程存在缺陷,且易朝着纤维化的方向发展。
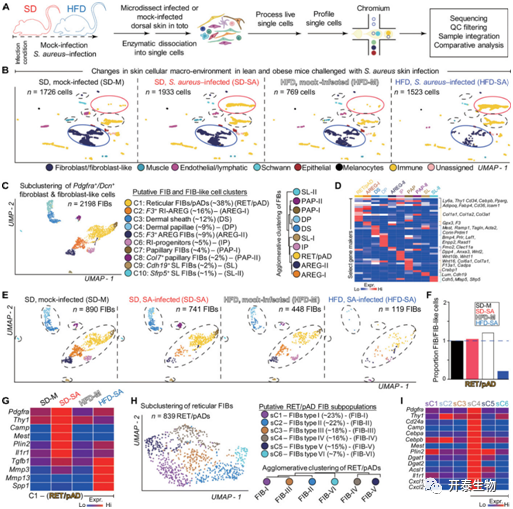
图2
03

对肥胖小鼠真皮层脂肪细胞的谱系追踪
随后,作者进一步想探究的问题是:肥胖的过程以及肥胖后如何能影响dFBs的成脂分化轨迹?为了研究该问题,作者构建了带有mTmG报告基因的Adipoq-CreER小鼠(图3 C)。该小鼠在他莫昔芬(tamoxifen,TAM)诱导下,可以帮助区分细胞的分化轨迹并有助于观察脂肪细胞的增生和肥大。作者在小鼠高脂饲喂的不同阶段使用TAM进行诱导发现,在高脂饲喂第一周后进诱导,超过95%的脂肪细胞被标记为红色(图 3D),说明此时绝大多数细胞为未成熟的脂肪前体细胞(因为只有成熟脂肪细胞才能表达adipoq,从而能够在TAM诱导下启动,使得细胞被标记为绿色),而在高脂饲喂六个月后再诱导,只有不超过20%的脂肪细胞被标记上红色。以上结果表明小鼠肥胖过程的早期会诱发小鼠真皮层脂肪组织中脂肪细胞的增生分化从而导致真皮层皮下脂肪前体祖细胞数量的减少,随后脂肪细胞的肥大过程替代了增生过程,成为皮下脂肪组织扩张的主要原因。

图3
04

成熟的脂肪细胞失去了其抗菌潜能
紧接着作者想知道的是,在小鼠皮下脂肪组织扩张的过程中,脂肪细胞是如何一步步失去分泌抗菌肽的能力,进而导致皮下脂肪组织不能正常行使免疫抗菌功能。为了研究这一问题,作者将小鼠皮下脂肪细胞祖细胞诱导为成熟脂肪细胞模型的周期划分为四个阶段(图3 E)。在第一阶段(subconfluent,s.c.)的细胞表现出纺锤体形态,并高表达Acta2、Ctgf等纤维化相关基因。而这些促纤维化基因的表达在第二阶段(postconfluent,p.c.)的细胞中则有所下调,且p.c.的细胞开始表现出一些pADs的典型特征(图3 E-F)。在p.c脂肪细胞接触抑制,启动成脂诱导后的第一天,其细胞外基质和先天免疫相关基因的表达出现短暂的增加。随后随着脂肪细胞的逐步分化,成熟脂肪细胞标志基因高表达的同时抗菌肽表达逐渐降低(图 3F)。一致的是,测序结果同样表明,脂肪细胞分化早期分泌抗菌肽相对较多,而成熟脂肪细胞则分泌较少(图 3G)。并且脂肪细胞抗菌肽基因的表达水平与脂肪细胞的抗菌能力直接相关(图 3H、I)。总的来说,体内和体外的结果表明脂肪前体细胞具有较强的先天免疫抗菌功能,而随着脂肪细胞的分化和进一步成熟,其免疫防御能力则会逐渐降低。
05

成熟脂肪细胞抑制dFBs的成脂分化
那么成熟脂肪细胞是否会反过来抑制dFBs的成脂分化呢?作者随后将dFB和成熟脂肪细胞进行共培养(图 4A)发现,共培养后dFBs的成脂分化能力显著下降(图 4B),且抗菌肽表达显著减少(图 4C-D)。随后,为了探究其背后的潜在机制,作者对共培养后dFBs的转录组分析发现,在所富集得到的前五个通路中,有四个和TGF-β有关(图 4E-F)。结合其他相关实验结果(图 4G-I)作者锚定到了TGFβ这一生长因子上进行后续的进一步机制研究。
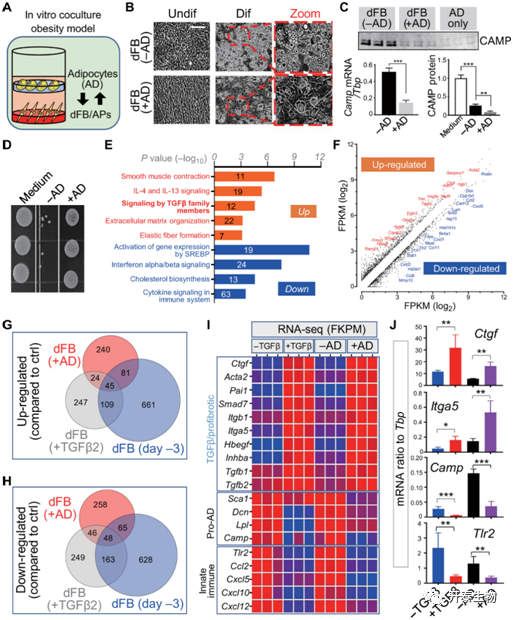
图4
06

成熟的脂肪细胞通过TGF-TGFBR-SMAD2/3通路抑制dFBs的先天免疫功能
为了研究TGFβ的功能,作者首先检测了脂肪细胞成脂分化期间自身TGFβ1和TGFβ2的表达(图 5A),结果发现与pAD相比,成熟脂肪细胞TGFβ1和TGFβ2的分泌量均显著升高,并且,将成熟脂肪细胞与dFBs共培养后,dFBs中SMAD2/3入核迅速增加,且核内磷酸化的SMAD2/3也显著增加(图 5B)(SMAD是TGF-β的关键细胞内效应因子)。为了进一步验证TGFβ在脂肪细胞脂肪生成过程中的作用,作者利用SB431542这一TGFBR的抑制剂加入共培养体系,结果发现SB431542显著挽救了成熟脂肪细胞对dFBs成脂分化的抑制效果(图 5C-D),并抑制了成熟脂肪细胞促进dFBs成纤维分化的过程(图 5E-F)。这一结果与体内观察到的实验结果是相一致的。(图 5H-K)
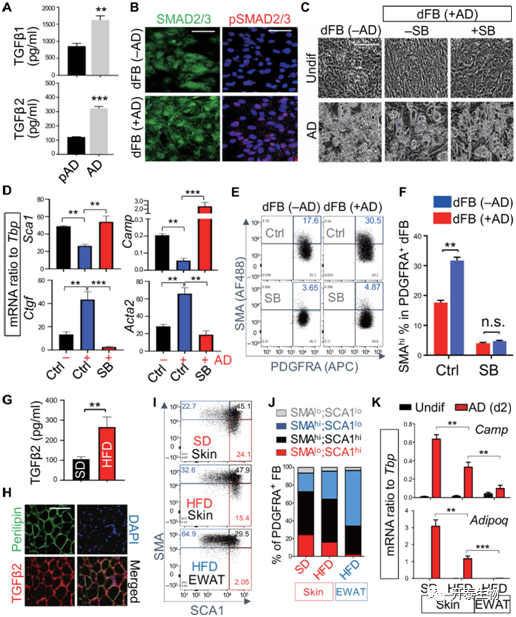
图5
07

罗格列酮或抑制TGF信号通路增加了小鼠对金黄色葡萄球菌感染的抵抗力
由于前人研究发现PPAR激动剂罗格列酮可以抑制肺成纤维细胞中的TGFβ介导的纤维化,随后,为了进一步佐证TGFβ在抑制dFBs成脂分化的同时对先天免疫功能存在影响,作者利用罗格列酮和TGFβ的抑制剂分别进行了体内和体外实验回补验证,结果发现用罗格列酮和TGFβ抑制剂治疗感染的肥胖小鼠后,皮肤脂肪组织中的脂肪形成以及脂肪细胞的成纤维化现象均得到改善(图6A-I)。最后,作者还在dFBs中特异性的敲除了TGFβ基因,并进行了高脂饲喂,结果发现高脂饲喂下,敲除该基因也显著恢复了小鼠抵抗感染的能力(图6 J-M)。
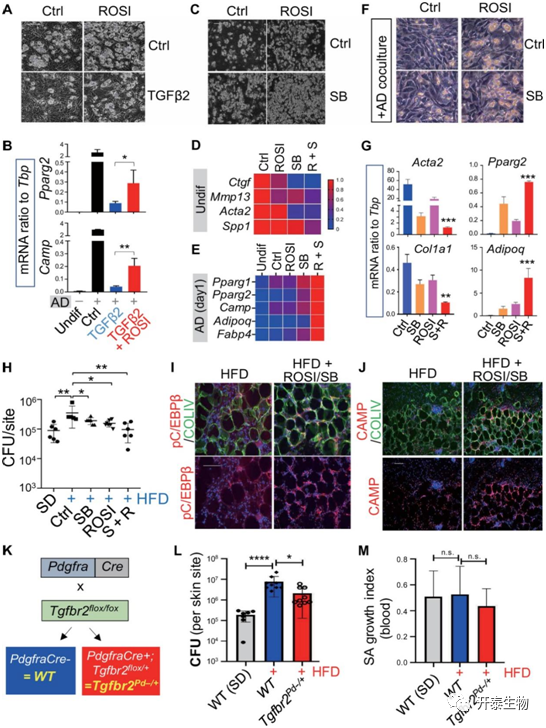
图6
+ + + + + + + + + + +
结 论
肥胖后脂肪细胞的过度堆积会导致皮肤抗菌免疫力低下,这一现象的原因是肥胖过程中成熟脂肪细胞分泌了过多的生长因子TGFβ,进而反过来抑制脂肪干细胞分化及表达抗菌肽的能力,使肥胖小鼠容易受到细菌的感染。采用药理学的手段如PPARγ激动剂罗格列酮或TGFβ受体抑制剂可恢复肥胖小鼠皮肤防御细菌感染的能力。
+ + + + +



 English
English

