文献解读|Dev Cell(11.8):母体和胚胎信号导致管腔上皮细胞的功能分化和容受性能力的建立
✦ +
+
论文ID
原名:Maternal and embryonic signals cause functional differentiation of luminal epithelial cells
and receptivity establishment
译名:母体和胚胎信号导致管腔上皮细胞的功能分化和容受性能力的建立
期刊:Development Cell
影响因子:11.8
发表时间:2023.08.22
DOI号:10.1016/j.devcel.2023.08.004
背 景
在哺乳动物中,胚胎的成功着床需要接受子宫内膜和激活囊胚之间的精确相互作用。尽管不同物种之间的胚胎着床相关事件的细节各不相同,但雌激素和孕激素在控制早期怀孕中所起的核心作用对许多哺乳动物来说是共同的。由于胚胎和子宫内膜的细胞复杂性和动态变化,时间和细胞特异性的动态变化是如何受到母体和胚胎发育信号依次调节的,这在很大程度上是未知的。
实验设计
结 果
01
子宫内膜上皮细胞在胚胎着床过程中表现出显著的转录组变化
为了研究胚胎着床过程中所有子宫细胞类型的动态变化,研究中团队比较了小鼠子宫在交配后(DPC) 4天(4.0 DPC)(胚胎着床时)和假怀孕(DPP) 4天 (4.0 DPP)(无胚胎刺激)时的单细胞转录组 (scRNA-seq) 特征(图1A)。基于已知标记物,他们在4.0 DPC的子宫内鉴定出13个聚类(图1B-C),可分为六种细胞: (1)上皮细胞,(2)基质细胞,(3)平滑肌细胞,(4)内皮细胞,(5)间皮细胞,(6)免疫细胞。此外,与假怀孕的子宫相比,怀孕的子宫中有更多的增殖基质细胞和更少的B细胞(图1D)。此外,通过转录组进行的细胞活性比较表明,上皮细胞,包括管状上皮细胞和腺上皮细胞,在差异表达基因 (DEG) 中表现出最显著的变化(图1E)。GO分析显示,与4.0 DPP相比,4.0 DPC的腺腔上皮细胞、内皮细胞、平滑肌细胞以及部分免疫细胞的蛋白质翻译和加工发生了动态变化,这可能与胚胎着床的影响有关(图1F)。值得注意的是,管腔上皮首先与子宫内的胚胎接触。因此,他们重点关注了腔上皮转录组在怀孕和假怀孕组之间的差异。结果表明,与胚胎粘附相关的一些突起在怀孕组的管腔上皮中表达上调(图1F)。这些发现表明,尽管上皮细胞群的大小没有显著变化,但子宫内膜上皮,特别是官腔上皮,在胚胎存在时经历了动态的转录组变化(图1D)。
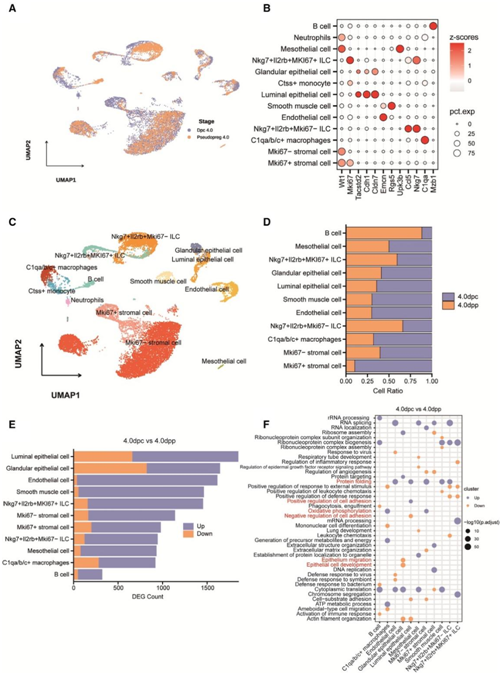
图1. 子宫内膜上皮细胞在胚胎着床过程中表现出显著的转录组变化。
(A) 4.0 DPC和4.0 DPP时小鼠子宫scRNA-seq数据的均匀流形近似和投影(UMAP)投影。(B)点图显示标记基因在4.0 DPC和4.0 DPP下log2-转化的表达,以鉴定小鼠子宫细胞类型。(C) UMAP显示4.0 DPC和4.0 DPP时小鼠子宫的细胞类型。(D)条形图显示4.0 DPC和4.0 DPP时小鼠子宫中细胞的相对比例。(E)条形图显示4.0 DPC和4.0 DPP时小鼠子宫细胞群中差异表达基因的计数。(F) GO分析。
02
胚胎着床期小鼠整个子宫的单细胞检测
为了研究母体和胎儿作用于子宫的信号,他们在每个指定的时间阶段(2.5、3.5、4.0和4.5 DPC)准备了两只怀孕小鼠作为怀孕组。他们收集了每只孕鼠一半的双角子宫,将其混合,并进行scRNA-seq。为了区分母体和胚胎信号的影响,他们还收集了相应时间点(2.5、3.5、4.0和4.5 DPP)的假孕小鼠的子宫进行scRNA-seq,获得了71682个细胞用于下游分析,并根据不同细胞类型的已知标记的表达将细胞分为11个聚类(图2B-D)。他们比较了怀孕和假怀孕小鼠在不同时间点的不同细胞群的细胞比例,发现多种细胞类型的细胞比例有显著差异(图2E)。例如,随着怀孕的进展,怀孕的子宫内B细胞的比例从2.5下降到4.5,这与免疫耐受的建立一致,而假怀孕的子宫内B细胞的比例则增加。有趣的是,基质细胞的比例在孕鼠子宫中逐渐增加,而在假怀孕小鼠子宫中下降,这表明这些细胞可能与蜕膜化有关。此外,在每个时间点,计算怀孕组和假怀孕组之间子宫中所有优势细胞类型(管腔上皮细胞、Mki67(-)基质细胞、Mki67(+)基质细胞和腺上皮细胞的DEG计数,管腔上皮和腺上皮表现出最显著的变化(图2F)。为了区分管腔上皮细胞和腺上皮细胞,他们鉴定了Tacstd2作为管腔上皮细胞的特异性标记物、Prss29作为腺上皮细胞的特异性标记物,并分别通过免疫组织化学和原位杂交(ISH)验证了它们的特异性(图2G)。
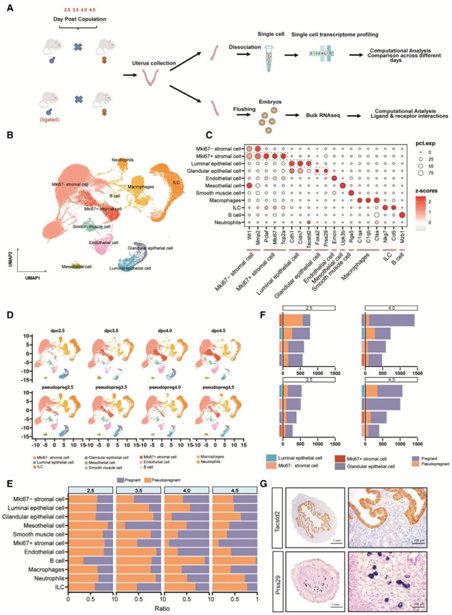
图2. 小鼠怀孕期和假怀孕期子宫单细胞谱分析。
(A)从怀孕或假怀孕小鼠获得scRNA-seq和大量RNA-seq数据的实验设计概述。(B)怀孕和假怀孕小鼠子宫scRNA-seq数据的UMAP预测。(C)点图显示标记基因的log2转化表达,用于识别小鼠子宫内的细胞类型。(D)每只小鼠输尿管细胞的UMAP。(E)条形图显示每个时间点怀孕和假怀孕小鼠细胞的相对比例。(F)柱状图显示怀孕和假怀孕小鼠在每个时间点的DEG计数。(G)小鼠子宫内表达的TACSTD2的免疫组织化学和Prss29的原位杂交。
03
腔内上皮细胞在着床期功能分化为粘附上皮细胞(AEC)和支持上皮细胞(SEC)
为了进一步了解管腔上皮细胞的动态变化,他们用Tacstd2分离管腔上皮细胞并进行伪时间分析。分析结果显示,管腔上皮细胞从伪时间开始时的“根(root)”细胞分化为两个分支亚型“branch1”和“branch2”(图3A)。2.5 DPC时以根细胞为主,branch 1和branch2细胞出现,说明管腔上皮细胞的分化始于2.5 DPC。根细胞在3.5 DPC几乎完全消失,并分化成两个分支。怀孕子宫和假怀孕子宫中管腔上皮细胞的三种亚型的Pearson相关系数显示了转录组特征的显著相似性(图3B),这表明管腔上皮细胞的分化是由母体信号而非胚胎来源的信号驱动。原位杂交结果证实根细胞在2.5 DPC时开始分化,在3.5 DPC时完全转化。branch1和branch2细胞出现在2.5 ~ 4.5 DPC(图3C)。有趣的是,在branch2中,Il17rb(branch2的特异性标记)在4.5 DPP处表达,而在4.5 DPC处不表达(图3C),这提示胚胎对管腔上皮细胞的影响。
利用京都基因和基因组百科全书 (KEGG)对六个基因集的分析表明,branch1细胞高表达与“PI3K-Akt信号通路”、“局部粘附”和“NT信号通路”相关的基因,而branch2细胞高表达与“氧化磷酸化”、“丙酮酸代谢”和“甾体生物合成” 相关的基因。根细胞表达与“细胞周期”相关的基因(图3D)。这些结果通过对所有三种上皮细胞的基因集变异分析(GSVA)得到证实,其中branch1和branch2显示出不同的KEGG通路评分模式。几个关键标记的伪时间相关基因表达分析表明,branch1细胞表达较高水平的细胞间粘附相关基因(Itgb6, Jam3和Vcam1)和细胞外基质粘附相关基因(Fn1),而branch2细胞表达较高水平的代谢活性相关基因(Cox17和Ndufa6)和铁死亡相关基因(Acs14和Alox15)(图3E)。
根据以上分析和后续的实验证实,branch1细胞是由胚胎直接粘附的,因此,他们称之为粘附性上皮细胞(AEC)。此外,branch2细胞表现出表明代谢支持的基因表达模式,因此,他们将其命名为支持上皮细胞(SEC)。
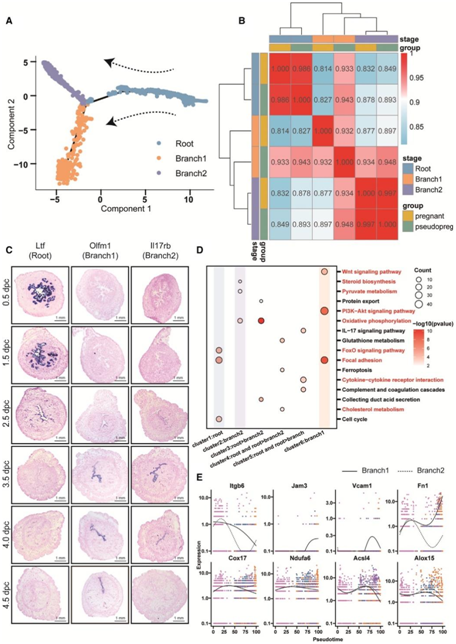
图3. 管腔上皮细胞在容受性建立过程中的功能分化。
(A)怀孕小鼠子宫内膜腔上皮细胞发育伪时间分析。(B)热图显示怀孕和假怀孕小鼠三种类型子宫内膜上皮细胞转录组的Pearson相关系数。(C) 0.5-4.5 DPC时小鼠子宫腔根(Ltf)、分支1 (Olfm1)和分支2 (Il17rb)的原位杂交标记。(D)不同伪时间差异表达基因聚类的KEGG富集结果点图。(E)按伪时间顺序排列的branch1和branch2之间关键基因的表达水平。
04
母体雌激素和孕激素信号对腔上皮细胞的功能分化至关重要
为了进一步阐明诱导腔上皮细胞功能分化的母体信号,他们构建去卵巢小鼠模型,通过注射雌激素和孕激素模拟交配状态下的内分泌状态(图4A)。他们发现腔上皮细胞的出现依赖于雌激素的刺激(图4A)。雌激素处理后2天可发现“根”,但此时其他类型细胞未出现“根”(图4A)。注射雌激素和黄体酮后,“根”完全消失,子宫内膜腔面出现AEC和SEC(图4A)。为了进一步证实E2和P4对根管上皮细胞分化的影响,他们从2.5 DPC的小鼠中分离“根”管腔上皮细胞,并让它们自组织生成类子宫内膜器官。E2 和P4处理组Ltf的表达降低,Olfm1和Il17rb的表达升高,与体内情况相似(图4B)。这些结果表明,AEC和SEC的功能分化依赖于孕酮的刺激。因此,母体雌激素和促孕素的顺序刺激对于着床期管腔上皮细胞的功能分化至关重要。根管腔上皮细胞表达Esr1,它编码雌激素受体(图4D),并由雌激素激活(图4A)。因此,他们称之为雌激素反应性上皮细胞(EEC)。
为了确定黄体酮对腔上皮细胞功能分化的影响,他们使用单细胞调节网络推断和聚类(SCENIC)算法构建了三种类型上皮细胞的转录因子 (TF) 网络或“规则”。基于伪时间顺序,他们发现不同上皮细胞的顺序调控子激活遵循不同的模式(图4C)。值得注意的是,调控因子如Elf3和Klf5在EEC中发生激活,随后在分化过程中失活,而Etv6和Myc持续激活直到分化完成(图4C)。在AEC中,Twist1和Wt1等调控因子受到激活,它们都与上皮-间质转化(EMT)有关(图4C)。在SEC中,首先激活Klf4(图4C),然后激活Gata2(图4C)。Klf4可提高氧化磷酸化水平,提示Klf4可能是提高SEC代谢率的重要TF。然后,他们发现所有三种类型的上皮细胞都表达Pgr[一种编码黄体酮受体(PR)的基因](图4D)。
为了进一步揭示孕酮影响上皮分化的机制,他们将SCENIC的结果与来自GEO:GSE34927数据集的染色质免疫沉淀测序(ChIP-seq)的结果整合在一起。GEO:GSE34927数据集基于P4或对照处理的小鼠子宫进行了全基因组PR相互作用位点分析。他们发现EEC中有13个TF, AEC中有5个TF, SEC中有8个TF与PR结合(图4E)。然后,他们用所有三种上皮细胞类型的TF构建了一个调控网络,发现EEC的关键TF Fosl2、AEC的关键TF Ebf1和SEC的关键TF Fos可能对所有三种上皮细胞的功能都很重要(图4F)。
KEGG富集分析证实这些TF的靶基因功能与AEC和SEC功能一致:Fosl2的下游基因参与黏着斑、紧密连接和ECM-受体相互作用;Ebf1的靶基因参与磷脂酰肌醇3-激酶(PI3K)- Akt信号通路、ECM-受体相互作用、黏着斑等通路,Fos与丝裂原活化蛋白激酶(MAPK)、WNT、转化生长因子b (TGF-b)等信号通路相关(图4G)。这些结果表明,黄体酮能激活管腔上皮细胞中的TF,通过PR引导EEC分化。
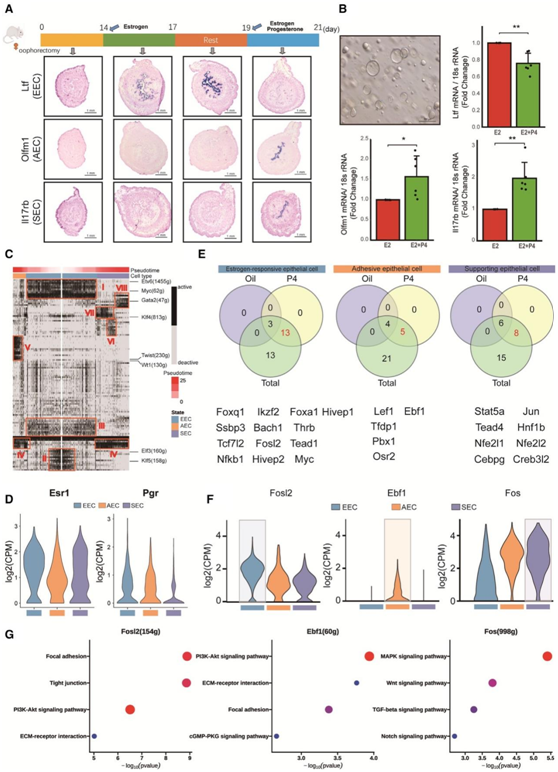
图4. 输卵管上皮细胞的功能分化是由母体信号诱导的。
(A)激素模型小鼠子宫标本采集模型图及小鼠子宫内雌激素反应性上皮细胞(Ltf)、粘附性上皮细胞(Olfm1)和支持性上皮细胞(Il17rb)的原位杂交标记。(B)根管腔上皮细胞在扩增培养基中的类器官图像,以及对雌激素反应性上皮细胞(Ltf)、粘附性上皮细胞(Olfm1)和支持性上皮细胞(Il17rb)的标记物的实时qPCR分析。(C)根据SCENIC分析显示管腔上皮细胞中调控子活性的热图。(D)小提琴图显示三种类型管腔上皮细胞中Esr1和Pgr的log2-转化表达。(E)维恩图显示了对照处理和P4处理的小鼠子宫中的TF与从SCENIC分析中得到的调控之间的关系。(F)小提琴图显示三种类型管腔上皮细胞中关键TF的log2-转化表达。(G)点阵图显示关键TF调控的靶基因KEGG富集结果。
05
胚胎源性PDGF信号调节AEC活性并介导着床过程中胚胎与子宫内膜的相互作用
接下来,他们比较了AEC在3.5、4.0和4.5 DPC的转录组谱和它们的假怀孕对应的转录组谱,发现当胚胎开始着床时,与在3.5或4.5 DPC的数量相比,在4.0 DPC的数量显著增加(图5A)。
为了将胚胎来源的信号与母体信号分离,他们去除了在假怀孕小鼠中表达的受体和表达与怀孕小鼠没有差异的受体。剩下的配体-受体对,他们称之为胚胎-AEC LR,是从胚胎分泌出来的,并与AEC结合。使用这种策略,他们确定了31条LR途径(图5B),其中WNT、EGF和SPP1信号通路可介导胚胎-子宫内膜相互作用,而EPHB、PDGF和PROS信号通路此前尚未报道。
为了研究胚胎来源的信号对AEC的影响,他们考虑了在每个时间点的怀孕和假怀孕小鼠之间的差异表达基因作为潜在的胚胎配体靶向基因。然后,他们使用nichenetR包预测胚胎到AEC的LR和胚胎配体靶向基因之间的调控关系。他们从31对LR配对中鉴定出16个配体,包括WNT7B和WNT4,它们在TE中表达,并且之前已经报道过,以及PDGFA,它也在TE中表达,但之前没有研究过(图5C)。此外,GO富集分析显示,胚胎配体靶向基因主要参与上皮细胞重塑,包括分支上皮细胞的形态发生和上皮细胞的迁移和粘附,以及ECM组织和细胞粘附的正向调节,这表明胚胎来源的信号调节胚胎和AEC之间的粘附(图5D)。
接下来,他们在子宫一侧注射PDGFR拮抗剂imatinib,在子宫另一侧注射生理盐水作为对照,然后他们将胚胎移植到老鼠体内。他们发现在4.5 DPC时,imatinib处理的子宫一侧胚胎着床位点数量显著减少,这表明PDGF通路在胚胎着床中起着至关重要的作用(图5E)。苏木精-伊红(H&E)染色结果表明,胚胎发育不受PDGF抑制的影响(图5G),但胚胎着床受到抑制。基于4.5 DPC的另一个AEC标志物Nudt19,他们发现4.5 DPC的AEC仅位于着床部位(图5H)。此外,他们发现imatinib处理组的产仔数低于生理盐水组18.5 DPC,但这两组之间的幼崽重量没有显著差异(图5I)。
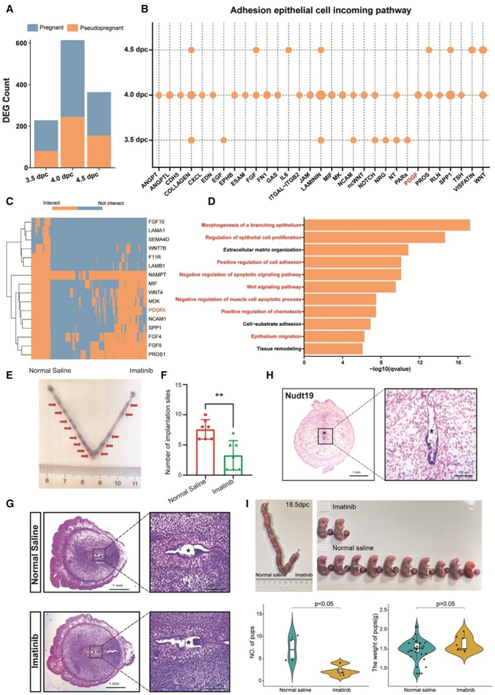
图5. 胚胎源性信号调节AEC活性和着床。
(A)柱状图显示怀孕和假怀孕小鼠AEC中DEG的数量。(B)点状图显示胚胎来源的信号在通路水平上与AEC相互作用。(C)热图显示胚胎源性信号靶向的怀孕和假怀孕小鼠子宫间AEC的DEG。(D)GO分析。(E)在4.5 DPC用生理盐水或PDGF抑制剂imatinib处理的代表性子宫。(F) 4.5 DPC生理盐水或PDGF抑制剂imatinib处理的胚胎着床位点数。(G)苏木精-伊红(HE)染色。(H) 4.5 DPC小鼠子宫内粘附上皮细胞(Nudt19)的原位杂交标记。(I) 小提琴图。
06
胚胎来源的Efna/EPHA信号调节SEC活性并影响初级蜕区形成
接下来,他们比较了3.5至4.5 DPC的SEC与假怀孕的SEC的转录组谱。分析显示,在4.0和4.5 DPC的DEG数量显著增加,这与胚胎着床期和随后的阶段相对应(图6A)。使用相同的策略,他们鉴定了15对LR对,它们的配体在4.0和4.5 DPC下由胚胎表达,其受体在SEC表达(图6B)。其中,WNT、EPHB、SPP1、VISFATIN、COLLAGEN和LAMNIN受体也在AEC中发现,而BMP、成纤维细胞生长因子(FGF)和EPHA受体是SEC特异性的。然后,他们鉴定了E4.0胚胎产生的6个配体和E4.5胚胎产生的9个配体,并使用nichenetR算法预测了配体与SEC中胚胎相关DEG之间的相互作用(图6C)。值得注意的是,配体包括Lamc2和Lamb1,以及Efna3和Efna4,它们在TE中表达,但之前没有报道。GO富集分析显示,这些基因在4.0和4.5 DPC均参与蛋白磷酸化、凋亡信号通路调节和分解代谢过程的正向调节(图6D)。
为了验证,他们将Epha1(Efna3和Efna4的受体)的小干扰RNA (siRNA)混合物注射到子宫一侧以降低其表达,并在2.5 DPC时在另一侧注射对照(NC) siRNA。然后,将相同数量的胚胎移植到两侧。他们发现,在4.5 DPC时,Epha1 siRNA处理的子宫中胚胎着床位点的数量显著减少,这表明Epha1通路在胚胎着床中起着关键作用(图6E-F)。HE染色结果显示,Epha1基因敲除后,胚胎发育不受影响,但PDZ的面积减少,脱个体化相关基因Prl8a2和Foxo1均显著降低(图6G-H)。结果表明,胚胎与SEC之间的相互作用与PDZ的形成有关,进而影响胚胎着床。
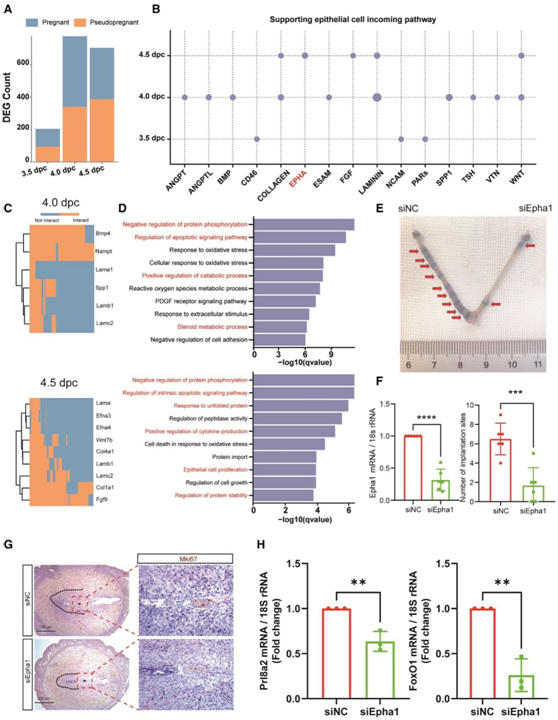
图6. 胚胎源性信号调节SEC活性和着床。
(A)柱状图显示怀孕和假怀孕小鼠之间的SEC中DEG的数量。(B)点状图显示胚胎来源的信号在通路水平上与SEC相互作用。(C)热图显示胚胎源性信号在4.0和4.5 DPC时靶向的怀孕和假怀孕小鼠子宫间SEC的DEG。(D)GO 分析。(E)在4.5 DPC上用NC siRNA或Epha1 siRNA混合物处理的代表性子宫。(F)实时荧光定量PCR检测siNC组和siEpha1组Epha1 mRNA表达水平以及4.5 DPC的 NC siRNA和Epha1 siRNA混合处理的胚胎着床位点数量。(G)在4.5 DPC用NC siRNA或Epha1 siRNA混合物处理着床部位的HE染色。(H) 实时 qPCR检测NC siRNA和Epha1 siRNA混合物处理小鼠子宫中Prl8a2和Foxo1 mRNA表达水平。
07
在人和小鼠中,管腔上皮细胞的分化和胎儿与母体之间的交流都是保守的
人子宫内膜包括四组上皮细胞:腺上皮细胞、非纤毛腔上皮细胞、纤毛腔上皮细胞和SOX9阳性腔上皮细胞。他们发现人类SOX9阳性上皮细胞与小鼠EEC相似,而人类纤毛上皮细胞与小鼠AEC相似,人类非纤毛上皮细胞与小鼠SEC相似(图7A)。
通过分析人类和小鼠胚胎和子宫之间的保守通讯,他们发现涉及10条通路的16个保守LR的纤毛管腔上皮细胞的信号传导,以及涉及8条通路的11个保守LR的无纤毛管腔上皮细胞的信号转导(图7C)。
为了探讨着床期上皮细胞分化的临床意义,他们选择了薄内膜和反复着床失败(RIF)两种子宫内膜疾病。他们使用Scissor算法将单细胞数据与大量序列数据集整合,以预测子宫内膜中病理相关的细胞群改变。在单细胞数据集中确定了1120个Scissor (-)细胞和580个Scissor(+)细胞(图7D)。Scissor (+) 细胞由与薄型子宫内膜相关的细胞群组成,Scissor (-)细胞由与正常子宫内膜相关的细胞群组成,其他细胞为背景细胞,与这一表型无关。
他们发现Scissor (+)和Scissor (-)细胞在基质细胞群中大量分布,这与子宫内膜增生期基质细胞的增殖和广泛分布一致。有趣的是,上皮细胞是第二丰富的细胞类型,Scissor (+)和Scissor (-)细胞分布在sox9阳性的上皮细胞群中(图7D)。比较Scissor(+)和Scissor (-) SOX9阳性上皮细胞的转录组,证实在Scissor (+) SOX9阳性上皮细胞中,与WNT信号通路负调控相关的过程发生上调,而与NOTCH信号通路正调控相关的过程发生下调(图7F)。
对于RIF,他们对三名患者进行了scRNA-seq。根据它们的标记表达,得到了7大类细胞:(1)腺上皮细胞(PAEP),(2)纤毛上皮细胞(PIFO),(3)非纤毛腔细胞(PTGS1和PAX2),(4)基质细胞(胰岛素生长因子1[IGF1]),(5)内皮细胞(CD34),(6)淋巴样细胞(PTPRC),(7)肌成纤维细胞(ACTA2)(图7E)。
他们还获得了154个与RIF相关的Scissor (+)细胞和336个与对照相关的Scissor (-)细胞(图7E)。有趣的是,他们发现Scissor(+)细胞分布在管腔非纤毛上皮细胞群中(图7E)。与Scissor (-)细胞相比,与代谢相关的通路,如酰基辅酶A (CoA)生物合成过程,固醇生物合成过程和脂肪酸β -氧化,在Scissor(+)细胞中上调;而细胞对铜离子的反应,细胞杀伤的正向调节和I型干扰素信号通路在Scissor(+)细胞中下调(图7G)。
这些研究结果表明,子宫内膜分化和功能受损可能导致子宫内膜薄和RIF。
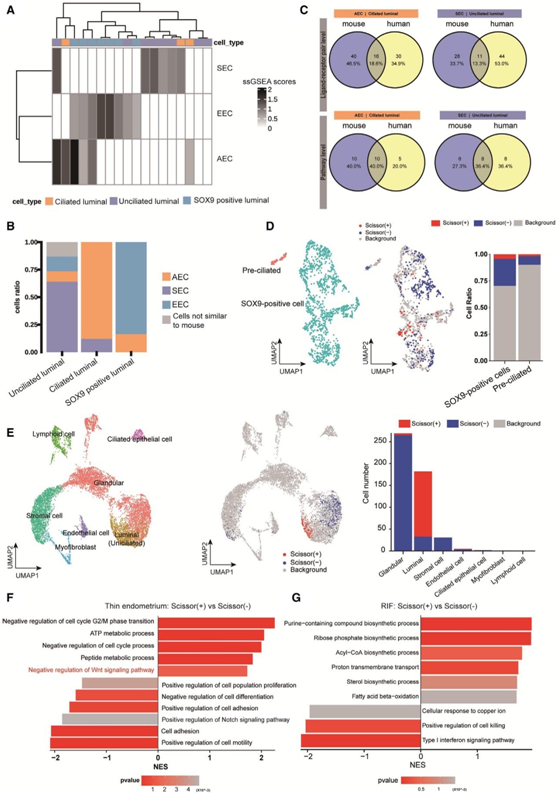
图7. 管腔上皮细胞分化和胎儿与母体之间的交流在人类和小鼠之间是保守的。
(A)热图显示三种小鼠管腔上皮细胞标记基因在人管腔上皮细胞中计算的单样本基因集富集分析(ssGSEA)评分。(B)条形图显示基于三种小鼠管腔上皮细胞预测的人类管腔上皮细胞的细胞比例。(C) 维恩图显示了小鼠和人类在配体受体水平和通路水平上的胚胎来源信号保守。(D) UMAP显示薄型和对照型子宫内膜上皮细胞类型(左)。条形图显示了人类子宫内膜中不同细胞类型的Scissor(+)和Scissor(-)细胞的分布(右)。(E) UMAP显示RIF患者子宫内膜的细胞类型(左)。条形图显示RIF患者子宫内膜中Scissor(+)和Scissor(-)细胞的分布(右)。(F)条形图显示薄型子宫内膜患者SOX9阳性细胞中Scissor(+)和Scissor(-)细胞之间的差异表达基因的ssGSEA评分。(G)条形图显示RIF患者管腔上皮细胞中Scissor(+)和Scissor (-)细胞之间的DEG富集的GSEA评分。
+ + + + + + + + + + +
结 论
本项研究通过对性交后 2.5 至 4.5 天的小鼠子宫进行scRNA-seq,并对 3.5 和 4.0 DPC 怀孕小鼠的相应胚胎进行bulk RNA-seq,发现EEC在功能上分化为黄体酮促进AEC和SEC。与母体信号一起,胚胎Pdgfa和Efna3/4信号分别激活 AEC 和 SEC,增强胚胎与子宫内膜的附着并促进胚胎发育,这种分化过程在人类和小鼠之间很大程度上是保守的。值得注意的是,SOX9阳性的人子宫内膜上皮细胞(类似于小鼠EEC)的发育缺陷与薄子宫内膜有关,而类似SEC的无纤毛上皮细胞的功能缺陷与RIF有关。本项研究结果提供了对母体和胚胎信号传导指导的子宫内膜腔上皮细胞发育的见解,这对于子宫内膜容受性至关重要。
+ + + + +



 English
English


