文献解读|Cancer Cell(48.8):单细胞的电生理与基因组整合图谱揭示人类胶质瘤中的放电肿瘤细胞
✦ +
+
论文ID
原名:Integrated electrophysiological and genomic profiles of single cells reveal spiking tumor cells in human glioma
译名:单细胞的电生理与基因组整合图谱揭示人类胶质瘤中的放电肿瘤细胞
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.08.24
DOI号:10.1016/j.ccell.2024.08.009
背 景
神经胶质瘤是最常见的中枢神经系统肿瘤,这些弥漫性神经胶质瘤包括异柠檬酸脱氢酶 (IDH) 突变型 (IDH mut) 和 IDH 野生型 (IDH WT) 亚型,每种亚型都具有独特的临床和组织病理学相关性。IDH WT肿瘤的预后结果较差,平均生存期不到 14 个月。相比之下,IDH mut肿瘤的预后明显更好,诊断后的平均生存期为 31-65 个月。虽然 IDH WT肿瘤通常是由肿瘤抑制因子或致癌基因的驱动突变引起的,IDH mut肿瘤均以IDH1或IDH2突变为特征。新兴研究证明了 GABA 能信号具有促肿瘤作用,但人类脑内肿瘤细胞的电生理学特征仍然不清楚。
实验设计
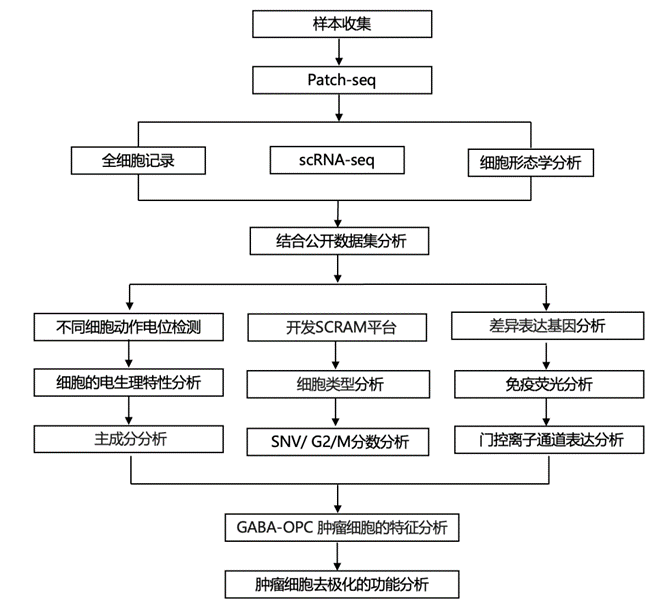
结 果
01
混合细胞发射单一动作电位,与神经元和神经胶质细胞不同
为了确定恶性胶质瘤中肿瘤细胞的电生理特性,研究团队对 10 名患者手术切除的脑切片进行了全细胞膜片钳记录,随后进行了Patch 测序(Patch-seq)[整合了全细胞记录、形态学分析和单细胞转录组分析(scRNA-seq)],这些样本包括 7 个 IDH mut胶质瘤、2 个 IDH WT胶质瘤和 1 个非肿瘤样本(图1A)。基于最大短暂的动作电位 (AP)发射速率、AP振幅、输入电阻和形态,在 157 个细胞中,108 个显示出与哺乳动物大脑中已建立的神经细胞类型一致的电生理和形态学特征,并且可以大致分为锥体细胞 (PC)、抑制性神经元 (IN) 或非脉冲细胞 (NS) (图1B-D)。需要注意的是,他们使用 NS 的电生理注释来一般描述电惰性细胞,其中可能还包括未成熟的神经元和神经前体细胞 (NPC)。有趣的是,四个 IDH mut神经胶质瘤和一个非肿瘤样本中的 49 个细胞显示出选择性的神经元电生理特性,但在形态上与成熟的神经元细胞类型不一致,通常类似于神经胶质细胞或 NPC(图1E-G)。他们将这些细胞指定为杂交细胞 (HC),从电生理学角度来看,它们代表了 36% 的 IDHmut细胞和 30% 的非肿瘤斑块细胞(图 1H),具有比神经元或神经干细胞更高的输入电阻,并且能够均匀地发射单个、较小的 AP(图 1I–1K)。他们将 AP 定义为最小 dv/dt 为 20V/S、最小峰高为 2 mV、最小绝对峰值水平为 −20 mV、最大间隔为 10 mS 和阈值分数为 0.05。相比之下,从两个 IDHWT肿瘤中记录的 20 个细胞中没有一个表现出 HC 特征。
为了研究 Patch-seq 细胞的分子谱,他们首先进行了主成分分析 (PCA),发现所有 HC 都聚集在一起,并且与 NS 聚集在一起(图 1L)。值得注意的是,一组十个 PC(以下称为 ΔPC)来自一个复发性 IDHmut患者,它们嵌入在这个 PCA 聚类中也具有异常高的输入电阻,就像 HC 一样,并且最大 AP 发射率低于其他有记录的 PC(图 1L)。这些初步研究表明,真正的神经胶质瘤细胞在神经生理学上是多样化的,并且可以呈现惰性、单峰或兴奋性电生理学特征。
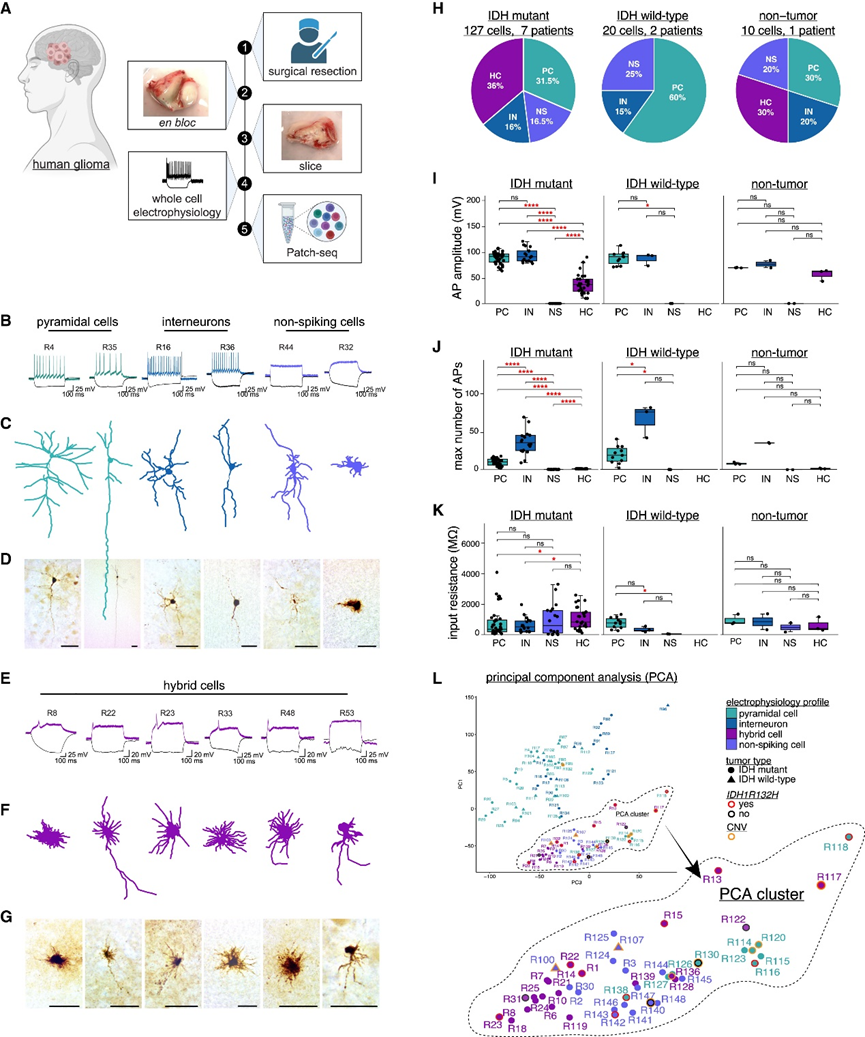
图1. 人类胶质瘤样本的 Patch-seq 显示肿瘤细胞激发动作电位。
(a) 全细胞膜片钳记录和全细胞膜片分析的实验工作流程,然后进行Patch-seq。 (b) 贴片的 PC、IN 和 NS 对 600 毫秒超极化电流步骤和超阈值去极化电流步骤。(c) 显示记录的神经元和神经胶质细胞的匹配追踪细胞形态。(d) 充满生物素的神经元和神经胶质细胞的细胞形态的匹配图像。(e) IDH mut HC 对 600 ms 超极化电流步骤和超阈值去极化电流步骤的示例性膜响应。(f) 显示记录的 HC 的匹配追踪细胞形态。(g) 与斑块状 HC 的充满生物素的细胞形态相匹配的图像。(h) 饼图显示实验组修补的 PC、IN、NS 和 HC 的百分比。(i) 箱线图显示 HC 细胞与神经元相比具有 AP 振幅。(J) 箱线图显示 HC 发射的脉冲比神经元少。 (K) 箱线图显示 HC 的输入电阻高于非肿瘤神经元。 (L) 95 个 Patch-seq 细胞的主成分分析 (PCA) 图显示了基于电生理特性的细胞聚类。
02
开发SCRAM平台
为了更好地定义在 Patch-seq 研究中发现的 HC,他们试图创建一个计算平台,可以单独注释来自 Patch-seq 的每个细胞。由于使用 Patch-seq 获得的细胞数量少,而且这些实验中使用的人类神经胶质瘤样本很少,注释工具需要能够分析每个细胞而不依赖于聚类方法,这需要数百到数千个细胞才能获得最佳分析。因此,他们开发了 SCRAM 工具,它可以独立于聚类逐个注释每个细胞。SCRAM 使用三步正交过程为每个细胞提供详细的转录和 RNA 推断基因组图谱:(1) 使用机器学习神经网络模型 (NNM) 进行细胞类型转录注释;(2) 使用 XCVATR 进行单核苷酸变异(SNV)分析,使用CaSpER和NUMBAT工具进行拷贝数变异 (CNV)分析(图2A-D)。Patch-seq 中的每个细胞都分配一个概率分数,用于训练数据集中的每种细胞类型(图 2E)。使用这种方法,单个细胞可能注释为多种细胞类型,这允许表征混合细胞状态,每个细胞的 SNV 和 CNV 也会添加到细胞注释中。如果细胞具有 ≥2 个肿瘤特征,则将其指定为“肿瘤”。
他们对来自 Patch-seq 实验的 95 个细胞运行了 SCRAM,发现所有具有 IN 电生理学特征的细胞均能正确注释为 GABA 能神经元,并且 41 个具有 PC 电生理学特征的细胞中有 24 个正确注释为谷氨酸能神经元(图2E)。所有具有 NS 电生理学特征的细胞均注释为神经胶质细胞亚型和/或神经胶质瘤细胞。从1例IDHWT患者和1例IDHmut复发患者中鉴定出13个PC,注释为GABA能神经元。虽然GABA能神经元具有稳健的转录组学特征,但这些细胞具有与兴奋性神经元一致的最大AP放电率(图2E-G)。使用细胞周期评分,他们发现只有三个细胞表现出增殖特征,其中两个是IDH1R132H突变体(图2G),然而,大多数HC的G2/M评分较低。与它们的电生理特征一致,所有 HC同时显示出 OPC、少突胶质细胞 (OL) 和 GABA 能神经元(混合物在此称为 GABA-OPC)和肿瘤细胞的注释,这表明 HC 具有选择性神经元和少突胶质细胞转录特征的混合,这些特征可能是这些细胞具有功能性电生理特性的原因(图2E-G)。
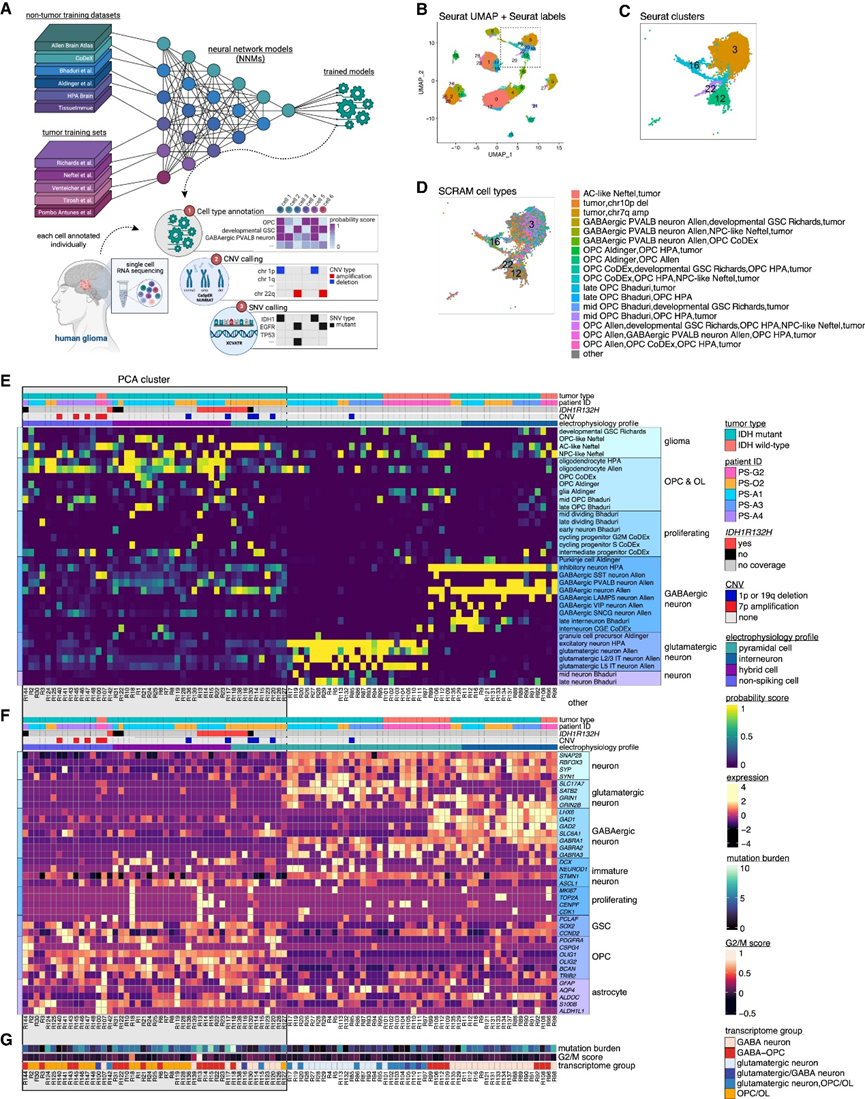
图2. SCRAM 显示 HC 细胞是 GABA-OPC 肿瘤细胞。
(a) SCRAM 流程示意图。(b) 显示了内部胶质瘤 scRNA-seq 数据集中的 234880 个细胞的 Seurat 聚类。 (c-d)UMAP可视化。(e) 热图显示 95 个 Patch-seq 细胞的 SCRAM 细胞类型概率分数。(f) 热图显示 95 个 Patch-seq 细胞的细胞类型标记。(g) 热图显示 95 个 Patch-seq 细胞的综合 SNV 分数(突变负担)和细胞周期分数(G2/M 分数)。
03
HC具有混合 GABA 能神经元-OPC特征
为了在更大的数据集中验证Patch-seq 数据,他们使用 SCRAM 分析了内部 scRNA-seq 数据集,该数据集包含来自 12 名 IDHmut和 IDHWT胶质瘤患者的 234880 个细胞(图2B-D)。SCRAM 分配的概率分数 >0.9 用于最终细胞注释,并进行UMAP可视化,该数据集基于细胞特征而不是转录特征的相似性对细胞进行聚类(图 3A)。 SNV、CNV 和特定于胶质瘤亚型的肿瘤表达标记的可视化显示,SCRAM 将大多数 IDHmut与 IDH WT肿瘤细胞区别开来(图3B)。 他们将重点放在包含大多数 IDH mut肿瘤细胞的 SCRAM 聚类上,这些聚类主要分布在三个离散的 SCRAM 聚类(聚类 13、18 和 19)中,这些聚类总共包含 <5% 的 IDH WT肿瘤细胞(图3C-E)。重要的是,所有IDH mut肿瘤患者均具有强健的GABA-OPC表达谱,而只有一名IDH WT患者显示出相同的表达谱(图3F-G)。对患者肿瘤细胞的分析显示,平均 41.3% 的 IDH mut肿瘤细胞为 GABA-OPC(图3H),这与这些肿瘤中 34% 的记录细胞存在 HC 电生理学相一致。相比之下,在 IDH WT肿瘤中,只有 2.2% 的肿瘤细胞获得了 GABA-OPC 注释(图3H),这与 Patch-seq 实验中 HC 电生理学的缺失一致。
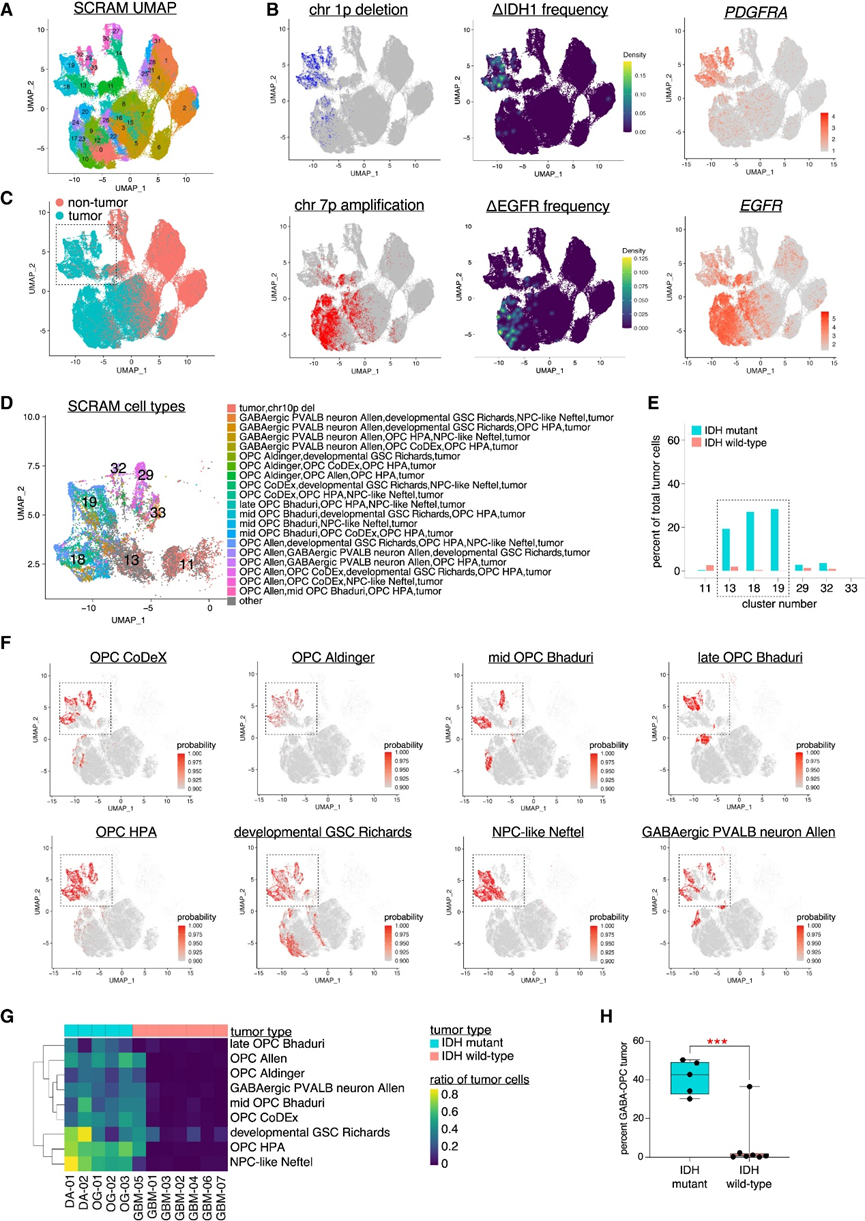
图3. 人类胶质瘤中的 GABA-OPC 肿瘤细胞。
(a) UMAP可视化。 (b) 显示了常用的 IDH mut(上)和 IDH WT(下)肿瘤特征。(c) SCRAM肿瘤和非肿瘤细胞注释。(d) 放大(C)中的插图,显示每个单元的 SCRAM 单元类型注释。(e) 条形图显示 (D) 中的大多数细胞来自 IDH mut肿瘤患者。 (f) 显示感兴趣的细胞类型的 SCRAM 概率分数。(g) SCRAM 细胞类型注释热图。(h) 箱线图显示具有 GABA-OPC 注释的肿瘤细胞百分比。
04
GABA-OPC 的特征揭示了 GABA 能神经元和 OPC 的转录依赖性
他们接下来使用了 Shapley 加性解释 (SHAP) 分析,该分析从机器学习 NNM 中提取了基本特征。他们从训练数据集中的每种细胞类型中识别了 SHAP 标记(例如来自 ABA 的 GABAergic PVALB 神经元),并将这些基因与 GABA-OPC 肿瘤细胞获得的差异表达基因 (DEG) 进行比较。GABA-OPC 基因集由 SHAP 基因组成,这些基因是来自肿瘤和非肿瘤训练数据集的细胞类型的关键转录特征(图4A-B)。通过分析GABA-OPC SHAP特征,训练细胞类型中GABA能神经元和OPC的代表性最高,表明大多数GABA-OPC的转录特征源自GABA能神经元和OPC。GABA-OPC 细胞在转录上最类似于晚期 OPC 和早期分化的 OL,这意味着 GABA-OPC 存在于前体 OPC 和完全分化的 OL 谱系之间的过渡状态。免疫染色分析显示这些 OL 谱系细胞类型具有 OLIG2 的 GABA-OPC 特征(图4C)。进一步的生物信息学分析表明,非肿瘤和发育性脑图谱中平均有 48% 的 OPC 具有 GABA-OPC 分子谱,并且这些细胞谱在成人脑中比在神经发育环境中更常见。这些结果表明,GABA-OPC 肿瘤细胞是 GABA 富集 OPC 亚类的恶性表现,这种亚类通常存在于非肿瘤人脑中。
他们发现谷氨酸脱羧酶 1 (GAD1) 和GABA 转氨酶(ABAT) 表达较高,这对 GABA 的合成和代谢至关重要(图4D)。在Patch-seq 队列中对这些基因的分析证实,ABAT和GAD1在 HC 中高度表达,后者存在于IDHmut 胶质瘤中(图4E-F)。与其他肿瘤细胞相比,GABA-OPC 肿瘤细胞中也有选择性 GABAR 表达,这表明 GABA-OPC 肿瘤细胞在转录上具备从神经元接收 GABA 介导的输入的能力(图D-E)。
接下来,他们试图了解GABA-OPC如何在机制上产生AP。重要的是,之前的研究表明,大鼠脑内的白质OPC亚群可以发射单一的、短的AP,这些AP与在Patch-seq研究中观察到的AP相似。这些突增的OPC的AP能力依赖于电压门控离子通道,特别是电压门控钠通道(Navs)和电压门控钾通道(Kvs),他们发现非肿瘤OPC选择性地表达这些离子通道。大多数 GABA-OPC 肿瘤细胞具有较高的Navs表达,但Kvs的表达仅限于较小的细胞群,并且在 HC 转录组中并不一致(图4D)。人类 IDHmut肿瘤中由SCN1A基因编码的电压门控钠通道Navs的免疫染色证实 GABA-OPC 肿瘤细胞表达Navs,这对于 AP 的上升期至关重要(图4H)。
为了验证钠通道对 GABA-OPC 的 AP 发射能力具有功能重要性,他们在存在河豚毒素 (TTX) 的情况下对手术切除的 IDHmut肿瘤核心切片进行了全细胞膜片钳记录。TTX 是一种强效神经毒素,通过结合并灭活 Navs来抑制 AP 发射。当应用 TTX 时,所有 HC 中的 AP 都消失,从而证实了 Navs是 GABA-OPC 离子通道库的重要组成部分(图4I)。对获得TTX处理记录的两个生物胞素保存的HC进行免疫染色,证实它们为OLIG2+(图4J),同时,他们还发现了OLIG2 +PC,该 PC 能够发射多个 AP,但这些 AP 由TTX 消除,这表明一些 GABA-OPC 可能能够发射不止一个 AP。
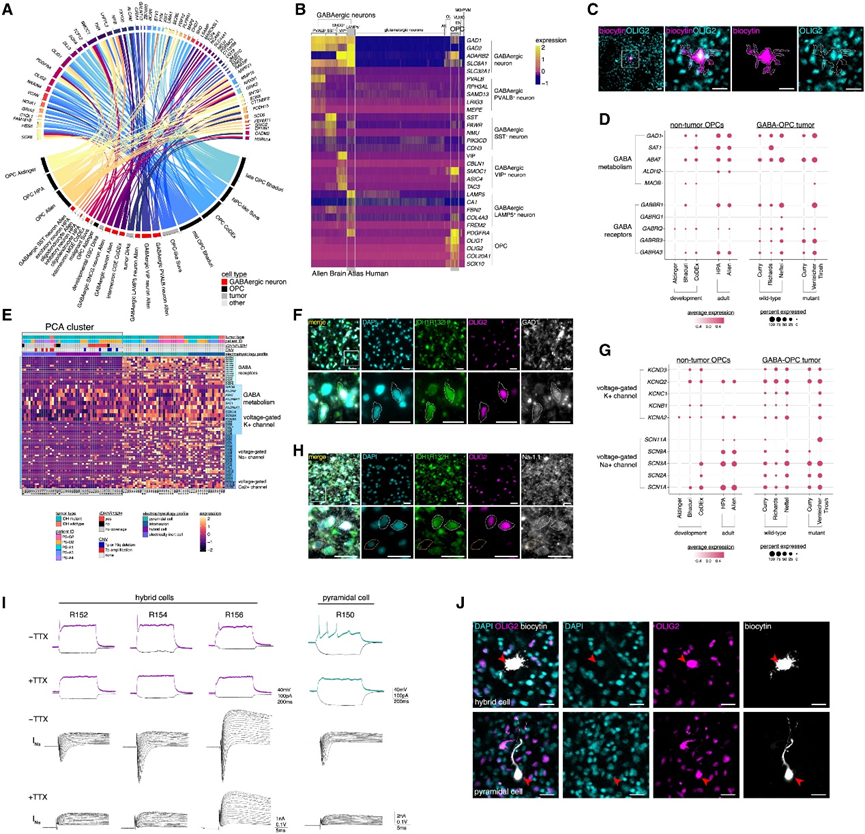
图4. GABA 能、神经元和 OPC 特征是 GABA-OPC 的标志。
(a) Circos 图显示构成 GABA-OPC 肿瘤细胞特征的 61 个基因 (b) Allen Brain Atlas 非肿瘤人类 scRNA-seq 数据的热图显示 GABAergic 神经元和 OPC 共有亚型特异性标记。(c) HC 的代表性图像。(d) 点图显示人类非肿瘤 OPC 和 GABA-OPC 肿瘤细胞中 GABAR 和 GABA 代谢基因的平均表达。(e) 热图显示 Patch-seq 数据中 GABAR、GABA 代谢基因、电压门控钠通道 (Na v s)、电压门控钾通道 (Kvs) 和电压门控钙通道的表达。 (f) 免疫染色分析。(g) 点图显示人类非肿瘤 OPC 以及 GABA-OPC 肿瘤细胞中电压门控钠通道 (Navs) 和电压门控钾通道 (Kvs) 基因的平均表达。(h) 免疫染色分析。(i) 显示了添加 TTX 之前和之后贴片的 HC 和 PC 对 600 ms超极化电流阶跃和超阈值去极化电流阶跃的典型膜响应。(J) 免疫染色分析。
05
GABA-OPC 特征明显,可增加 IDHmut型胶质瘤患者的生存率
为了验证GABA-OPC特征在IDHmut队列中比在IIDHWT中更为显著的结果,他们使用GABA-OPC样胶质瘤基因集对来自癌症基因组图谱(TCGA)的216个IDHWT样本和366个IDHmut样本的转录组数据进行评分(图5A)。IDH mut样本的 GABA-OPC 评分高于 IDHWT样本。按 IDHWT分子亚型分析评分显示,GABA-OPC 评分最高的属于 OPC 样和 NPC 样分子亚型(图5B)。与这些观察结果一致,OPC 样样本的 GABA-OPC 肿瘤百分比明显高于其他分子亚型(图5C)。对 TCGA IDH mut样本按组织病理学亚型进行的分析表明,低级别胶质瘤 (LGG) 的 GABA-OPC 评分高于高级别胶质瘤 (HGG),这表明较强的 GABA-OPC 表型与较低级别的肿瘤相关(图5D)。三个IDH mut和一个OPC样 IDH WT样本的RNA速度伪时间分析表明,GABA-OPC肿瘤细胞从更原始的肿瘤细胞类型中出现,成为肿瘤中最大的神经胶质瘤细胞群,这表明来自IDH mut和IDH WT不同遗传背景的某些肿瘤细胞在共同的转录表型上汇聚(图5E-F)。
为了确定 GABA-OPC 肿瘤细胞对神经胶质瘤进展的影响,他们对IDH突变型胶质瘤样本进行了GABA-OPC特征评分,根据中位表达量将样本分为低和高GABA-OPC 组。Kaplan-Meier 生存分析显示,低 GABA-OPC 肿瘤患者的中位生存期为 84.5 个月,而高 GABA-OPC 肿瘤患者的中位生存期为 156.9 个月(图5G)。即使在高级别 IDHmut患者中,低 GABA-OPC 评分也会导致更差的生存结果,低 GABA-OPC 组和高 GABA-OPC 组的中位生存期分别为 80.5 和 182.5(图5H)。总之,这些分析证实了 GABA-OPC 肿瘤细胞是 IDHmut神经胶质瘤和 IDH WT神经胶质瘤亚型的决定性特征,并表明 GABA-OPC 特征减少与IDHmut神经胶质瘤患者的生存结果明显较差有关。
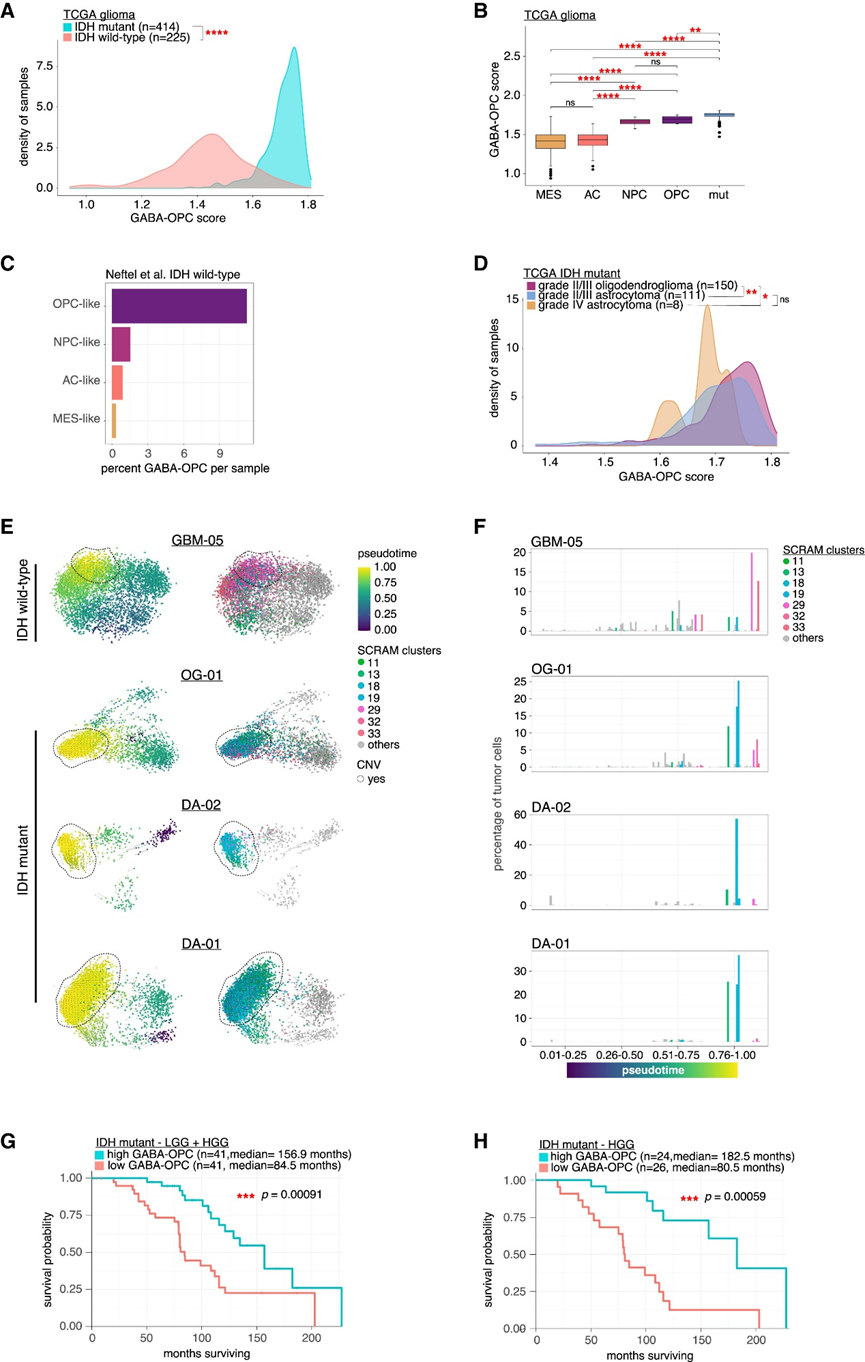
图5. GABA-OPC 肿瘤细胞在 IDHmut肿瘤中具有保护作用。
(a) 胶质瘤样本的 GABA-OPC 肿瘤评分密度图。(b) 箱线图显示 TCGA 样本的 GABA-OPC 得分。(c) GABA-OPC 肿瘤细胞的百分比。(d) 胶质瘤样本的 GABA-OPC 肿瘤评分密度图。(e) RNA 速度伪时间分析。(f) 条形图显示伪时间内各聚类肿瘤细胞的百分比。 (g-h)生存分析。
06
肿瘤内在去极化以 IDH 亚型依赖的方式差异性地改变增殖
鉴于 GABA-OPC 特征与 IDH mut神经胶质瘤患者的生存结果改善相关,他们试图了解 GABA-OPC 细胞对肿瘤细胞增殖的影响。大约 85% 的 GABA-OPC 肿瘤细胞为 OLIG2 +,58% 的非 GABA-OPC 肿瘤细胞也表达 OLIG2。免疫染色分析显示 38% 的细胞为 IDH1R132H + OLIG2 +;考虑到同样表达 OLIG2 的 GABA-OPC 和非 GABA-OPC 肿瘤细胞的百分比,他们估计这些 IDH132H + OLIG2 +细胞中大约有一半是真正的 GABA-OPC,约为 18%–20%(图6A)。将 KI67 免疫染色添加到此分析中,结果显示 IDH1R132H + OLIG2+细胞大多不具有增殖性,只有 3.1% 的双阳性细胞也显示 KI67 阳性(图6B-C)。有趣的是,他们注意到 KI67+细胞通常对 OLIG2 呈阴性,但保留了 IDH1R132H 阳性,这表明与未经历 G2/M 转换的细胞相比,IDH mut肿瘤中活跃增殖的细胞会失去OLIG2表达(图6C-D)。
在进行生物信息学分析时,他们观察到 NPC 和 OPC 样 IDH WT肿瘤中的 GABA-OPC 显示出较高的 G2/M 评分,这表明 GABA-OPC 可能对肿瘤细胞增殖产生相反的影响,这种影响依赖于 IDH 亚型(图6E-F)。与90% 以上的IDH mut神经胶质瘤中发生的IDH1R132H突变不同,IDH WT肿瘤中发生的突变是异质性的,因此缺乏针对 IDH WT肿瘤细胞的特异性抗体。为了克服这一限制并检测肿瘤内在去极化对 IDH WT肿瘤增殖的影响,他们采用光遗传学诱导肿瘤细胞去极化,使用 RFP 标记的宫内电穿孔 (IUE) IDHWT神经胶质瘤小鼠模型(图6G)。重要的是,他们在 IUE 肿瘤小鼠中发现了类似的 GABA-OPC 肿瘤细胞群和相应的 HC 电生理学,使其成为可以进行这些实验的合适模型(图6H)。ChR2 和 BrdU 的免疫染色显示,表达 ChR2 的肿瘤 (pbCAG-ChR2-RFP) 比不表达 ChR2 的肿瘤 (pbCAG-RFP) 增殖性更强(图6I-K)。这些数据表明,在IDH WT条件中,反复的肿瘤细胞去极化会促进神经胶质瘤细胞增殖。
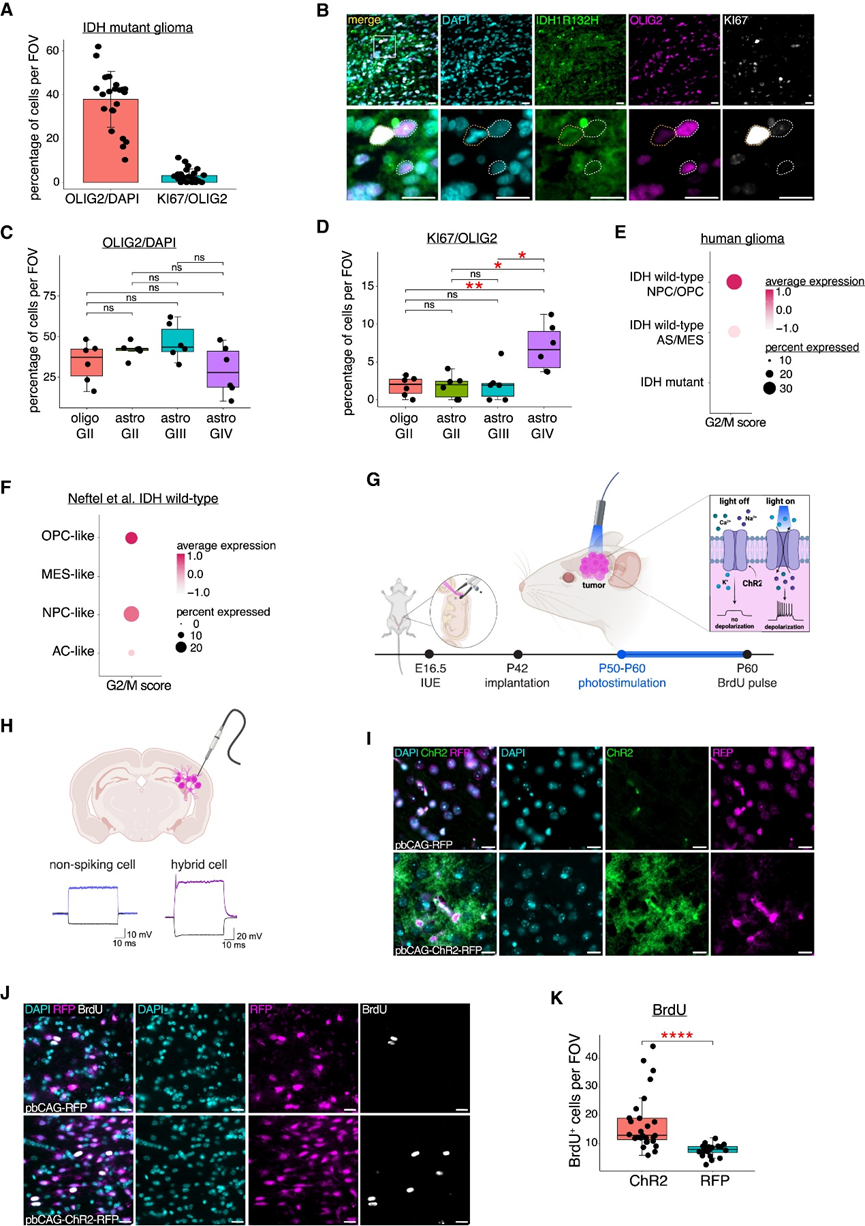
图6. 肿瘤细胞去极化以 IDH 依赖的方式差异性地改变神经胶质瘤细胞增殖。
(a) IDH1R132H + OLIG2 +细胞和IDH1R132H + OLIG2 + KI67 +细胞的百分比 。(b) 免疫染色分析。(c) 箱线图显示通过免疫染色检测到的每个 IDH mut肿瘤样本的 IDH1R132H + OLIG2 +细胞百分比。(d) 箱线图显示通过免疫染色检测到的每个 IDHmut肿瘤样本的 IDH1R132H + OLIG2 + KI67 +细胞百分比。 (e) 细胞周期评分的点图显示了人类神经胶质瘤 scRNA-seq 数据集中经历 G2/M 的 GABA-OPC 肿瘤细胞的百分比和平均表达。(f) 细胞周期评分的点图显示了IDHWT胶质瘤中经历 G2/M 的 GABA-OPC 肿瘤细胞的百分比和平均表达。(g-h)实验设计示意图。(i) 光遗传学 IUE 肿瘤小鼠的代表性图像。(J) 光遗传学 IUE 肿瘤小鼠的代表性图像显示 OLIG2(粉色)和 BrdU(白色)的免疫染色。(K) 箱线图和晶须图显示每个视野 (FOV) 中BrdU +细胞数量。
+ + + + + + + + + + +
结 论
本项研究对人类神经胶质瘤标本进行了Patch-seq,发现IDH mut 肿瘤中三分之一的细胞同时表现出神经元和神经胶质细胞的特性。SCRAM 分析显示,HC 具有 GABA 能神经元和少突胶质细胞前体细胞的特征。本项研究描述了人类神经胶质瘤细胞的综合电生理和分子特性,并描述了人类神经胶质瘤中一种具有独特电生理和转录组学特性的细胞类型,这种细胞类型也可能存在于非肿瘤大脑中。
+ + + + +



 English
English


