文献解读|SCIENCE(63.714):病原体诱导的内生根微生物群的疾病抑制功能的激活
✦ +
+
论文ID
原名:Pathogen-induced activation of disease-suppressive functions in the endophytic root microbiome
译名:病原体诱导的内生根微生物群的疾病抑制功能的激活
期刊:SCIENCE
影响因子:63.714
发表时间:2019.11.01
DOI号:10.1126/science.aaw9285
背 景
植物的内生根微生物群可以促进植物生长和健康,但它们的基因组和功能多样性目前还不完全清楚。
元基因组学和网络推理显示,真菌感染植物根部后,根部内层的Chitinophagaceae和Flavobacteriaceae富集,并且几丁质酶基因和各种未知的生物合成基因簇编码生产非核糖体肽合成酶(NRPS)和聚酮体合成酶(PKS)。
经过菌株级的基因组重建,设计了一个由Chitinophaga和Flavobacterium组成的联合体,该联合体能持续抑制真菌根部疾病。然后,定点诱变发现,一个以前未被识别的、来自Flavobacterium的NRPS-PKS基因簇对内生根微生物的疾病抑制至关重要。
该研究结果强调,内生根微生物具有丰富的、尚未知的功能性状,协调一致后可以从内到外保护植物。
实验设计
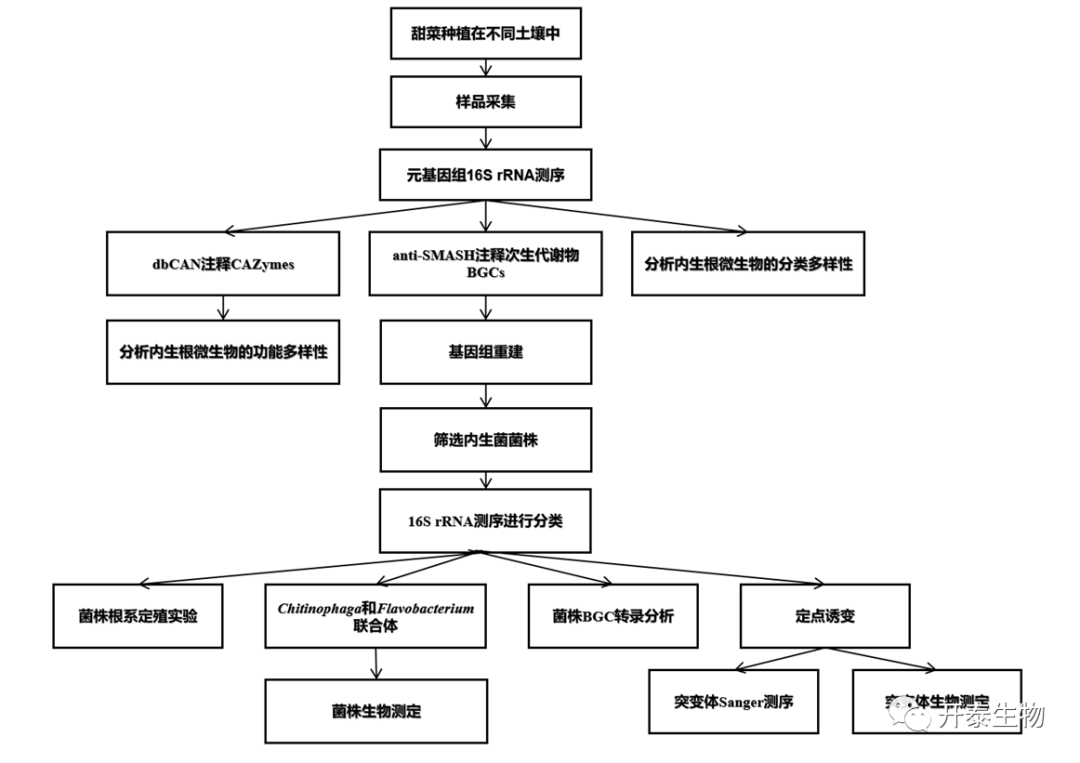
结 果
01

内生根微生物的分类多样性
甜菜种植在接种病原体(R)+抑制性土壤(S)中的发病率为15至30%,在接种病原体(R)+诱病性土壤(C)的发病率超过80%。在甜菜生长4周后,研究了在其余三种土壤条件(C、S和S+R)下生长的植物的内生根微生物的分类学多样性和功能潜力(鉴于C+R的发病率很高,没有足够的根材料用于对这种情况进行深入的微生物组学分析)。
经过元基因组测序和生物信息学分析,甜菜根部内层的微生物细胞的序列片段76.1%为细菌、10.5%为真核生物、0.0065%为古细菌。
对于真核生物序列,主坐标约束分析显示,C、S和S+R中的内生根微生物组成存在显著差异。这主要是由于在S+R土壤中,与Rhizoctonia相关的序列片段的增加。这些结果表明,在抑制疾病的土壤中,虽然R. solani定殖并渗透到植物根部,但几乎没有引起疾病。
元基因组16S rRNA测序结果表明,Proteobacteria 、Bacteroidetes在内生根微生物群落中占主导地位,共有10个OTU:Pseudomonadaceae(2个)、Xanthomonadaceae(4个)、Chitinophagaceae(1个)、Flavobacteriaceae(2个)Veillonellaceae(1个),与S土壤相比,这些单位在S+R土壤中都变得丰富(图1A)。
共现网络分析显示,与C、S土壤相比,S+R土壤的复杂性有所增加。
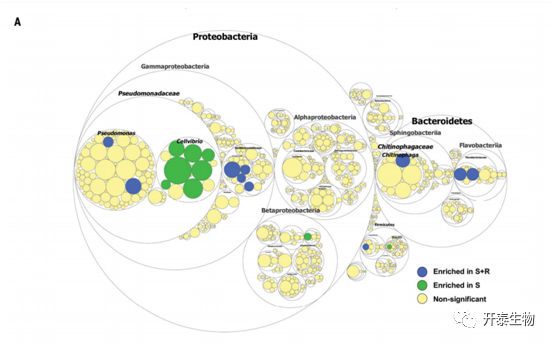
图1.病原菌引起内生根微生物多样性和功能的变化
(A)分类学差异基于从元基因组中提取的16S rRNA序列 最大圆圈代表门的级别,内圈代表类、科和属
02

内生根微生物的功能多样性
在从元基因组数据中检索到的基因中,与生长在C土壤中的甜菜相比,402个功能基因在生长在S土壤中的甜菜的内生细菌群中明显富集,这些基因功能主要属于“碳水化合物运输和代谢”和“信号转导机制”分类。在S+R土壤中,这种功能富集的比例增加了10倍以上(4443)(图1B)。
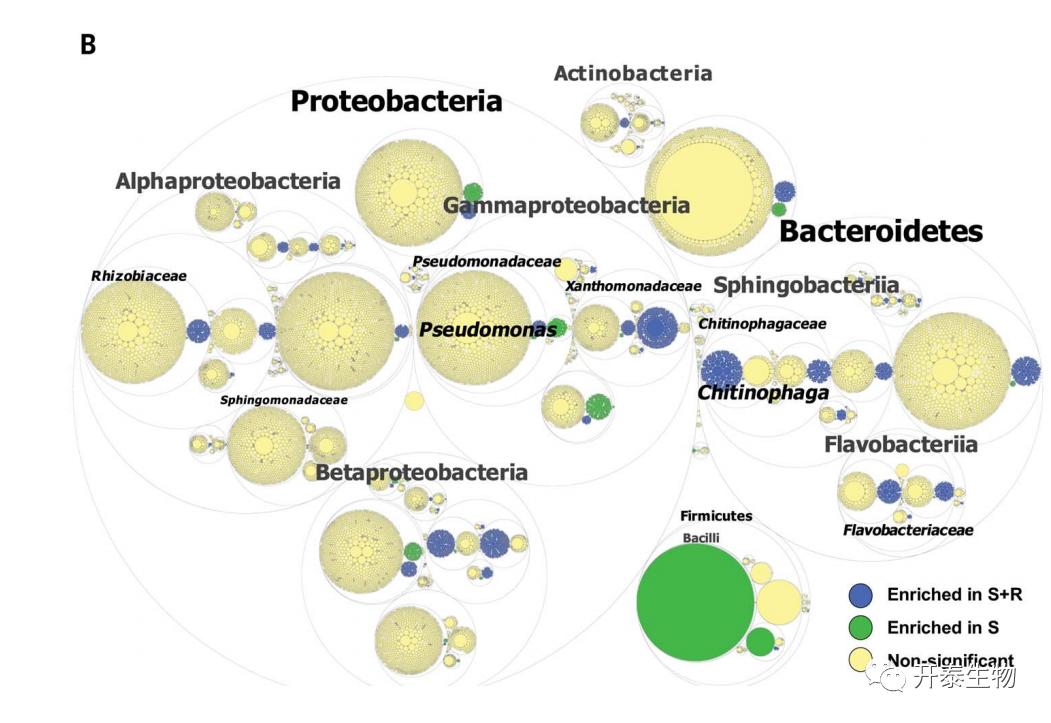
图1.病原菌引起内生根微生物多样性和功能的变化
(B)功能差异基于元基因组序列数据并分配给分类群 最小的圆表示 COG 类别组;圆圈大小代表不同丰度的分类群和功能的平均相对丰度;在S和S+R的比较中,显著富集的细菌类群或功能(FDR<0.1)用绿色表示S,用蓝色表示S+R;不显著的类群和功能用黄色表示
S+R土壤中大多数高表达基因与Chitinophagaceae 和 Flavobacteriaceae相关(图1B)。样本间所有Bacteroidetes的基因的累积差异丰度分析强调,来自同源群(COG)Q类(次生代谢物生物合成、运输和分解代谢)簇的基因是S+R和S之间差异最大,而G类(碳水化合物运输和代谢)的基因在S和C之间差异最大(图1C)。
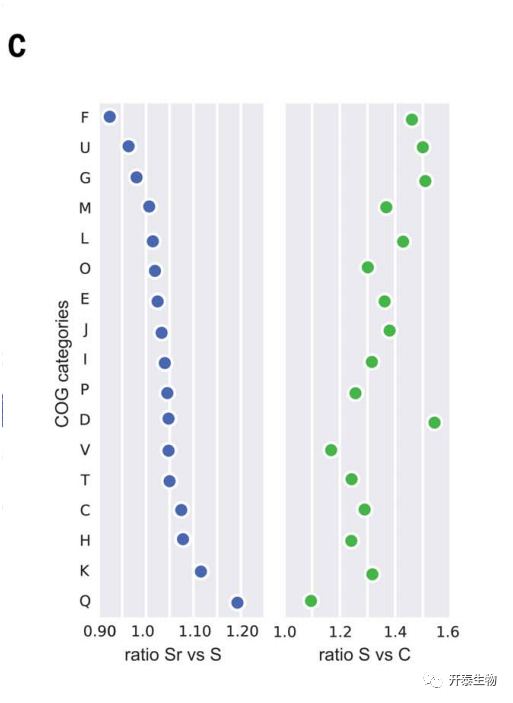
图1.病原菌引起内生根微生物多样性和功能的变化
(C)属于COG核心功能类别的所有基因的平均丰度比
使用dbCAN和anti-SMASH在元基因组序列中注释碳水化合物活性酶(CAZymes)和次生代谢物生物合成基因簇,进一步研究与COG中G类、Q类相关的特定功能。结果表明内生菌元基因组中有1822个具有糖苷水解酶、糖基转移酶、多糖裂解酶和碳水化合物酯酶结构域以及非催化碳水化合物结合结构域的基因。将相关功能的结构域的多样性映射到用hhsearch算法构建的蛋白质家族相似性网络中。糖苷水解酶和糖基转移酶在S+R内生微生物中含量更高,并与疾病抑制相关(图2A)。

图2.内生根微生物中碳水化合物活性酶的多样性和分布
(A)参与糖代谢的酶(CAZymes)的已知和推定蛋白质结构域的相似网络
三个内生菌科(Chitinophagaceae, Burkholderiaceae, Xanthomonadaceae)在S+R和S之间的CAZyme组成存在统计显著差异(图2A)。此外,还发现Chitinophagaceae含有几种与真菌细胞壁降解相关的酶域,如几丁质酶类、β-葡聚糖酶和内切葡聚糖酶(图2A)。Burkholderiaceae ,Xanthomonadaceae也发现了两个几丁质酶结构域和其他三个参与几丁质降解的酶。Chitinophagaceae, Burkholderiaceae,Xanthomonadaceae之间只有5个结构域是共享的(图2B),表明这些家族之间的功能冗余有限。编码几丁质降解酶的基因的富集表明了这些内生真菌在抑制疾病方面的作用。
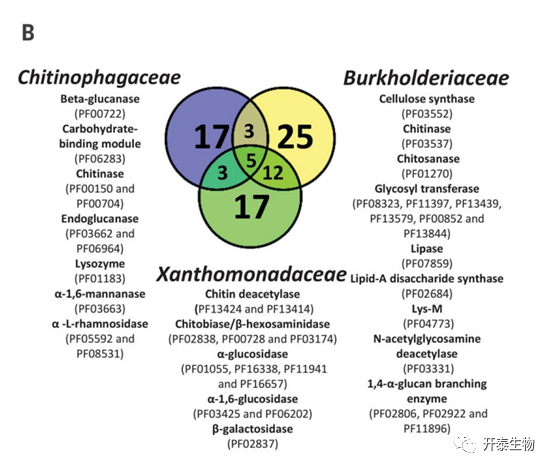
图2.内生根微生物中碳水化合物活性酶的多样性和分布
(B)三种内生菌的不同CAZymes注释的维恩图
对次级代谢物的反SMASH分析显示,共有730个生物合成基因簇BGCs与非核糖体肽、聚酮类、萜类、芳基多烯类、核糖体合成和翻译后修饰的肽(RiPPs)、膦酸酯类、酚嗪类和苷酸类的生物合成相关(图3A)。在这些BGCs中,有thanamycin 和 brabantamide的BGCs。这两种非核糖体肽合成酶(NRPS)衍生的产物曾在生长在抑制根瘤菌土壤中的植物的根际微生物中被检测到。在S+R土壤中,117个BGCs在根际内层的比例明显过高,其中34个BGCs属于 Bacteroidetes (图3,A至F)。
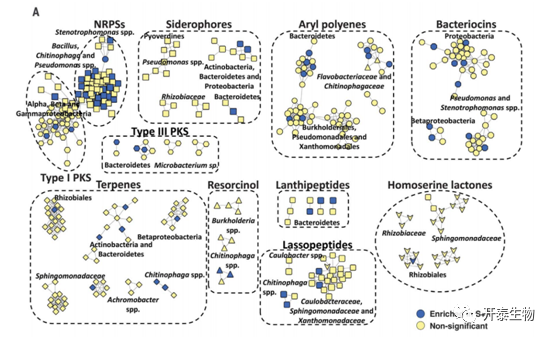
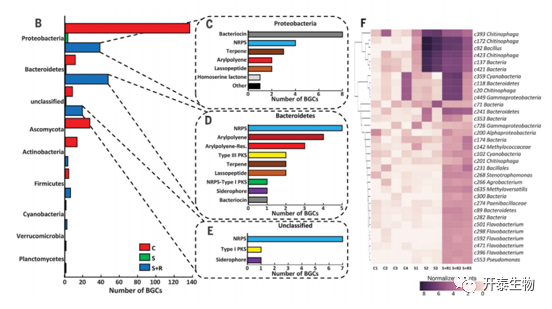
图3.内生根微生物中生物合成基因簇的多样性和分布
(A)内生根微生物中检测到的不同类别的BGCs的序列相似性网络 (B) 生长在C、S和S+R土壤中的植物内生根微生物群中的不同细菌门类( C到E)分配给Proteobacteria、Bacteroidetes 、未分类菌群的BGCs的数量和类型 (F)相对丰度的聚类热图
03

内生根微生物基因组的从头组装
通过antiSMASH在元基因组中鉴定的730个BGCs中,有157个在25个元基因组组装的基因组(MAGs)中发现,重建了这些基因。MAGs、管家基因和确定的BGCs被用来产生特定的引物,用于转录组分析,并将BGCs与内生根微生物的菌株联系起来。
筛选的1935个内生菌菌株通过16S rRNA测序进行了分类,有8个不同的属,主要为Bacteroidetes、Gammaproteobacteria。尽管通过PCR筛选没有发现与Chitinophaga或Pseudomonas相关的BGCs,但在从S+R条件下获得的Flavobacterium菌株中发现了4个BGCs(BGC298、BGC396、BGC471和BGC592)。其中三个编码NRPS(BGC396、BGC471和BGC592),第四个是NRPS-聚酮酸合成酶(PKS)混合基因簇(BGC298,图4A)。类似的方法证实了从S+R条件下获得的三个内生的Chitinophaga菌株中存在糖基水解酶(GH18)基因(图2A)。
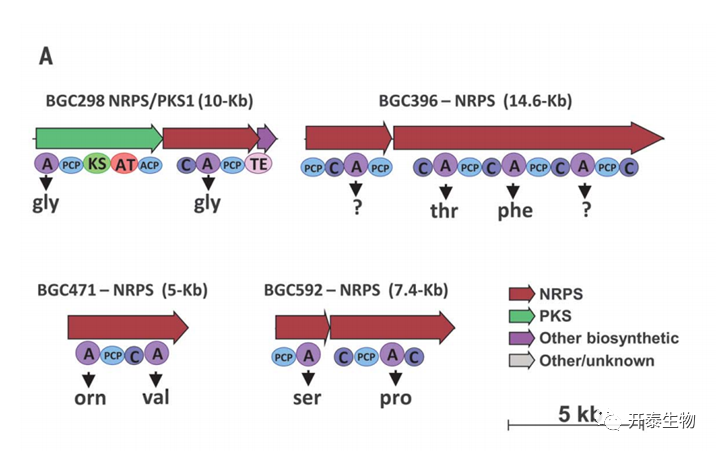
图4.疾病抑制联合体的转录和功能分析
04

疾病抑制联合体的重建和功能分析
选择了7个测序的Bacteroidetes菌株进行根系定殖实验和BGC转录分析。所有的菌株都在甜菜幼苗的根际和根际内层定殖。转录分析表明,在接种了病原体的根际和根际内层的菌株中,几丁质酶的表达明显较高(图4,B和C)。在四个Flavobacterium基因簇中,当植物根部受到病原体R solani侵染时,BGC298在根际的表达水平明显高于内层(图4C)。
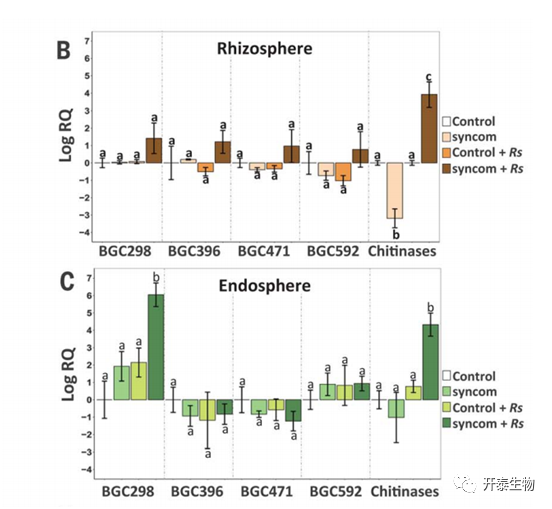
图4.疾病抑制联合体的转录和功能分析
Chitinophaga和Flavobacterium在疾病抑制土壤中生长的植物功能网络中处于中心位置,它们在内层定殖的能力,以及病原体诱导合成BGC298和几丁质酶基因的表达,都表明了它们抑制R. solani的作用。
生物测定表明,与单个菌株相比,Chitinophaga和Flavobacterium联合体对真菌根部感染具有显著且更稳定的保护作用(图4,D至F)。

图4.疾病抑制联合体的转录和功能分析
为了证实Flavobacterium BGC298在疾病抑制中的作用,实验开发了一种SpyCas9介导的系统,用于在Flavobacterium sp.98中引入双链DNA断裂,获得两个独立的BGC298突变体,其中的PKS基因用特定的引物进行Sanger测序,验证了PKS基因的缺失。当单独或与Chitinophaga一起引入时,这两个突变体在根际和内层的定殖程度与野生型Flavobacterium sp.98相同。当在生物测定中测试两个独立的BGC298突变体时,该突变单独降低Flavobacterium sp.98的疾病抑制活性(图4F)。
+ + + + + + + + + + +
结 论
实验结果表明,当病原体入侵时,在植物内生根中Chitinophagaceae 和 Flavobacteriaceae的丰度升高,与有关真菌细胞壁降解的酶的活性增强,合成由NRPSs和PKSs编码的次级代谢物。通过组装元基因组重建了一个由Flavobacterium和Chitinophaga组成的联合体,该联合体有可能通过诱导根部的抗性提供疾病保护。目前尚不清楚BGC298是具有抗真菌活性的代谢物,还是其他保护特性的调节器。可能是几丁质酶生成的壳寡糖诱导BGC298的表达。
这项研究采用元基因组分析和网络推理确定了内生根微生物群中丰富的微生物属和功能特性。以便有针对性地设计微生物联合体,达到特定的微生物组相关的植物表型。
+ + + + +



 English
English

