文献解读|Nat Commun(16.6):受抑制的Blautia -乙酸盐免疫轴是慢性压力促进乳腺癌进展的基础
✦ +
+
论文ID
原名:Repressed Blautia-acetate immunological axis underlies breast cancer progression promoted by chronic stress
译名:受抑制的Blautia -乙酸盐免疫轴是慢性压力促进乳腺癌进展的基础
期刊:Nature Communications
影响因子:16.6
发表时间:2023.10.03
DOI号:10.1038/s41467-023-41817-2
背 景
乳腺癌是一个主要的全球健康问题,约占女性所有癌症病例的 25%。根据临床和临床前研究,抑郁症是一种心理健康状况,与乳腺癌的发生、进展和不良治疗结果有关。抑郁症对免疫系统和炎症通路的影响可能会导致乳腺癌的发生。慢性压力是乳腺癌的已知危险因素,慢性压力引起的肠道微生物群失调可能在癌症进展中发挥关键作用。然而,目前尚不清楚宿主-微生物群向免疫系统发出的共代谢信号在慢性压力促进的癌症进展过程中是如何参与的。
实验设计
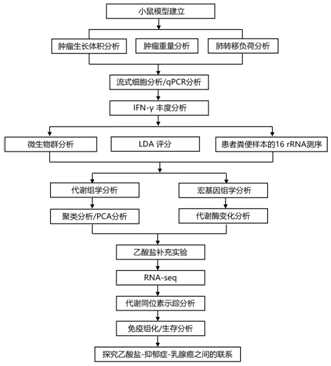
结 果
01
慢性压力加速乳腺癌进展,与 CD8+ T 细胞反应受损相关
为了研究慢性压力对肿瘤进展的影响,研究者团队将小鼠进行慢性束缚压力(CRS)或慢性不可预知的压力(CUS) 处理2周,然后接种4T1或E0771细胞,从而建立了两种不同的乳腺癌生长模型(图1a-b)。与非压力小鼠相比,受到慢性压力的小鼠肿瘤进展加速(图1c)。在慢性压力条件下,血液、脾脏和肿瘤组织中的T细胞,尤其是CD8+ T细胞显著减少;而肿瘤组织中B细胞、巨噬细胞、单核细胞和NK细胞未见明显变化。此外,他们观察到,在受到慢性压力的小鼠中,肿瘤浸润CD8+ T细胞产生炎性细胞因子γ干扰素(IFN-γ)的能力下降,并且其数量减少(图1e-h),但未观察到细胞溶解分子颗粒酶B (GZMB)和肿瘤坏死因子-α (TNF-α)的水平发生显著变化。这些结果表明,慢性压力通过肿瘤中浸润的 CD8+ T 细胞的反应受损而导致乳腺癌进展加速。
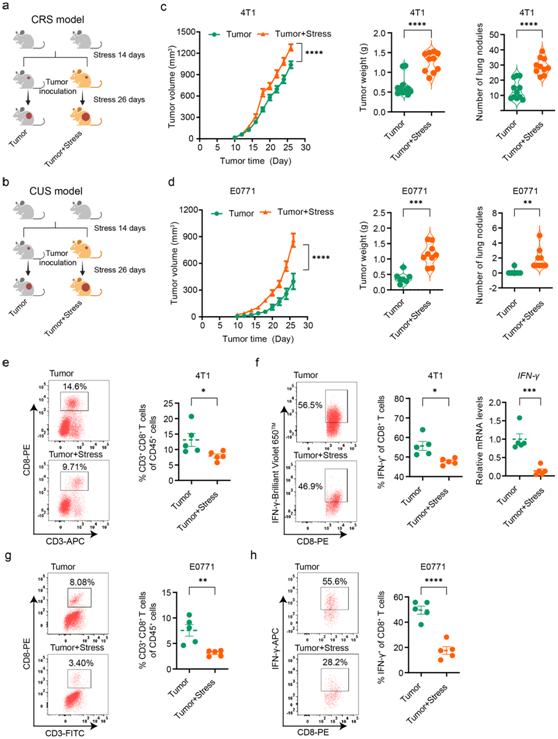
图1. 慢性压力会促进乳腺癌进展并损害瘤内 CD8+ T 细胞。
(a) Balb/c小鼠的实验设计。 (b) C57BL/6小鼠的实验设计。(c) 接种4T1细胞的小鼠的肿瘤生长体积、重量和肺转移负荷。 (d) 接种E0771细胞的小鼠的肿瘤生长体积、重量和肺转移负荷。(e) 通过流式细胞分析接种 4T1 细胞的小鼠中的肿瘤浸润 CD8+ T 细胞。 (f) 通过流式细胞分析或 qPCR 分析接种 4T1 细胞的小鼠肿瘤浸润 CD8+ T 细胞中的 IFN-γ 表达。 (g) 通过流式细胞分析接种 E0771 细胞的小鼠中的肿瘤浸润 CD8+ T 细胞。 (h) 通过流式细胞术分析接种 E0771 细胞的小鼠肿瘤浸润 CD8+ T 细胞中的 IFN-γ 表达。
02
肠道微生物群介导慢性压力促进乳腺癌进展
为了探索肠道微生物群与慢性压力加剧的乳腺癌进展之间的潜在联系,他们给小鼠注射了抗生素混合物(ABX)以消除肠道中的共生细菌。
研究表明,慢性压力会加速乳腺癌的进展,而接受 ABX 处理的小鼠则不存在慢性压力的促肿瘤作用(图2a-c)。值得注意的是,在ABX处理后,压力小鼠和非压力小鼠之间肿瘤浸润的CD8+ T细胞的丰度和功能没有观察到显著差异(图2d)。此外,与未接受 ABX 处理的小鼠相比,ABX 处理本身并不影响无压力小鼠的乳腺癌进展(图 2b-d)。这些发现表明肠道共生细菌在调节乳腺癌进展中慢性压力的肿瘤促进作用中具有潜在作用。
为了进一步证实肠道微生物群在慢性压力促进乳腺癌进展中的重要作用,他们建立了共同饲养小鼠模型(图2e),将微生物群落从一只小鼠转移到另一只小鼠体内,从而实现预期的正常化肠道相关表型。
这些结果表明,当受压力的肿瘤小鼠与未受压力的小鼠共同饲养时,由慢性压力引起的乳腺癌加速进展会发生消除(图2f-g)。更重要的是,在共同饲养条件下,压力小鼠的肿瘤浸润CD8+ T细胞的丰度和功能显著增强(图2h)。此外,在共同饲养的压力小鼠中也观察到肿瘤浸润CD8+ T细胞产生的IFN-γ增加(图2h)。综上所述,这些数据证明了肠道微生物群在慢性压力条件下参与促进乳腺癌进展。
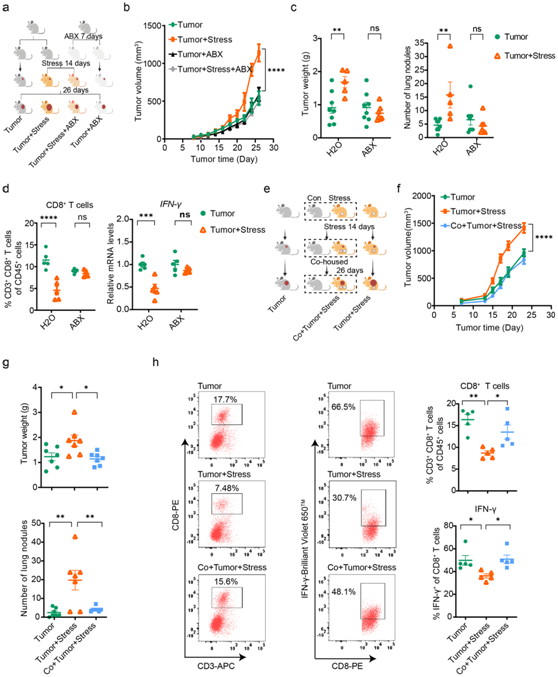
图2. 肠道微生物群调节因慢性压力而加剧的乳腺癌进展。
(a) ABX 处理的实验设计。(b) ABX治疗实验中的肿瘤生长体积。(c) ABX处理后肺的肿瘤重量和肿瘤负荷。(d) ABX处理后肿瘤浸润 CD8+ T 细胞和肿瘤浸润 CD8+ T 细胞中 IFN-γ 的丰度。(e) 共同饲养实验的实验设计,其中无压力、压力和压力条件下的小鼠分别接种 4T1 细胞。(f) 共同饲养实验中的肿瘤生长体积。(g) 共同饲养实验中肺的肿瘤重量和肿瘤负荷。(h) 共同饲养实验中肿瘤浸润 CD8+ T 细胞和肿瘤浸润 CD8+ T 细胞的 IFN-γ 丰度。
03
Blautia下降是慢性压力促进乳腺癌进展的基础
为了减少混杂微生物的影响并确定确切的致病微生物群和代谢物,他们采用并修改了时空微生物表型三角测量方法。他们发现了几种显著改变的微生物,包括布劳氏菌属(Blautia)、瘤胃梭菌属(Ruminiclostridium)、肠单胞菌属(Intestinimonas)和消化球菌属(Peptococcus)(图3a-c)。
他们沿时间轴分析了共同饲养的压力肿瘤组在不同时间点的粪便样本,观察到从第 14 天开始,Blautia、Ruminiclostridium、Ruminococcus和Lachnospiraceae_NK4A136_group的丰度逐渐增加,在第40 天后出现最大变化(图3d-f)。这种时空方法使他们能够将Blautia和Ruminiclostridium确定为促进抑郁相关乳腺癌进展的潜在致病微生物。
此外,对从重度抑郁症(MDD)患者和健康对照(HC)获得的粪便样本进行16S rRNA测序,发现MDD患者中的 Blautia丰度显著低于HC(图3g)。
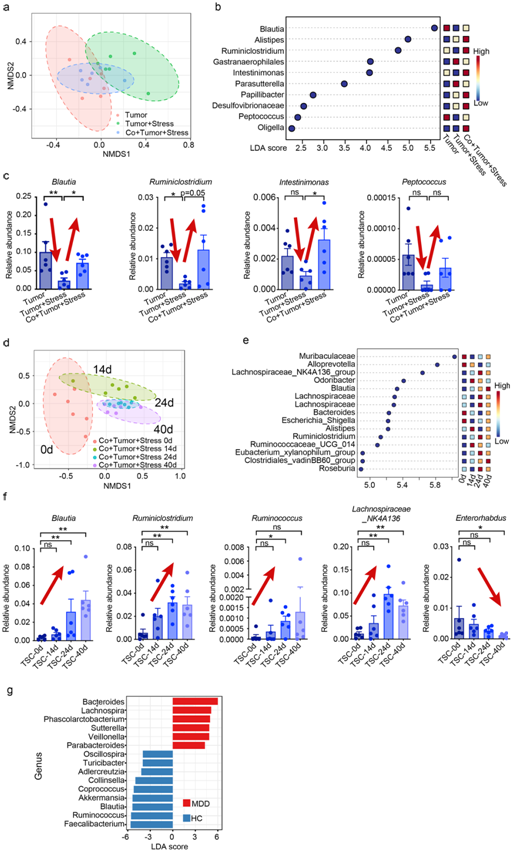
图3. 肠道微生物群的时空交错分析。
(a) 第40 天时,非压力、压力和共同饲养压力肿瘤小鼠的盲肠微生物群的非度量多维标度 (NMDS) 图。 (b) 从盲肠微生物丰度的 LEfSe 分析中获得的差异表达属的线性判别分析 (LDA) 评分。(c) 共同饲养实验中盲肠微生物群在属水平上的相对丰度发生显著变化。 (d) NMDS 图显示共同饲养的压力肿瘤小鼠在第 0、14、24 和 40 天时粪便微生物组成随时间的变化。 (e) 通过对共同饲养的压力肿瘤小鼠的粪便微生物丰度进行 LEfSe 分析获得的差异表达属的 LDA 评分。(f) 共同饲养的压力肿瘤小鼠 (TSC) 的粪便微生物群在属水平上的相对丰度存在显著的时间依赖性变化。(g) LEfSe 图显示 MDD和 HC中属的丰度差异。
为了证实Blautia在慢性压力促进的乳腺癌进展中的因果作用,他们进行了一项实验,向遭受慢性压力的肿瘤小鼠进行了Blautia coccoides (BC)和Blautia obeum (BO)处理(图4a-b)。结果表明,BC和BO同时处理可显著抑制慢性压力引起的乳腺癌加速进展(图 4c-d)。此外,与压力对照组相比,BC和BO处理均显著增加了CD8+ T细胞向肿瘤的浸润,并有效刺激了CD8+ T细胞产生IFN-γ(图4e-f)。
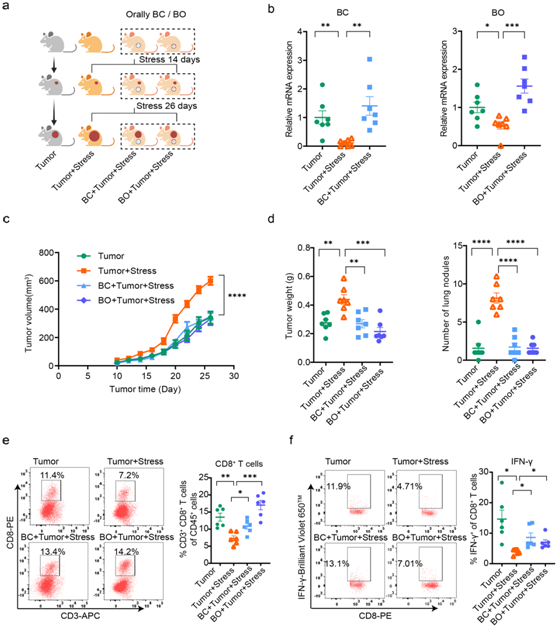
图4. 补充 BC 和 BO 消除了慢性压力促进的乳腺癌进展。
(a) 实验设计示意图。(b) 通过 qPCR 测量小鼠定植 14 天后 BC 和 BO 的 mRNA 表达。(c) 用 BC 和 BO 定植后的肿瘤生长体积。(d) BC 和 BO 定植后肺中的肿瘤重量和肿瘤负荷。(e) 用 BC 和 BO 定植后通过流式细胞术分析肿瘤浸润的 CD8+ T 细胞。(f) BC 和 BO 定植后肿瘤浸润 CD8+ T 细胞的 IFN-γ 丰度。
04
Blautia的减少会导致乙酸盐的生产受到影响
为了阐明Blautia丰度减少与慢性压力促进的乳腺癌进展有关的机制,他们使用从参与共同饲养实验的小鼠中获得的血清和肿瘤样本进行了代谢组学分析。主成分分析 (PCA) 显示不同组中样本有明显的聚类(图5a-b),在血清和肿瘤组织中分别鉴定出总共203种和208种代谢物。值得注意的是,热图显示了三组之间的 50 种有区别的代谢物,表明共同居住对微生物-宿主代谢平衡产生了深远的影响(图5c-d)。乙酸盐和硬脂酰肉碱是共同饲养后血清和肿瘤样品中变化最显著的代谢物(图 5e-f)。随后,他们对代谢物和肠道微生物群之间进行了相关性分析,发现乙酸盐和硬脂酰肉碱的含量与Blautia的丰度呈强烈正相关。CUS模型中肿瘤组织中乙酸盐的含量降低(图 5g)。此外,MDD患者的乙酸含量也显著低于HC(图 5h)。
为了进一步验证Blautia-乙酸轴的作用,他们使用进行了基因组分析来确定Blautia参与乙酸代谢的酶的变化。宏基因组数据表明,Blautia生成乙酸盐的主要通路:Wood-Ljundahl通路显著下调,表明乙酰-CoA能力下降(图5i-j)。几乎所有参与CO2固定(K00198, K15022)、甲酰四氢叶酸连接酶(K01491, K00297)和乙酰CoA合成酶(K01438)的关键基因都显著减少(图5k),证明慢性压力时乙酰CoA生物合成的减少。进一步的分析揭示了压力肿瘤小鼠中丙酮酸代谢的显著变化,包括磷酸酰化酶(K00625)和乙酸激酶(K00925)(图5k)。综上所述,这些研究证明,在慢性压力条件下,Blautia丰度的降低更有可能导致乙酸盐减少,Blautia-乙酸盐轴的破坏可能与慢性压力促进的乳腺癌病理进展有关。
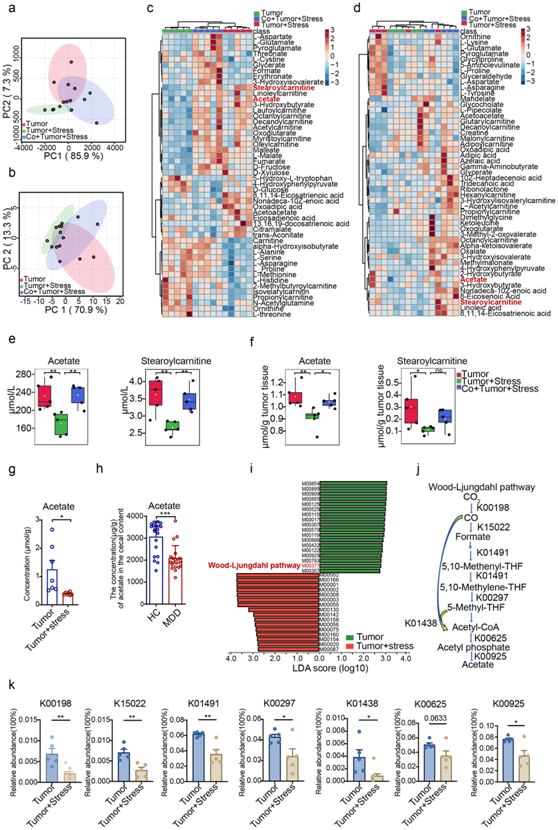
图5. 微生物代谢的代谢组学和宏基因组学分析。
(a-b) 在40天结束时,根据非压力、压力和共饲养压力肿瘤小鼠的血清和肿瘤代谢谱进行主成分分析(PCA)。(c-d) 热图显示三组之间血清和肿瘤组织的差异代谢谱。 (e-f) 小鼠血清和肿瘤组织中乙酸酯和硬脂酰肉碱的浓度。 (g) 肿瘤和压力(CUS)肿瘤小鼠肿瘤组织中乙酸酯的浓度。(h) MDD和HC患者粪便中乙酸盐的含量 。 (i) KEGG 模块中肿瘤组和压力肿瘤组之间的 LEfSe 分析。(j) Wood-Ljundahl 通路概述。(k) 与 Wood-Ljundahl 通路相关的 KO 相对丰度。
05
乙酸盐激活 CD8+ T 细胞并延缓慢性压力促进的乳腺癌进展
为了验证慢性压力下乙酸盐与乳腺癌进展之间的因果关系,他们进行了补充乙酸钠的实验(图 6a)。与氯化钠处理相比,乙酸钠处理显著抑制了压力肿瘤小鼠的肿瘤进展(图6b-c)。值得注意的是,在补充乙酸钠后,慢性压力肿瘤小鼠的瘤内 CD8+ T 细胞积累和 IFN-γ 产量显著增加(图6d-e)。有趣的是,乙酸钠处理并没有对非压力肿瘤小鼠的乳腺癌进展产生显著抑制作用(图 6b-c)。
为了研究 CD8+ T 细胞在压力肿瘤小鼠中乙酸钠介导的肿瘤延迟生长中的重要作用,他们使用 CD8 中和抗体来消除小鼠中的 CD8+ T 细胞,结果表明,CD8 + T 细胞的耗竭消除了乙酸钠的抗肿瘤作用(图 6 f-h),表明 CD8 + T 细胞在乙酸钠对压力肿瘤小鼠的肿瘤抑制中发挥着关键作用。
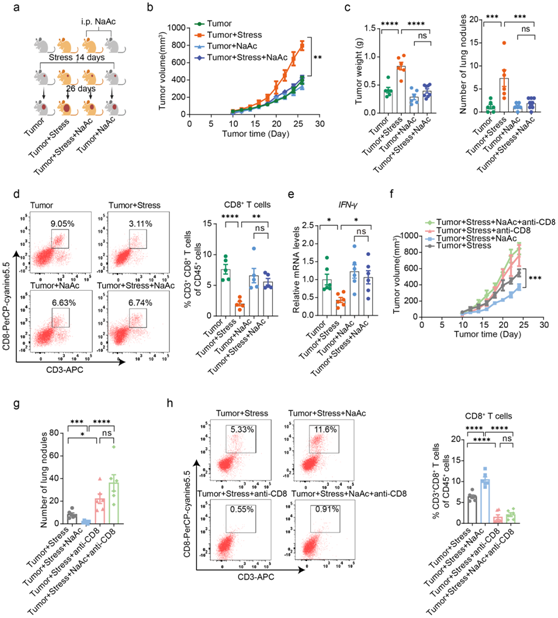
图6. 乙酸补充通过激活 CD8+ T 细胞来克服慢性压力促进的乳腺癌进展。
(a) 实验设计的示意图。(b) 小鼠肿瘤生长体积分析。(c) 小鼠肺部的肿瘤重量和肿瘤负荷。 (d) 小鼠体内经或不经 NaAc 处理的肿瘤浸润 CD8+ T 细胞。(e) 通过 qPCR 检测肿瘤浸润 CD8+ T 细胞中的 IFN-γ 表达。 (f-g) 补充 NaAc 后肿瘤小鼠的肿瘤生长体积和肿瘤负荷。 (h) NaAc 处理后小鼠肿瘤浸润 CD8+ T 细胞。
他们建立了CD8+ T细胞与4T1细胞共培养的细胞模型来研究乙酸钠的作用。有趣的是,与4T1细胞共培养的 CD8+ T细胞的细胞毒能力通过乙酸钠处理以剂量依赖性方式显著增强(图7a)。值得注意的是,乙酸钠处理以及丙酸钠和丁酸钠增加了与4T1 细胞共培养的 CD8+ T 细胞中的存活率和 IFN-γ 的产生(图7b-c)。
为了探索乙酸盐在共培养条件下如何影响 CD8+ T 细胞功能,他们对与经或不经乙酸钠处理的 4T1 细胞共培养的CD8 + T 细胞进行了 转录组分析(RNA-seq) 。在表达的29956个基因转录本中,只有1828个基因在组间存在显著差异,并且组间没有观察到显著的聚类(图 7d)。在mRNA水平上,他们观察到,在乙酸盐处理CD8+ T细胞中,Slc16a1(编码单羧酸转录蛋白)的表达增加(图7e-f)。
已有研究证明,乙酸盐可能以依赖于乙酰辅酶A合成酶(ACSS)和ATP柠檬酸裂解酶(ACLY)的方式增强IFN-γ的产生。在本项研究中,他们观察到乙酸盐处理的 CD8 + T 细胞中Acss1、Acss2和Acly的 mRNA 水平上调(图 7f)。
同位素示踪研究表明,乙酸盐有助于柠檬酸盐、氧化戊二酸盐、富马酸盐和苹果酸盐的产生(图 7g)。此外,外源性补充乙酸盐增加了CD8 + T细胞的细胞乙酰CoA含量(图 7h)。总之,这些数据表明,在 CD8+ T 细胞与癌细胞共培养的条件下,乙酸钠处理可能通过增加乙酰Co A 含量来增强 CD8+ T 细胞的活性,并随后增加 IFN-γ 的产生。
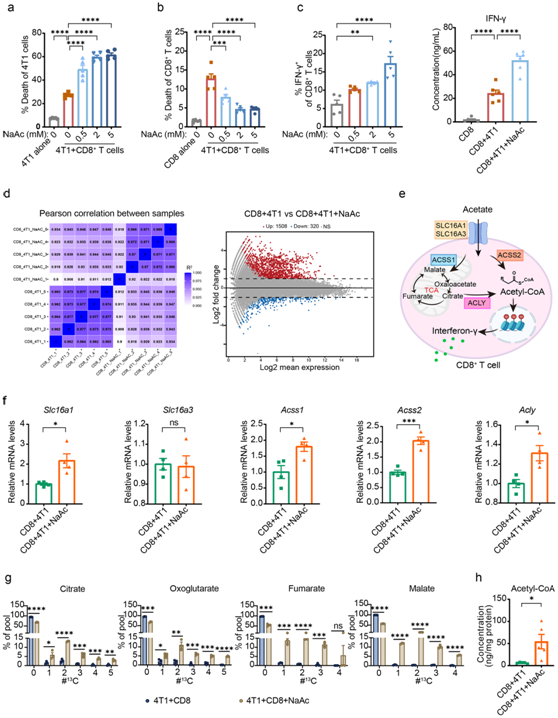
图7. 乙酸盐在与癌细胞共培养期间通过补充乙酰辅酶 A含量来增强 CD8+ T 细胞的活性。
(a) 4T1 细胞死亡的百分比。(b) CD8+ T 细胞死亡的百分比。 (c) 定量IFN-γ 丰度定量。(d) 对照和乙酸盐处理的 CD8+ T 细胞与 4T1 细胞共培养的转录组热图(左图)和 MA 曲线(右图)。(e) CD8+ T 细胞中乙酸盐摄取和代谢通路。 (f) 通过 qPCR 检测Slc16a1、Slc16a3、Acss1、Acss2和Acly的 mRNA表达。(g) 代谢同位素示踪分析。(h) 乙酰辅酶A 浓度分析。
06
乳腺癌患者的乙酸水平与 CD8+ T 细胞相关。
他们接下来将探究乳腺癌患者血清乙酸盐浓度、肿瘤浸润 CD8+ T 细胞和抑郁症之间的关系。与没有抑郁症的乳腺癌患者相比,患有抑郁症的乳腺癌患者血清乙酸盐水平较低(图 8a),肿瘤浸润CD8 + T细胞水平也较低(图 8b)。此外,乙酸盐水平与肿瘤浸润CD8+ T细胞之间存在正相关(图 8c),而抑郁症与乙酸盐水平呈负相关(图 8d)。与未患有抑郁症的乳腺癌患者相比,患有抑郁症的乳腺癌患者的无转移生存率显著较低(图 8e)。
这些结果表明,乳腺癌患者的抑郁症可能导致乙酸盐产生减少、CD8+ T 细胞浸润受损,并最终增加转移风险。
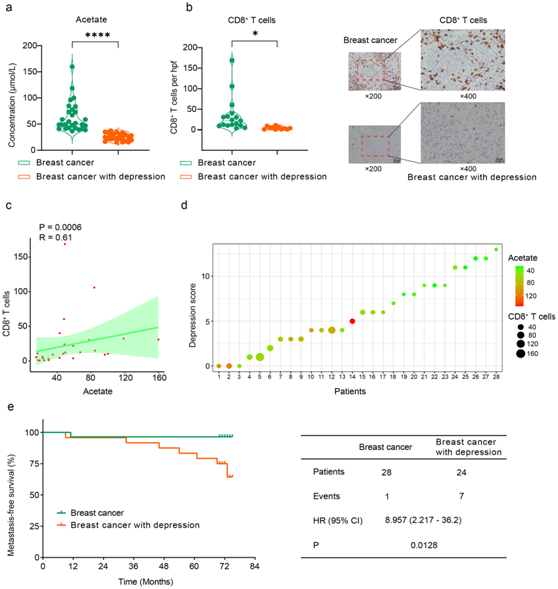
图8. 乳腺癌患者的乙酸水平与 CD8+ T 细胞相关。
(a) 患有和不患有抑郁症的乳腺癌患者的血清乙酸水平。(b) 免疫组织化学染色分析。(c) 血清乙酸盐水平与肿瘤浸润 CD8+ T 细胞计数之间的 Spearman 相关分析。(d) 乳腺癌患者血清乙酸水平、肿瘤浸润CD8+ T细胞计数与抑郁评分之间的关系。 (e) Kaplan-Meier 无转移生存曲线。
+ + + + + + + + + + +
结 论
本项研究探讨了微生物和代谢信号在慢性压力促进的乳腺癌进展中的潜在参与,揭示了Blautia及其代谢物乙酸盐丰度的减少可能有助于乳腺癌进展。Blautia和乙酸盐可增加 CD8+ T 细胞的抗肿瘤反应,并逆转雌性小鼠慢性压力引起的乳腺癌进展。抑郁症患者的Blautia和乙酸盐丰度较低,患有抑郁症的女性乳腺癌患者乙酸盐丰度较低,肿瘤浸润 CD8+ T 细胞数量减少,转移风险增加。这些结果表明,Blautia衍生的乙酸盐在调节乳腺癌免疫反应中发挥着至关重要的作用,其减少可能有助于慢性压力促进的癌症进展。本项研究结果揭示了抑郁症患者癌症中涉及的微生物和代谢信号之间的联系,并可能为患有乳腺癌和抑郁症的女性患者提供治疗选择。
+ + + + +



 English
English


