文献解读|Nat Cancer(23.5):微生物组失调、中性粒细胞募集和间皮细胞间质转化促进结直肠癌腹膜转移
✦ +
+
论文ID
原名:Microbiome dysbiosis, neutrophil recruitment and mesenchymal transition of mesothelial cells promotes peritoneal metastasis of colorectal cancer
译名:微生物组失调、中性粒细胞募集和间皮细胞间质转化促进结直肠癌腹膜转移
期刊:Nature Cancer
影响因子:23.5
发表时间:2025.02.18
DOI号:10.1038/s43018-025-00910-9
背 景
结直肠癌 (CRC) 死亡率高,一直是重大公共卫生问题。2020 年,全球约有 187 万例 CRC 确诊病例,其中 915880 例死亡。在新诊断的 CRC 患者中,20% 的患者出现转移性疾病,另有 25% 的患者最初诊断为局部性疾病,最终发展为远处转移。腹膜是CRC转移的常见部位,此外还有肝脏和肺部。在接受原发性CRC切除术的患者中,约5%的患者可确诊为同步性腹膜转移(PM);CRC-PM的预后通常较差,如果不治疗,中位生存期约为5个月,但其潜在机制尚不清楚。
实验设计
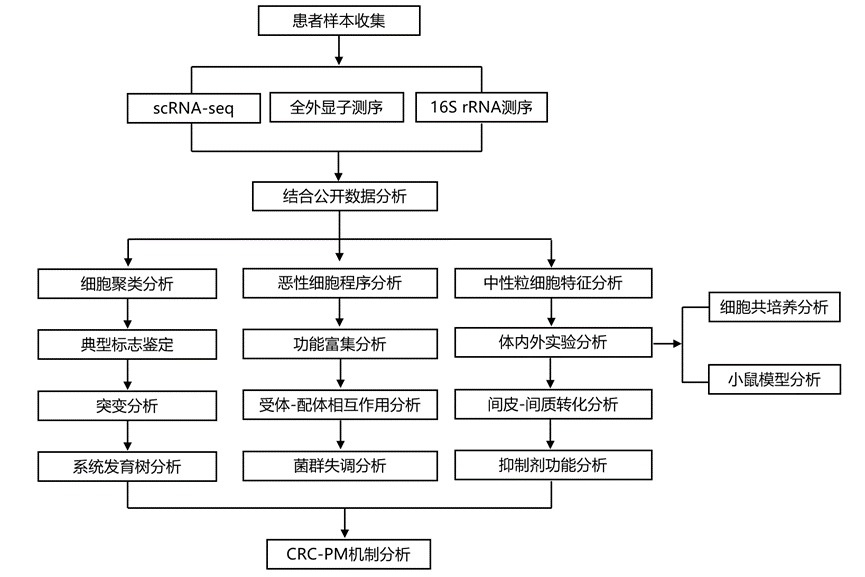
结 果
01
CRC 和 PM 的单细胞景观
研究团队建立了CRC-PM患者的配对队列,收集患者样本,生成了总共 48 个匹配样本的单细胞转录组分析(scRNA-seq)数据,包括 12 例未经治疗 的 CRC-PM 患者的原发性结直肠肿瘤( n = 12)、 邻近健康结肠组织 (n = 12)、PM (n = 12)、邻近健康腹膜组织 (n = 9)、肝转移( n = 2) 和邻近健康肝组织 (n = 1)(图1a)。他们将所有细胞分为八种主要细胞类型,包括上皮细胞(n = 67513)、T /自然杀伤(NK)淋巴细胞(n = 95509)、B 细胞(n = 16962)、浆细胞(n = 21131)、髓样细胞(n = 30038)、中性粒细胞(n = 32267)、肥大细胞(n = 6004)和基质细胞(n = 46645)(图1b)。他们根据典型标记基因的表达对这些聚类进行了注释(图1b)。
在免疫细胞中,T/NK 淋巴细胞根据典型标志进一步分为 12 个亚群(IEL_GDT、CD8_TEFF、CD8_Tcycling、CD8_TEX、CD8_TPEX、CD8_TRM、CD4_TH17、CD4_TREG、CD4_TNAIVE、CD4_TFH、NK 和 ILC),包括 5 个 CD8+ T 细胞亚群和 4 个 CD4 + T 细胞亚群。B 细胞和浆细胞聚类根据典型标志分为 4 个B 细胞亚群(GC_B、Follicular_B、Memory_B 和 Breg)和 5 个浆细胞亚群(IGHA_PC、IGHM_PC、IGHG4_PC、IGHG1G3_PC 和 IGHG2_PC)。根据差异基因表达,他们鉴定出8个中性粒细胞亚群(Neu-IL1B-1、Neu-IL1B-2、Neu-DUSP6、Neu-MMP9-1、Neu-MMP9-2、Neu-HSPA1A、Neu-ISG15-1和Neu-ISG15-2)和2个不同的肥大细胞亚群(Mast-NFKB1和Mast-EGR1)。根据典型标志,将髓系细胞分为11个亚群(巨噬细胞-FN1、巨噬细胞-IL1B、巨噬细胞-SELENOP、巨噬细胞-TREM2、单核细胞-CD14、单核细胞-CD16、月状细胞-FCN1、cDC1、cDC2、cDC-Mature和pDC),其中包括4个巨噬细胞亚群和4个树突状细胞(DC)亚群(图1b)。值得注意的是,两种巨噬细胞亚群巨噬细胞-IL1B 和巨噬细胞-TREM2 表现出类似于先前报道的 CRC 中巨噬细胞二分状态的特征。此外,他们还鉴定出一种与 PM 相关的独特巨噬细胞亚群,其特征是FN1高表达和转化生长因子 (TGF)-β 信号富集,表明其可能参与纤维化。此外,巨噬细胞-FN1 同时表现出巨噬细胞-IL1B 和巨噬细胞-TREM2 表型的特征,RNA 速度分析表明其与巨噬细胞-IL1B 有区别。在 PM 组织切片的多重免疫组织化学 (mIHC) 染色中也验证了该巨噬细胞群巨噬细胞-FN1 的存在。
在基质细胞聚类中,细胞可分成14个亚群(周细胞-RGS5、SMC-DES、SMC-RERGL、成纤维细胞-INHBA、成纤维细胞-ACTA2、成纤维细胞-APOE、成纤维细胞-BMP4、Endo-S100A8、Endo-SELP、Endo-DLL4、Endo-LYVE1、MSC/ASC-NT5E、间皮-MSLN和雪旺细胞-S100B),包括内皮细胞、周细胞、平滑肌细胞(SMC)和雪旺细胞。除了在其他 CRC scRNA-seq 数据集中发现的这些亚群之外,他们还发现了间充质干细胞 (MSC) 或脂肪干细胞 (ASC)(标记为NT5E)和腹膜特异性间皮细胞(MSLN和CALB2)(图1b)。与既往研究一致,健康肠道上皮细胞的亚聚类分析揭示了不同的分化状态,例如结肠细胞、肠内分泌细胞 (EEC)、杯状细胞和簇状细胞(图1b)。对于肿瘤样本中的上皮细胞,他们保留了大多数推断出存在大规模染色体拷贝数变异 (CNV) 的细胞,并将其归类为恶性细胞。正常上皮细胞按细胞亚群聚类,而恶性细胞通常按患者个体分组(图1b)。
为了全面描述CRC-PM中TME的重塑,他们比较了多个组之间的细胞比例变化。首先,直接比较了腹膜中PM微环境与结肠中原发性肿瘤微环境的差异。在主要细胞聚类水平上,与CRC相比,PM在基质细胞中富集,而肥大细胞和中性粒细胞则减少。在亚聚类水平上,与CRC相比,PM在cDC2、成纤维细胞-ACTA2、成纤维细胞-APOE和间皮细胞-MSLN中富集,而Neu-IL1B-1、Neu-DUSP6、Mast-EGR1、Mast-NFKB1、周细胞-RGS5、SMC-DES、成纤维细胞-BMP4和雪旺细胞-S100B则减少。 mIHC定量分析为这些细胞比例差异提供了佐证。同时,他们还比较了健康结肠和健康腹膜之间的固有差异(图1c)。
其次,他们比较了CRC肿瘤微环境相对于健康结肠的重塑,以及PM相对于健康腹膜的重塑(图1c)。他们鉴定了肿瘤微环境中结肠或腹膜特有的重塑事件。在结肠中,CRC特异性地富集了CD8_TEFF、CD8_Tcycling、Neu-IL1B-1、Neu-IL1B-2、Neu-DUSP6、Neu-MMP9-1、Neu-MMP9-2、Neu-HSPA1A、Neu-ISG15-1和pDC,而缺乏与健康结肠相关的IEL_GDT、CD4_TFH、Follicular_B、IGHA_PC和IGHM_PC。在腹膜中,PM 特异性地富集了 CD8_TPEX、巨噬细胞-SELENOP、周细胞-RGS5、成纤维细胞-ACTA2 和 Endo-DLL4,并且耗尽了与健康腹膜相关的 Neu-MMP92、Neu-HSPA1A、Neu-ISG15-2、Mono-CD14 和 MSCs/ASCs-NT5E(图1c)。
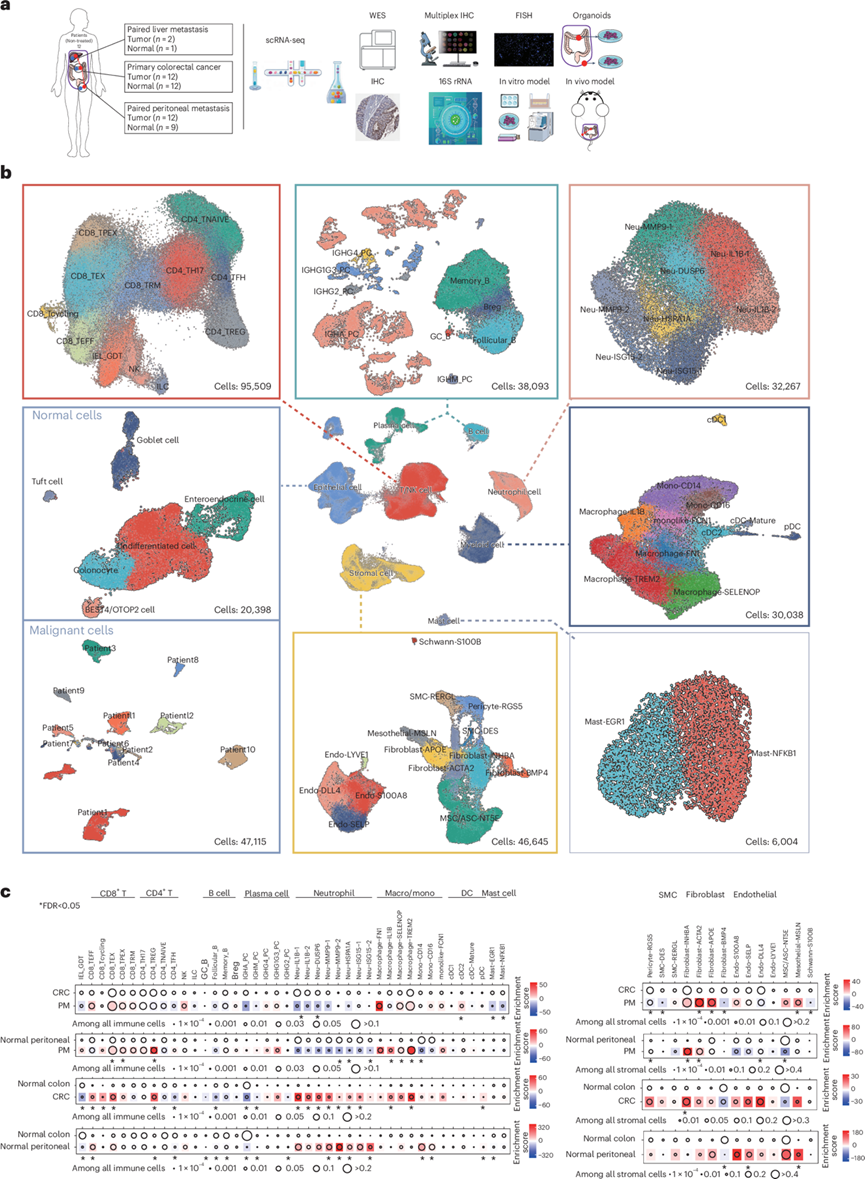
图1. 研究设计、单细胞图谱以及免疫和基质细胞亚聚类的组成变化。
(a) 研究设计说明了样本的收集和所使用的验证方法。(b) 按主要细胞聚类和亚聚类对 316069 个细胞进行均匀流形近似和投影 (UMAP)。(c) PM相对于原发性 CRC(上)、PM 相对于健康腹膜组织(第二幅图)、CRC 相对于健康结肠组织(第三幅图)和健康腹膜组织相对于健康结肠组织(下)的免疫和基质细胞亚聚类的组成变化。
02
三个恶性程序在不同患者之间共存
他们重点关注上皮细胞,并从11例患者中获取了这些肿瘤的全外显子组测序 (WES) 数据,揭示了各种假定的驱动突变(图S2a)。为了描述每位患者中CRC和PM之间的关系,基于从WES和scRNA-seq数据推断出的突变和CNV构建了系统发育树(图S2b,c)。高比例的共同突变的存在表明CRC的腹膜和肝脏转移播散相对较晚(图S2c)。
为了表征肿瘤转移中的转录组变化,他们采用了成对比较策略,以消除由个体异质性和患者间细胞数量差异引起的分析偏差。他们鉴定了每个个体中恶性PM细胞和恶性CRC细胞之间的差异表达基因。随后,总结了所有个体间共有的差异,并使用卡方检验评估其显著性,并通过哑铃图呈现最显著的发现(图2a)。在大多数个体中,CRC 表现出比 PM 更强烈的炎症特征,这可以通过NFKBIA和CXCL2的表达来证明(图2a),而与 CRC 相反,在大多数个体中,PM 类似于间充质状态的细胞,这可以通过COL3A1、COL1A1、COL1A2和SPP1等基因的更高表达来反映(图2a)。
为了进一步阐明驱动患者 PM 的共有生物程序,他们使用共识非负矩阵分解 (cNMF) 推断了不同肿瘤恶性细胞中的复发表达程序。他们分析了来自多名患者的细胞之间共有的 42 个恶性细胞程序,并根据其前 50 个加权基因对每个程序进行了注释(图2b),确定了两个与细胞周期相关的程序、12 个反映患者或肿瘤异质性的程序和四个反映谱系(结肠细胞、EEC 杯状细胞和簇状细胞)的程序(图2c)。对来自两个外部单细胞数据集的正常上皮细胞和上皮细胞的评分证实了四个谱系程序的代表性(图2c)。在通过成对比较分析的42个程序中,有三个程序尤为突出,其中两个程序(程序11和程序13)在12例患者中的9例中,CRC的表达显著高于PM。第三个程序(程序22)在12例患者中的9例中,PM的表达显著高于CRC(图2d)。每个样本的程序平均得分的成对比较与此结果一致(图2e)。
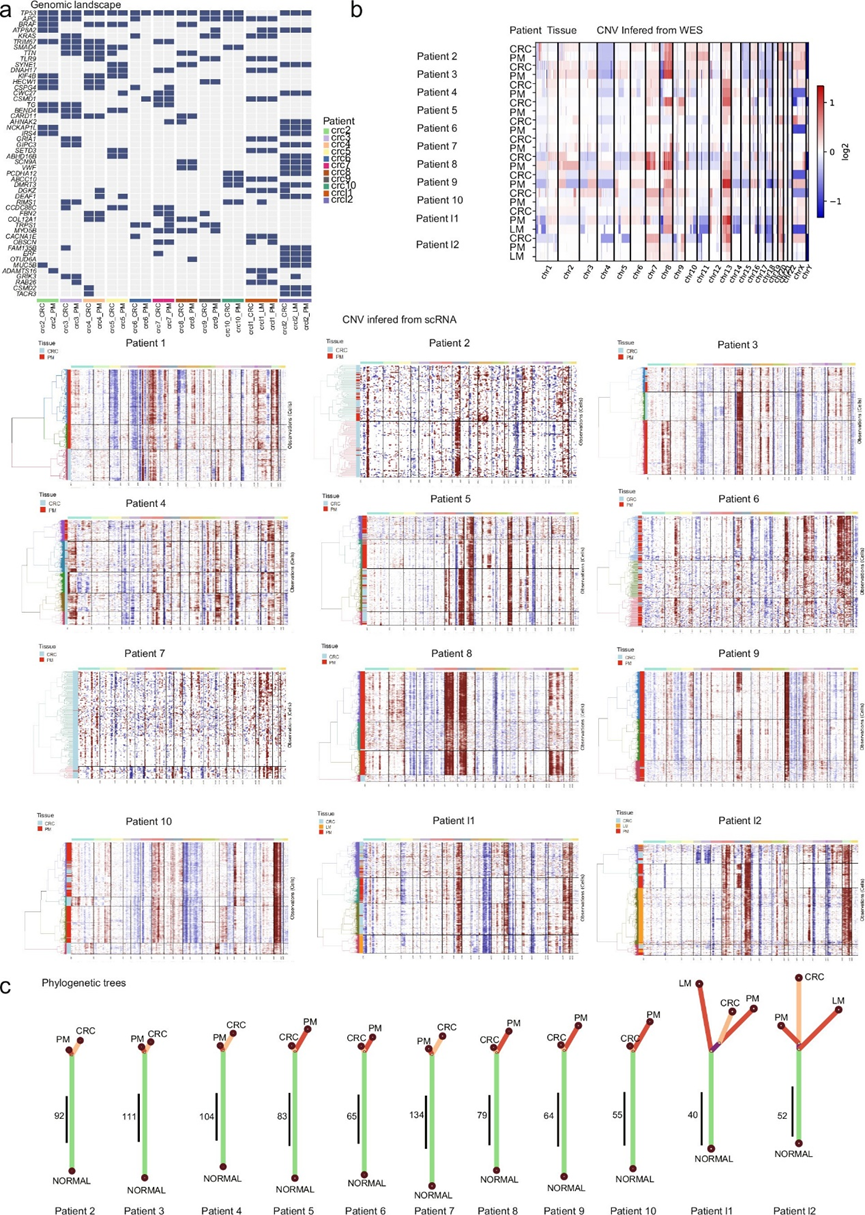
图S2. 恶性细胞的全外显子测序和CNV亚克隆分析。
(a) 11 位患者的 24 个样本的基因组景观。(b) 从患者 DNA 全外显子组测序(上)和 scRNA-seq(下)推断出的 CNV 谱。(c) 根据在每个患者身上观察到的突变构建系统发育树。
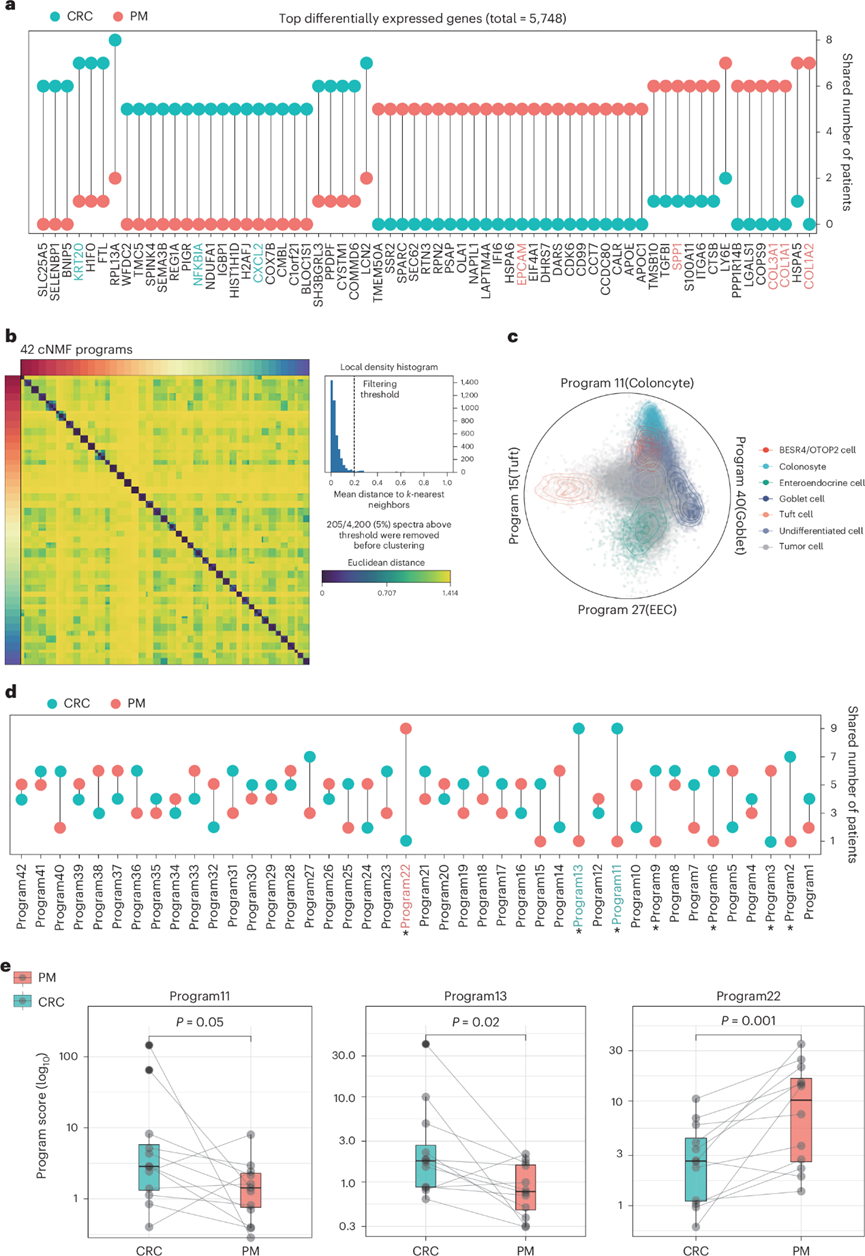
图2. 腹膜转移瘤和结直肠癌中癌细胞的转录组差异。
(a) 哑铃图显示了具有差异表达基因的患者数量。(b) cNMF 从恶性细胞中识别出 42 个程序。(c) Radviz可视化正常上皮细胞和恶性细胞子集中四个程序的表达分数。(d) 哑铃图说明共有差异程序的患者数量。(e) CRC 细胞和 PM 肿瘤细胞中三个程序的平均值的配对比较。
03
CRC 中的中性粒细胞富集与菌群失调有关
程序 13 基因集包括中性粒细胞募集因子CXCL2,并富含与炎症反应相关的功能(图3a)。与 PM 微环境相比,他们始终观察到 CRC 微环境中中性粒细胞显著富集。值得注意的是,他们观察到两种免疫微环境中中性粒细胞重塑。与健康结肠组织相比,中性粒细胞在 CRC 微环境中显著富集;然而,与健康腹膜组织相比,中性粒细胞在 PM 微环境中显著减少。这些结果通过免疫组织化学 (IHC) 定量得到证实(图3b)。
他们首先试图了解中性粒细胞在CRC微环境中的富集情况,基于受体-配体相互作用推断了相互作用网络,以探究CRC中中性粒细胞募集的起源。与健康结肠组织相比,CRC中的上皮细胞、内皮细胞、成纤维细胞、Mono/Macro细胞和MSC/ASC经常表达趋化因子(CXCL1 / 2 / 3 / 6 / 8)来募集CXCR2 / 4 +中性粒细胞(图3c)。NLRP3是一种众所周知的感知细菌病原体的模式识别受体,它在 CRC 微环境中的中性粒细胞中的活性显著升高,这使他们假设 CRC 中中性粒细胞的富集可能与对细菌感染的自然免疫反应有关(图3d)。
通过对细菌 16S rRNA 进行靶向荧光原位杂交 (FISH) 成像,直观地证实了与健康结肠组织相比,CRC 中存在大量浸润性细菌(图3e)。为了进一步研究肿瘤内微生物群,他们在正交 CRC 患者队列中进行了 16S rRNA 基因测序。与最近的报道一致,发现梭杆菌属和拟杆菌属是 CRC 19中最主要的属。同时,在前十个属中,与配对的非肿瘤组织相比,CRC 中的梭杆菌属显著增加,而两个瘤胃球菌属显著减少。
此外,本研究的单细胞景观揭示了两种重要的粘膜免疫成分IGHA浆细胞和IEL_GDT的显著消耗(图3f)。长期以来,黏膜免疫与肠道微生物群的稳态密切相关,对CRC的多项研究已经注意到它们的失调。为了验证这些发现,他们整合了两个外部scRNA-seq数据集确认了观察到的消耗,并在CRC中进行了多重免疫荧光(IF)染色分析(图3f)。多重免疫组织化学成像显示,IgA+ CD138 + IGHA浆 细胞和CD3 + CD160 + IEL_GDT细胞群迅速减少。在正交队列中,他们使用 mIHC 定量来验证中性粒细胞募集与粘膜免疫崩溃以及细菌侵袭之间的相关性。基于这些发现,他们推断,CRC 肿瘤发生过程中粘膜免疫的重塑和肠道细菌的失调促进了相互作用,从而导致了抗菌中性粒细胞的募集。
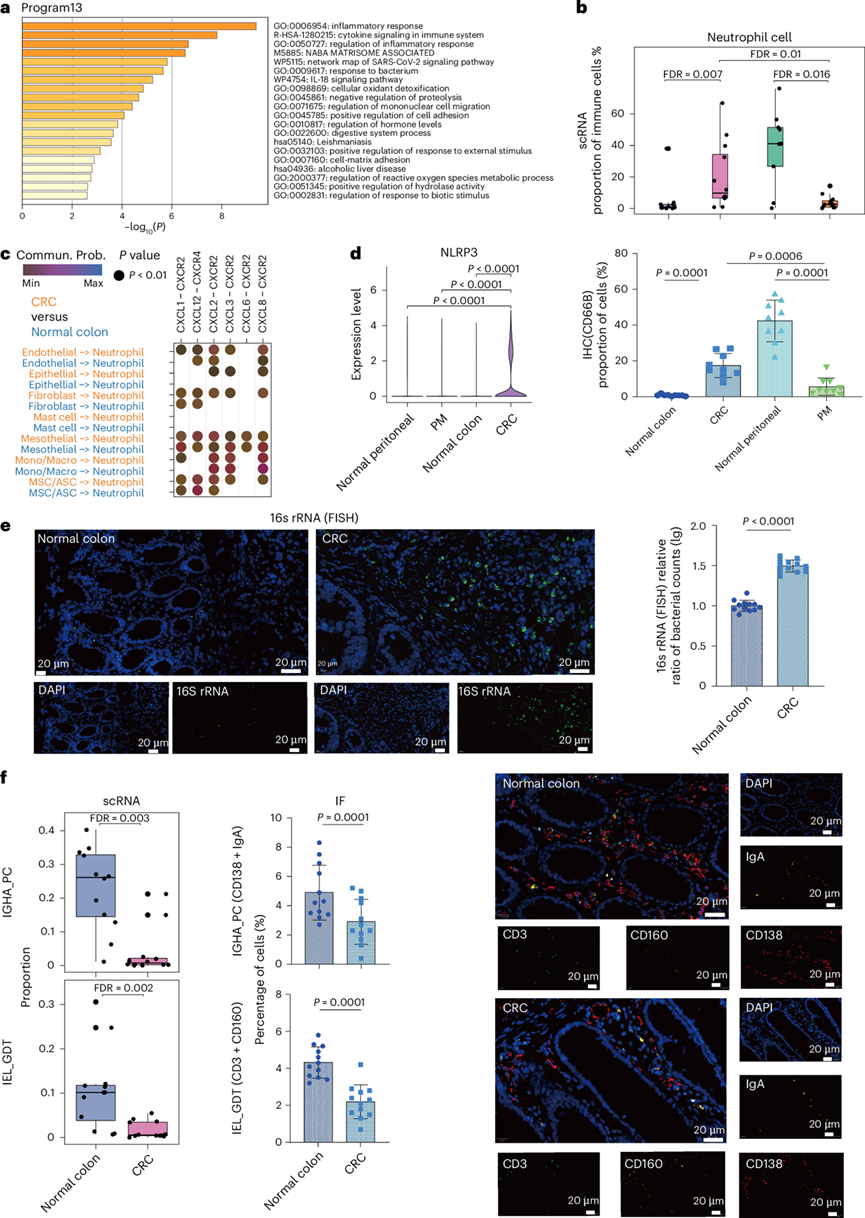
图3. CRC 中中性粒细胞的富集与菌群失调有关。
(a) 功能富集分析。(b) scRNA-seq 数据集内不同组织中中性粒细胞的比例(上)。通过 IHC 检测不同组织中中性粒细胞(CD66B+)的比例(下)。(c) 与健康结肠组织相比,CRC 中中性粒细胞与其他细胞之间选定的配体-受体相互作用。(d) 小提琴图显示NLRP3在不同组织中的中性粒细胞中的表达。(e) 16S rRNA FISH 图像显示健康结肠(作为对照)和 CRC 样本(n = 12 个实验的代表性图像)中细菌群落的空间分布和相对比例定量 。(f)细胞比例分析。
04
PM 中的中性粒细胞耗竭是由于 CXCL14 的缺失
在研究细胞因子基因表达的过程中,他们重点关注了孤儿配体CXCL14(图4a)。与 PM 相比,CXCL14优先在健康腹膜组织中表达,主要在富集的聚类 MSC/ASC中(图4b)。CXCL14是中性粒细胞的强效诱导因子,但是其受体尚未阐明。因此,他们假设 MSC/ASC 聚类高表达CXCL14以募集中性粒细胞至健康腹膜组织,并且这种微环境在转移性癌细胞定植后会发生重塑。
为了验证这一假设,他们在PM样本中对中性粒细胞(CD66B)和MSC/ASC(NT5E)标志物以及CXCL14进行了染色。基于图像的定量分析显示,与PM相比,健康腹膜组织中表达CXCL14的MSC/ASC显著聚集(图4c)。正如预期的那样,中性粒细胞与表达CXCL14的MSC/ASC非常接近(图4c)。为了进一步验证CXCL14对中性粒细胞的趋化活性,他们进行了趋化性试验。添加CXCL14的培养基对中性粒细胞有明显的吸引作用,而对照培养基则没有明显的趋化活性。综上所述,这些结果揭示了程序13在CRC和PM恶性细胞中的差异表达,这与中性粒细胞的分布有关。CRC中中性粒细胞的富集可归因于失调菌浸润引发的炎症反应。另一方面,在健康的腹膜组织中,中性粒细胞由表达CXCL14的MSC/ASC募集。
他们进一步研究了中性粒细胞分布重塑如何影响肿瘤发展。在本研究的scRNA-seq 数据集中,他们鉴定出 8 个表现出明显组织特异性偏好的中性粒细胞亚群(图4d)。基因集变异分析 (GSVA) 和差异表达基因 (DEG) 分析显示,CRC 主要富集于炎症相关的中性粒细胞亚群 Neu-IL1B-2,该亚群表现出趋化因子CCL3和CCL4以及经典促炎因子IL1B的高表达水平(图1c)。相比之下,健康腹膜组织主要富集于与免疫系统激活、TRAIL 信号传导和吞噬途径相关的亚群。这些亚群包括 Neu-MMP9-2,其显示出典型中性粒细胞标志物MMP9的高表达,以及 Neu-ISG15-2,其显示出一组干扰素 (IFN) 刺激因子(ISG15、IFIT2和IFIT3)的高表达(图1c)。此外,这两个亚群表现出已确定的中性粒细胞成熟标志物 (CXCR2、MME和FCGR3B)的高表达水平和CXCL8的下调。他们根据组织类型对中性粒细胞进行分类,以比较它们在不同组织中的功能。CRC 中的中性粒细胞特别富集在与细菌反应和经典炎症IL4和IL13信号传导相关的途径中。相比之下,健康腹膜组织中的中性粒细胞特别富集在与 IFN 信号传导和免疫系统相关的通路中。
根据中性粒细胞的功能和组织特异性富集,他们假设在CRC中富集的中性粒细胞具有促肿瘤表型,而相对于健康腹膜组织,在PM中缺乏的中性粒细胞具有抗肿瘤表型。为了进一步探究中性粒细胞的异质性,他们评估了上游转录因子 (TF) 的激活情况。正如预期,健康腹膜组织和CRC之间的TF激活存在显著差异。值得注意的是,NFKB1是CRC中中性粒细胞中最显著上调的TF,而STAT4是健康腹膜组织中中性粒细胞中最显著上调的TF(图4e)。NFKB1通过调控包括CCL3、CCL4和IL1B在内的一系列基因来协调炎症反应。而STAT4则倾向于通过调控细胞毒性相关基因(如IFNG和PRF1)来调节免疫反应。
他们通过对中性粒细胞样 dHL-60 细胞和人源性中性粒细胞进行体外和体内实验,旨在研究NFKB1和STAT4分别对中性粒细胞的促肿瘤和抗肿瘤功能的影响。他们观察到与NFKB1过表达的dHL-60细胞共培养的两种CRC细胞系的增殖和迁移能力显著增强,而与STAT4过表达的dHL-60细胞共培养时增殖和迁移能力显著降低(图4f)。Luminex检测结果表明,STAT4过表达的dHL-60细胞通过表达高水平的IFNγ和肿瘤坏死因子(TNF)等细胞毒因子表现出杀伤肿瘤的能力,而NFKB1过表达的dHL-60细胞则显著抑制了相关细胞毒细胞因子的表达,从而降低了对癌细胞的毒性,这表明了两种中性粒细胞亚型分别独立地表现出促肿瘤和抗肿瘤功能的潜在机制。
通过将健康人群来源的中性粒细胞与肿瘤细胞共培养获得了一致的结果,其中NFKB1和STAT4的过表达分别表现出不同的促肿瘤和抗肿瘤功能(图4g)。然后,他们从患者来源的中性粒细胞中分选出NFKB1激活亚群和STAT4激活亚群。由于NFKB1和STAT4均不在细胞膜上表达,他们选择了在这两个中性粒细胞亚群中具有高表达特异性的两个膜蛋白:NLRP3(针对NFKB1激活的中性粒细胞)和TNFSF10 (针对STAT4激活的中性粒细胞)。通过流式细胞分析,他们富集了NLRP3 + TNFSF10 −中性粒细胞和TNFSF10 + NLRP3 −中性粒细胞,它们代表了单细胞分析中鉴定出的两种不同的中性粒细胞表型(图4h)。他们通过qPCR验证了TF的差异活性。同样,他们通过与两种CRC细胞系共培养,证实了上述分选的中性粒细胞亚型的促肿瘤和抗肿瘤功能。最后,他们使用体内CRC小鼠模型进行了功能性实验。他们利用RKO细胞系,将NOD-scid小鼠皮下移植肿瘤(图4i)。注射NLRP3+ TNFSF10 -中性粒细胞的小鼠的肿瘤大小与对照组相比显著增大,而注射TNFSF10 + NLRP3-中性粒细胞的小鼠的肿瘤大小与对照组相比显著减小(图4i),这有力地证明了两种中性粒细胞亚群的抗肿瘤和促肿瘤表型。
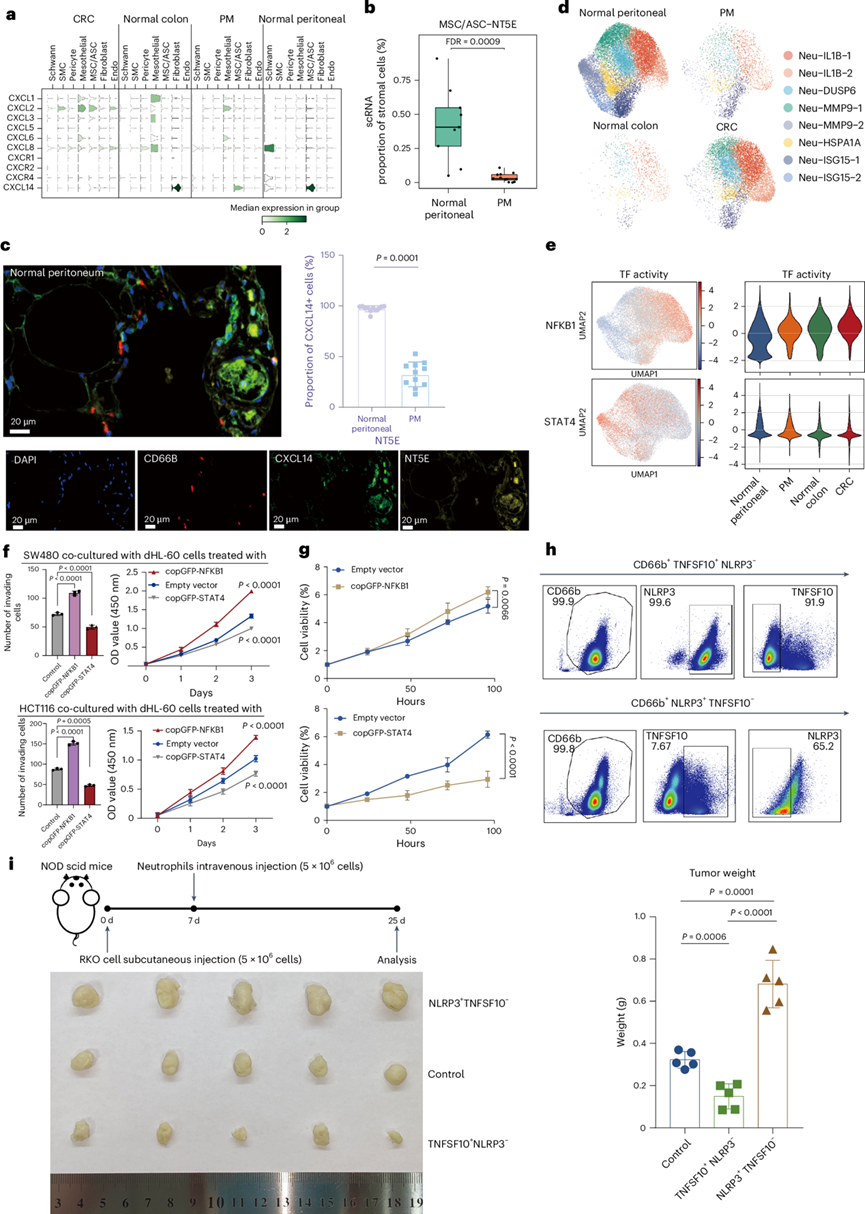
图4. PM 中中性粒细胞的减少归因于 CXCL14 表达的丧失和中性粒细胞的多样性。
(a) 不同组织中基本基质细胞类型中趋化因子和受体的表达。(b) scRNA-seq 数据集中健康腹膜组织与 PM 中 MSC/ASC-NT5E 的比例。(c) 通过 mIHC 检测健康腹膜组织与 PM 中NT5E+ MSC/ASC 中CXCL14+ MSC /ASC的比例(左)。健康腹膜组织中中性粒细胞 (CD66B)、MSC/ASC (NT5E) 和 CXCL14+细胞的染色代表性图像(右)。(d) UMAP 和小提琴图组合,显示中性粒细胞中 NFKB1 和 STAT4 的转录因子活性。(e) UMAP 和小提琴图组合(小提琴图根据组织类型着色,y轴表示 TF 活性评分),显示中性粒细胞中 NFKB1 和 STAT4 的转录因子活性。(f) SW480 细胞(上)和 HCT116 细胞(下)与对照 dHL-60 细胞、NFKB1 过表达 dHL-60 细胞和 STAT4 过表达 dHL-60 细胞共培养 3 天后的迁移和增殖。(g) HCT116细胞与对照组(健康人来源的中性粒细胞)、NFKB1过表达的健康人来源的中性粒细胞以及STAT4过表达的健康人来源的中性粒细胞共培养3天后的细胞活力。(h) 中性粒细胞的流式细胞分选。(i)小鼠肿瘤代表性照片和重量分析。
05
PM中的偶联间充质转化
随后,他们重点研究了程序22,与CRC相比,该程序在PM恶性细胞中高度上调。该程序经鉴定为一个间充质程序,富含参与基质体和细胞外基质组织的通路和基因,包括COL1A1、COL3A1和EFEMP1(图5a)。结合程序11(在PM中下调的结肠细胞程序), PM中的恶性细胞已描述为缺乏结肠细胞特征并经历上皮-间充质转化(EMT),这导致其形态有利于从上皮层分离并随后迁移。
基于程序 22 的基质组织功能,他们提出恶性细胞的改变可能与基质细胞的重塑有关。与 CRC 微环境相比,他们观察到 PM 微环境中成纤维细胞的一致富集(图5b)。此外,通讯信号的比较分析表明,与健康腹膜组织相比,间皮细胞在 PM 中经历了最明显的变化,特别是在间质相关的信号通路中,例如胶原蛋白、FN1和SPP1(图5c)。进一步分析显示,与健康腹膜组织相比,PM 中间皮细胞和恶性细胞之间的细胞通讯增强(图5d)。
另一方面,与健康腹膜组织相比,PM 微环境中成纤维细胞的比例也显著增加(图5e)。值得注意的是,他们发现间皮细胞标志物MSLN在 PM 内的成纤维细胞中广泛表达,而健康腹膜组织中的间皮细胞则严格表达(图5e)。这些发现促使他们研究间皮细胞是否经历类似于 EMT 的独特细胞转变形式,称为间皮-间质转变 (MMT),从而导致成纤维细胞的生成。
为了进一步验证他们的假设,他们构建了一个命运图,推断成纤维细胞的可能起源,在均匀流形近似和投影 (UMAP) 嵌入中的马尔可夫链上生成随机游动,指定间皮细胞、周细胞、MSC/ASC 和 SMC 作为起点,成纤维细胞作为终点(图5f)。根据他们的假设,PM 中的大部分成纤维细胞源自间皮细胞,而健康腹膜组织中的成纤维细胞源自 MSC/ASC。此外,mIHC 提供的证据表明,间皮细胞标志物MSLN和成纤维细胞标志物 αSMA 仅在 PM 中共表达,与健康腹膜相比,在 PM 相关间皮细胞中观察到显著的形态变化和去极化。
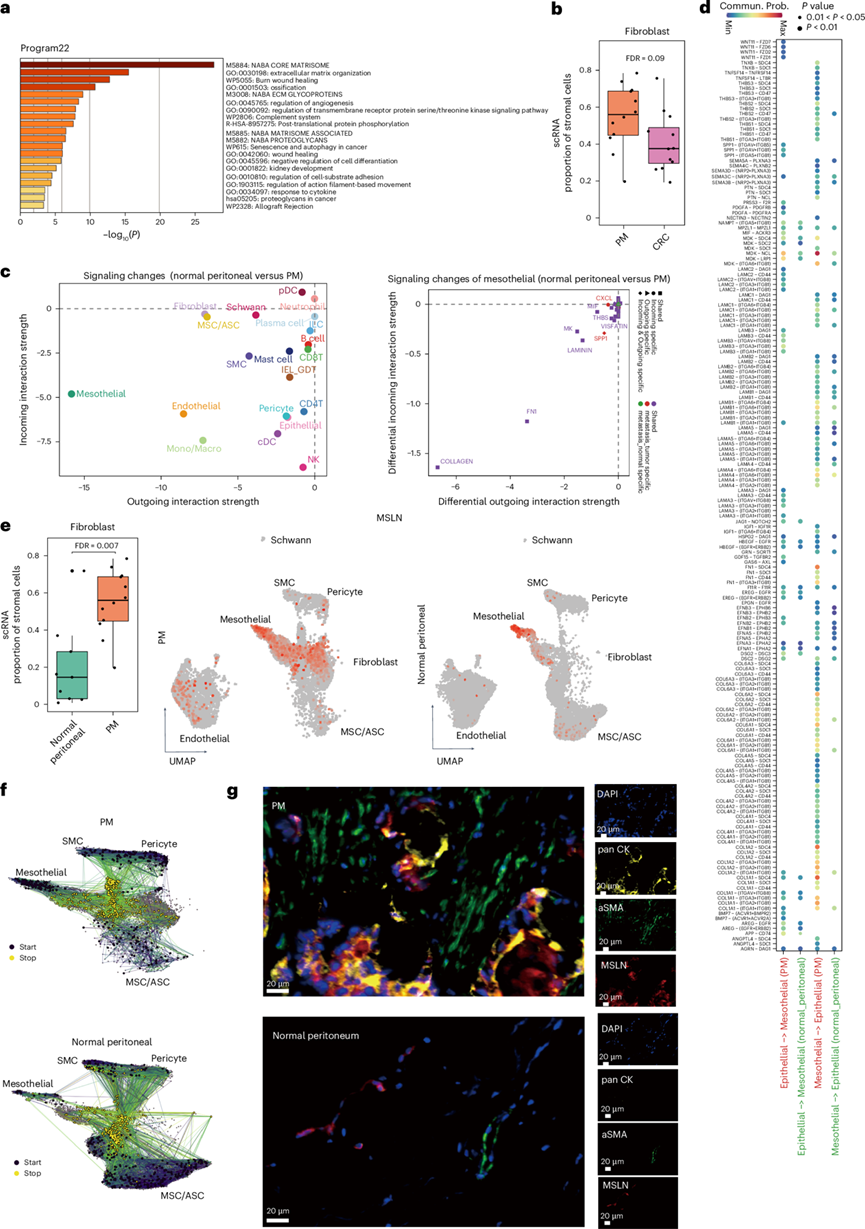
图5. 间皮-间质转化。(a)进行功能富集。
(b) scRNA-seq 数据集中PM中成纤维细胞的比例与 CRC 相比。(c) 使用 CellChat 比较健康腹膜组织与 PM 中基本细胞类型的信号变化。(d) 点图描绘了 PM 与健康腹膜组织中间皮细胞和上皮细胞之间选定的配体-受体相互作用。(e) scRNA-seq 数据集中 PM 与 CRC 中成纤维细胞的比例(左)。PM和健康腹膜组织内基质细胞中MSLN的表达(右)。(f)UMAP可视化。(g) 通过 mIHC 检测 PM(上)和健康腹膜组织(下)中成纤维细胞 (αSMA)、间皮细胞 (MSLN) 和恶性细胞 (pan-CK) 的空间分布。
06
CRC 的 PM 可由抗间皮素抗体抑制
对间皮细胞中 DEG 表达、TF 激活和通路富集的进一步分析支持了他们的假设。具体而言,包括胶原蛋白家族和 FN1 在内的间充质相关基因在PM内的间皮细胞中表现出优先表达(图6a)。PM 中ATF2的激活与 ERK-AP-1 信号通路有关,该通路与调节细胞扩增有关。此外, PM 中高度激活的 YAP-MAL 信号通路相关 TF,例如SRF、SMAD3和ELK4可能调节细胞拉伸(图6b)。这两种机制可能有助于 MMT 期间发生的形态变化。此外,GSVA 表明与健康腹膜组织相比,PM 中胶原蛋白和 ECM 相关通路优先富集(图6c)。
此外,他们用绿色荧光蛋白 (GFP) 标记 MET-5A 细胞,用红色荧光探针染色 RKO 细胞。与对照组相比,CRC-PDO 组和 PM-PDO 组的 MET-5A 细胞形态均向间质化转变。此外,共培养 30 分钟后,他们观察到 RKO 细胞与 PM-PDO 组的 MET-5A 细胞直接相互作用后粘附更紧密。这表明间皮细胞经历了 MMT(图5g)。同时,上皮细胞(pan-CK)与间皮细胞(MSLN)的紧密接近表明它们之间存在直接相互作用。这些发现也解释了 PM 中中性粒细胞减少的根本原因,这可以归因于 PM 微环境中源自间皮细胞的成纤维细胞对 MSC/ASC的取代。
为了研究癌症和间皮细胞之间间质转化的相互诱导,他们使用人类 CRC 细胞系 (RKO) 和永生化人类间皮细胞系 (MET-5A) 进行了共培养实验。共培养 48 小时后,他们观察到 RKO 和 MET-5A 细胞中上皮标志物 E-钙粘蛋白的蛋白质水平降低,间质相关蛋白(N-钙粘蛋白和波形蛋白)的蛋白质水平升高。此外,与单独培养的两种细胞系相比,共培养的细胞表现出增强的侵袭性(图6d-e)。此外,他们分别进行了使用原代 CRC 类器官(CRC-PDO 组)和 PM 类器官(PM-PDO 组)的培养基培养 MET-5A 的实验(图6f)。在CRC类器官和PM类器官的培养基中培养48小时后,他们使用共培养后的MET-5A进行了Transwell实验。与在对照培养基中培养的MET-5A相比,在与两种类器官的培养基共培养后,MET-5A均表现出显著的迁移能力,且PM-PDO组的迁移能力有优于CRC-PDO组的趋势(图6g)。他们将MET-5A细胞与RKO细胞共培养,并用抗MSLN抗体处理48小时,结果显示,抗MSLN抗体处理显著抑制了细胞的侵袭、相互作用及形态学改变(图6g)。
这些观察结果通过体内 PM 模型得到了进一步证实。在腹膜内注射模型中,肿瘤细胞注射 3 周后用抗 MSLN 治疗导致腹腔内生物发光信号显著减弱。在另一种原位注射模型中,抗 MSLN 治疗导致腹膜和结肠重量显著减轻。此外,与同型对照相比,抗 MSLN 治疗后 PM 中的肿瘤几乎无法检测到(图6h-j)。此外,他们在体内 PM 模型中使用 MSLN 敲除 CRC 细胞系(MSLN-KO MC38 细胞)进行了抗 MSLN 治疗,以验证抗 MSLN 药物不仅靶向原发癌细胞,还通过对腹膜间皮细胞发挥作用来抑制 CRC-PM。这些数据表明,针对 MSLN 可能成为抑制 CRC 中 PM 的一种有前景的治疗策略。
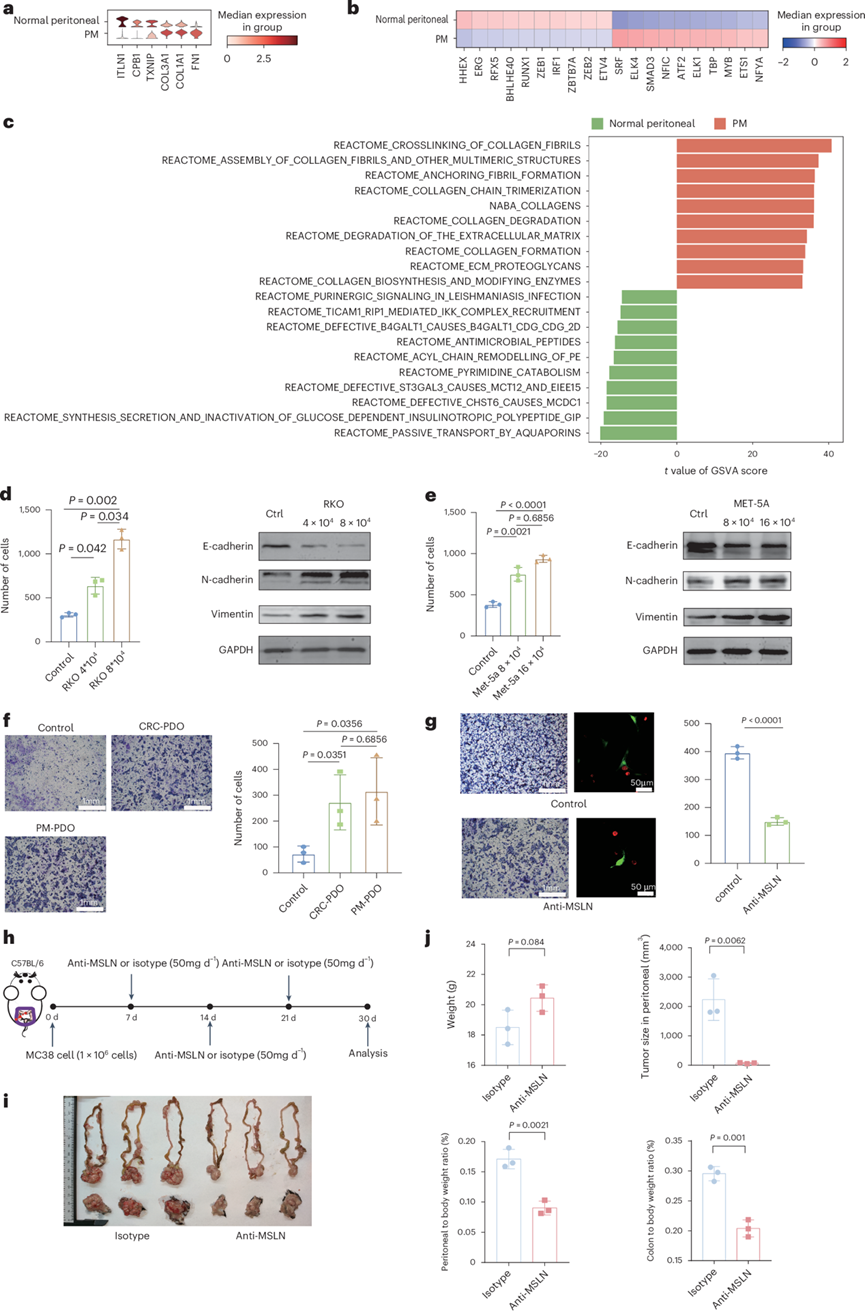
图7. 抗MSLN治疗策略抑制结直肠癌腹膜转移。
(a) 健康腹膜组织和PM内间皮细胞中选定基因的表达水平。(b) 健康腹膜组织和PM内间皮细胞中活性排名前十的TF。(c) PM和健康腹膜组织内间皮细胞中选定的通路活性。(d-e)免疫印迹分析。(f) 对照组和CRC-PDO组以及PM-PDO组MET-5A细胞的迁移能力。(g) 对照组和抗MSLN组MET-5A细胞的迁移能力(左),条形图显示迁移试验后的MET-5A细胞数量(右)。(h) 抗 MSLN 治疗流程示意图。(i-j) 抗 MSLN 组和对照组结肠和腹膜组织的代表性照片。
+ + + + + + + + + + +
结 论
本研究探究了CRC、PM 及其邻近组织的转录谱,揭示了促进 PM 的关键因子。对来自 12 例患者的 48 个匹配样本进行单细胞分析显示,恶性细胞和肿瘤微环境的重塑促进了 CRC 的进展和转移。多重成像证实了 CRC 组织中中性粒细胞的富集导致 PM 减少,这与粘膜免疫功能紊乱、肠道菌群失调以及癌细胞和间皮细胞的间质转化有关。在细胞系、类器官和体内模型中进行的功能分析表明,菌群失调促进了炎症和促肿瘤中性粒细胞的募集,而恶性细胞和间皮细胞的偶联间质转化则破坏了基质结构并增加了癌细胞的侵袭性。本研究结果表明,针对间皮细胞和肿瘤微环境重塑可能为 CRC-PM 提供治疗策略。
+ + + + +



 English
English


