文献解读|ISME J(11.217):番茄根际厚壁菌和放线菌丰度的干扰导致青枯病的发生
✦ +
+
论文ID
原名:Disruption of Firmicutes and Actinobacteria abundance in tomato rhizosphere causes the incidence of bacterial wilt disease
译名:番茄根际厚壁菌和放线菌丰度的干扰导致青枯病的发生
期刊:ISME Journal
影响因子:11.217
发表时间:2021.01
DOI号:10.1038/s41396-020-00785-x
背 景
根际微生物群在植物适应、发育和免疫方面发挥着重要作用。疾病抑制性土壤被定义为具有最低疾病发病率的土壤,主要对土壤传播的真菌病原体抑制。诱导性系统抗性(ISR)的激发间接地促进了疾病的抑制。拟南芥和番茄中的ISR主要由茉莉酸(JA)和乙烯(ET)信号调节。某些根际细菌也可以在植物中引发水杨酸(SA)依赖性的ISR诱导。
大多数关于疾病抑制土壤的研究都集中于选定的微生物菌株,而不是微生物群落对目标病原体的影响。最近,为了模拟自然疾病抑制群落,人们尝试将包含多种微生物菌株的合成群落(SynCom)引入无菌或非抑制性土壤中。因此,设计一种人工抑制疾病的SynCom并维持引入的 SynCom 与根际已有微生物群落之间的稳态至关重要。
实验设计

结 果
01

温室中青枯病症状分布不均匀
在两株间距< 30厘米、受青枯病影响的番茄植株(图1a)的HRS和DRS中,病原体R. solanacearum的丰度都足以引起青枯病。HRS微生物在11、13和14 dpi时分别显著降低了疾病的严重程度83%、65%和64%(图1d)。DRS微生物在所有时间点都不能抑制青枯病(图1d)。表明番茄植株之间青枯病发生率的差异是由于HRS和DRS之间土壤微生物群落的差异,而不是病原体丰度的差异。


图1. 两个相邻的番茄植株的根际病害抑制差异
(a)Damyang、Yongin和Gwangju距离30厘米内生长的健康和患病番茄植株 红色箭头表示受R. solanacearum感染的枯萎番茄植株(b)R. solanacearum的细胞密度(c)病害严重程度的评价标准(d)接种后10-14天,经HRS和DRS处理的番茄植株的疾病严重程度
02

HRS和DRS的微生物群比较
对HRS和DRS样品进行16S rDNA测序(图2)。分析表明,变形杆菌,厚壁菌, 放线菌, 酸杆菌, 拟杆菌是主要细菌群落(图2a),HRS和DRS之间存在显著差异(图2b),HRS中革兰氏阳性厚壁菌, 放线菌的丰度高于DRS(图2c)。
进行3% KOH串联试验,并在选择性培养基上培养厚壁菌和放线菌并计算其 CFU (图2d)。与DRS相比,HRS中活性厚壁菌和放线菌与革兰氏阴性细菌的比例分别增加了26.2% 和26.3% (图2d)。这些数据可以假设厚壁菌和放线菌的相对丰度的变化决定了番茄青枯病的抑制。
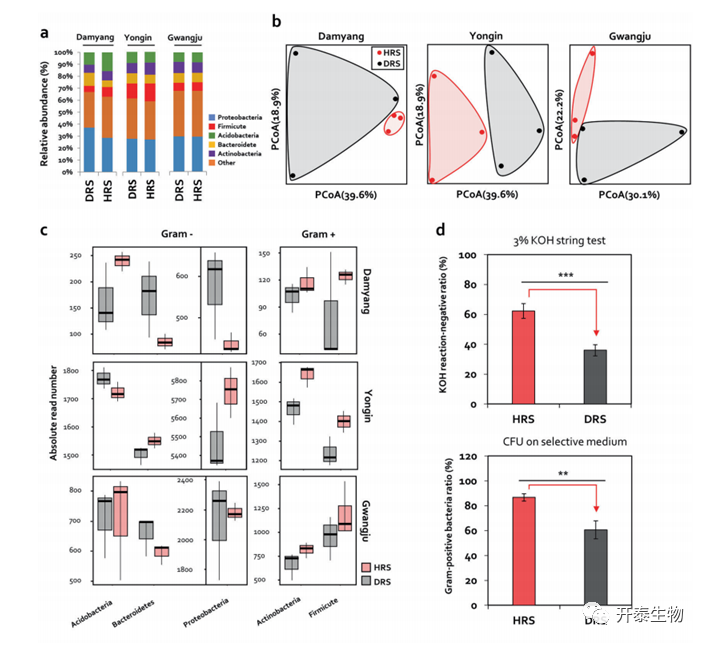
图2.基于16S rRNA测序的HRS和DRS土壤群落结构比较
(a)HRS和DRS中门级根细菌的相对丰度(b)Bray–Curtis差异的二维主坐标分析(PCoA)HRS和DRS中检测到微生物群落组成存在显著差异 (c) HRS和DRS中厚壁菌、放线菌、变形杆菌、酸杆菌和拟杆菌的片段数 (d)HRS和DRS中的活性厚壁菌和放线菌与革兰氏阴性细菌的比率
03

厚壁菌和放线菌的破坏对HRS疾病抑制的影响
将经或不经500μg/mL万古霉素预处理的HRS和DRS微生物群落接种于番茄根系(图3a、b)。与HRS处理相比,万古霉素预处理的HRS中青枯病严重程度显著增加(图3b)。与DRS处理相比,万古霉素预处理的DRS没有改变青枯病的严重程度(图3b)。与对照组相比,滴入万古霉素并未直接抑制青枯病菌的生长(图3b)。
在3% KOH串联试验中,HRS+万古霉素处理的番茄根际厚壁菌和放线菌的存活率明显低于HRS(图3d);DRS和DRS+万古霉素处理之间没有发现差异(图3d)。在5wpi时HRS、HRS+万古霉素、DRS和DRS+万古霉素处理下的R. solanacearum和细菌总数没有显著差异(图3c)。这些数据表明,破坏对万古霉素敏感的HRS中特异性厚壁菌和放线菌可减弱HRS介导的对R. solanacearum 的疾病抑制。
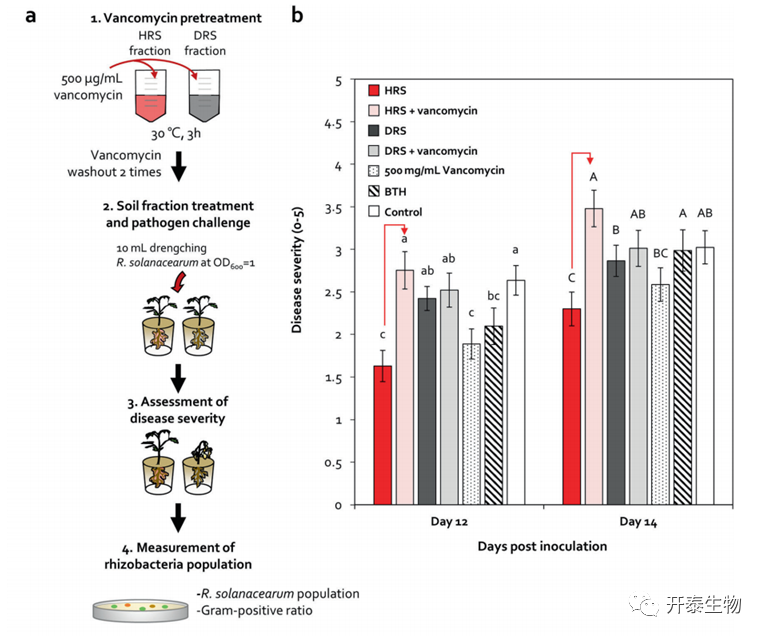

图3.番茄根际厚壁菌和放线菌的生态失调
(a)用或不用万古霉素预处理的HRS和DRS中的疾病严重程度和活性厚壁菌比率 (b)HRS和DRS处理的番茄青枯病的严重程度 (c)HRS和DRS预处理中R. solanacearum细胞密度的变化 (d) HRS和DRS预处理中厚壁菌丰度的变化
04

富集在HRS中的厚壁菌和放线菌的分离
在HRS和DRS中通过热处理分别分离出59和67个革兰氏阳性细菌属于厚壁菌和放线菌(图4a), 根据可培养细菌丰度选择B.frigoritolerans HRS1(HRS1),B. niacini HRS2 (HRS2), S. silvestris HRS3 (HRS3), B. luciferensis HRS4(HRS4)为HRS的关键分类群(图4b)。
HRS中B. frigoritolerans 和 B. niacini的相对丰度分别是DRS的5.5倍和5.22倍(图4c)。与对照组相比,菌株HRS1和HRS2在13dpi和14dpi时显著降低了疾病严重性(图4d),而HRS3和HRS4在所有时间点都未能抑制青枯病(图4d)。引入根际的厚壁菌和放线菌的种群动态如图4e所示。这四种菌株在任何时间点均未在浸透表面灭菌的根和茎组织中检测到。这些结果表明,HRS1和HRS2在番茄青枯病抑制中起着重要作用。
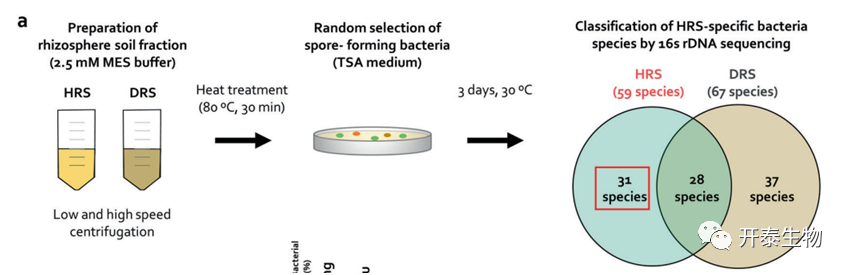
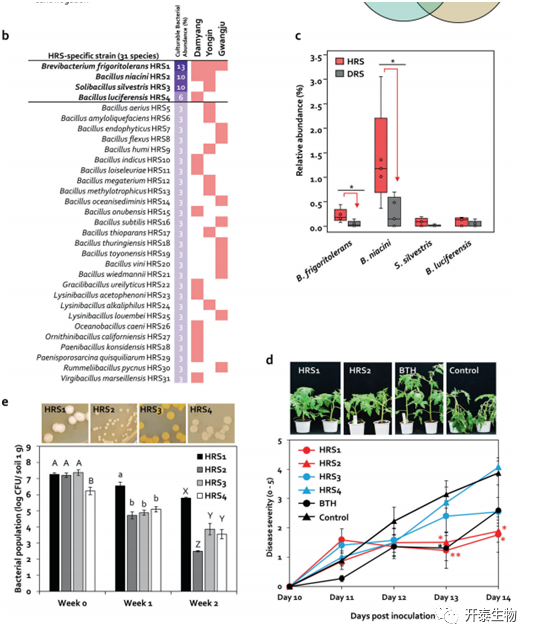
图4. HRS和DRS中热稳定的厚壁菌和放线菌的鉴定
(a)从80°C处理30分钟的HRS和DRS中分离的产孢厚壁菌(b)鉴定HRS特异性厚壁菌(c)基于16S rRNA 测序的番茄根际细菌分布(d) HRS特异性厚壁菌处理的番茄幼苗青枯病严重程度
05

HRS和个体根际细菌对植物免疫的激活作用
在共培养期间,R. solanacearum 与单个菌株之间缺乏拮抗作用(图5a),接种四种菌株于番茄根部,注射R. solanacearum到番茄植株的茎部以保持根际细菌和病原体之间的空间分离(图5a,b)。
在对照处理中,茎接种比根浸液施用早9天出现青枯病症状(图5c,d),BTH对疾病抑制的作用是对照的1.5倍;HRS1和HRS2对疾病抑制的作用是BTH的1.5倍(图5c),HRS3和HRS4未抑制疾病的严重程度(图5 c),除2 dpi 外,DRS 未抑制番茄青枯病(图5d)。结果表明,HRS1和 HRS2对R. solanacearum产生ISR。这些结果可以假设厚壁菌和放线菌在HRS中引起组合效应。
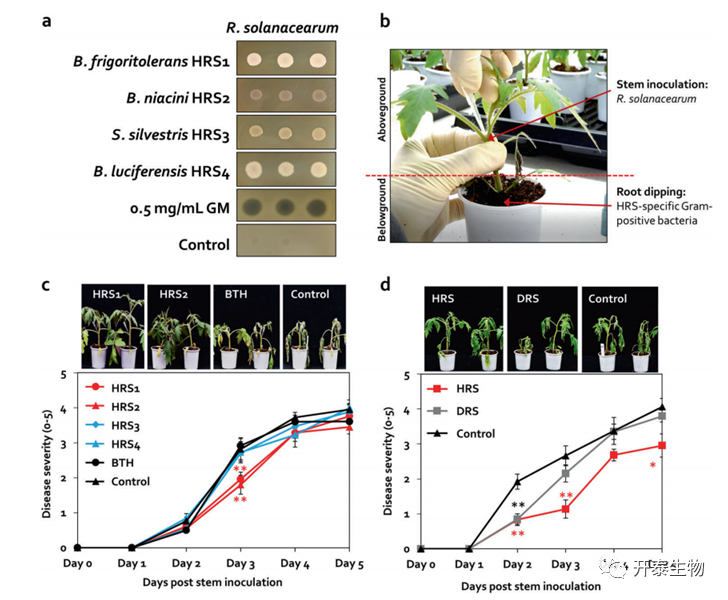
图5. 产孢的厚壁菌和放线菌激活HRS对R. solanacearum的诱导系统抗性(ISR)
(a)在TSA琼脂培养基上共同培养HRS特异性厚壁菌和R. solanacearum(b)空间分离系统(c) 番茄茎部注射R. solanacearum悬浮液后番茄青枯病严重程度(d)用HRS和DRS馏分引起的番茄青枯病严重程度
06

厚壁菌和放线菌的最小SynCom激活ISR
HRS1和HRS2单独施用4dpi后未能减轻青枯病发病程度(图5 c);与对照组相比,这两种菌株(HRS1+HRS2)的混合物在4和5 dpi时分别将疾病严重性显著降低1.7倍和1.5倍,并达到与HRS相似的水平(图5 d和6 a)。因此,实验测试了SynCom(HRS1+HRS2)与HRS3和/或HRS4对疾病严重程度的影响(图6 a)。数据表明,包含所有四个菌株的SynCom在番茄中激活了最高水平的ISR,以对抗番茄中的R. solanacearum。
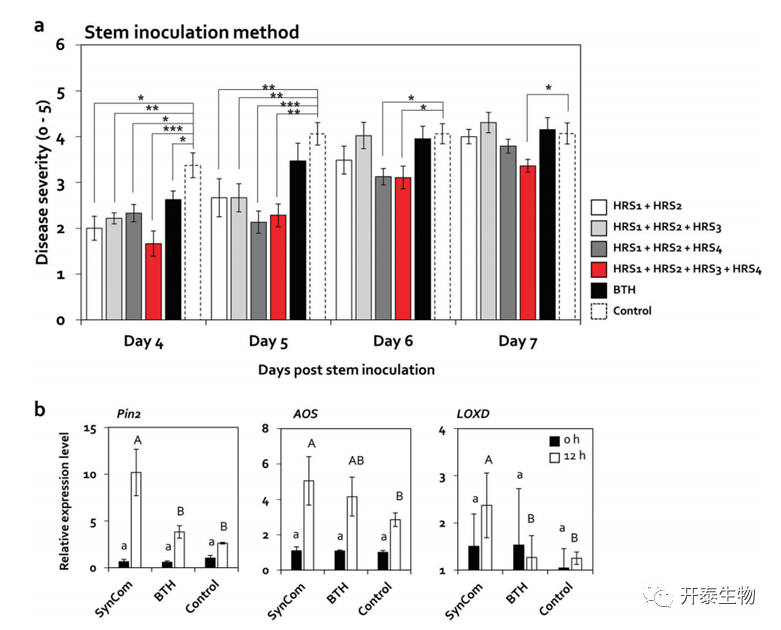

图6.由包含四种HRS特异性厚壁菌菌株的SynCom激活ISR
(a)四种厚壁菌的不同组合处理后,接种R. solanacearum的番茄植株中青枯病的严重程度 用SynCom处理的番茄植株的系统叶片中茉莉酸(JA)信号标记基因(b)和水杨酸(SA)信号标志基因(c)的相对表达水平
实验分析了接种后0和12小时(hpi)叶片中涉及JA、SA、ET和脱落酸(ABA)信号的防御相关标记基因的表达(图6 b)。结果表明,SynCom 引发了R. solanacearum对JA 和SA的依赖性 ISR。
+ + + + + + + + + + +
结 论
实验分析了在韩国三个不同地点的温室里生长的、相距小于30厘米的健康和患病番茄植株的根际微生物群落。通过16S rRNA测序对番茄根际样品进行分析,结果表明,病害根际土壤(DRS)中的放线菌和厚壁菌数量下降,而致病性青枯菌种群没有变化。用500μg/mL的万古霉素人为破坏 HRS中的革兰氏阳性菌,增加了番茄青枯病的发生。
从HRS中分离的耐热可培养细菌菌株中筛选出Bacillus niacini HRS2, Solibacillus silvestris HRS3, Bacillus luciferensis HRS4。这四个菌株组成的合成群落不直接对抗青枯病菌,而是通过激活激活JA信号依赖的ISR,以对抗番茄中的R. solanacearum,并且与每个单独菌株相比,对植物的保护期延长了4天。
总的来说,研究结果首次证明 DRS中保护性革兰氏阳性细菌群落的生态失调促进了疾病的发生。
+ + + + +



 English
English

