文献解读|Nat Commun(14.7):多组学分析揭示肝细胞癌肝移植接受者存在超出米兰标准的 CAF 干性分类
✦ +
+
论文ID
原名:Multi-omic analysis reveals a CAF-stemness-governed classification in HCC liver transplant recipients beyond the Milan criteria
译名:多组学分析揭示肝细胞癌肝移植接受者存在超出米兰标准的 CAF 干性分类
期刊:Nature Communications
影响因子:14.7
发表时间:2025.05.12
DOI号:10.1038/s41467-025-59745-8
背 景
肝移植 (LT) 是治疗肝细胞癌 (HCC) 的一种根治方法,尤其适用于符合米兰标准(单个肿瘤直径 ≤ 5 cm,或最多 3 个肿瘤,每个肿瘤直径 ≤ 3 cm;无肝外转移;无主要血管受累)的患者。符合米兰标准的 HCC 患者接受 LT 治疗后,5 年总生存率 (OS) 通常可达 70%。几年来,人们一直提议扩大 LT 标准。在过去的二十年中,已经开发出修改和扩展的选择标准。在扩展标准中,肿瘤形态(包括肿瘤大小和数量)主要有所增加。LT前甲胎蛋白 (AFP)水平高也与 HCC 复发风险较高相关。以各种免疫和基质细胞为特征的肿瘤免疫微环境 (TIME) 是促进肿瘤转移的驱动因素。特定细胞成分,如中性粒细胞和癌症相关成纤维细胞 (CAF),与免疫抑制 TIME 密切相关,这可能促进 HCC 在 LT 前转移到血液中。
实验设计
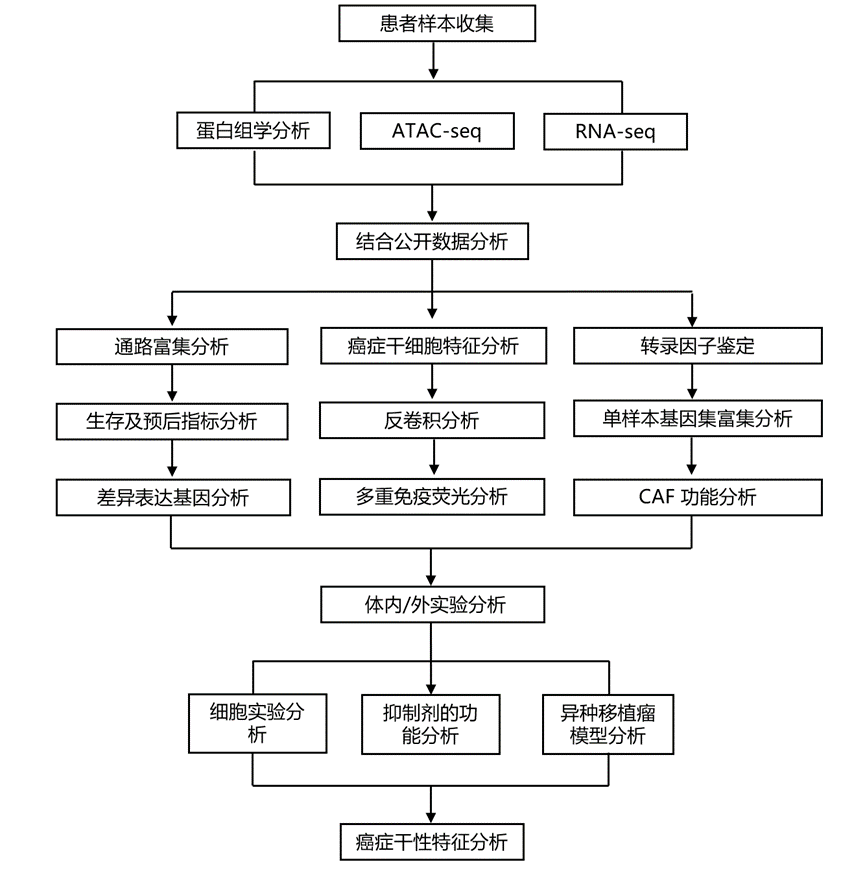
结 果
01
转录组分析确定了与肝移植后生存相关的肝细胞癌聚类
为了获得肝癌伴肝转移患者的全面分子谱,研究团队收集了 122 例 HCC 患者的肝外植体肿瘤样本,并根据严格标准进行了转录组分析(RNA-seq)、转座酶可及染色质测序(ATAC-seq)和蛋白质组学分析。为了实现精准识别米兰标准以外的适合肝细胞癌的肝移植患者这一目标,他们利用转录组信息建立模型,将肝细胞癌患者聚类为亚组。转录组数据可以反映基因的表达情况,是目前各种组学方法中最成熟、最稳定的。通过转录组数据分析,筛选出57条正调控通路和1条负调控通路。然后,他们根据这些通路的转录组活性进行无监督聚类,在100例肝细胞癌患者中确定了三个亚组,即低危组(n =39)、中危组(n =30)和高危组(n =31)。
他们鉴定了转录组亚组显著富集的通路(图 1A),亚组在 OS(图1B)和复发(图 1C)方面存在显著差异,根据多变量分析确定为超出米兰标准的 HCC LT 独立预后指标。低危组的 5 年 OS 率为 69.5%(图 1B)。此外,肿瘤大小、肿瘤数目及AFP水平并非独立的预后指标(图 1D),表明传统的形态学参数和肿瘤生物标志物无法准确筛选出米兰标准以外的肝移植合适的HCC患者,上述队列在本研究中视为衍生队列。
为了验证转录组分层,他们按照相同的入组规则,进一步收集了来自中国两个肝移植中心的80例接受肝移植的HCC患者的新鲜冰冻组织样本。通过limma调节t统计量的转录组分析检测亚型的特征基因。使用最近模板预测(NTP)方法将验证队列样本分为三个亚型。验证队列中的特征基因表达谱与预测的亚型显著相关(图 1E)。低危组与高危组的 OS 和复发率相似(图 1F-G),多变量分析也表明转录组亚组是独立的预后指标。他们还将转录组分层应用于癌症基因组图谱 (TCGA) 数据库。然而,在接受手术切除的患者中,OS 和 HCC 复发率没有差异,验证了本研究的分层系统在 HCC 患者选择和 LT 预后预测中的特异性和重要性。
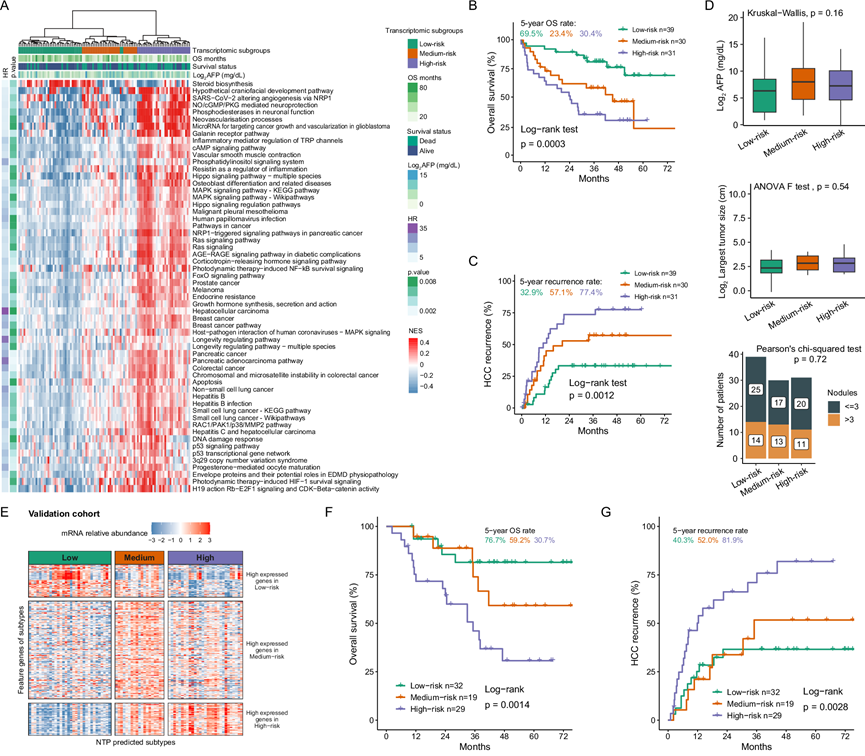
图1. 接受 LT 的超出米兰标准的 HCC 患者的转录组分层及其临床相关性。
(A) 热图表示三个 RNA-seq 亚组中显著富集的通路。(B-C) 基于 RNA-seq 亚组的 OS 或 HCC 复发的 Kaplan-Meier 曲线。(D) 三个RNA-seq 亚组的AFP水平和肿瘤大小的箱线图以及肿瘤结节的柱状图。(E) 使用 NTP 方法将验证队列(来自大连医科大学附属第二医院和青岛大学附属医院)样本分为三个亚型。热图显示了具有亚型预测(FDR < 0.01)的样本中特征基因的 RNA-seq 表达谱。(F-G) 基于验证队列中 RNA-seq 亚组的 OS 或 HCC 复发的 Kaplan-Meier 曲线。
02
癌症干细胞特征是肝移植后肝细胞癌患者生存率低的主要原因
与低危组相比,在衍生队列的高危组中鉴定出 952 个差异表达基因,即 721 个上调基因和 231 个下调基因(图 2A)。通路富集分析揭示了几条显著改变的通路(图 2B)。其中,值得注意的是癌症干细胞(CSC)通路在高危组中显著上调,CSC是驱动癌细胞扩散的原因。因此,他们利用市售的CSC基因panel(QIAGEN,PAHS-176ZA)分析了三个亚组中27个发生显著变化的癌症干细胞相关基因的表达(图 2C),并分析了验证队列中部分癌症干细胞相关基因的表达,热图清晰地显示,这些基因在高危组中上调。
从蛋白质表达水平来看,基于同量异位串联质谱标签的全局蛋白质组学平均每个样本鉴定出4022个蛋白质。然后他们根据蛋白质进行了无监督聚类。低风险组以代谢相关通路为特征,例如脂肪酸降解和丙酮酸代谢。在高风险组中,与干细胞相关的通路,例如癌症干细胞和造血细胞谱系,得到富集并有效验证了转录组亚群模型(图 2D)。蛋白质组亚群与转录组亚群呈显著正相关(图 2D),并且在生存率方面也存在差异(图 2E)。为了进一步探讨干细胞相关蛋白与肝移植术后HCC患者预后的关系,他们对不同生存风险患者的干细胞相关蛋白进行了聚类分析(图 2F)。选择CD44、ENG、MCAM和THY1等几种干细胞生物标志物作为聚类蛋白,这些标志物的高表达预示着本组患者OS较差(图 2G)。总体而言,蛋白质组学和RNA-seq结果显示,癌症干细胞特征是导致HCC患者肝移植术后生存率较差的主要原因。
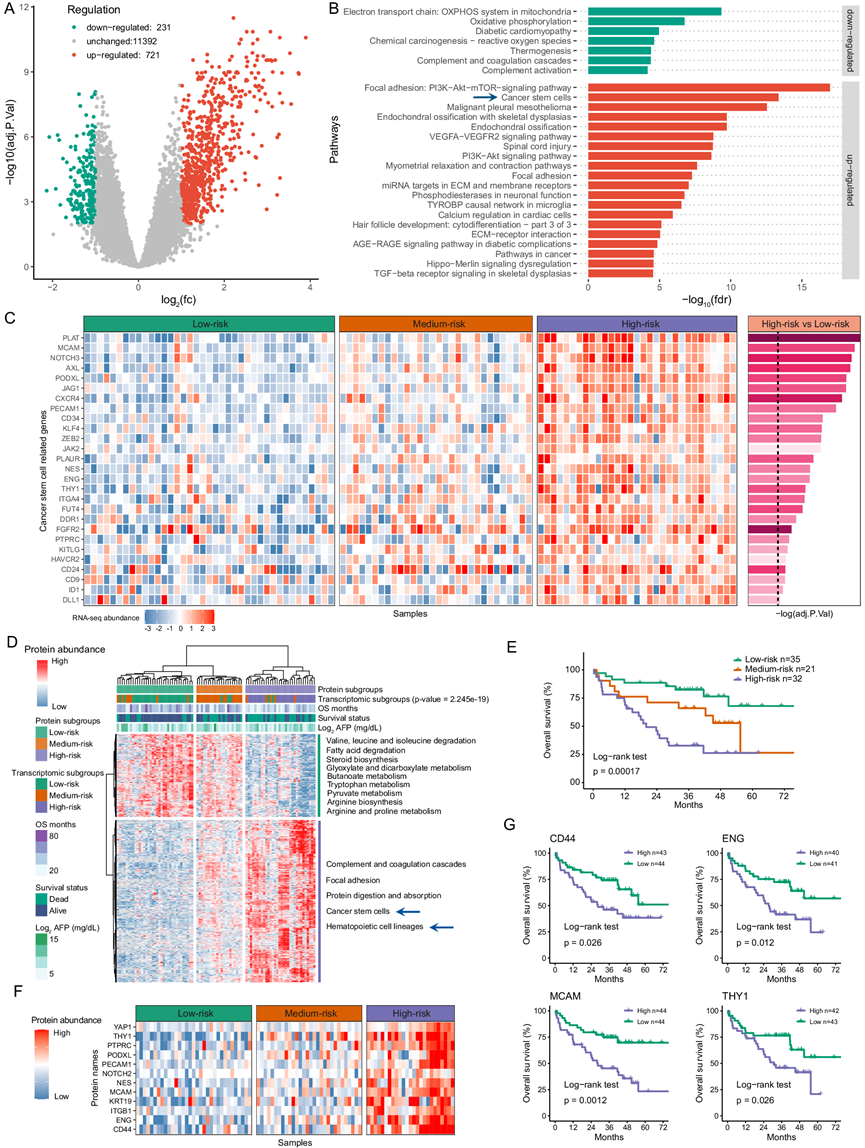
图2. 控制接受 LT 的 HCC 患者生存率低的关键基因和蛋白质特征。
(A-B) 高风险和低风险 RNA-seq 亚组之间显著差异表达基因的火山图和富集通路。(C) CSC通路中差异表达基因的热图和定量分析。(D) 三个蛋白质组亚组中差异表达蛋白的热图。(E) 基于本 HCC LT 队列蛋白质组亚组的 OS 的 Kaplan-Meier 曲线。(F) 三个蛋白质组亚组中CSC相关蛋白的热图。(G) 本队列中某些CSC标志物的OS Kaplan-Meier曲线。
03
累积的CAF与HCC的高干性相关
为了确定三个亚组之间细胞亚群组成和比例的差异,他们基于推导队列和验证队列的转录组数据进行了反卷积分析(图 3A)。在所有存在差异的细胞亚群中,他们发现三个亚组之间造血干细胞和CAF的不同特征与其相应的预后相一致。在推导队列中,呈现了存在差异的细胞亚群的得分,其中,作为肿瘤微环境主要成分的CAF在高危组中显著富集。
他们接下来使用多重免疫荧光 (mIF) 染色分析了 HCC 样本中 CAF 的浸润(图 3B),CAF-high 组的 CAF 评分是 CAF-low 组的 4.5 倍(图 3C)。为了进一步探讨 CAF 与 HCC 干性之间的关系,他们分析了高和低 CAF 浸润两组中干性相关基因的表达,结果显示在高 CAF 浸润组中干性相关基因的表达水平较高(图 3D)。此外,他们分析了 CAF 浸润对预后的影响,结果表明 CAF 浸润高的 HCC 患者 LT 后预后较差(图 3E-F)。此外,通过分析另一项已发表研究中来自 10 个 HCC 组织的一组单细胞转录组 (scRNA-seq) 数据,发现与 CAF 浸润较低的 HCC 组织相比,癌症干性相关基因在 CAF 浸润较高的 HCC 组织中高表达(图 3G)。上述结果表明,在本队列中,积累的 CAF 与 HCC 的高干性相关。
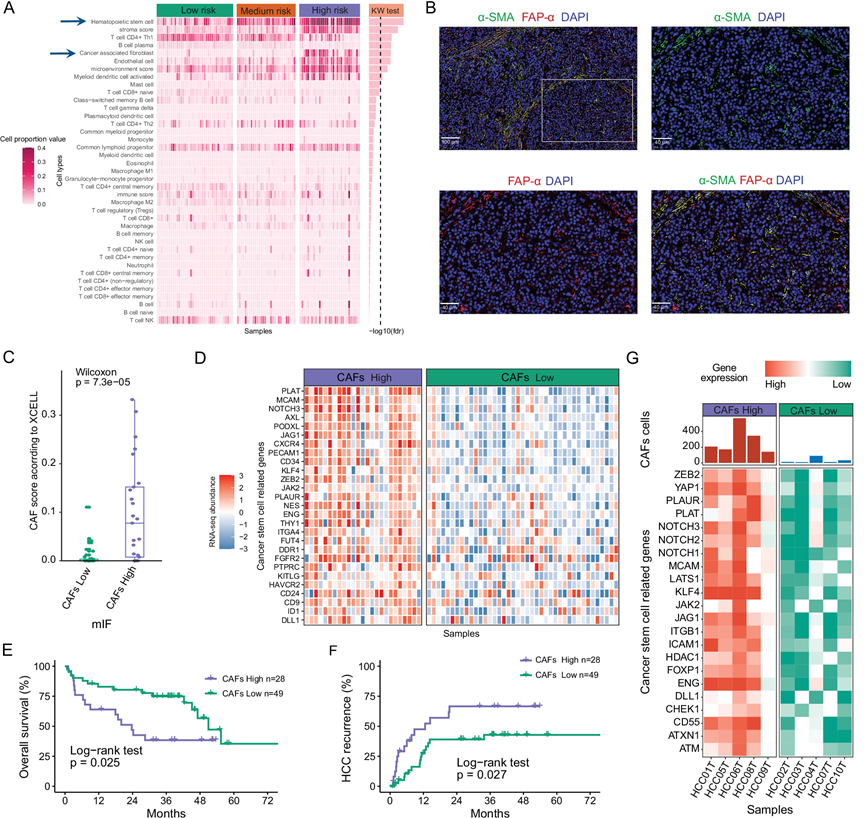
图3. CAF 浸润与接受 LT 的 HCC 患者的癌症干性和不良生存率有关。
(A) xCell 衍生的免疫、微环境、中性粒细胞和基质评分在三个 RNA-seq 亚组中的热图。(B) 通过mIF 检测 CAF,由 α-SMA 和 FAP-α 染色确定。(C) 通过双尾 Wilcoxon 秩和检验,对 mIF 中 CAF 评分高或低的患者的 xCell 衍生 CAF 评分进行箱线图分析。(D) mIF CAF 评分高或低患者的癌症干细胞通路 DEG 热图。(E-F) mIF CAF 评分高或低患者的 OS和 HCC 复发的 Kaplan-Meier 曲线。(G) 来自10个独立 HCC 队列的 scRNA-seq 数据集的 CAF 浸润高或低患者的 CSC 通路DEG热图。
04
ATAC-seq揭示与干细胞相关基因相关的转录因子
CAF可以通过分泌细胞因子和刺激某些信号通路和转录因子(TF)来促进癌细胞存活。他们进行了 ATAC-seq 以确定高危人群中驱动肝细胞癌干性的关键 TF。根据基于 RNA-seq 数据的预后分组(图 4A)。接下来,他们分析了高危组和低危组之间转录活性差异最大的 TF。多种 DNA 结合蛋白或 TF,如 X 射线修复交叉互补组 5(XRCC5)、MYCN、TFAP2C、TFAP2A、NFYA 和 NANOG,确定在高危组的 HCC 中处于激活状态(图 4B)。其中,MYCN和 NANOG与 HCC 中的干细胞特性密切相关的 TF。为了进一步验证癌症干细胞在 HCC LT 患者的重要作用,基于数据库分析了由六个 TF 调控的下游干细胞相关基因的网络关系(图 4C)。此外,他们分析了 TFAP2C 和 XRCC5 的活性与肿瘤组织中干细胞相关基因表达之间的相关性(图 4D)。根据RNA-seq结果确定CSC基因的表达水平。综上所述,ATAC-seq的结果主要揭示了本组HCC患者中多个TF与CSC基因表达呈正相关。
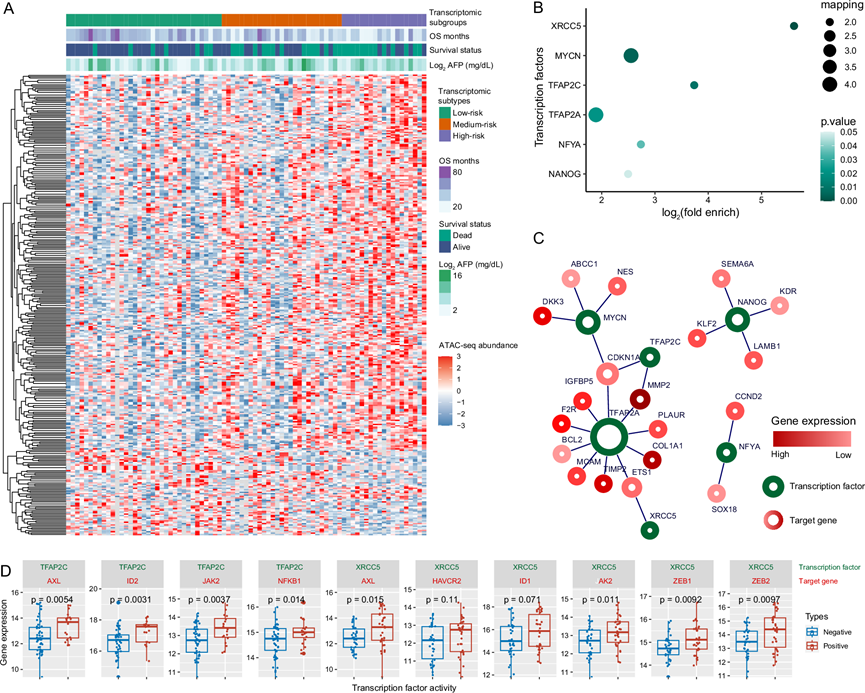
图4. ATAC-seq 鉴定的关键转录因子 (TF)。
(A) ATAC-seq 检测的差异表达开放染色质区域热图,并按基于 RNA-seq 的亚组分组。(B) 气泡图表示在 ATAC-seq 峰差异表达基因中显著富集的 TF。(C) 显著富集目标基因的 TF 网络,其表达水平根据 RNA-seq 结果确定。(D) 箱线图显示转录活性为 TFPA2C和 XRCC5的患者的基因表达情况。
05
XRCC5促进肝细胞癌的癌症干性特征
为了在本研究中确定 CAF 和癌症干性之间的联系,他们选择了 DNA 修复蛋白 XRCC5,该蛋白很少有报道涉及促进癌症干性。在 CAF培养基中培养的 HCC 细胞中 XRCC5 水平升高(图 5A)或与 CAF共同接种到裸鼠体内时。与 CAF共同接种的 HuH-7 细胞异种移植瘤的生长速度明显快于单纯的 HuH-7 细胞异种移植瘤(图 5B-C)。然后,他们使用基于慢病毒的方法在 HCC 细胞中建立稳定的 XRCC5 敲低(图 5A)。 XRCC5 敲低导致肝球形成减少近 70%(图 5D),并导致迁移能力降低约 80%,以及恢复由 CAF 诱导的迁移能力(图 5E-F)。XRCC5 的降低抑制了 CSC 标志物的 mRNA 表达,并抑制了 CAF 诱导的 CSC 标志物(例如CD24、CD44、CD133和EPCAM )的上调(图 5G-H)。此外,他们还通过将 shNC 或 shXRCC5 HuH-7 细胞以三种稀释度(2 × 106、2 × 105和 2×104)皮下注射到 NOD/SCID 小鼠体内并使其生长四周来分析 XRCC5 敲低的 HCC 细胞的致瘤性(图 5I)。计算了使用有限稀释法的 1/(干细胞频率)的置信区间(CI)。XRCC5敲低组的干细胞频率(1/CI)为 1/1868283,而 NC HuH-7 细胞中的干细胞频率为 1/184087。同样,XRCC5 的过表达也显著促进了 HCC 细胞中癌症干性的表型(图5J-M)。最后,为了初步确认XRCC5的临床作用,他们对来自衍生队列的82个HCC样本进行了XRCC5的免疫组织化学(IHC)染色(图 5N),绘制了与CSC相关基因的热图(图 5O),XRCC5高表达预示该队列的OS更差(图 5P)。多变量分析显示,XRCC5高表达是超越米兰标准的HCC LT的独立预后指标。
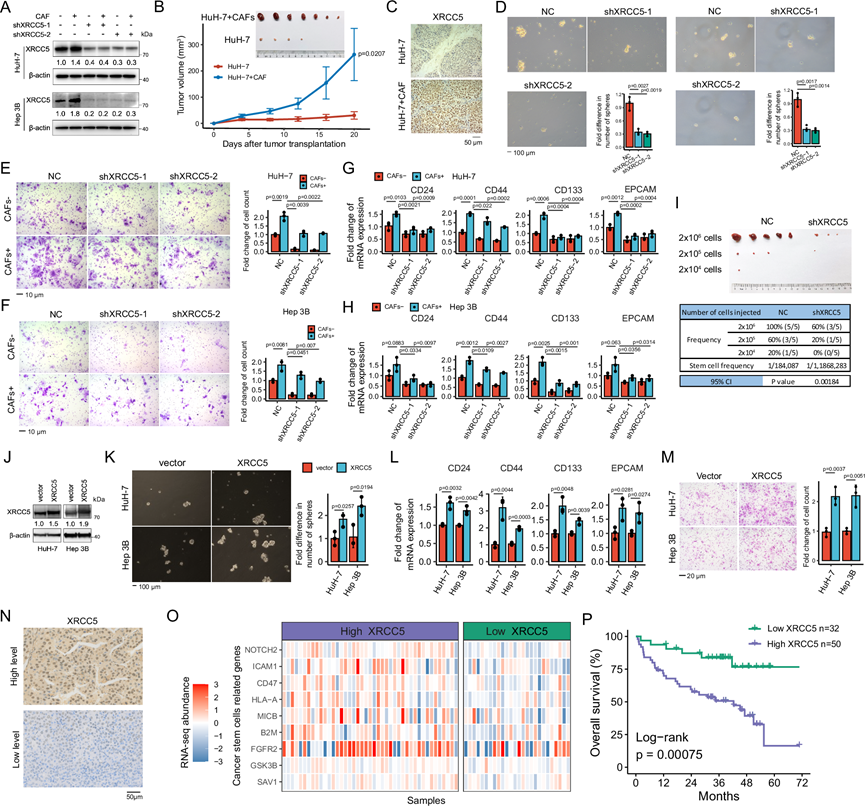
图5. CAF 诱导的 XRCC5 维持 HCC 细胞的干性。
(A) 将XRCC5敲低(shXRCC5-1和shXRCC5-2)或未敲低的HuH-7细胞和Hep 3B细胞分别在CAF+或未敲低的培养基中培养。(B) 裸鼠体内HuH-7细胞组和CAF共接种HuH-7细胞组肿瘤结节体积曲线。(C) 20天后切除肿瘤结节,用IHC染色检测XRCC5的表达。(D-I) 通过体外自我更新能力、细胞迁移、干细胞相关基因mRNA表达水平及NOD/SCID小鼠有限稀释异种移植形成展示XRCC5敲低与否对HCC细胞干性的影响 ,并计算干细胞频率。(J-M) 在过表达(OE)或不表达(载体)XRCC5的HuH-7细胞和Hep 3B细胞中,用免疫印迹检测XRCC5。通过体外自我更新能力、干细胞相关基因mRNA表达水平和细胞迁移展示上述细胞的干性。(N) 接受LT的HCC患者XRCC5的IHC染色。(O) 来自IHC的高或低XRCC5表达患者的CSC通路中差异表达基因的热图。(P) Kaplan-Meier 曲线。
06
CAF衍生的CXCL12通过CXCR4促进XRCC5维持HCC细胞的干细胞性
最终,他们深入研究了 CAF 和 XRCC5 在驱动干性方面的连接机制。趋化因子受体 CXCR4 在高危组的肝细胞癌组织中高表达(图 2C),其配体细胞因子 CXCL12 可由 CAF分泌。在用 CAF调节的培养基中 CXCL12 的浓度比人肝星状细胞系 LX-2 中的浓度高 3 倍以上(图 6A)。使用外源提供的 CXCL12 治疗导致肝癌细胞中的 XRCC5 水平升高(图 6B-C),而敲低 CXCR4 可以消除这种升高(图 6D-F)。与 XRCC5 变异一致,癌症干性的表型也可以通过 CXCR4 敲低(图 6G-I)或 CXCR4 抑制剂 AMD3100(图 6J)消除。HCC 细胞和 CAF进行直接接触(GFP+ HuH-7 细胞)(图 6K),结果显示 CSC 基因表达趋势与 CAF条件培养基相似(图 6L-M)。这表明 HCC 细胞和 CAF之间的直接相互作用可能不会影响 CXCL12/CXCR4 驱动的癌症干性。他们还对用于 XRCC5 染色的相同 HCC 样本进行了 CXCL12 和 CXCR4 的 IHC 染色(图 5N),结果显示 XRCC5 与 CXCL12 以及 XRCC5 与 CXCR4 之间存在正相关性(图 6N-O)。总之,综合多组学分析表明,CAF 衍生的 CXCL12 通过 CXCR4 促进 XRCC5 来维持 HCC 细胞的干性(图 6P)。
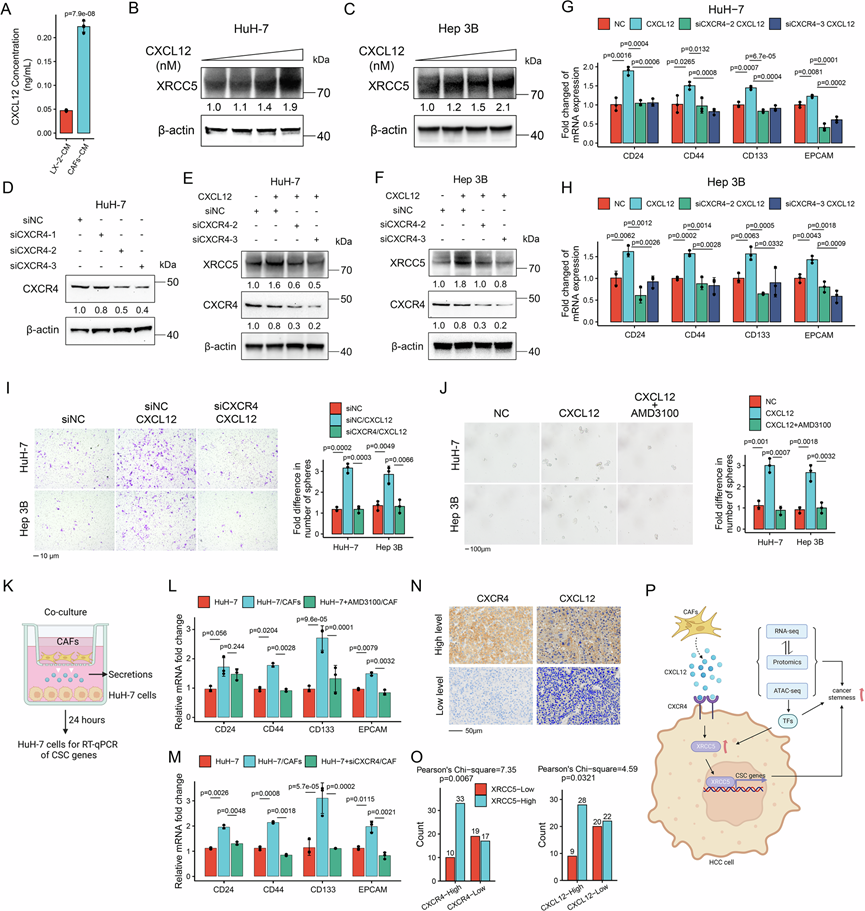
图6. CAF 衍生的 CXCL12 对 CXCR4/XRCC5 轴和 HCC 细胞干性的影响。
(A) 使用 ELISA 检测 CAF 条件培养基 (CAF-CM) 和 LX-2 条件培养基 (LX-2-CM) 中的 CXCL12 浓度。(B-C) 检测 XRCC5 表达。(D) 检测 siCXCR4 的作用。(E-F) 检测 XRCC5 和 CXCR4 表达。(G-J) 通过干细胞相关基因的mRNA表达水平、细胞迁移、体外自我更新能力显示了 CXCL12 刺激(1 μM)与 CXCR4 敲低或不敲低,以及给予或不给予 CXCR4 抑制剂 AMD3100 (1 μM)对 HCC 细胞干性的影响。(K) HCC 细胞和 CAF的 Transwell小室共培养模型示意图。(L-M) 通过干细胞相关基因的mRNA表达水平显示了 CXCR4 敲低或不敲低共培养以及给予或不给予 AMD3100(1 μM)对 HCC 细胞干性的影响。(N) 接受肝移植的 HCC 患者中 CXCR4 和 CXCL12 的 IHC 染色。(O) 79个HCC 样本中 XRCC5 与 CXCR4 和 CXCL12 呈正相关。(P) 于整合多组学和实验证据的机制图形总结。
+ + + + + + + + + + +
结 论
本研究利用多组学技术对肿瘤组织进行整合分析。基于转录组学,在衍生队列中发现了三个总体生存率存在显著差异的亚组,并在一个独立队列中验证了这些发现。利用RNA-seq和蛋白质组学进行的深入生物信息学分析表明,CAF对癌症干细胞特性的促进作用可能是高危HCC患者出现负面生物学特征的原因。ATAC-seq 识别出了调控转录的关键因子,这些因子可能在CAF浸润和干细胞特性之间架起桥梁。最后,本研究证明 CAF 衍生的 CXCL12 通过 CXCR4 促进 XRCC5 来维持 HCC 细胞的干性。
+ + + + +



 English
English


