文献解读|Nat Commun(14.7):衰老和饮食改变小鼠大脑中的蛋白质泛素化景观
✦ +
+
论文ID
原名:Aging and diet alter the protein ubiquitylation landscape in the mouse brain
译名:衰老和饮食改变小鼠大脑中的蛋白质泛素化景观
期刊:Nature Communications
影响因子:14.7
发表时间:2025.06.06
DOI号:10.1038/s41467-025-60542-6
背 景
翻译后修饰 (PTM) 通过产生由同一基因编码的不同蛋白质形式来扩大蛋白质的化学多样性。PTM调节蛋白质的定位、相互作用、稳定性和周转,从而影响蛋白质稳态(蛋白稳态)。蛋白稳态的丧失是衰老和与年龄相关的疾病(尤其是神经退行性疾病)的标志。乙酰化、磷酸化和泛素化是研究最多的PTM,占迄今为止所有已报告修饰的 90% 以上。乙酰化是大脑基因表达的基础,调节组蛋白的可及性。组蛋白乙酰化对神经元成熟、突触形成和神经回路的建立至关重要。磷酸化介导信号传导并调节多种神经元功能。例如,钙/钙调蛋白依赖性蛋白激酶 II 调节突触强度,主要通过影响谷氨酸跨膜受体的运输、功能和锚定到突触后膜。泛素化通过泛素-蛋白酶体系统 (UPS) 在蛋白质降解中起着重要作用。UPS 活性下降是脑衰老的早期事件。泛素信号也是细胞器周转所必需的,例如,通过线粒体自噬的线粒体和通过内质网 (ER) 自噬的内质网,它可以调节突触活动和可塑性。
实验设计
结 果
01
衰老对蛋白质翻译后修饰的影响
为了评估衰老对小鼠脑(C57BL/6J,雄性)中 PTM 的影响,研究团队使用了无标记数据非依赖采集 (DIA) 质谱(MS)进行了蛋白组学分析,并分析了同一组年轻和老年小鼠的三种主要 PTM(泛素化、磷酸化和乙酰化)(图 1A)。为了富集泛素化肽段,他们使用了赖氨酸二甘氨酸 (K-ε-GG) 亲和富集技术(二甘氨酸是泛素化修饰后赖氨酸残基上的特征结构)。该方法还可以富集其他修饰,如 NEDDylation 和 ISGylation。然而,超过 95% 的 K- ε -GG 修饰位点已证实来自泛素。从现在起,他们将 K-ε-GG 修饰位点称为泛素化位点。他们分别定量了10487个磷酸化、7031个泛素化和6049个乙酰化位点的变化。同时,他们还检测了总蛋白和转录本丰度的差异,涵盖6453个蛋白和17994个转录本。该数据集重现了此前与衰老和疾病相关的PTM的变化,例如MAPT过度磷酸化和GFAP乙酰化。
在分析的 PTM 中,他们观察到衰老对泛素化位点百分比有显著影响(图 1B)。这些结果促使他们将注意力集中在这种特定的修饰上。泛素数据集的主成分分析(PCA)始终如一地描绘出年轻组和老年组之间的明显分离差异(图 1C)。在老年样本中鉴定出更多的泛素化位点(图 S2B),并且与年龄相关的泛素化变化偏向正值(图 1D)。这些观察结果与之前的观察结果一致,即小鼠脑中高分子量泛素化结合物增加,而游离泛素没有增加。虽然泛素化总体呈随衰老增加的趋势,但也有一小部分位点显示泛素化降低(图 1D)。在评估哪些细胞成分类别受到这些变化的影响时,GO 富集分析显示髓鞘、线粒体和 GTPase 复合物均显示泛素化增加(图 1E)。相反,在随衰老泛素化降低的蛋白质中,属于突触区室的蛋白质富集(图 1E)。他们没有在蛋白质组和转录组数据集中发现这些变化,相反,这些数据集突出了一种显著的炎症特征,这是衰老的一个明确标志。
接下来,他们探究泛素化肽丰度的变化是否可能源于总蛋白质丰度的潜在变化。虽然泛素化的变化与蛋白质丰度的变化呈正相关,但29%的改变位点无法用蛋白质丰度的变化来解释。这一观察结果表明,泛素化位点占据率的变化发生在衰老的大脑中(图 1F)。在泛素化显著增加(与蛋白质水平无关)的病例中,他们发现了由神经退行性疾病相关基因(例如 APP、TUBB5)和分子伴侣/辅分子伴侣(例如 DNAJB2)编码的蛋白质(图 1G)。相反,一些组蛋白、去泛素化酶和突触蛋白,包括H2AFY、USP33和CAMK2A,表现出泛素化降低(图 1H)。有趣的是,他们鉴定出多个含有泛素化位点的蛋白质受到相反的影响,这表明衰老小鼠大脑中蛋白质泛素化发生了复杂的重塑。
因为泛素介导的降解可以调节蛋白质的半衰期,他们将蛋白质泛素化数据与蛋白质半衰期以及通过稳定同位素标记与 MS 偶联测量的小鼠大脑中衰老过程中蛋白质半衰期的变化关联起来。较高水平的泛素化与蛋白质半衰期随衰老而增加相关,但与半衰期本身无关(图 1I),这表明泛素化变化与衰老大脑中蛋白质组周转率改变之间存在联系。总之,这些结果表明,蛋白质泛素化在老年小鼠大脑中受到显著影响,超过其他蛋白质修饰,并且泛素化衰老特征在很大程度上具有器官特异性。泛素化蛋白质形式的积累与衰老大脑中蛋白质半衰期的变化相关。
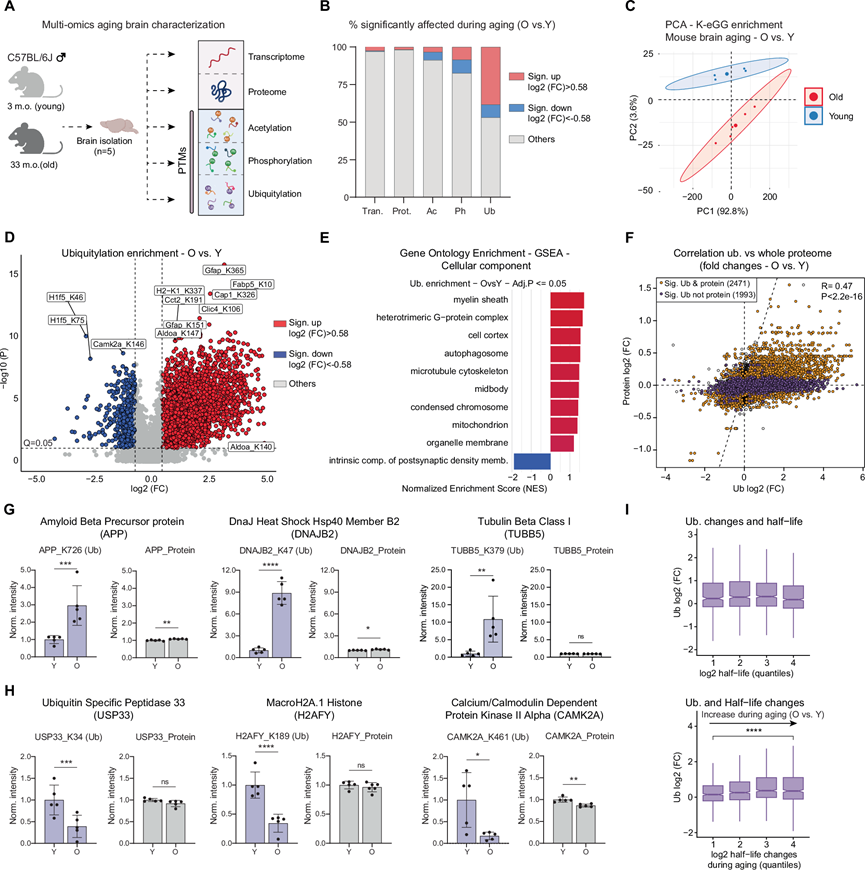
图. 1 小鼠衰老大脑中蛋白质翻译后修饰的状况。
(A) 多组学方法方案。(B) 显著受影响的转录本、蛋白质或翻译后修饰 (PTM) 的百分比。(C) 基于小鼠脑中泛素化肽丰度的PCA。(D) 小鼠脑衰老中泛素富集的火山图。(E) 基因集富集分析 (GSEA)。(F) 散点图显示了蛋白质丰度差异倍数与相应泛素化肽水平随年龄变化之间的关系。(G-H) 显示与年龄相关的泛素化变化的蛋白质示例。(I) 泛素化变化与蛋白质半衰期(上)或小鼠脑衰老过程中蛋白质半衰期变化(下)之间的相关性。
02
衰老小鼠和鳉鱼中保守的泛素化变化
接下来,他们通过将小鼠数据集与之前为短命鳉鱼生成的数据集进行比较,研究了与年龄相关的泛素化改变在不同物种之间是否保守。他们假设任何共同的变化都可能揭示与脊椎动物大脑衰老相关的基本泛素化特征。首先,在鳉鱼中,一部分泛素化的差异与蛋白质丰度无关。接下来,他们比对了小鼠和鳉鱼的泛素化位点,并在校正了蛋白质丰度变化后比较了两个物种中与年龄相关的泛素化变化。在小鼠和鳉鱼之间可以比对的 1157 个位点中,48% 在放宽过滤标准时发生了一致变化或显示出一致的趋势(图 2A)。
此外,他们还分析了年龄相关性泛素化与蛋白质组差异之间的相关性,以确定它们在两个物种间的保守性。泛素化变化之间的一致性高于其各自的蛋白质组,且与所用的显著性截断值无关(图 2B)。当分析哪些类别的蛋白质持续受到影响时,他们发现了一组与突触、自噬、细胞骨架和代谢相关的蛋白质(图 2C)。
此外,他们观察到其中一些蛋白质显示出多个保守的受影响位点,例如MYO1D、HSPA8和CAMK2A(图 2D-G)。MYO1D参与自噬调控,而HSPA8是一种分子伴侣,据报道可防止tau纤维延长。CAMK2A是一种重要的突触可塑性调节因子,在老年大脑中泛素化作用降低,这些蛋白质的稳健和保守效应表明它们是大脑衰老的潜在泛素化生物标志物。
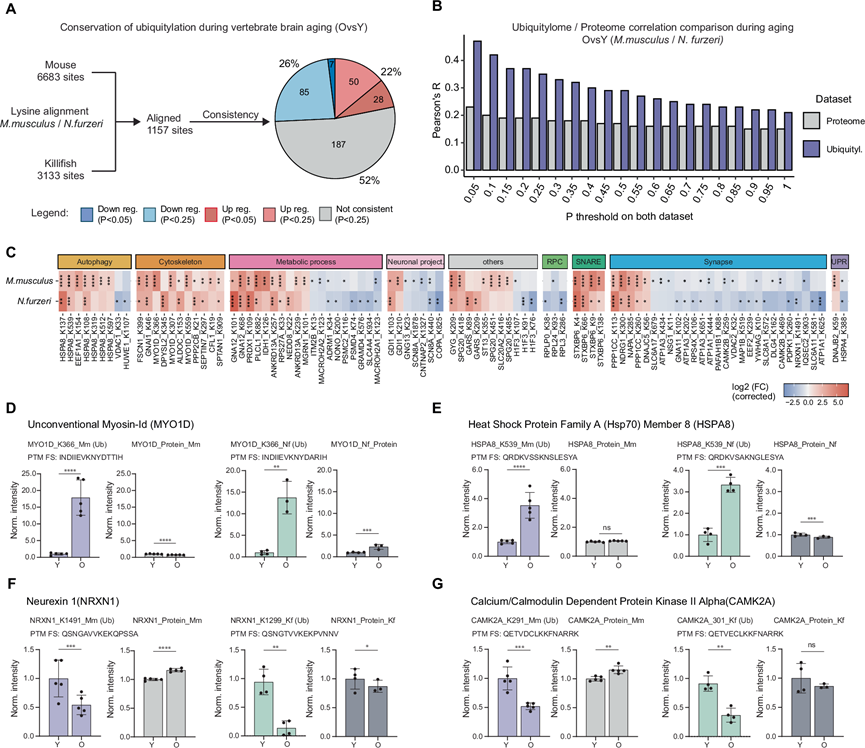
图2. 鳉鱼和小鼠中与年龄相关的泛素化变化的保守性。
(A) 鳉鱼和小鼠之间泛素化位点的映射。(B) 条形图显示了小鼠和鳉鱼中泛素化肽段(紫色条)和蛋白质丰度(灰色条)的年龄相关变化之间的相关性。(C) 小鼠和鳉鱼中受年龄影响的保守泛素化位点的热图。(D-G) 在小鼠和鳉鱼中,显示与年龄相关的泛素化变化。
03
蛋白酶体和溶酶体酸化抑制剂对iNeurons泛素化蛋白质组的影响
在鉴定出大脑中的蛋白质泛素化衰老特征后,他们旨在确定其潜在的分子原因。先前的研究将蛋白酶体活性降低定义为大脑衰老的标志,他们在小鼠样本队列中证实了这一结果。他们选择使用人类 iPSC 衍生的神经元 (iNeurons),因为它们已证实为人类年龄相关神经退行性疾病的参考体外模型。此外,iNeurons 已有效用于蛋白质组范围的蛋白质泛素化研究。因此,他们使用硼替佐米(bortezomib)处理24 小时削弱了分化后 7 天和 14 天的 iNeurons 的蛋白酶体活性。同时,他们评估了溶酶体自噬通路的贡献,因为据报道衰老小鼠大脑中巨自噬减少,并且参与该通路的几个基因与人类神经退行性变有关。他们还分析了用溶酶体 V-ATPase 抑制剂 bafilomycin 处理的 iNeurons,该抑制剂可降低溶酶体的酸化并随之抑制溶酶体蛋白酶,第三组用硼替佐米和 bafilomycin 处理(图 3A)。治疗 24 小时后未观察到明显的细胞毒性。蛋白质组数据的主成分分析(PCA)显示分化日是最显著的特征,不同处理方法的效果也可见(图 3B)。
相反,K-ε-GG 富集肽的数据突显了药物处理在分化过程中的更显著影响(图 3C)。正如预期的那样,他们注意到硼替佐米处理后已鉴定的泛素化肽的数量强劲增加,而总蛋白质的数量保持相似(图 3D)。使用显示泛素化变化的蛋白质进行的 GO 富集分析表明,药物处理影响了不同的细胞区室。硼替佐米增加了线粒体和未折叠蛋白反应相关蛋白的修饰,并导致参与 mRNA 成熟的因子的泛素化降低(图 3E)。相反,bafilomycin 治疗主要影响与神经元投射和高尔基囊泡运输相关的蛋白质(图 3F)。为了更好地理解两种药物治疗对培养神经元诱导的信号与衰老过程中体内观察到的蛋白质修饰之间的相关性,他们将人类赖氨酸残基与相应的小鼠和鳉鱼直系同源物比对,可以在所有 iNeurons 治疗条件下映射小鼠 57%(3961 个位点)和鳉鱼 45%(1408 个位点)的泛素化赖氨酸。
当他们将iNeurons 和小鼠之间显著受影响的位点关联起来时,他们观察到蛋白酶体抑制,而不是溶酶体酸化损伤,可以重现相当一部分与年龄相关的泛素化变化(图3G)。小鼠中大多数受年龄影响的泛素化位点在蛋白酶体抑制治疗14 天后表现出一致的变化。有趣的是,在这些共同的改变中,参与细胞质泛素内含物的形成和自噬降解的 SQSTM1 (p62)在小鼠脑衰老和硼替佐米治疗的 14 天 iNeurons 中表现出显著的泛素化增加。这些结果表明,蛋白酶体部分抑制可以重现衰老过程中体内发生的相当一部分泛素化变化,与溶酶体酸化损伤相比,蛋白酶体部分抑制表现出更高的相关性,并且持续调控的泛素化位点百分比也更高(图 3H)。
最后,由于泛素化是几种神经退行性疾病的标志,他们重点研究了与人类神经退行性疾病有遗传关联的一组蛋白质,并探究它们的修饰状态是否以蛋白酶体依赖的方式受到衰老的影响。他们在神经退行性疾病相关蛋白质上定位了多个泛素化位点,这些蛋白质在小鼠脑衰老过程中以及在 14 天的 iNeurons 中接受硼替佐米治疗后会持续发生变化(图 3I)。含缬氨酸蛋白 (VCP) 和 2′,3′-环核苷酸 3′ 磷酸二酯酶 (CNP) 这两种蛋白质显示出多个受泛素化增加影响的位点。VCP 的主要功能是展开蛋白质以便在内质网中降解,但它也参与应激颗粒清除和基因组稳定性。它与患者神经元和突变蛋白表达细胞中的蛋白质聚集体共定位,并与FTD和包涵体肌病相关。CNP对髓鞘形成至关重要,它在髓鞘内形成对正常轴突信号传导至关重要的通道,其缺乏会导致髓鞘形成不足性白质营养不良,但其与泛素化的联系尚不清楚。这些发现强调,即使在没有突变的情况下,年龄相关的蛋白质稳态障碍(例如蛋白酶体活性降低)也可以触发神经退行性疾病相关基因编码蛋白质的泛素化变化。
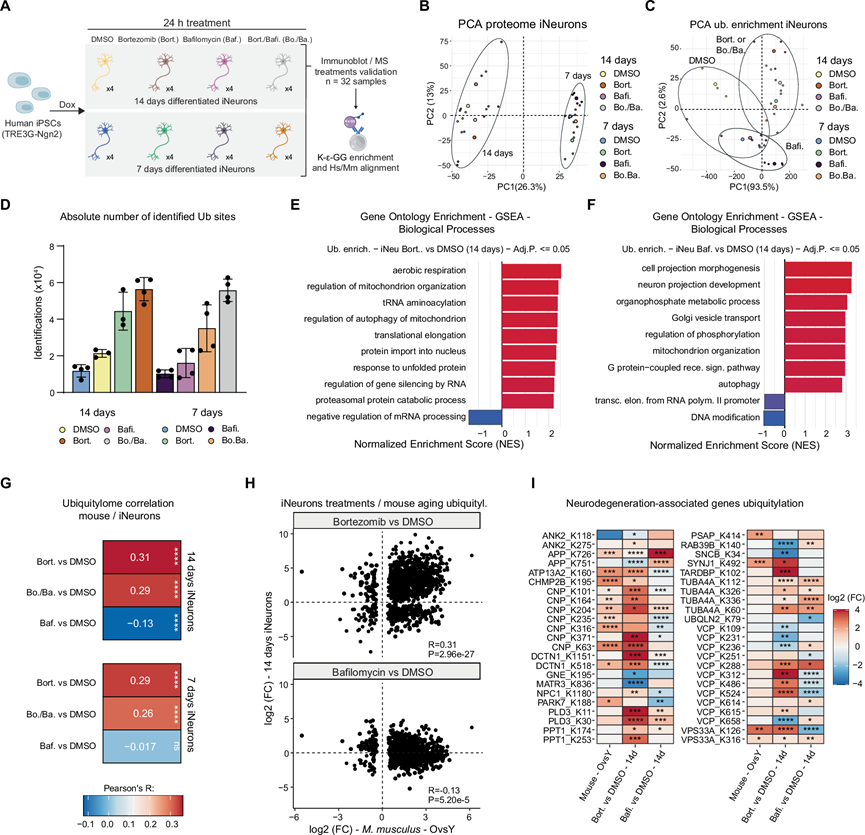
图3. 蛋白酶体抑制和溶酶体酸化受损对 iNeurons 中蛋白质泛素化的影响。
(A) iNeurons 药物治疗和表征的实验方案。(B) 基于来自 iNeurons 的蛋白质组数据的PCA。(C) 基于来自 iNeurons 的泛素化肽丰度的PCA。(D) 条形图显示不同样本组中已鉴定的泛素化位点的数量。(E-F) 基因集富集分析 (GSEA)。(G) 小鼠脑衰老过程中观察到的泛素化变化与用硼替佐米或 bafilomycin 治疗的 14 天 iNeurons 之间的相关性。(H) 散点图比较小鼠脑衰老和用硼替佐米(上图)或 bafilomycin(下图)治疗的 14 天 iNeurons 中观察到的泛素化变化。(I) 神经变性相关蛋白中泛素化变化的热图。
04
衰老和蛋白酶体抑制对泛素链连接的影响
蛋白质泛素化的一个关键方面是形成多种泛素链连接以介导不同的细胞信号。虽然 K48 连接链的主要功能是靶向蛋白质进行蛋白酶体降解,但其他连接,包括 K6、K27、K33 和 K63 连接,主要与非蛋白酶体途径相关,例如 DNA 损伤反应、先天免疫和自噬调节等。因此,研究泛素链连接的变化可能有助于阐明蛋白质稳态之外在衰老过程中发生改变的特定分子机制。为了解决这个问题,他们首先检测了小鼠 DIA K-ε-GG富集数据,发现四种连接(K6、K11、K27 和 K33)在脑衰老过程中显著增加。为了验证这些发现,他们采用了基于平行反应监测的靶向蛋白质组学测量方法,并使用绝对定量同位素标记的spike-in参考肽(AQUA-PRM)(图 4A)。该方法使他们能够定量除K29之外的所有连接,从而精确测量不同泛素连接中与年龄相关的变化。此外,他们将AQUA-PRM应用于用硼替佐米和bafilomycin处理的iNeurons,以评估这些处理对泛素链连接的影响,并将其与脑衰老进行比较。
首先,AQUA-PRM 数据证实,泛素链仅占小鼠组织中总泛素池的 2-5%,与之前的研究结果相似,而在 iNeurons 中这一比例增加到 25%(图 4B)。虽然年轻小鼠和老年小鼠中总泛素池和多聚泛素池之间的比例没有差异,但观察到用硼替佐米处理的 iNeurons 中的多聚泛素显著增加(图 4B)。其次,他们证实了 DIA 数据中观察到的总泛素和所有赖氨酸连接的增加,但K27 除外(图 4C)。值得注意的是,在用硼替佐米抑制蛋白酶体(单独使用或与 bafilomycin 联合使用)后,在 iNeurons 中观察到总泛素以及 K11、K48 和 K63 链的类似增加(K6 链低于 iNeurons 中的检测限)。
虽然在衰老和iNeurons数据集中观察到的模式基本一致,但也出现了显著的差异。例如,在蛋白酶体受损的iNeurons中观察到K27链显著增加,而在老年小鼠大脑中则没有。相反,仅在bafilomycin处理的细胞与bafilomycin和硼替佐米处理的细胞进行比较时,老年大脑中观察到的K33链显著增加(图 4C)。这些发现表明,虽然衰老对泛素链的大部分影响可以通过蛋白酶体或溶酶体酸化受损在iNeurons中模拟,但其他机制也可能导致老年大脑中的特定改变,例如K33链的改变。
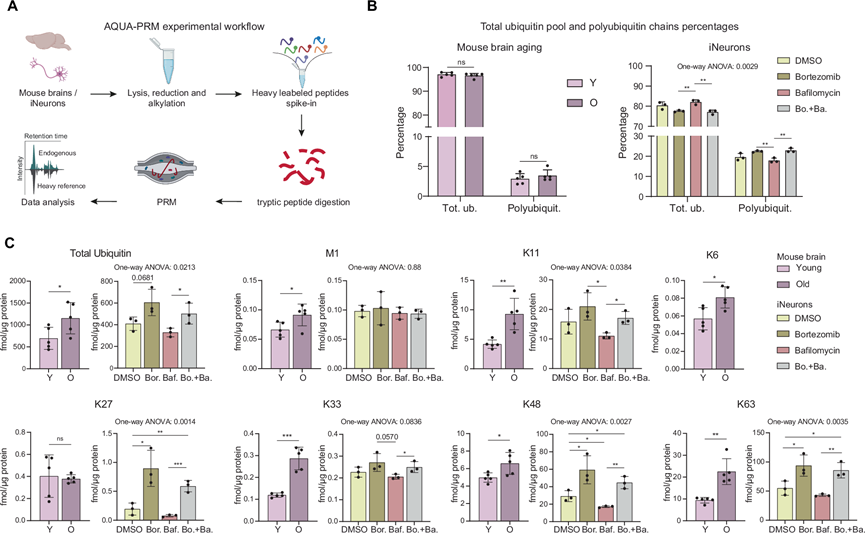
图4. 小鼠大脑和 iNeurons 中泛素链连接的定量。
(A) 绝对定量泛素链和总泛素池的实验方案。(B) 通过 AQUA-PRM 测量小鼠脑老化和药物治疗后 iNeurons 中总泛素和多泛素的百分比。(C) 年轻和老年小鼠大脑和 iNeurons 中的总泛素、线性(M1)和分支赖氨酸链绝对定量的条形图。
05
饮食干预对大脑泛素化蛋白质组的影响
最后,他们试图探究大脑中的蛋白质泛素化是否可以通过影响衰老的干预措施进行改变。他们专注于限制卡路里摄入的饮食干预,因为它们已证明可以促进认知功能并逆转各种生物体(包括啮齿动物和人类)的大脑衰老特征。为了探索饮食变化是否会对大脑中的蛋白质泛素化产生持久影响,他们让 26 个月大的雄性小鼠接受 30% 的饮食限制 (DR) 4 周,然后随意(AL) 重新喂食 (RF) 7 天(图 5A)。包括 RF 阶段是为了捕捉 DR 期间大脑泛素化的持续变化,并最大限度地减少应激反应和体重减轻的混杂效应(图 5A)。因此,他们从接受 DR + RF(以下称为 RF)和 AL 喂养对照小鼠的大脑中生成了泛素化和完整蛋白质组数据。RF 小鼠的蛋白质组除了已知受 DR 影响的少数蛋白质( 例如精氨酸酶-1(ARG1)和氨基甲酰磷酸合成酶 I(CPS1)外,变化很小(<1 %的定量蛋白质)(图5B-D)。相反,他们检测到 RF 对泛素化蛋白质组的明显影响(图 5B),37%的定量泛素化位点受到显著影响(图 5C-D)。GO富集分析显示,RF处理后,与髓鞘、溶酶体、线粒体和突触相关的蛋白质泛素化显著增加,大多数泛素化变化与蛋白质丰度无关。
接下来,他们研究了年龄和饮食干预是否影响相同蛋白质靶标的泛素化,并发现 39% 的交叉量化位点同时受到衰老和 RF 的显著影响(图 5E)。针对至少在一次比较中受到影响的位点,他们将衰老和 RF 引起的泛素组变化关联起来。该分析揭示了 RF 和衰老的影响之间 存在适度但统计学上显著的正相关性(图5F)。值得注意的是,1016 个泛素化位点表现出一致的调控,表明 RF 可能会加剧衰老对泛素化蛋白质组的一些影响。然而,约 23% 的泛素化位点表现出衰老和 RF 之间的相反调控。为了了解不同细胞组分如何受到饮食干预和衰老的影响,他们比较了两次实验中显著调控的泛素化位点中的富集情况(图 5G)。饮食干预加剧了髓鞘、溶酶体和蛋白酶体的蛋白质组分的泛素化,而突触后膜蛋白、核糖体大亚基和其他蛋白质组分的泛素化则发生逆转(图 5H)。
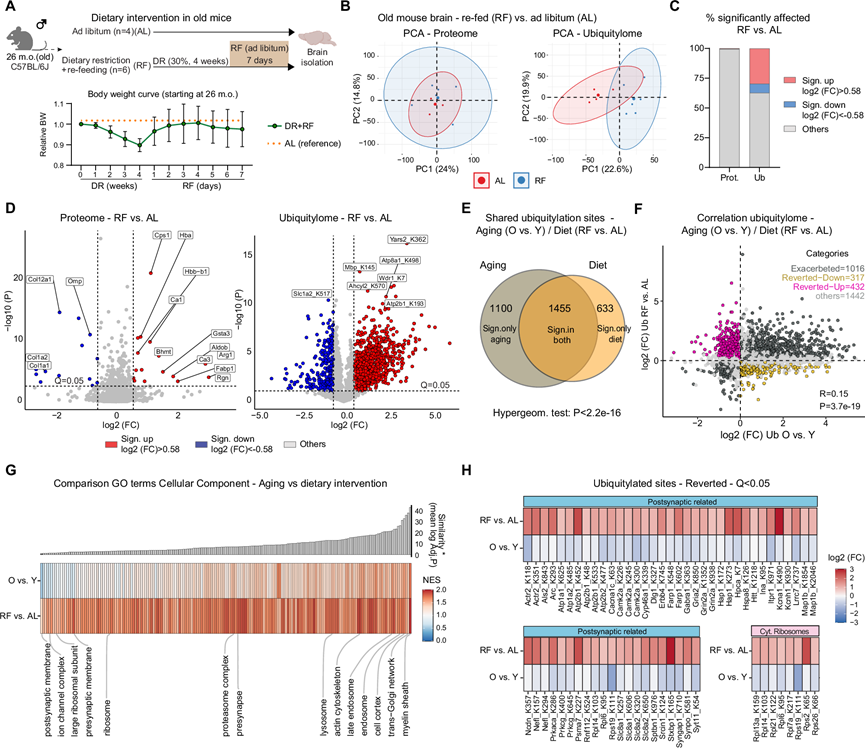
图5. 饮食干预对老年小鼠脑蛋白质组和泛素组的影响。
(A) 老年小鼠实施饮食干预的方案。(B) 基于自由采食(AL) 和重新采食小鼠 (RF) 的蛋白质组和泛素组数据的PCA。(C) 显著受影响的蛋白质或泛素化肽的百分比。(D) 火山图显示 RF 与 AL 小鼠的蛋白质丰度和泛素化肽变化。(E) 维恩图显示受衰老和饮食干预显著影响(Q < 0.05)的泛素化之间存在重叠。(F) 散点图说明了衰老过程中观察到的泛素化肽变化与老年小鼠饮食干预后的变化之间的关系。(G) 热图比较了对年龄相关和饮食引起的泛素化变化进行的基因集富集分析 (GSEA) 的归一化富集得分 (NES)。(H) 热图突出显示了通过饮食干预可回复的与年龄相关的泛素化变化。
+ + + + + + + + + + +
结 论
本研究利用质谱技术揭示了小鼠衰老大脑中数百个蛋白质泛素化、乙酰化和磷酸化位点的变化。结果表明,衰老对蛋白质泛素化有重大影响。29%的定量泛素化位点受到影响,且与蛋白质丰度无关,这表明 PTM 化学计量学发生了改变。利用 iPSC 衍生的神经元,本研究估计在衰老大脑中观察到的 35% 泛素化变化可归因于蛋白酶体活性降低。最后,本研究检测了饮食干预是否会对大脑中的蛋白质泛素化产生影响。一个周期的饮食限制和重新喂养会改变大脑的泛素组,挽救一些在老年大脑中观察到的泛素化变化,但加剧其他变化。本项研究结果揭示了一种可通过饮食干预改变的与年龄相关的泛素化特征,为了解蛋白质稳态受损的机制提供了见解,并突出了大脑衰老的潜在生物标志物。
+ + + + +



 English
English


