文献解读|Cell Metab(27.7):肠道微生物 L-鸟氨酸在增强乌司奴单抗治疗克罗恩病疗效中的协同作用
✦ +
+
论文ID
原名:Synergistic role of gut-microbial L-ornithine in enhancing ustekinumab efficacy for Crohn's disease
译名:肠道微生物 L-鸟氨酸在增强乌司奴单抗治疗克罗恩病疗效中的协同作用
期刊:Cell Metabolism
影响因子:27.7
发表时间:2025.05.06
DOI号:10.1016/j.cmet.2025.01.007
背 景
近年来,炎症性肠病 (IBD) 的治疗发生了革命性的变化,出现了以英夫利昔单抗和乌司奴单抗 (UST) 为代表的阻断炎症细胞因子作用的疗法。UST于 2016 年在美国和欧盟获批用于治疗克罗恩病 (CD),2020 年在中国获批。到目前为止,全球大量的前瞻性和回顾性研究证实了 UST 对治疗 IBD 的有效性。UST 是一种针对白细胞介素 (IL)-12/23 p40 亚基的 IgG1 单克隆抗体。它主要抑制 p40 亚基与 T 细胞上 IL-12RB1 受体的相互作用,从而抑制 IL-12 介导的 Th1 细胞活化和 IL-23 介导的 Th17 细胞活化。虽然 UST 在治疗 IBD 方面显示出巨大的潜力,但大约 40% 的患者仍然经历原发性无反应或继发性反应丧失。此外,由于缺乏足够的证据来预测对患者最有益的药物,现有的治疗策略通常涉及在先前的治疗失败后尝试不同的方案,这可能会导致延误和不太理想的结果。因此,确定影响 UST 治疗效果的因素并了解潜在的分子机制对于有效合理地在 IBD 患者中使用 UST 至关重要。
实验设计
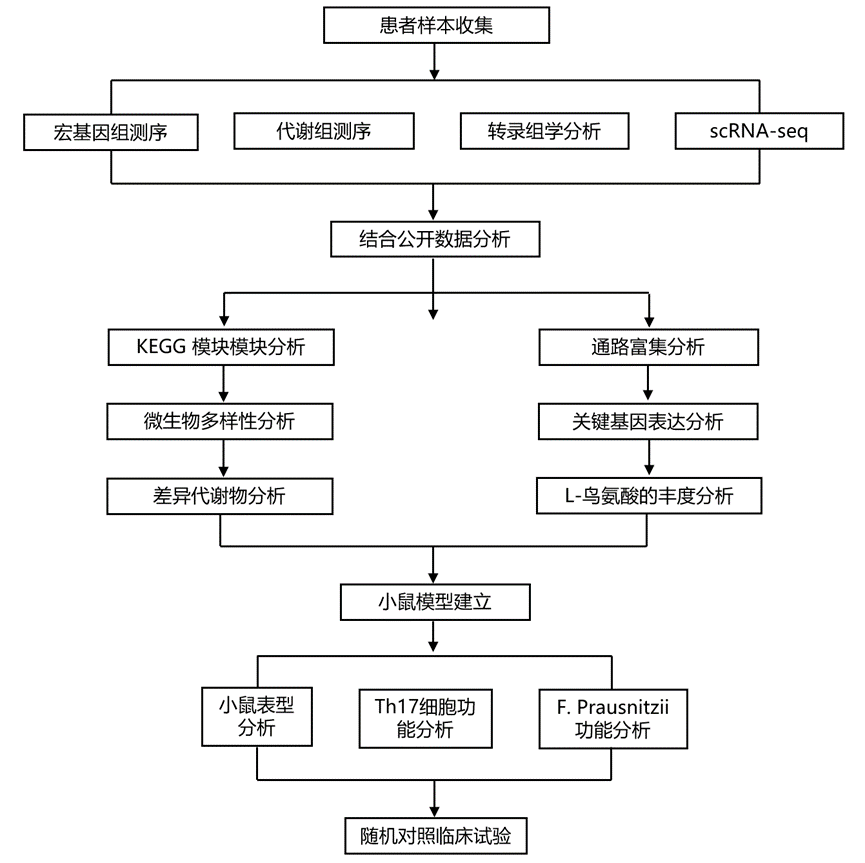
结 果
01
临床缓解和未缓解患者的基线宏基因组和代谢组特征可区分
本研究共纳入了来自上海交通大学附属仁济医院(n= 51)和中南大学附属湘雅三医院(n= 34)的 85 名计划接受标准 UST 治疗的 CD 患者。在 52 周的随访结束时,上海队列中 51.1% 的患者和长沙队列中 50.0% 的患者达到临床缓解(图 1)。为了研究 UST 治疗的关键决定因素,研究团队在基线时从 CD 患者收集了粪便和肠粘膜样本。他们对所有 85 名患者的粪便样本进行了宏基因组测序。此外,其中 48 名患者的粪便和肠粘膜样本都保存了下来,这使他们能够进行代谢组分析和转录组分析。
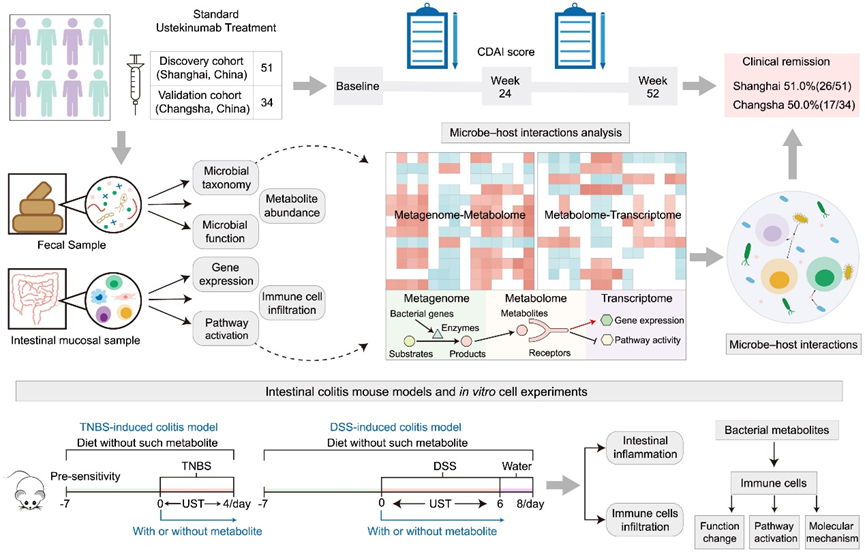
图1. 整体研究流程。
首先,他们利用 KEGG 数据库将微生物读段衍生的基因家族注释为KEGG直系同源物 (KO),最终鉴定出 7404 个 KO。为了便于解释与临床缓解相关的微生物功能,将KO 水平聚合成 216 个 KEGG 模块。对于这些模块,分析每个样本的富集分数,从而在模块级别降低宏基因组谱的维度。在发现和验证队列中,缓解和未缓解的患者在宏基因组分类和功能模块以及代谢物组成方面均表现出部分但显著的分离(图 2 A-B)。与之前的研究一致,接受 UST 治疗并达到临床缓解的患者表现出明显更高的微生物物种 alpha 多样性基线指数,包括丰富度和香农多样性。α多样性指数(丰富度和香农度)与红细胞沉降率(ESR)和C反应蛋白(CRP)水平呈负相关,但与其他主要临床和人口统计学特征无显著相关性。通过基于读取的分类法鉴定的20个物种在缓解组和非缓解组之间表现出不同的丰度,在发现队列和验证队列中具有一致的方向性(图2C)。Blautia sp_AF19_10LB(B. sp_AF19_10LB)、Faecalibacterium prausnitzii(F. prausnitzii)和Dysosmobacter welbionis(D. welbionis)的相对丰度在缓解组中增加最多,而大肠杆菌(E. coli)是减少最多的物种(图2C)。此外,丰度增加的物种与缓解期CD患者的ESR和CRP水平呈负相关。在获得的216个KEGG模块中,28个模块在缓解组中富集,而7个模块在非缓解组中富集(图2D)。“氨基酸生物合成和代谢”和“碳水化合物代谢”是缓解组主要富集的功能类别,而非缓解组则以“细菌运输和分泌系统”为主。
通过分析靶向代谢组学数据,他们发现了缓解期和非缓解期患者粪便代谢物的差异,结果在发现队列和验证队列中共鉴定出 26 种不同的代谢物(图 2 E)。大多数差异代谢物在缓解组中更为富集,但“脂质和脂质样分子”除外,而“脂质和脂质样分子”有所减少。Spearman 相关性分析显示,缓解期 CD 患者富集的代谢物水平与 ESR 和 CRP 水平呈负相关,表明这些代谢物可能对 CD 患者具有抗炎作用。先前研究表明,长链饱和脂肪酸会加重IBD的炎症表型,本研究中未缓解组中观察到的硬脂酸、棕榈酸和十七烷酸含量较高。然而,这些代谢物对UST治疗疗效的影响尚不清楚。值得注意的是,缓解组中含量更高的代谢物主要是氨基酸和有机酸,包括鸟氨酸生物合成的代谢终产物L-鸟氨酸(M044),这与CD患者宏基因组数据中观察到的KEGG模块改变相一致(图2 D)。
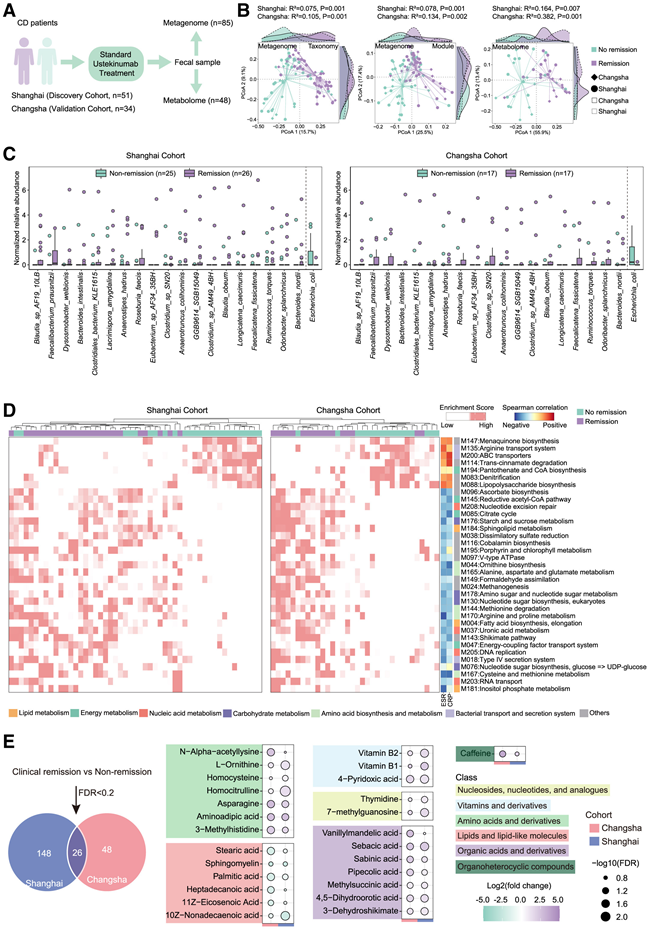
图2. 临床缓解和未缓解患者的基线宏基因组和代谢组特征可区分。
(A) 描述宏基因组和代谢组队列设计的示意图。(B) 在探索组(上海)和验证组(长沙)中,对缓解组和非缓解组的宏基因组分类、宏基因组模块和代谢物进行主坐标分析 (PCOA)。(C) 使用基于读段的分类法,绘制缓解组和非缓解组之间 20 个差异丰度物种(FDR < 0.2)的箱线图。(D) 聚类热图显示了发现队列和验证队列中差异富集的KEGG模块。(E) 气泡图显示了发现队列和验证队列中重叠的差异代谢物。
02
微生物-宿主相互作用的综合多组学分析
他们假设肠道菌群产生或消耗影响宿主基因表达和免疫细胞功能的代谢物,可能影响患者对 UST 治疗的反应。为了验证这一假设,他们沿宏基因组-代谢组-转录组轴进行了逐步中介分析。该分析评估了微生物组功能、代谢物水平和宿主基因表达的变化如何介导 CD 患者对 UST 治疗的反应(图 3 A)。首先,对缓解期和非缓解期 CD 患者的转录通路进行了差异分析,确定了缓解组中富集的 29 条信号通路和非缓解组中占主导地位的 14 条信号通路。中介分析显示,301个配对宏基因组-代谢组中介链接和 346 个配对代谢组-转录组中介链接对 CD 患者 UST 的临床缓解表现出显著的中介作用(图 3 B)。对于这些联系,正向中介效应明显强于相应的反向中介效应(图 3C),这表明微生物组直接影响患者对 UST 的缓解,从而影响代谢物水平的假设不成立。为了帮助解释宏基因组模块的功能,他们将生物学联系定义如下:如果宏基因组模块中的 KO 编码一种催化代谢物反应的酶,则认为该宏基因组模块和代谢物具有生物学联系。此外,如果转录组途径显示出与代谢物的显著中介和相关性,则由宏基因组模块、代谢物和转录组途径形成的轴可视为生物链。他们总共鉴定了 87 条与 UST 治疗临床缓解密切相关的宏基因组模块-代谢物-转录组途径生物连锁链(图 3D)。在所有生物链接模块和代谢物中,“M004:脂肪酸生物合成和延伸”和“棕榈酸”表现出显著的负相关性,因此在后续分析中排除。
通过将生物链接链纳入随机森林 (RF) 模型并根据其 AUC 值进行排序,他们确定对 UST 治疗最具预测性的生物链包括“M044:鸟氨酸生物合成”、“L-鸟氨酸”和“IL-12/23 至 JAK/STAT 信号通路”(图 3 E)。这些结果支持一个机制假设:即肠道微生物群中鸟氨酸生物合成增加导致通过 UST 治疗获得临床缓解的 CD 患者的 L-鸟氨酸水平升高。这种升高可能降低了宿主细胞中 IL-12/IL23 至 JAK/STAT 信号通路的激活,从而增强了 UST 治疗的有效性。随后,对 14 名 IBD 患者的单细胞转录组分析 (scRNA-seq) 数据进行比对,IL-12/23 至 JAK/STAT 信号通路在 Th1 和 Th17 细胞中激活程度最高(图 3F),而 Th1 和Th17细胞是 IBD 中的关键促炎细胞。有趣的是,在通过 UST 治疗获得临床缓解的 CD 患者的肠粘膜样本中,Th1 和 Th17 细胞的基线浸润水平明显较低(图 3G)。同时,Th1和Th17细胞的浸润水平与IL-12/23至JAK/STAT信号通路的激活呈显著正相关,与L-鸟氨酸的丰度呈显著负相关(图3H)。此外,他们利用CD患者的代谢组和转录组数据,研究了L-鸟氨酸与IL-12/23至JAK/STAT信号通路中必需基因表达的关系,相关性分析数据表明IL-12RB1与L-鸟氨酸的相关性最强(图3I)。在IBD患者的scRNA-seq数据中,Th1和Th17细胞中L-鸟氨酸从细胞外到细胞内的跨膜交换也与IL-12RB1的表达水平呈显著负相关(图3J)。在整个治疗过程中,IBD患者粪便中L-鸟氨酸的浓度保持相对稳定。值得注意的是,与IBD患者未缓解组相比,缓解组的IL-12RB1水平持续较高。基于这些数据,他们假设L-鸟氨酸对IL-12/23至JAK/STAT信号通路的抑制作用可能主要发生在Th1和Th17细胞中,并首先抑制IL-12RB1的表达。
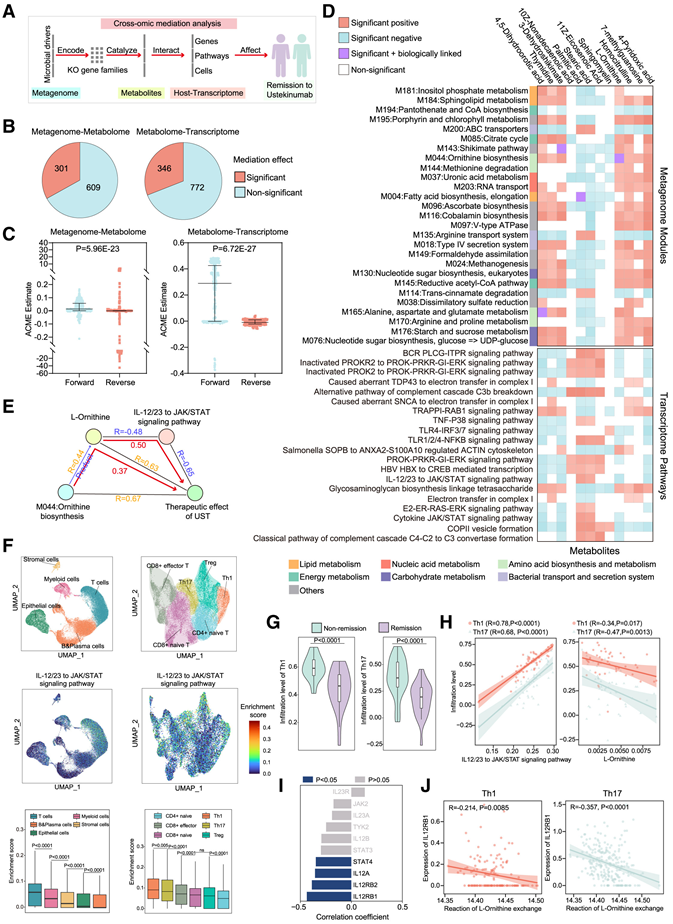
图3. 微生物-宿主相互作用的综合多组学分析揭示了L-鸟氨酸与UST协同作用的潜在机制。
(A) 微生物-宿主相互作用的多组学分析实验流程。(B)对宿主表型(缓解/非缓解)有或无显著中介效应的宏基因组模块-代谢物、代谢物-转录组通路配对数量。(C) 正向(宏基因组-代谢组-宿主表型,代谢组-转录组-宿主表型)和反向(宏基因组-宿主表型-代谢组,代谢组-宿主表型-转录组)中介效应比较。(D) 热图显示了与至少5个其他组学特征具有显著中介效应的组学特征。(E)宿主表型最重要的宏基因组-代谢组-转录组关联。(F) IL-12/23 在 IBD 患者不同细胞亚群中对 JAK/STAT 信号通路的富集评分。(G) 根据Bulk RNA-seq数据计算缓解组和非缓解组中Th1和Th17的浸润水平。(H) Th1/Th17 的浸润水平与 IL-12/23 对 JAK/STAT 信号通路的富集分数或 L-鸟氨酸的丰度的 Spearman 相关性分析。(I) L-鸟氨酸的丰度与IL-12/23至JAK/STAT信号通路关键基因的Spearman相关性分析。(J) IL-12RB1的表达和L-鸟氨酸交换反应进行 Spearman 相关性分析。
03
L-鸟氨酸增强小鼠结肠炎模型中 UST 介导的抗炎活性
为了全面评估L-鸟氨酸在促进UST治疗效果中的潜在作用,他们采用了2,4,6-三硝基苯磺酸(TNBS)、葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠模型,以及IL-10敲除(IL-10 KO)诱导的慢性结肠炎小鼠模型进行进一步验证。为了排除饮食中L-鸟氨酸对结果的影响,在诱导结肠炎小鼠模型之前,小鼠先喂食不含L-鸟氨酸的食物1周(图4A)。表型数据显示,L-鸟氨酸显著增强UST对TNBS诱导的炎症的抑制作用,其特点是体重减轻减少(图4B)、结肠缩短减少(图4C)以及腺体结构扭曲和炎症细胞浸润减少(图4D)。同样地,在DSS诱导和IL-10 KO诱导的结肠炎模型中,L-鸟氨酸与UST联合使用也表现出了协同减炎作用。流式细胞分析证实,L-鸟氨酸显著降低了用UST治疗的TNBS诱导小鼠肠粘膜中Th17细胞的浸润,但不影响Th1细胞的水平(图4E-G)。在用UST治疗的DSS诱导和IL-10 KO诱导的小鼠模型中也观察到了类似的现象。基于实验数据和多组学分析,他们假设L-鸟氨酸与UST的协同抗炎作用主要归因于其对Th17细胞的影响。因此,他们将后续研究导向调查 L-鸟氨酸影响 Th17 细胞功能的潜在机制。
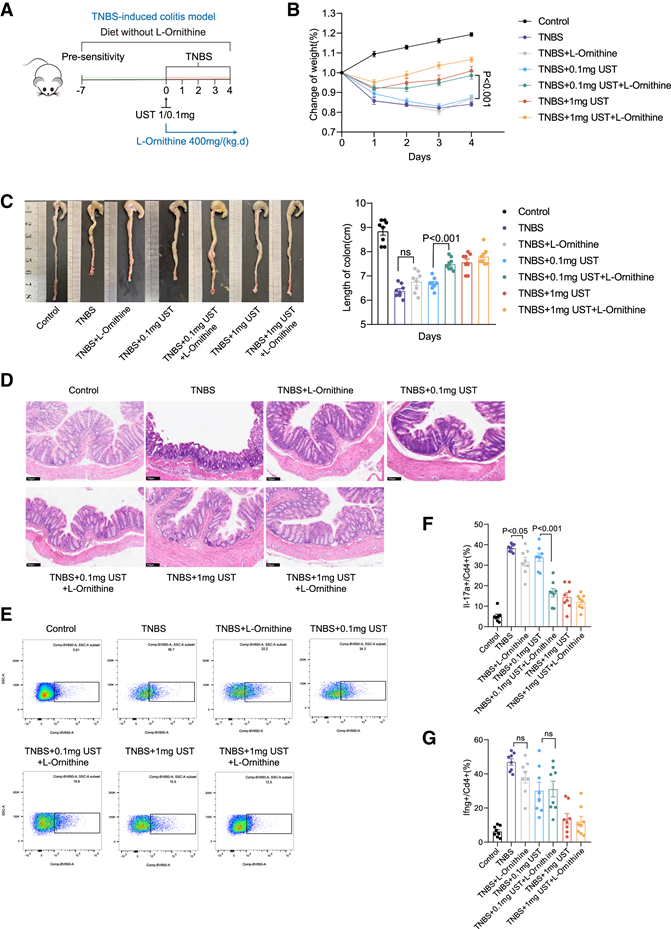
图4. L-鸟氨酸增强肠结肠炎小鼠模型中UST介导的抗炎活性。
(A) TNBS诱发的小鼠结肠炎模型中不同治疗的示意图。(B) 不同治疗方法下 TNBS 诱发结肠炎小鼠的体重变化。(C) 不同治疗条件下 TNBS 诱发结肠炎小鼠结肠大体形态和长度的变化。(D) 以 20 倍放大倍数显示 TNBS 诱发的结肠炎小鼠的 H&E 染色结肠切片。(E-F) 不同治疗组Th17细胞的流式细胞分析。(G) 不同小鼠组 Th1 细胞比例的流式细胞分析。
04
L-鸟氨酸通过阻断Egr1介导的IL-12rb1转录来抑制促炎性Th17细胞的功能
为了探究L-鸟氨酸和UST之间可能的协同抗炎机制,他们首先对TNBS诱导的结肠炎小鼠模型的结肠黏膜组织进行了转录组分析(RNA-seq)。基因集富集分析(GSEA)数据表明,与单独用UST治疗相比,L-鸟氨酸治疗显著抑制了小鼠IL-12/23对JAK/STAT信号通路的激活(图5 A)。进一步的RNA-seq分析数据显示,在TNBS诱导的结肠炎小鼠的肠道组织中,L-鸟氨酸治疗后,IL-12/23对JAK/STAT信号通路中只有IL-12rb1 (IL-23受体的组成部分)的表达显著下调(图5 B)。这些数据与之前的多组学分析一致,该分析发现CD患者中IL-12RB1和L-鸟氨酸丰度之间存在最强的负相关性(图3I)。有趣的是,GSEA 数据显示,与单独使用 UST 治疗的小鼠相比,使用 UST 加 L-鸟氨酸治疗的小鼠的 IL-17 信号通路 (KEGG) 受到显著抑制,但 Th1/Th2 通路 (BIOCARTA) 没有受到显著抑制。这些数据表明 L-鸟氨酸更有可能通过调节IL-12RB1表达来抑制 Th17 细胞中的 IL-12/23 至 JAK/STAT 信号通路。接下来,他们从小鼠脾脏中分离 CD4+ 幼稚 T 细胞,并使用 IL-6、抗 IL-4、抗 Ifn-γ 和转化生长因子 β (TGF-β) 将它们诱导成 mTh17(小鼠 Th17)细胞。进一步的实时 PCR 和蛋白质印迹数据证实,L-鸟氨酸处理后,mTh17 细胞中 IL-12rb1 的 mRNA(图 5 C)和蛋白质水平显著下调。为了探究L-鸟氨酸抑制IL-12rb1表达的机制,他们假设L-鸟氨酸可能影响mTh17细胞中IL-12rb1的转录。荧光素酶报告基因检测显示,经L-鸟氨酸处理后,mTh17细胞中IL-12rb1启动子的转录活性显著降低(图5D)。此外,他们使用dbtoolkit、GeneCards和UCSC数据库预测了18个可能调控IL-12RB1表达的转录因子(TF)。基于scRNA-seq数据,他们将研究重点缩小至Th17细胞中表达最高的三个TF(EGR1、ELF1和BHLHE40)。
实时 PCR 分析表明,Egr1在 mTh17 细胞中表达水平最高。利用 JASPAR 数据库预测 Egr1 在IL-12rb1启动子上的结合位点。另外,此前报道 EGR1 与 Th17 细胞的活化密切相关。因此,他们鉴定 EGR1是影响IL -12RB1表达的潜在 TF,受 L-鸟氨酸调控。实时 PCR 数据显示,在 mTh17 细胞中敲低Egr1后,IL-12rb1的 mRNA 水平显著降低(图 5 E),IL-12rb1启动子的转录活性也显著降低(图 5 F)。随后的染色质免疫沉淀 (ChIP)实验表明,L-鸟氨酸处理显著降低了mTh17 细胞中Egr1 与IL-12rb1启动子区的结合效率(图5 G)。然后他们研究了 L-鸟氨酸对 Egr1 本身的影响,发现它不会抑制mTh17 细胞中的Egr1 mRNA和蛋白质水平(图 5 H)。然而,在引入外源 L-鸟氨酸后,mTh17 细胞中细胞内 L-鸟氨酸水平显著增加,这使他们假设 L-鸟氨酸可能进入 Th17 细胞并直接影响 EGR1 功能。此外,AutoDock Vina 预测 L-鸟氨酸会与 EGR1 的锌指结构域结合。已知该结构域对于 EGR1 结合基因启动子区域并启动转录至关重要。
表面等离子体共振(SPR)分析进一步证实L-鸟氨酸能直接与EGR1结合(图5 I)。随后,他们用IL-23和L-鸟氨酸联合处理mTh17细胞,分析其对IL-12rb1下游信号分子的影响(图5 J)。Western blot分析显示,L-鸟氨酸处理后mTh17细胞中IL-23受体信号下游效应分子Tyk2和Stat3的磷酸化水平明显降低(图5 K)。同时,在mTh17细胞中,L-鸟氨酸处理后Rorc、IL-17a、IL-17f和IL-22的mRNA表达水平也明显降低(图5 L)。ELISA数据进一步验证了结果的可靠性。这些数据表明 L-鸟氨酸可能通过直接结合 EGR1下调IL-12RB1表达,从而抑制 IL-23 诱导的 Th17 细胞稳定。
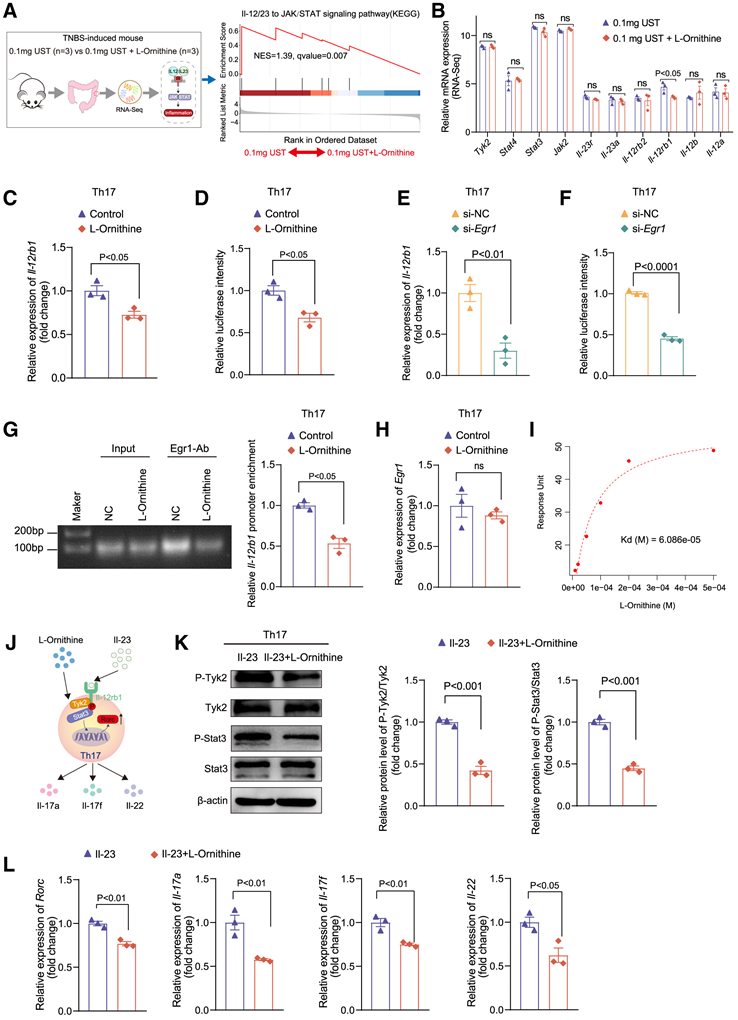
图5. L-鸟氨酸通过阻断Egr1介导的 IL-12rb1转录抑制促炎性Th17细胞的功能。
(A)实验示意图。(B) 来自Bulk RNA测序数据中IL-12/IL23至JAK/STAT信号通路中关键基因的表达情况。(C) 比较对照组和 L-鸟氨酸治疗组 mTh17 细胞中IL-12rb1的相对 mRNA 表达。(D) 比较对照组和 L-鸟氨酸治疗组 mTh17 细胞中IL-12rb1启动子的相对荧光素酶强度。(E) 比较 si-NC 和 si- Egr1治疗组的 mTh17 细胞中IL-12rb1的相对 mRNA 表达。(F) 比较si-NC 和 si- Egr1组的 mTh17 细胞中IL-12rb1启动子的相对荧光素酶强度。(G) 染色质免疫沉淀 (ChIP) 测定和实时 PCR 显示对照组和 L-鸟氨酸治疗组的 mTh17 细胞中Egr1 与IL-12rb1启动子的结合效率。(H) 比较对照组和 L-鸟氨酸治疗组 mTh17 细胞中Egr1的相对 mRNA 表达。(I) BIAcore 测量 L-鸟氨酸和 EGR1 纯化蛋白之间的相互作用。(J) mTh17 细胞中 IL-23 受体信号通路的示意图。(K) 比较 IL-23 和 IL-23+L-鸟氨酸治疗组的 mTh17 细胞中 P-Tyk2、Tyk2、P-Stat3 和 Stat3 的蛋白质水平。(L) 比较IL-23 和 IL-23+L-鸟氨酸治疗组的 mTh17 细胞中Rorc、IL-17a、IL-17f和IL-22的相对 mRNA 表达。
05
以F. prausnitzii为代表的肠道菌群促进临床缓解的 CD 患者的 L-鸟氨酸生物合成
为了探究宿主细胞是否是粪便样本中 L-鸟氨酸来源的一部分,他们分析了缓解组和非缓解组参与 L-鸟氨酸合成的宿主细胞中关键基因编码合酶(ARG1、ARG2和OAT)的表达水平。RNA-seq 数据显示,除了缓解组ARG2表达降低外,ARG1和OAT的表达并没有显著差异(图 6A),这表明临床缓解患者中 L-鸟氨酸的增加不太可能归因于宿主细胞。接下来,他们检测了抗生素治疗前后健康小鼠粪便样本中的 L-鸟氨酸水平。ELISA 数据显示,抗生素治疗导致粪便样本中 L-鸟氨酸水平显著降低(图6B),这表明肠道中的 L-鸟氨酸可能主要来自肠道微生物群。
为了鉴定负责L-鸟氨酸生物合成的微生物种类,他们对M044:鸟氨酸生物合成模块进行了差异分析。分析数据显示,除K01438(乙酰鸟氨酸脱乙酰酶)和K14682(氨基酸N-乙酰转移酶)外,该模块中的所有其他KO在缓解组中均显著上调。他们发现了M044鸟氨酸生物合成中每个关键KO的具体功能作用及其改变模式(图6C)。随后的RF预测模型发现,K00145(N-乙酰-γ-谷氨酰磷酸还原酶)、K00930(乙酰谷氨酸激酶)和K00821(N-琥珀酰二氨基庚二酸氨基转移酶)是对整个L-鸟氨酸生物合成模块贡献最重要的KO。他们进一步探究了微生物种类对三个KO的贡献。离差相关分析表明,KO(K00145、K00930和K00821)的组成可能受到Anaerostipes hadrus(A. hadrus)、Ruminococcus twists(R.torques)和F. prausnitzii的影响,它们都在缓解组中富集。中介分析和相关性分析表明,只有F. prausnitzii通过M044:鸟氨酸生物合成对L-鸟氨酸的丰度表现出显著的正中介作用(图6D)。在整个处理过程中,F. prausnitzii的丰度在 IBD 患者粪便中保持相对稳定。与非缓解组相比,缓解组中其丰度始终较高。此外,ELISA 数据显示,F. prausnitzii治疗可显著提高 C57 小鼠肠道中 L-鸟氨酸的水平(图 6E)。在 TNBS 诱发的小鼠结肠炎模型中(图 6F),UST 和F. prausnitzii的组合可显著减少体重减轻(图 6 G)、结肠缩短(图 6 H)、腺体结构扭曲和炎症细胞浸润(图 6 I)以及 Th17 细胞的含量(图 6 J)。同样,在 DSS 诱发的结肠炎模型中,F. prausnitzii与 UST 联合使用时也表现出减轻炎症的协同作用。用F- prausnitzii接种小鼠粪便上清液处理 mTh17 细胞后,IL-12rb1的表达显著降低(图 6K)。与 L-鸟氨酸类似,F.-prausnitzii接种小鼠粪便上清液也显著抑制了 IL-23 激活的 Tyk2 和 Stat3 磷酸化(图 6L)以及 mTh17 中Rorc、IL-17a、IL-17f和IL-22的 mRNA 水平(图6M)。此外,F. prausnitzii还显著抑制了从 TNBS 诱发的结肠炎小鼠中分选出的 Th17 细胞中Rorc、IL-17a、IL-17f和IL-22的 mRNA 水平。此前,F. prausnitzii是一种产丁酸的微生物。因此,他们接下来研究了丁酸是否也能抑制mTh17 细胞中IL-12rb1的表达。实时荧光定量 PCR 数据显示,丁酸并不抑制mTh17 细胞中IL-12rb1 的表达或其启动子活性。这些数据表明,F. prausnitzii抑制了 Th17 细胞的活化,并通过促进 L-鸟氨酸的产生(而非丁酸)来增强 CD 患者的 UST 治疗效果。
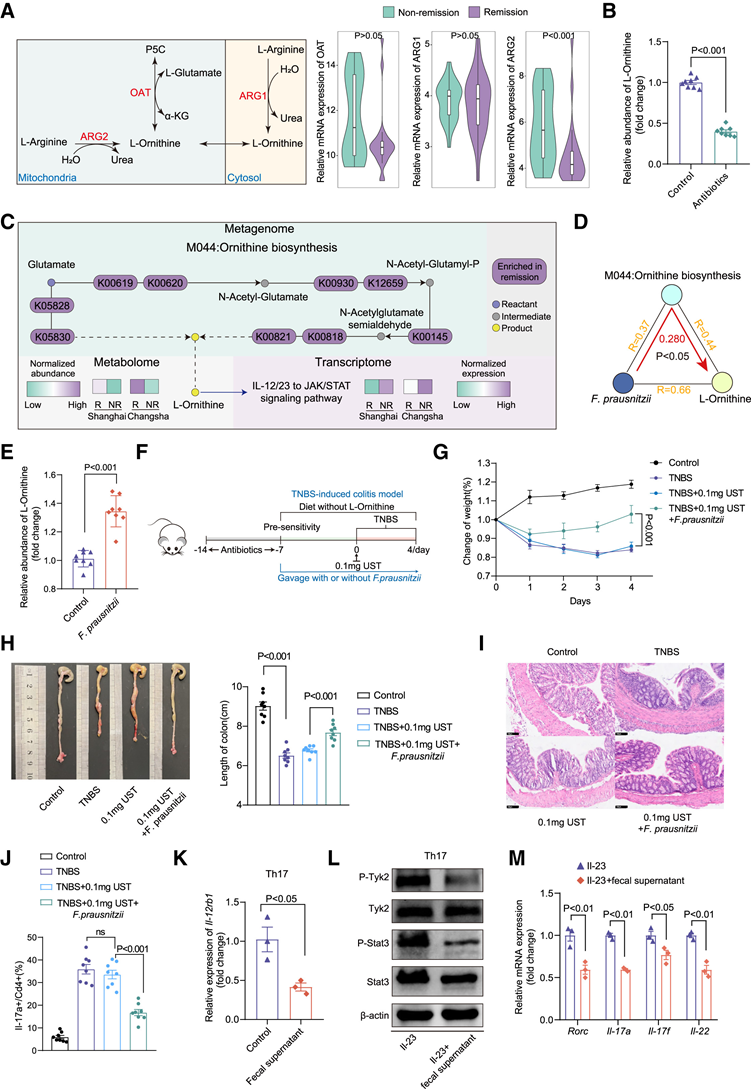
图6. 以 F. prausnitzii为代表的肠道菌群促进临床缓解期CD患者的L-鸟氨酸生物合成。
(A) 利用Bulk RNA-seq数据分析宿主细胞中L-鸟氨酸的潜在胞内来源,以及参与L-鸟氨酸合成的关键基因(ARG1、ARG2、OAT)的mRNA表达水平。(B) 比较对照组和抗生素治疗组小鼠粪便样本中 L-鸟氨酸的相对丰度。(C) 对 M044 宏基因组模块中关键 KO 及其改变方向的生物学解释:鸟氨酸生物合成。(D) F. prausnitzii、M044:鸟氨酸生物合成和L-鸟氨酸之间的中介联系。(E) 比较对照组和管饲组小鼠粪便样本中 L-鸟氨酸的相对丰度以及F. prausnitzii治疗组小鼠粪便样本中的 L-鸟氨酸相对丰度。(F) TNBS 诱发的小鼠结肠炎模型中不同治疗的示意图。(G) 不同治疗方法下 TNBS 诱发结肠炎小鼠的体重变化。(H) 不同治疗条件下 TNBS 诱发结肠炎的小鼠结肠大体形态和长度的变化。(I) 以 20 倍放大倍数显示 TNBS 诱发的结肠炎小鼠的 H&E 染色结肠切片。(J) 不同小鼠组 Th17 细胞比例的流式细胞分析。(K) IL-12rb1的相对 mRNA 表达。(L) P-Tyk2、Tyk2、P-STAT3 和 STAT3 的蛋白质水平。(M) Rorc、IL-17a、IL-17f和IL-22的相对 mRNA 表达。
06
在随机对照临床试验中,补充 L-鸟氨酸可增强 CD 患者 UST 治疗的疗效
由于 L-鸟氨酸在达到临床缓解的 CD 患者粪便样本中显著富集,为了更好地评估 L-鸟氨酸对 UST 的协同抗炎作用的临床应用价值,他们接下来招募了 16 名经过 24 周标准 UST 治疗后 Harvey-Bradshaw 指数 (HBI) 显著降低但未达到内镜缓解的 CD 患者。患者随机分为 L-鸟氨酸 + UST 治疗组 (n = 8) 和 UST 治疗组 (n= 8)。L-鸟氨酸 + UST 治疗组患者接受标准化 UST 治疗,每天口服两次 1.5 mg L-鸟氨酸,连续 12 周,每周通过电话咨询进行随访(图 7 A)。两组之间的主要临床和人口统计学特征没有显著差异。疾病活动性评分数据显示,与仅接受标准化 UST 治疗的患者相比,补充 L-鸟氨酸的患者 HBI水平下降更为显著(图 7 B)。此外,补充 L-鸟氨酸的患者在同一节段的临床病变改善更为显著,CD 的简单内镜评分 (SES-CD) 降低更为显著(图 7C)。补充 L-鸟氨酸还可导致 CD 患者的病理减少更为明显(图 7 D)。为了评估 L-鸟氨酸是否可以增强其他生物药物的抗炎作用,他们在 TNBS 诱导的小鼠结肠炎模型中研究了 L-鸟氨酸与低剂量 risankizumab 或英夫利昔单抗的组合。表型和组织学评分数据表明,与单独使用risankizumab和英夫利昔单抗相比,L-鸟氨酸与低剂量risankizumab和英夫利昔单抗联合使用并未提高这些药物缓解肠道炎症的疗效。这些结果表明,L-鸟氨酸特异性地增强了UST治疗结肠炎的疗效(图7E)。此外,L-鸟氨酸与UST联合治疗有望解决单用UST疗效不佳的CD患者获得缓解的临床挑战。
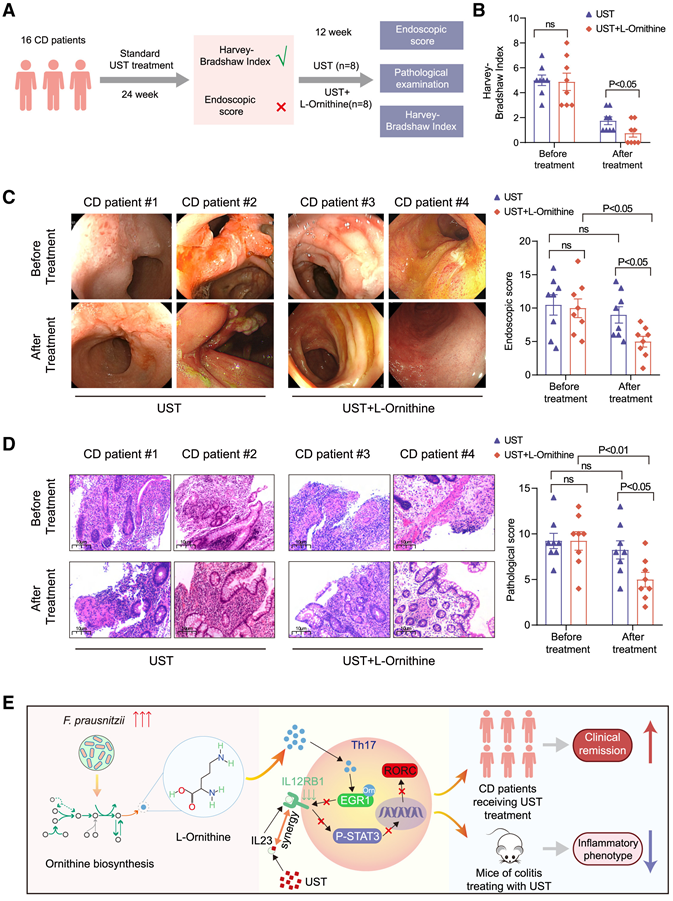
图7. 在随机对照临床试验中,补充 L-鸟氨酸可增强 CD 患者 UST 治疗的疗效。
(A) 随机对照临床试验的示意图。(B) 比较 CD 患者接受 UST 和 UST + L-鸟氨酸治疗 12 周后的 Harvey-Bradshaw 指数 (HBI)。(C) CD 患者代表性内镜图像及 UST 和 UST + L-鸟氨酸治疗 12 周后的临床评分汇总图。(D) CD 患者代表性结肠切片及 UST 和 UST + L-鸟氨酸治疗 12 周后的病理评分汇总图(放大 100 倍)。(E)机制示意图。
+ + + + + + + + + + +
结 论
本研究探讨了接受UST治疗的 CD 患者的微生物-宿主相互作用,采用多组学整合和中介分析技术,分析了 85 例 CD 患者的粪便宏基因组、代谢组和宿主转录组数据。研究结果揭示了显著的微生物组-代谢物-宿主相互作用。具体而言,F. prausnitzii与 L-鸟氨酸生物合成改变有关,导致患者在接受 UST 治疗前 L-鸟氨酸水平升高。体内和体外研究表明,来自微生物组的 L-鸟氨酸可通过干扰宿主的 IL-23 受体信号传导并通过 IL-12RB1/TYK2/STAT3 轴抑制 Th17 细胞稳定性,从而增强 CD 对 UST 治疗的敏感性。一项前瞻性临床试验证实,L-鸟氨酸可显著增强 UST 对 CD 患者的治疗效果。这些发现表明,针对特定的微生物-宿主代谢途径可能会提高IBD治疗的疗效。
+ + + + +



 English
English


