文献解读|Nat Commun(14.7):多组学分析揭示复发性 I 期非小细胞肺癌的生物学和临床见解
✦ +
+
论文ID
原名:Multi-omics analyses reveal biological and clinical insights in recurrent stage I non-small cell lung cancer
译名:多组学分析揭示复发性 I 期非小细胞肺癌的生物学和临床见解
期刊:Nature Communications
影响因子:14.7
发表时间:2025.02.10
DOI号:10.1038/s41467-024-55068-2
背 景
肺癌是全球最常见的恶性肿瘤,也是癌症死亡的主要原因。约 85% 的肺癌病例为非小细胞肺癌 (NSCLC),而肺腺癌 (LUAD) 和肺鳞状细胞癌 (LUSC) 是 NSCLC 的两种主要亚型。目前临床上手术是早期 NSCLC 的标准治疗方法。然而,即使可以手术切除,复发仍然是一项重大挑战。据估计,20%-40% 的 I 期 NSCLC 患者会经历肿瘤复发。约80 %的复发发生在手术后2年内并导致治疗失败。复发后 5 年生存率极低,为 15% 至16.6 %。因此,迫切需要阐明 I 期 NSCLC 术后复发的生物学机制。
实验设计
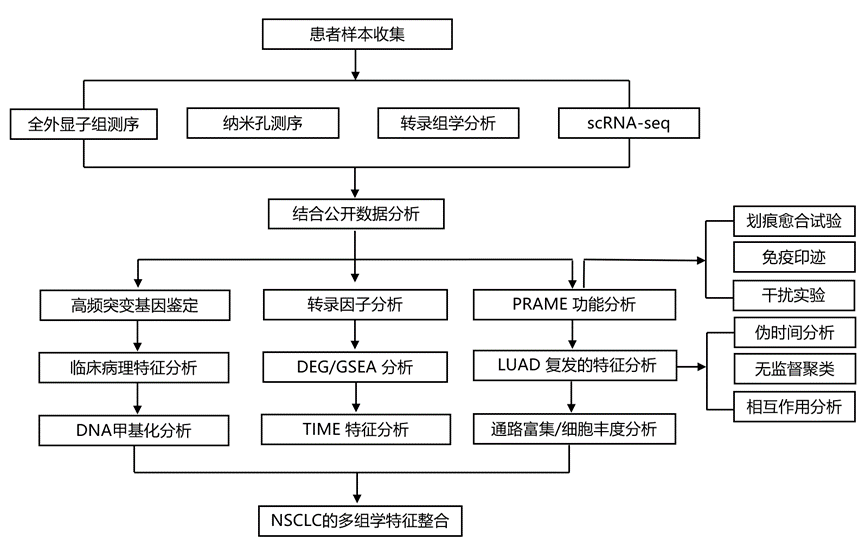
结 果
01
I 期 NSCLC 患者群体概述
为了全面阐明早期 NSCLC 术后复发的多组学特征,纳入了 122 例未接受过治疗的 I 期 NSCLC 患者的样本。采集了 47 名患者的新鲜冷冻(FF)肿瘤组织和配对的癌旁正常组织。提取 DNA 和 RNA,并进行了全外显子组测序 (WES)、纳米孔测序和转录组分析(RNA-seq)以及单细胞转录组分析(scRNA-seq)。根据至少 3 年的随访,患者分为复发(Rec,n = 57)组和非复发(NonRec,n = 65)组(图 1a)。
为了揭示与术后复发相关的基因组特征,他们对 108 名 NSCLC 患者进行了全面分析,这些患者包括 47 名具有 FF 组织的患者和 61 名具有 FFPE 组织的患者,他们发现了 Rec 和 NonRec 组中的一系列体细胞突变、基因特征、克隆结构和结构变异 (SV)。
与先前的研究一致,他们发现已知的致癌基因和肿瘤抑制基因体细胞突变包括TP53(47%)、EGFR(30%)、APC(11%)在本研究队列中普遍存在。他们还对 LUAD 样本应用了更精细的亚型分类,将其分为低级别(贴壁型)、中级别(腺泡、乳头状)和高级别(微乳头状、实性)为主的组,高级别为主的组的肿瘤患者的复发率最高。TP53突变是所有组中最常见的突变,但其在以高级别为主的组中的发生率(75%)明显高于中/低级别为主的组。此外,TP53突变在 LUAD 的 Rec 组中更常见,提示其潜在的恶性程度更高。然后,他们进一步分析了与位点差异和复发时间相关的突变。与胸内复发相比,发生胸外复发的患者已知驱动基因(包括TP53和EGFR)的突变比例更高(图 1c-d)。据报道,DNA 结合域中的TP53错义突变会影响 p53 23的功能,因此他们还研究了其在复发时间中的作用,并发现它与较差的无复发生存期(RFS)显著相关。
根据突变谱,他们鉴定出 4 个突变特征(Sig1、Sig2、Sig3 和 Sig4)。Sig 1 与 APOBEC 家族相关,而 Sig 2 与缺陷的 DNA 错配修复(dMMR)相关,由 C > T 转换24定义,这两者在 Rec 组中均有所增加(图 1e)。此外,尽管 Rec 组和非 Rec 组的拷贝数变异(CNV)负担和肿瘤突变负担(TMB)没有差异,但 LUAD Rec 组的同源重组缺陷(HRD)评分明显更高(图 1f)。
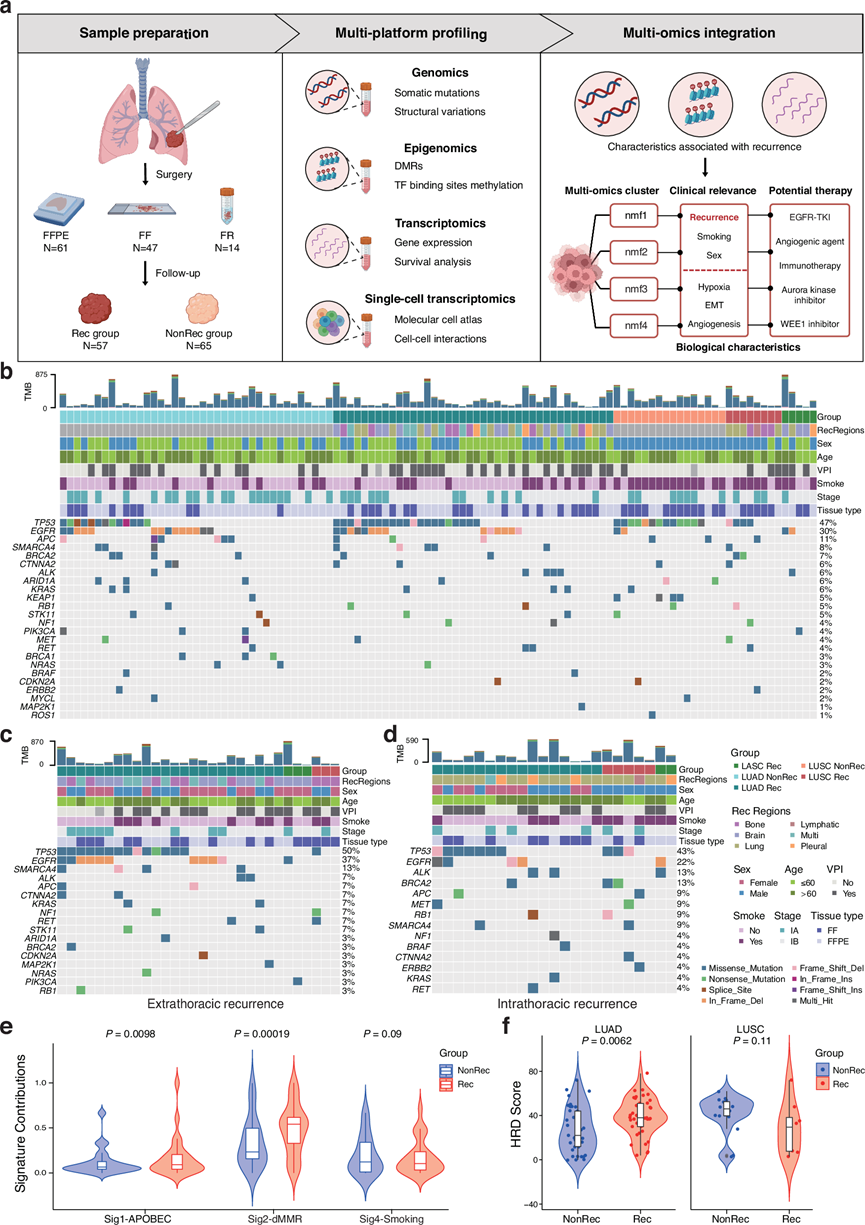
图1. NSCLC 复发队列的研究设计和基因组特征概述。
(a) 研究设计的示意图。(b) FF和 FFPE 队列中 Rec 和非 Rec NSCLC 组之间的临床病理特征和体细胞基因突变。(c-d) 胸外复发和胸内复发病例的临床病理特征和体细胞基因突变。(e) 小提琴图描绘了 Rec和非 Rec组中突变特征的贡献。(f) 小提琴图描绘了 Rec和非 Rec组中的 HRD 评分。
02
DNA甲基化与术后复发相关
以 DNA 甲基化为例的表观遗传学改变导致了各种癌症(包括肺癌)的肿瘤发生、复发和转移。他们应用纳米孔测序数据来评估 Rec 和非 Rec NSCLC 组之间的 DNA 甲基化谱,确定了差异甲基化区域 (DMR)(图2a-b)。总体而言,在 LUAD 中发现了 11412 个 DMR,而在 LUSC 中发现了 28671 个 DMR。在 LUAD 和 LUSC 中,都观察到 DMR 在不同调控区域中的分布趋势相似。这些变化大部分发生在内含子区域,其次是远端基因间区域和启动子区域。
CpG 甲基化水平分析表明,与 NonRec 组相比,Rec 组的 LUAD 和 LUSC 均表现出明显的低甲基化(图 2c)。为了确定 NSCLC 复发中的表观遗传失调通路,他们对 Rec 组的低甲基化基因进行了通路富集分析,结果表明 LUAD 中的 EMT 和 LUSC 中的炎症反应激活。EMT 是一个众所周知的细胞程序,通过重塑细胞间和细胞-细胞外相互作用参与恶性进展。此外,KEGG 分析表明 Rap1 信号通路和 ECM-受体相互作用在 LUAD 和 LUSC Rec 组中均富集。
DNA甲基化可以调节基因表达,肺癌原发性病变中差异甲基化和基因表达的相互作用已用于预测癌症进展。总的来说,他们分别在 LUAD 和 LUSC 的 Rec 组中鉴定了 1642 个和 3613 个显著低甲基化的基因。此外,他们还检测了 Rec 组中低甲基化基因的表达水平。有趣的是,他们发现 LUAD 中有 6 个基因和 LUSC 中有 8 个基因在 Rec 组中同时低甲基化和上调(图 2d)。转录因子 (TF) 的结合可以因其 DNA 结合位点的甲基化而减少。因此,为了研究 TF 结合位点的甲基化如何影响靶基因的表达,他们确定了驱动低甲基化基因过度表达的 TF 组以进行进一步分析。随后,利用活性评分来评估特定基因的表达与 TF 结合位点甲基化水平之间的关联(图 2e-f)。最强烈激活的基因是位于 22 号染色体上的PRAME。在PRAME的相关 TF 中,TEAD1在调节组织稳态和肿瘤发生中起着关键作用。TEAD1及其辅激活因子 YAP/TAZ 的异常激活与各种癌症的进展有关。这些结果还表明,TEAD1结合位点的低甲基化与PRAME过表达相关(图 2g),并且TEAD1表达与PRAME表达呈正相关(图 2h)。综上所述,Rec组与NonRec组相比存在明显的低甲基化,这可能影响基因表达水平并导致术后复发。
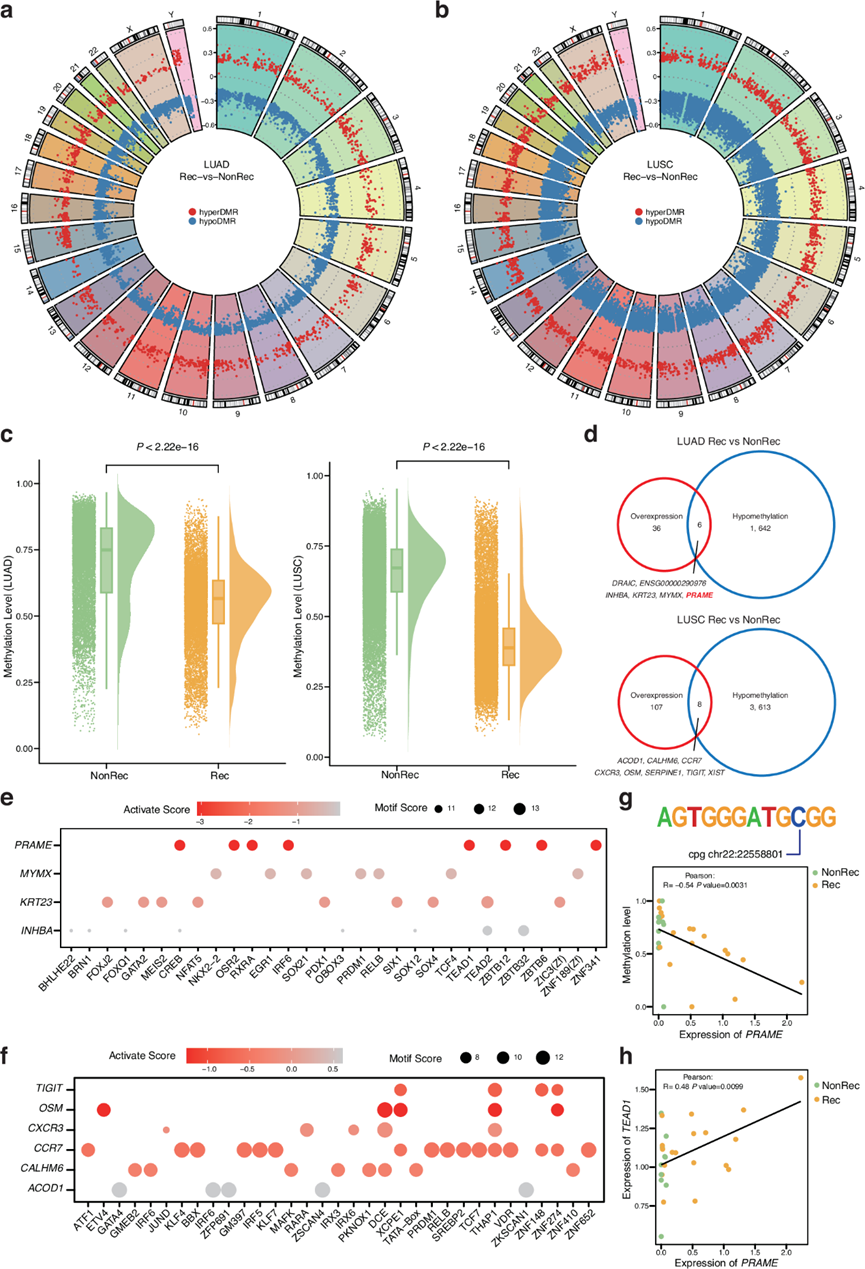
图2. NSCLC群体的甲基化特征。
(a-b) LUAD和 LUSC中 DMR 的分布。(c) Rec和 NonRec组之间的甲基化水平比较。(d) Rec 和 NonRec 组之间的低甲基化和上调基因。(e-f) 整合了 LUAD和 LUSC中 TF 结合位点甲基化与靶基因表达之间关联的活性图。(g) TEAD1结合基序的甲基化水平与PRAME表达之间的相关性。(h) TEAD1和PRAME表达的相关性。
03
与 I 期 NSCLC 术后复发相关的转录组特征
利用差异表达分析来识别与 I 期 NSCLC 术后复发相关的转录组特征。Rec 组和非Rec 组之间 LUAD 共有 85 个差异表达基因 (DEG),LUSC 共有 206 个 DEG(图 3a-b)。复发性 LUAD 中高表达的基因包括PRAME、DRAIC和DUXAP8(图 3a),而COL22A1、TIMD4和PLA2G2D在 LUSC 的 Rec 组中显著上调(图 3b)。然后他们整合临床数据来评估 DEG 的预后价值。LUAD 中的DRAIC和DUXAP8以及LUSC 中的TIMD4和COL22A1证实为与较差 RFS 相关的潜在“高风险基因”。有趣的是,DRAIC和DUXAP8分别是促进乳腺癌和胰腺癌进展的致癌基因。此外,高表达TIMD4的腔内驻留巨噬细胞可削弱 CD8 + T 细胞的抗肿瘤活性,从而促进癌症进展。
为了探索驱动肺癌复发的生物学过程,他们随后对 MSigDB Hallmarks 基因集进行了基因集富集分析 (GSEA),并揭示了富集的通路(图 3c-d)。在 LUAD 和 LUSC 的 Rec 组中观察到已知可触发癌细胞迁移和播散的 EMT 和血管生成等途径的激活(图3c-d)。此外,GO 和 KEGG 分析还表明细胞外基质和细胞粘附分子相关通路在 Rec 组中上调(图 3e-f)。值得注意的是,细胞外基质重塑可能导致上皮细胞与邻近细胞和基底膜分离,这对 EMT 40至关重要。整合素等细胞粘附分子可能导致肿瘤血管生成。因此,EMT和血管生成是与I期NSCLC复发相关的常见生物学行为。
肿瘤免疫微环境(TIME)在肺癌进展中起着至关重要的作用。为了表征与NSCLC复发相关的TIME,使用定义的基因集(幼稚:TCF7,SELL,LEF1,CCR7;耗竭:LAG3,TIGIT,PDCD1,HAVCR2,CTLA4;细胞毒性:TNFSF10,CST7,GZMA,GZMB,NKG7,GNLY,IFNG,PRF1)整合单样本基因集富集分析(ssGSEA)评分。他们观察到Rec组的naïve和exhausted标记明显较高,而Rec组和非Rec组之间的细胞毒性评分没有显著差异,表明免疫抑制环境有利于复发(图 3g)。最重要的是,该研究揭示了与 NSCLC 复发相关的关键 DEG,并强调激活的 EMT 和血管生成特征可能导致 I 期 NSCLC 术后复发。此外,Rec 组的疲劳评分高于 NonRec 组,表明 TIME 受到抑制。
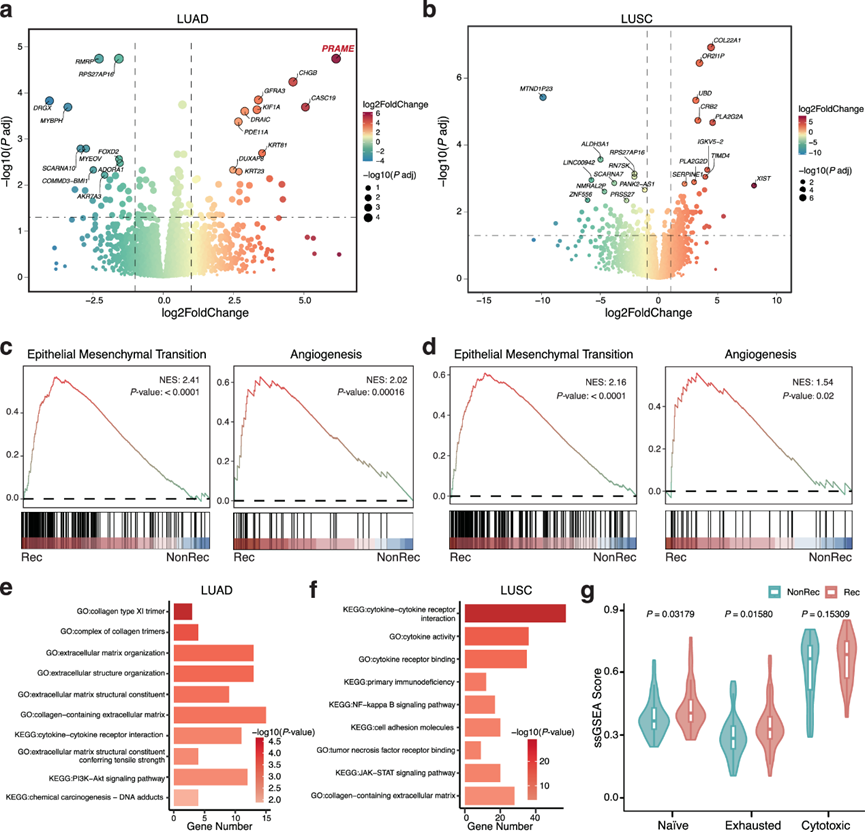
图3. Rec 和 NonRec NSCLC 组的转录组学表征。
(a) 火山图显示 Rec 和 NonRec LUAD 组中的 DEG。(b) 火山图显示 Rec 和 NonRec LUSC 组中的 DEG。(c) Rec和 NonRec LUAD 组之间的EMT和血管生成评分。(d) Rec 和 NonRec LUSC 组之间的 EMT 和血管生成评分。(e-f)GO富集分析。(g) 根据 Rec和 NonRec组之间的 ssGSEA 评分得出的幼稚状态、衰竭状态和细胞毒性状态评估。
04
PRAME是 I 期 LUAD 术后复发的关键基因
如前所述,他们观察到PRAME在 LUAD Rec 组中高表达且低甲基化。在功能上,PRAME调节细胞死亡和视黄酸受体信号传导,这可能导致肿瘤进展和预后恶化。
为了获得综合的视角,他们创建了一个坐标轴,整合了 LUAD Rec 组与 NonRec 组的转录组和表观基因组学结果,其中将PRAME基因确定为考虑差异表达和差异甲基化水平的最显著基因(图 4a)。在相关性分析中,LUAD 样本中PRAME的甲基化和表达之间存在明显的负相关性(图 4b)。此外,基于PRAME的表达水平,将LUAD 样本分为PRAME -high组和PRAME -low组。Hallmark 分析显示,与PRAME -low组相比,多种增殖和转移相关通路如 EMT、MYC 靶标 v1、E2F 靶标和 MTORC1 信号传导在PRAME-high组中显着正向富集(图 4c)。此外,生存分析显示PRAME-high表达与较差的 RFS 相关,P值为 0.0065(图 4d)。
为了研究PRAME在LUAD复发中的作用,他们首先将PRAME cDNA扩增到A549、PC9和H1299细胞(PRAME -OE细胞)中。划痕愈合试验显示,与对照细胞相比, PRAME -OE细胞中的细胞迁移率显著增强(图4e)。转录组分析表明,PRAME过表达上调了EMT基因特征、E2F靶基因特征以及参与细胞增殖和迁移的多种通路(图 4f-h)。RT-qPCR的结果验证了PRAME过表达后EMT相关基因ACTA2、COL1A1、DAB2、MMP2和TAGLN的相对表达水平上调(图 4i)。与转录组分析一致,免疫印迹显示,与对照细胞相比,PRAME -OE 细胞中增殖和迁移相关蛋白 mTOR、PCNA 和 Rap1 上调(图4j)。此外,他们引入了针对PRAME基因的小干扰 RNA (siRNA) 来抑制其在 A549、H1299 和 PC9 细胞中的表达。与 siNC 细胞相比,si PRAME细胞显示出显著抑制的细胞增殖和迁移。免疫印迹显示PRAME基因沉默显著抑制了 mTOR、PCNA 和 Rap1 蛋白的表达。
为了进一步验证PRAME在体内的作用,他们利用CRISPR设计工具设计了两个单向导RNA(sgRNA),并用Cas9将sgRNA转导到A549细胞中。通过免疫印迹法证实了PRAME的破坏。PRAME的破坏显著抑制了细胞增殖和迁移(图 4k-l)。RT-qPCR显示,与sgScr相比,sg PRAME A549细胞中EMT相关基因ACTA2、COL1A1、MMP2和TAGLN的相对表达水平受到显著抑制(图 4m)。一致的是,免疫印迹法显示PRAME的破坏降低了细胞增殖和迁移相关蛋白mTOR、Rap1和PCNA的表达水平(图 4n)。然后通过尾静脉注射将sg PRAME细胞移植到受体小鼠体内。移植24天后收获小鼠。活检显示肺中存在一些具有特异性 mcherry 荧光蛋白表达的病变,这表明病变源自移植细胞。在 sg PRAME细胞受体小鼠的肺中观察到的病变比对照小鼠的肺中减少(图 4o)。一致的是,病理分析表明,在 sg PRAME细胞受体小鼠的肺中病变减少(图 4p-q)。综上所述,这些数据强烈表明PRAME缺乏抑制了小鼠的 LUAD 转移。
总而言之,综合分析确定PRAME基因是 LUAD 复发的关键介质,因为它具有高表达和低甲基化。他们通过一系列体外和体内实验全面验证了PRAME的生物学功能。这些发现阐明了PRAME激活在促进 LUAD 进展中的关键作用,突出了其作为预防复发的治疗靶点的潜力。
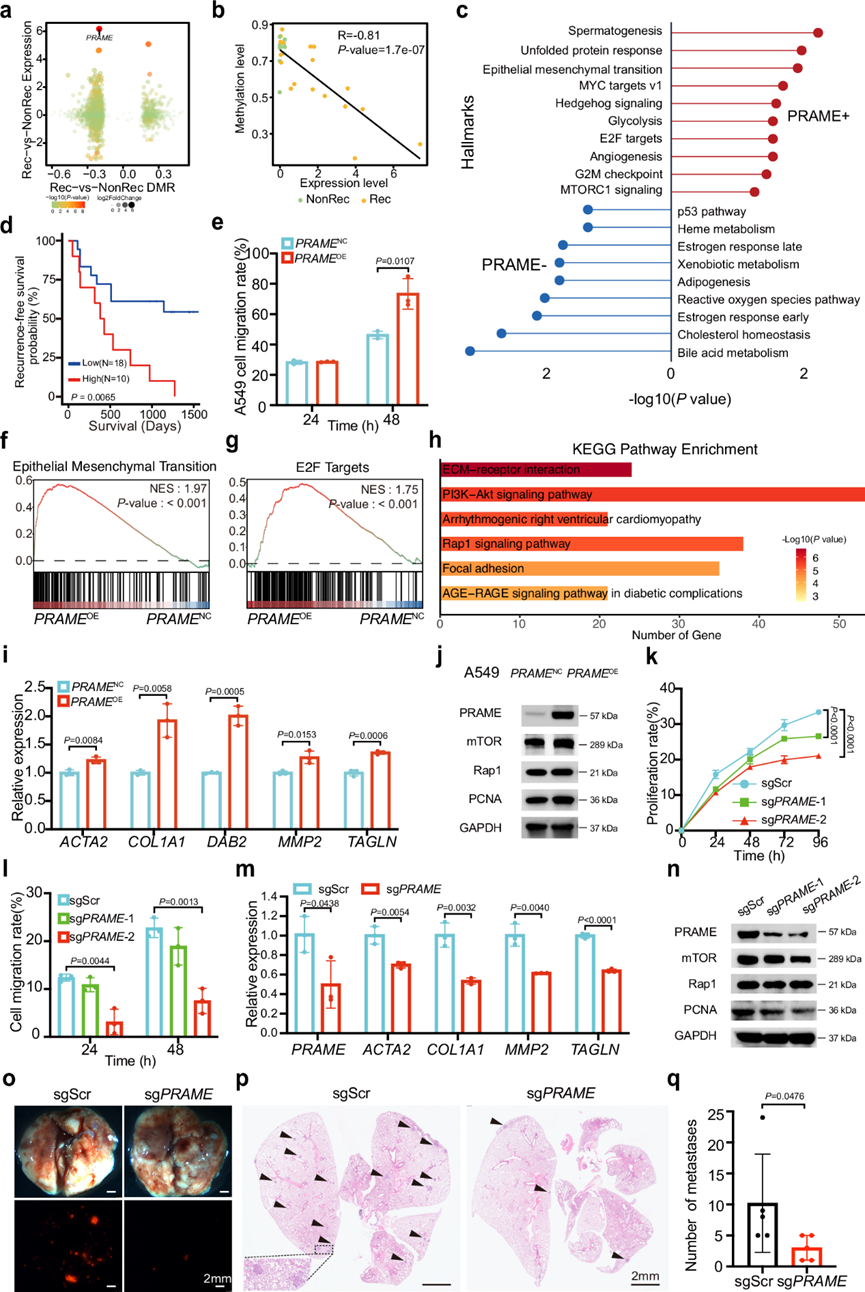
图4. PRAME的作用及相关实验验证。
(a) 散点图将表达变化与重叠基因的差异甲基化水平相关联。(b) 散点图表明 PRAME 的低甲基化与其在Rec 和 NonRec 组之间上调的表达相关。(c) 与PRAME高/低表达有关的生物学过程。(d) Kaplan-Meier 分析。(e) PRAMEOE细胞与PRAMENC A549 细胞相比的细胞迁移率。(f-g) PRAME OE细胞中 EMT和 E2F 靶标的富集。(h) KEGG 通路富集。(i) EMT 相关基因的相对表达水平。(j)免疫印迹分析。(k) sg PRAME和 sgScr A549细胞的相对细胞活力。(l) sg PRAME和 sgScr A549 细胞的细胞迁移率。(m) sg PRAME和 sgScr A549 细胞中 EMT 相关基因的相对表达水平。(n) 免疫印迹分析。(o) 代表性明场(上)和荧光(下)图像显示受体小鼠肺部 sg PRAME和 sgScr A549 细胞的转移性病变。(p) H&E 染色的代表性图像。(q) 统计图表显示受体小鼠(n = 5 只小鼠)肺部转移病变数量。
05
AT2 特征的丧失和恶性肿瘤的增加与手术后 LUAD 复发有关
为了揭示肿瘤生态系统在 LUAD 术后复发中的作用,他们收集了 14 名患者的新鲜肿瘤标本和邻近非肿瘤样本进行 scRNA-seq。经过质量控制程序,获得了总共 118860 个细胞的高质量转录组数据。这些细胞用已知标记注释,分配到 15 个主要聚类中,包括上皮细胞(AT1、AT2、基底细胞、纤毛细胞和棒状细胞)、成纤维细胞、内皮细胞以及免疫细胞(淋巴细胞和髓细胞),并通过 t 分布随机邻域嵌入 (tSNE) 进行可视化(图 5a)。虽然所有的细胞聚类在Rec组和NonRec组中均有出现,但AT2细胞在Rec组中更丰富,而AT1细胞和CD8+T细胞在NonRec组中更富集(图 5b)。
由于 AT2 细胞是 LUAD 的起源,他们首先研究了 Rec 和 NonRec 组之间 AT2 细胞的转录组异质性。根据基因表达谱,将AT2 细胞分为 AT2-SFTPC 细胞[其特征是典型 AT2 标志物(包括SFTPC)的高表达]以及 AT2 样细胞(其特征是SFTPC表达降低以及细胞增殖基因上调)。他们进一步将 AT2 样细胞细分为 5 个聚类(AT2-like 1-5),其中 AT2-like 2 在 Rec 组中占比较高。通路富集表明肿瘤进展的标志包括缺氧、EMT、血管生成等在Rec组AT2细胞中富集(图 5c),主要体现在AT2-like 1和AT2-like 2聚类中。为了进一步研究AT2细胞亚群的恶性状态,以邻近正常组织为参考,应用了inferCNV。正如预期的那样,在正常组织中几乎没有检测到CNV事件。Rec组的AT2细胞的CNV异质性相对NonRec组更高(图 5d)。例如,在Rec组的AT2细胞中,CNV扩增在7号和8号染色体上更为富集,18、19和20号染色体上的缺失也很明显。鉴于癌症与大规模CNV的关系,AT2样细胞称为LUAD细胞。具体而言,AT2-like 2 亚群获得的染色体 CNV 规模明显大于其他聚类,显示出更恶性的表型。此外,为了更好地了解 LUAD 复发期间 AT2 细胞聚类的进化动态,他们使用 Monocle 2 进行了伪时间分析,检测到了两种不同的分化轨迹,路径1 轨迹显示 AT2-SFTPC 细胞丰度增加,主要由来自 NonRec 组的细胞组成。然而,在MDK、SAA1和ITGB8基因高表达的整个路径 2 发育轨迹中,AT2-SFTPC 细胞的比例降低,而 AT2-like 2 保持较高比例。此外,路径 2 以来自 Rec 组的细胞结束,并且 CNV 负担仅沿着路径 2 轨迹积累(图 5e)。因此,路径 2 类似于术后复发的细胞轨迹。总体而言,他们深入了解了 AT2 细胞的异质性,并确定了 AT2 样 2 细胞亚群,这可能导致 LUAD 复发。
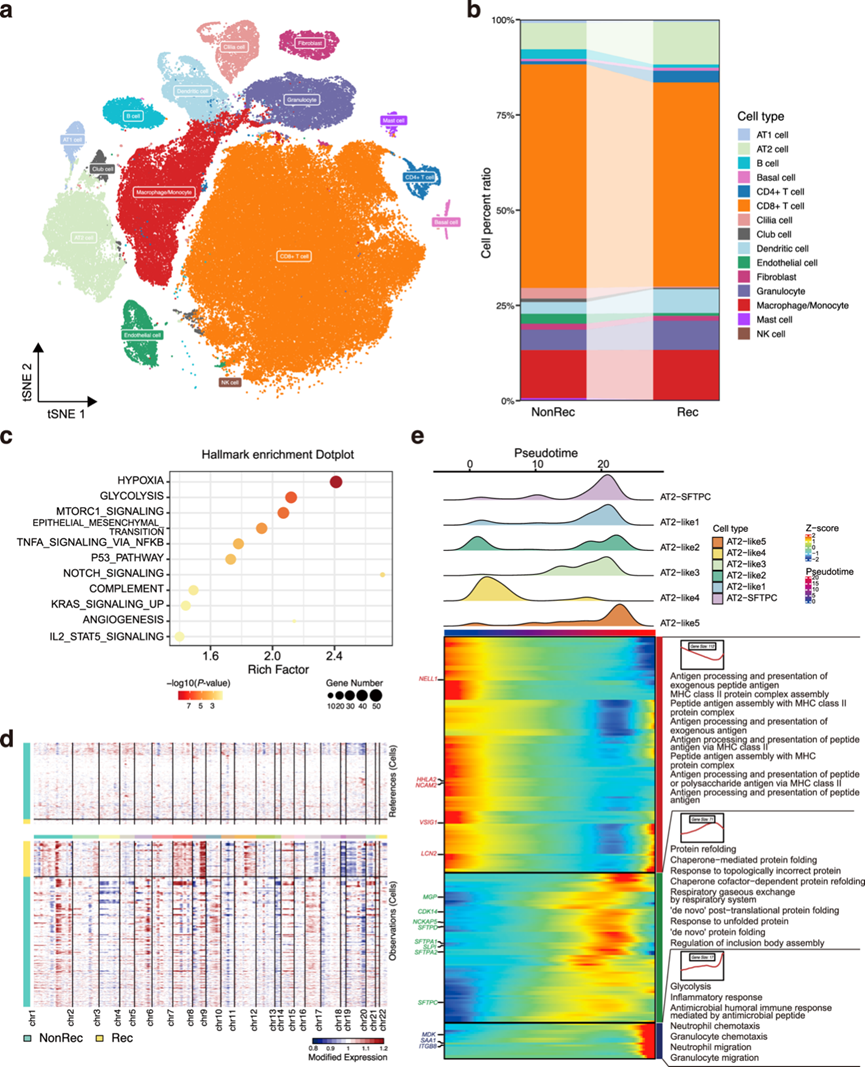
图5. I 期 LUAD 复发的单细胞转录组分析。
(a) tSNE 描绘了 LUAD 患者 15 种不同表型的组成。(b) NonRec组和 Rec 组的细胞百分比。(c) Rec组和 NonRec 组之间 AT2 细胞中高表达基因的显著富集特征。(d) scRNA-seq 推断的 CNV。(e) 岭图和热图显示 AT2 细胞的细胞密度和基因表达随伪时间的动态变化。
06
免疫细胞向 LUAD 复发性微环境的转录重编程
为了解决导致肺癌复发的独特 TIME,他们接下来对巨噬细胞/单核细胞和 CD8+ T 细胞进行了无监督聚类。巨噬细胞/单核细胞在髓系细胞中的丰度最高(图 5a),据报道,髓系细胞在重塑肿瘤微环境 (TME) 中起着关键作用。在这里,它们可细分为 5 个聚类,即 Macro_KLRB1、Macro_FABP4、Macro_PPARG、Macro_SPP1 和单核细胞(图 6a)。与 NonRec 组相比,通路富集显示 Rec 组的巨噬细胞/单核细胞中激活了炎症通路(图 6b)。高表达CD14 的Macro_SPP1定义为起关键促肿瘤发生作用的单核细胞衍生的巨噬细胞 (MDM),而 Macro_PPARG是组织驻留巨噬细胞 (TRM)。尽管各组之间的巨噬细胞/单核细胞比例相似(图 5b),但 Rec 组的特定亚群(包括 Macro_SPP1 和单核细胞)的丰度高于 NonRec 组(图 6c)。此外,伪时间分析显示,Macro_SPP1 和单核细胞主要处于分化路径的终末阶段,其特征是VEGFA(一种重要的血管生成调节因子)上调并激活炎症相关通路(图 6d)。一致地,标志通路分析也表明炎症反应在这两个聚类中富集(图 6e-f)。综上所述, Macro_SPP1 和单核细胞的富集通过触发血管生成和促进肿瘤的炎症导致肺癌复发。
CD8 + T 细胞可分为 5 个亚群(CD8-CCR6、CD8-GZMH、CD8-GZMK、CD8-LAG3 和 CD8-XCL1)。与 NonRec 组相比,Rec 组中 CD8-CCR6 、CD8-LAG3 和 CD8-GZMK 的比例更高。为了说明 Rec 组和 NonRec 组之间 CD8+ T 细胞的转录异质性,他们评估了细胞毒性、耗竭和幼稚表型的表达状态。在这些亚群中,CD8-CCR6 过表达耗竭标志物 (CTLA4和TIGHT)和幼稚基因(SELL和CCR7),因此称为早期耗竭 CD8+ T 细胞。 CD8-LAG3为耗竭型CD8+T细胞,CD8-GZMH表现为细胞毒性特征,而CD8-XCL1和CD8-GZMK则表现为幼稚特征。接下来研究了CD8+T细胞的细胞转变。伪时间分析中,转变始于NonRec组占比较高的细胞毒性亚型CD8-GZMH,并最终达到耗竭状态。此外,通路分析还显示,与NonRec组相比,Rec组的CD8+ T细胞中免疫缺陷相关通路富集,而细胞毒性相关通路受到抑制。因此,低细胞毒性、高耗竭状态的免疫抑制TME与肺癌术后复发有关。
他们使用 CellPhoneDB 来破译基于配体-受体 (LR) 相互作用导致肺癌复发的潜在相互作用。总体而言,Rec 组的细胞相互作用比 NonRec 组少得多。具体而言,Rec 组中 AT2 细胞和髓样细胞之间的相互作用减少是显而易见的,表明肿瘤细胞与相应环境之间的接触较少。虽然相互作用减少,但 Rec 组中 CD8-GZMK 和 CD8-CCR6 方面的细胞相互作用比 NonRec 组更强。因此,细胞间通讯普遍减少,以及耗竭 T 细胞调节增强,可能是导致肺癌细胞在复发部位定植的重要生物学行为。总之,具有高度炎症特征、免疫抑制状态和 TME 中细胞间通讯减少的 Macro_SPP1 的富集可能对于 I 期 LUAD 复发至关重要。
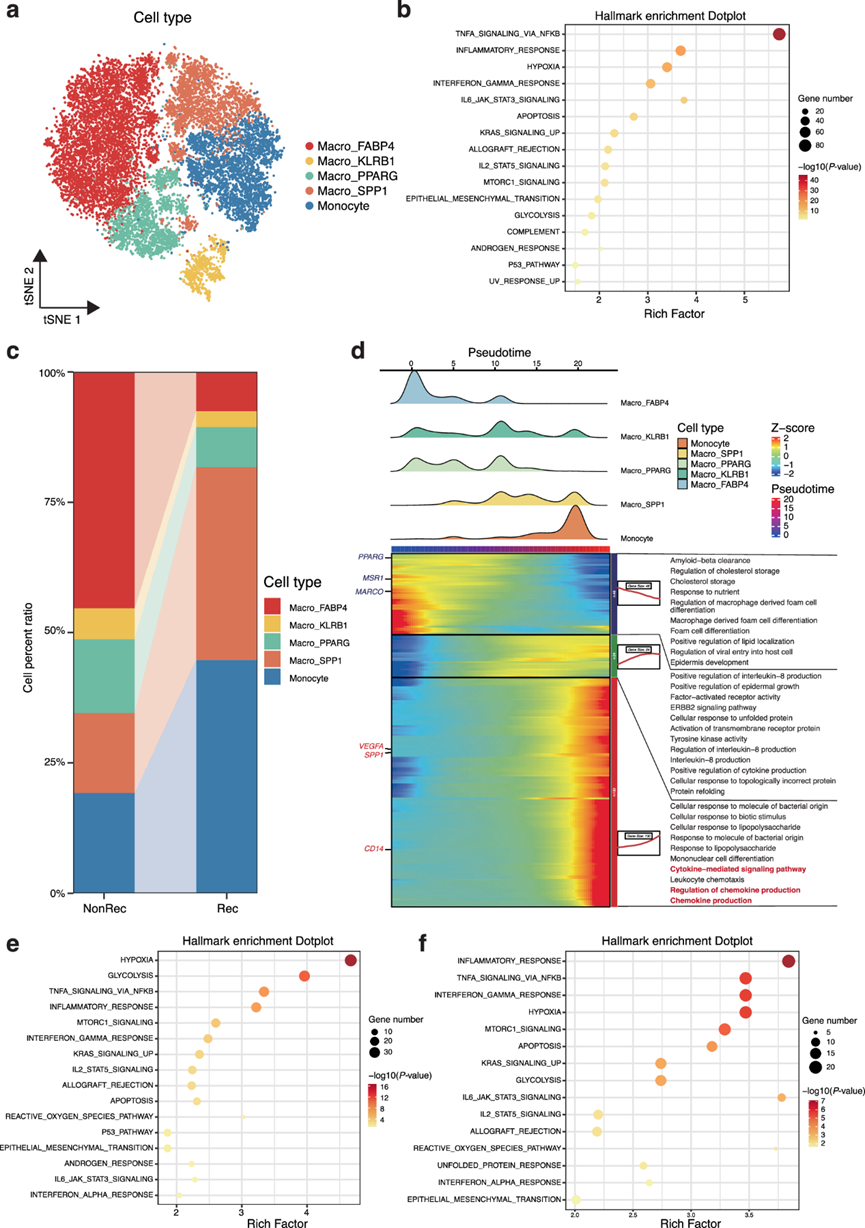
图6. I 期 LUAD 复发的巨噬细胞/单核细胞景观。
(a) 巨噬细胞/单核细胞的 tSNE 图按亚型着色。(b) Rec组和 NonRec 组之间巨噬细胞/单核细胞中高表达基因的显著富集特征。(c) Rec 组和 NonRec 组之间巨噬细胞/单核细胞亚聚类的细胞百分比。(d) 岭图和热图显示巨噬细胞/单核细胞的细胞密度和基因表达随伪时间的动态变化。(e-f) 高表达基因的显著富集特征。
07
多组学整合为非小细胞肺癌复发风险分层和精准治疗提供新见解
鉴于已经描述了Rec和非Rec组之间的基因组、表观基因组和转录组景观,采用无监督非负矩阵分解(NMF)聚类将肿瘤分为4个亚聚类(nmf1,nmf2,nmf3,nmf4)(图 7a)。生存分析表明,综合亚型有助于对患者的复发风险进行分层,其中nmf1和nmf2表现出较高的复发风险,nmf3代表中等复发风险,而nmf4中的病例显示出较低的复发风险。他们进一步深入研究了每个亚型的多组学特征。虽然LUAD中EGFR突变的频率很高,但nmf1和nmf2组的肿瘤均缺乏EGFR突变(图 7a-b)。nmf1亚型主要由来自LUAD和LUSC Rec组的肿瘤组成,其特点是EMT、血管生成和缺氧通路的富集,以及最高的衰竭评分(图 7c-f),表明强大的侵袭性和免疫逃逸潜力。对于主要涉及来自LUAD Rec组的肿瘤的nmf2亚聚类,MYC靶标、G2M检查点、E2F靶标通路发生激活,dMMR特征也富集(图 7f)。nmf3亚聚类由LUAD肿瘤组成,其中一半来自Rec组,其特征是EGFR突变比例高(图 7a-b)。最后,nmf4 包括来自 LUSC NonRec 组的绝大多数肿瘤,其特点是显著的吸烟特征,以及相对较低的血管生成评分(图 7d)。
基于上述分子特征,他们进一步关注某些亚群的治疗脆弱性。nmf1亚群表现出最高水平的血管生成激活和耗竭评分,该评分由LAG3、TIGIT、PDCD1和CTLA4等基因表达计算得出(图 7d)。先前的研究表明,贝伐单抗等抗血管生成药物可以改善具有血管生成特征的 NSCLC 的预后,而耗竭基因高表达的 T 细胞与免疫治疗效果密切相关。有趣的是,据报道 VEGFR 抑制剂-免疫检查点抑制剂 (ICI) 组合可提高免疫治疗的效率。因此,ICI 和抗血管生成药物的联合治疗可能是 nmf1 患者的最佳治疗方法。此外,Aurora 激酶抑制已证明是治疗 MYC 扩增癌症的一种新策略,而靶向 WEE1 可以抑制 G2M 通路,提示 nmf2 亚群具有潜在的选择。nmf3 组的复发率高达 50%,EGFR 突变率高(图 7a)。因此,对于属于 nmf3 聚类的EGFR突变病例,EGFR-TKI 可能有益,以降低术后复发风险。此外,nmf4 亚群中的患者主要来自 NonRec 组,因此可能不需要辅助治疗。这些结果强调了基于多组学亚聚类的 NSCLC 治疗在指导术后个性化治疗和降低复发风险方面的潜力。
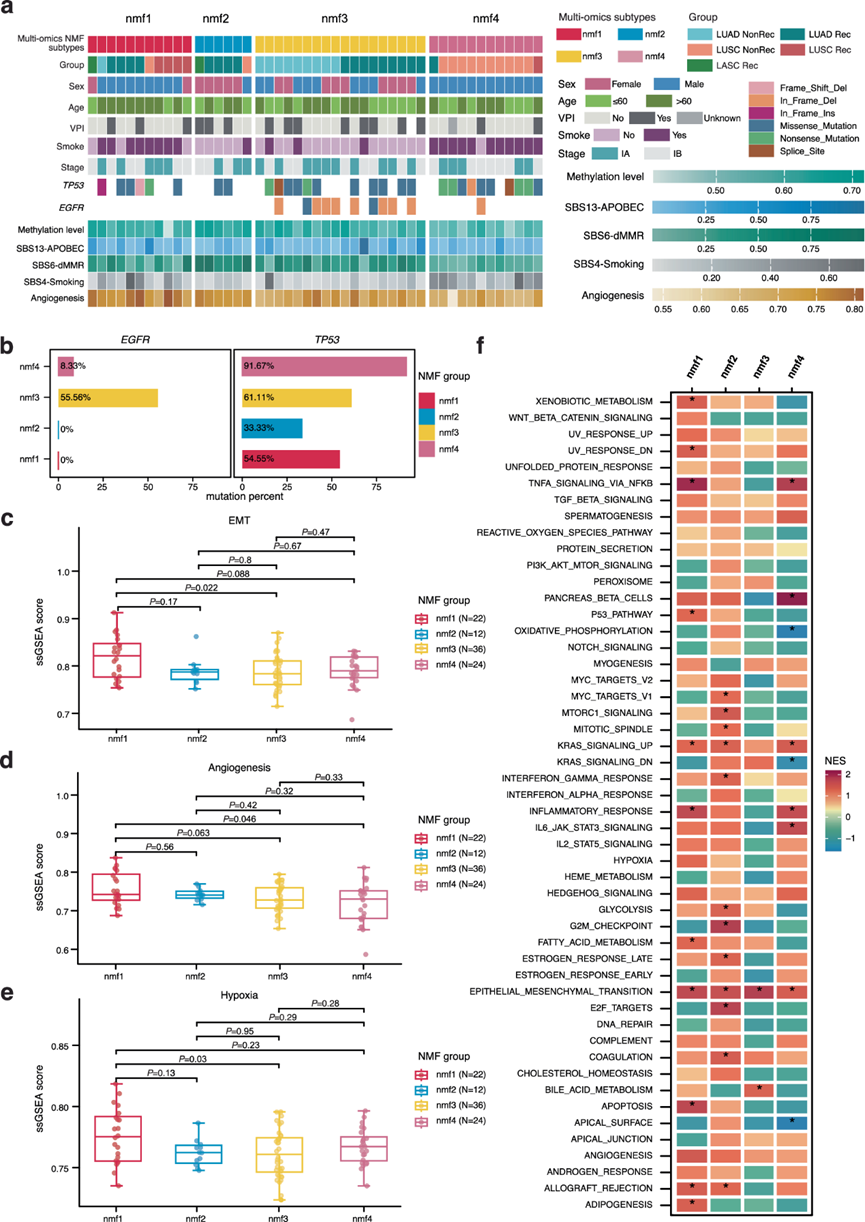
图7. NSCLC队列和生物学特征的多组学整合。
(a) 热图显示 NSCLC 肿瘤多组学整合到 4 个 NMF 衍生聚类中。(b) 每个亚聚类的基因突变比例。(c-e) 通过 ssGSEA 评估每个亚聚类中 EMT、血管生成和缺氧的富集。(f) ssGSEA检测到的每个亚聚类中的通路富集热图。
+ + + + + + + + + + +
结 论
本研究从 122 名 I 期 NSCLC 患者中生成了配对肿瘤和邻近组织的基因组、表观基因组和转录组谱,其中 57 名患者在随访期间在手术后出现复发。综合分析表明,以实性或微乳头状为主的组织学亚型、基因组不稳定性增加和 APOBEC 相关特征与复发有关。此外,DNA 结合域中的TP53错义突变可能导致复发时间缩短。DNA 低甲基化在复发性 NSCLC 中很明显,PRAME是LUAD中显著低甲基化和过表达的基因。从机制上讲,TEAD1结合位点的低甲基化促进了PRAME的转录激活。抑制PRAME可通过下调上皮间质转化相关基因来抑制肿瘤转移。多组学聚类可以将 NSCLC 患者分为 4 个亚群,这些亚群具有不同的复发风险和亚群特异性治疗靶点。
+ + + + +



 English
English


