文献解读|Immunity(25.5):深度分析解构与记忆性 CD8 + T 细胞组织驻留相关的特征
✦ +
+
论文ID
原名:Deep profiling deconstructs features associated with memory CD8+ T cell tissue residence
译名:深度分析解构与记忆性 CD8 + T 细胞组织驻留相关的特征
期刊:Immunity
影响因子:25.5
发表时间:2025.01.14
DOI号:10.1016/j.immuni.2024.11.007
背 景
CD8+ T 细胞通过细胞接触来调查宿主组织;因此,它们的位置对其功能至关重要。CD8+记忆 T 细胞通常根据假定的迁移特性分为不同的亚群。循环记忆 T (Tcirc)细胞包括在血液、次级淋巴器官 (SLO) 和淋巴之间循环的中央记忆 (Tcm) 细胞,以及巡逻血液和偶尔的非淋巴组织 (NLT) 的效应记忆 (Tem) 细胞。组织驻留记忆T (Trm )细胞持久驻留在全身各个组织中而无需再循环,并在防止外周再感染和癌症方面发挥特殊作用。虽然可能与迁移相关的标记和基因列表已大大增加,但缺乏对它们预测T细胞在不同组织和环境中驻留的准确性的全面评估。
实验设计
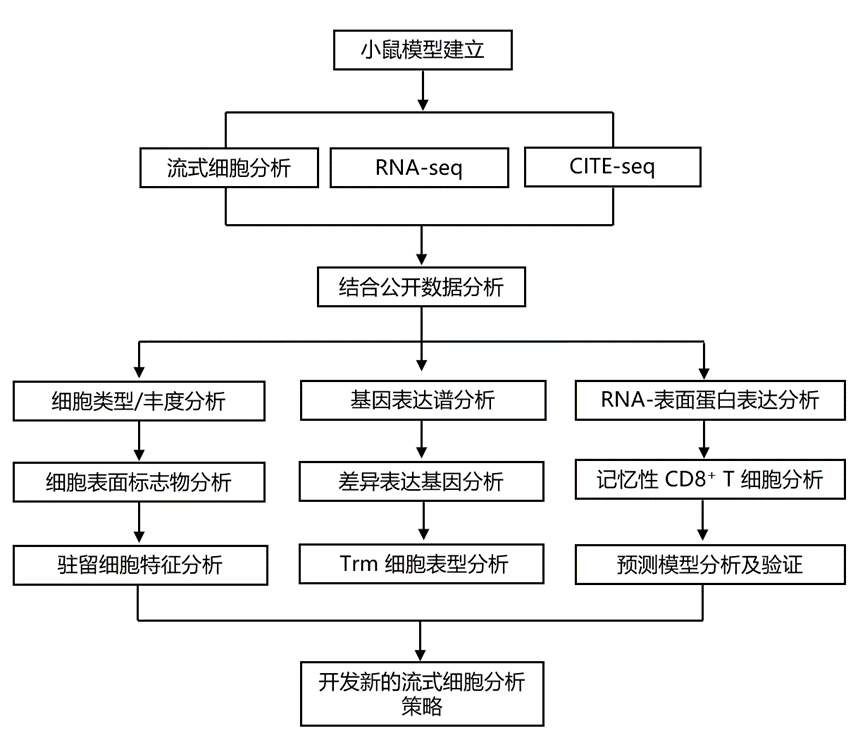
结 果
01
位置、抗原分布和抗原持久性影响 T 细胞是否驻留
研究团队建立了小鼠模型,从经历过免疫反应的小鼠的几乎每个固体器官和屏障部位都可以分离出记忆CD8+ T细胞。他们研究了 23 个解剖区室,以了解迁移特性在器官和组织中的差异。由于局部抗原水平会影响 T 细胞分化和组织驻留,他们利用了五种不同的启动方式,这些代表了抗原分布或持续时间的范围。为了模拟不存在抗原的情况,他们首先在体外刺激幼稚的 Thy1.1 +或 CD45.1+同源标记的 P14 T 细胞(针对免疫显性淋巴细胞脉络丛脑膜炎病毒 [LCMV] 表位 gp33),然后转移到幼稚的受体中。转移后 50 至 60 天,通过异体共生手术将具有 Thy1.1+ P14 细胞的小鼠与具有 CD45.1+ P14 细胞的小鼠连接起来(图 1 A)。休息 21-28 天后,对异体共生体进行血管内 (iv) 抗体染色。然后收集组织,分离和染色细胞,识别宿主和配对来源的细胞,并计算驻留细胞的比例(图 1B-C)。
为了模拟急性全身感染,他们转移了幼稚的 OT-I T 细胞(针对鸡卵清蛋白内的免疫显性 SIINFEKL 表位),随后静脉感染表达卵清蛋白的水泡性口炎病毒 (VSVova) 感染,或转移了幼稚的 P14 T 细胞,随后腹膜内 (ip) LCMV Armstrong (Arm) 感染。为了模拟急性局部感染,将 P14 T 细胞转移到幼稚小鼠体内,然后用表达 gp33 (PR8-gp33) 的重组小鼠适应性 PR8 甲型流感病毒 (IAV) 株进行鼻内 (in) 感染。最后,为了模拟持久性抗原,他们转移了 P14 细胞,耗尽了 CD4 + T 细胞,并静脉感染了 LCMV 克隆 13 (Cl13),这是一种研究 T 细胞耗竭的常用模型。将基因上不同的VSVova 、LCMV Arm 、PR8 或 LCMV Cl13免疫的小鼠在感染后( pi) 30 天以上通过手术连体,休息 21-28 天,然后对组织细胞进行评估。
体外激活(不存在体内抗原)足以在转移到幼稚小鼠后建立 Trm 细胞,从而提供了令人信服的证据,表明局部抗原不是启动驻留分化所必需的(图 1A-C)。无论细胞是通过体外刺激进行引发还是通过急性复制全身感染在体内激活,对于给定组织,不同模型中的 Trm 细胞与平衡细胞的比例相对一致。例如,无论何种方式,记忆性 CD8+ T 细胞主要驻留在唾液腺和小肠 (SI) 内(>90%),而在肝脏中,它们部分平衡(<25% 驻留),在脾脏中,它们几乎完全平衡(<10% 驻留)。尽管在引起局部呼吸道感染的 PR8 中,记忆性 CD8+ T 细胞广泛分布,但它也导致未经静脉注射抗体染色的肺部部分、气道(支气管肺泡灌洗 [BAL] 液)和肺引流纵隔淋巴结 (medLN) 内的 Trm 细胞扩增(图 1A-C)。这支持了以下结论:即使不是必需的,局部抗原也可以增强位点特异性 Trm 细胞分化。Trm 细胞的形成独立于局部抗原识别,但也与局部抗原识别增强Trm细胞分化和丰度的报道一致。慢性感染对 T 细胞迁移的影响最为显著,导致血液中 P14 细胞很少,并且所有分析的组织中驻留细胞占主导地位(图1 A-C)。
综合起来,无论何种方式,驻留 CD8+ T 细胞通常在 NLT 中占主导地位。然而,有几个变量会影响驻留CD8+ T 细胞的比例:组织位置、反应早期阶段的抗原分布和抗原持久性。
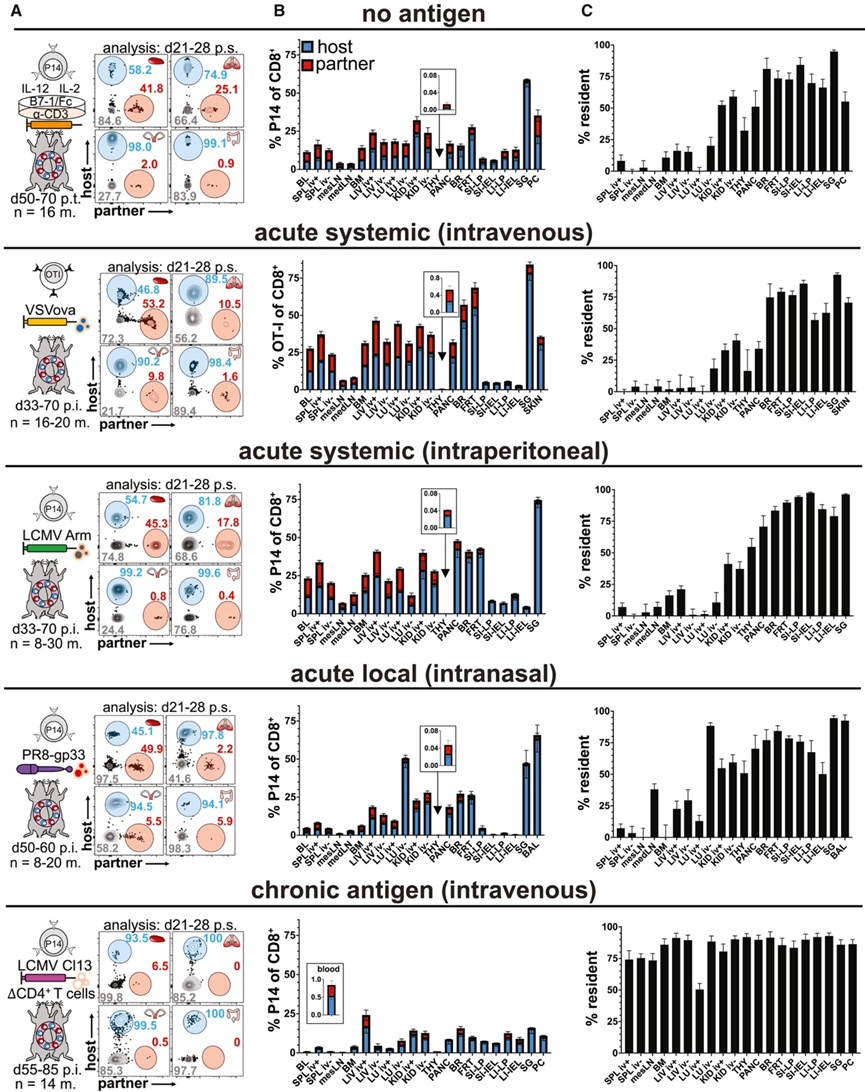
图1. 解剖位置、抗原分布和抗原持久性影响组织驻留。
(A)实验方案。(B) CD8 + T 细胞的百分比。(C) 驻留细胞百分比。
02
细胞表面标志物的表达与驻留之间的相关性因解剖位置和环境条件而异
Trm 细胞是通过驻留来定义的,但迁移测定在技术上具有挑战性,有时甚至不可行。因此,细胞表面标志物通常用作迁移状态的代理。他们评估了常用表型代理的表达与异体共生测定中驻留的 T 细胞比例之间的相关性。首先,他们专注于单个标志物,并评估了来自 LCMV Arm 免疫异体共生体的 18 个解剖位置的记忆 P14 细胞(图 2 A)。目标是评估表达特定标志物的细胞百分比与异体共生测定中确定为驻留的细胞比例的匹配程度。
单个细胞表面标志物可能会高估或低估驻留时间。例如,CXC 趋化因子受体 6 型 (CXCR6) 由 Trm 细胞和非 Trm 细胞表达(图 2 A)。相比之下,CD101 表达严格识别 Trm 细胞,但许多细胞不表达 CD101(图2 A-C)。此外,某些标志物的染色强度[例如整合素 VLA-1 的 α1 链 (CD49a)]差异很大,并且没有产生双峰表达模式,因此很难确定“阳性百分比”测量值(图 2 D)。此外,CD103 并非普遍由 Trm 细胞表达,而是由循环幼稚 (CD44− ) CD8+ T 细胞表达(图 2 E-F)。
与之前的研究一致,并非所有 Trm 细胞都表达 CD69,包括胰腺 (PANC) 和雌性生殖道 (FRT) 中的一些驻留细胞(图 2 F)。然而,在无特定病原体 (SPF) 小鼠中,与 CD103 不同,CD69 在检测的所有组织中的许多 Trm 细胞上都有表达(图 2 A-F)。事实上,CD69 表达在肝脏和脾脏的实质和血管相邻区室内均有发现(图 2 G-H)。然而,这种相关性并不是绝对的;例如,即使最近迁移到骨髓,许多记忆性 P14 细胞也会表达 CD69(图 2I)。此外,T 细胞通过 T 细胞受体 (TCR) 或干扰素和细胞因子激活后会提高 CD69 的表达。用异源 VSV 感染 LCMV Arm 免疫小鼠,导致血液和 SLO 中非交叉反应记忆 P14 细胞中 CD69 表达增加,但预计它们不会持久驻留(图2J-L)。
CD69 和 CD103 的表达均受到宿主环境的影响(图 2 M-N)。由于与宠物店小鼠同笼培养,SI 中表达 CD103 的 LCMV Arm 特异性 P14 Trm 细胞较少,并且且微生物暴露增加(图 2 F-N)。此外,许多最近迁移到组织的 P14 细胞表达 CD69(图2N)。内源性 CD69+ CD8 + T 细胞也在共生体之间达到平衡,包括具有幼稚表型的共生体(图2O-P)。在人类 SLO 中观察到幼稚表型 CD69+T 细胞。这些观察结果表明了非驻留 T 细胞可能表达 CD69 的可能性,尤其是在 SPF 环境之外。
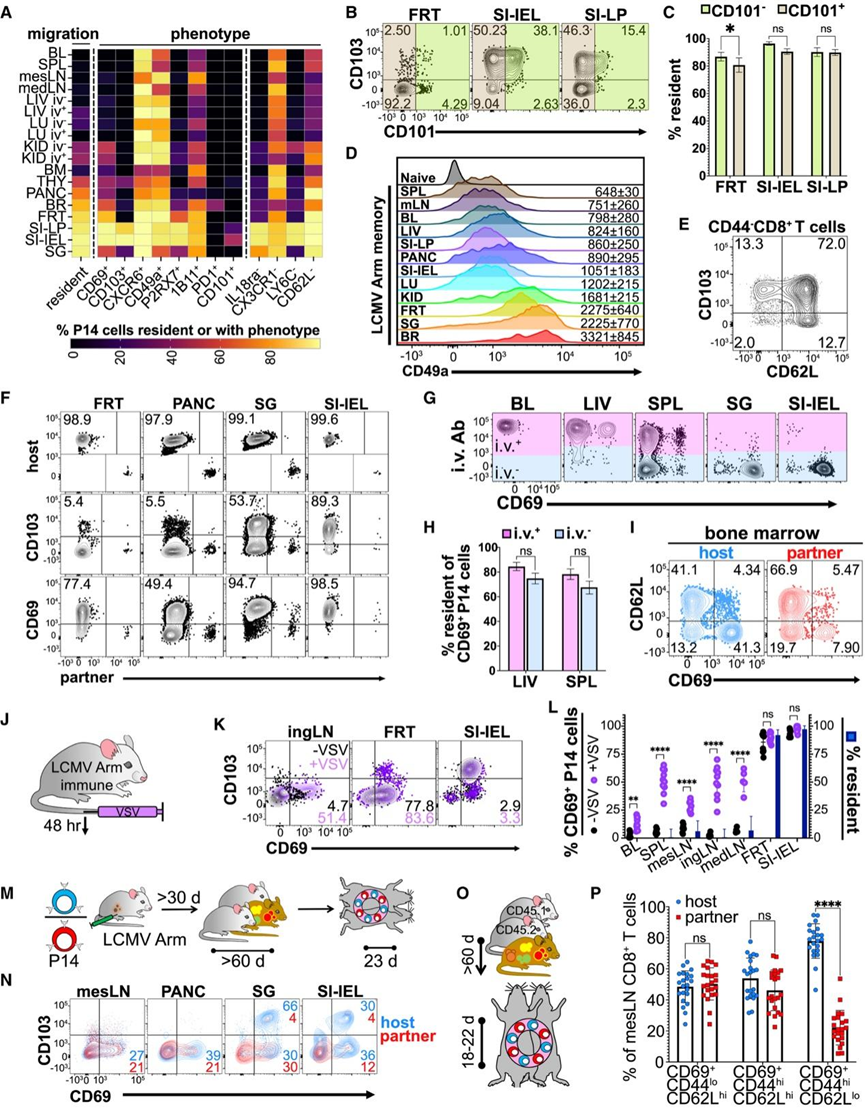
图2. 细胞表面标志表达与驻留的关系。
(A) 驻留细胞百分比和表达或缺乏指示标记的总 P14 细胞百分比。(B) 从指定组织分离的 P14 细胞上 CD103 和 CD101 表达的代表性图。 (C) CD101+和 CD101−P14 细胞的驻留百分比。(D) 代表性 CD49a 表达。(E) 代表性 CD49a 表达。(F) 宿主和配对同类基因标记 CD69 和 CD103 在 LCMV Arm 特异性 P14 细胞上的表达。(G-H) 特征性静脉注射抗体和 CD69 染色以及CD69 + P14 细胞的百分比驻留值。(I) 骨髓来源的 LCMV 臂特异性 P14 细胞的 CD69 和 CD62L 表达说明。(J-K) P14 细胞上的 CD69 和 CD103 表达。(L) 表达 CD69 的 P14 细胞百分比(左)和驻留细胞百分比(右)。(M-N) CD69 和 CD103 表达评估。(O) 对共居共生体中的 CD8 + T 细胞进行了 CD44、CD62L 和 CD69 的表达评估。(P) 所示子集中mesLN CD69 +细胞的频率。
03
静息 Trm 细胞在转录上是不同的
他们力求鉴定出能够将静息 Trm 细胞与其他 CD69 +和 CD69 − CD8 + T 细胞区分开来的替代标记。为此,他们对 (1) 静息 CD69 + Trm 细胞(根据之前的异体共生试验推测为驻留细胞)、LCMV Arm 建立的CD69 − Tcm 细胞和 CD69 − Tem 细胞、(2) 最近刺激的 CD69+ P14 细胞(LCMV Arm 感染后 4 天从 LN 中分选出来)、(3) CD69 +旁观者激活记忆细胞(VSV 感染后 48 小时从 LN 中分选出来的 Arm 免疫 P14 细胞)和 (4) CD4 + T 细胞耗竭小鼠慢性 LCMV Cl13 感染后 50 天从 SLO 中分选出来的内源性 CD69 + H - 2D b限制性 gp33 四聚体+ CD8 +细胞进行了转录组分析(RNA-seq)。
为了了解这些群体之间的转录相关性,他们首先对它们的基因表达谱进行了无监督多维可视化。静息 Trm 群体与 Tcirc 群体不同(图 3 A)。然而,SLO 衍生的 Cl13 特异性 CD8+ T 细胞主要通过迁移测定驻留(图 1),与任何 LCMV Arm 产生的 Trm 群体并不紧密相关(图 3 A)。
相对于 Tcirc细胞群,LCMV Cl13 和 Arm 产生的驻留细胞群之间仅有 114 个共同的差异表达基因 (DEG),包括已知的驻留和衰竭相关基因,例如S1pr1和Tox(图3B)。因此,尽管驻留 CD69+ Cl13 反应细胞群可能适应与静息 CD69+ Trm 细胞相关的一些特征,但它们的基因表达谱与最近受到刺激的 CD8+ T 细胞群(即感染后第 4 天或旁观者激活的细胞)有很多共同之处。事实上,增殖相关基因表达增加是慢性、最近和旁观者激活的 CD69+ CD8+ T细胞的共同特征(图3C-D)。
最后,他们将所有静息记忆性 Trm 群体(无论其组织来源如何)分组,并将它们与 Tcirc 和最近受到刺激的群体进行比较。静息 Trm 群体中升高的基因包括Cd38、P2rx7、Cd160和Itga1(编码 CD49)。Trm 细胞群体中降低的基因包括转录因子 Krüppel 样因子 2 ( Klf2 )、Sell(编码 CD62L)、杀伤细胞凝集素样受体 G1 (Klrg1) 和Il18r1(图 3 E)。Itgae(编码 CD103)和Cd101在静息 Trm 细胞中也增加,尽管在此分析中表达主要局限于一部分 Trm 细胞(图 2)。此外,Cxcr6在许多 Trm 细胞中表达,但与 CD69 不同,Cxcr6 不会因炎症而在记忆性 CD8+ T 细胞上诱导,未出现差异表达。这些发现强调需要对更广泛的组织和环境中的记忆性 CD8+ T 细胞进行更高分辨率的单细胞分析,以鉴定 Trm 细胞独有的潜在普遍特征。
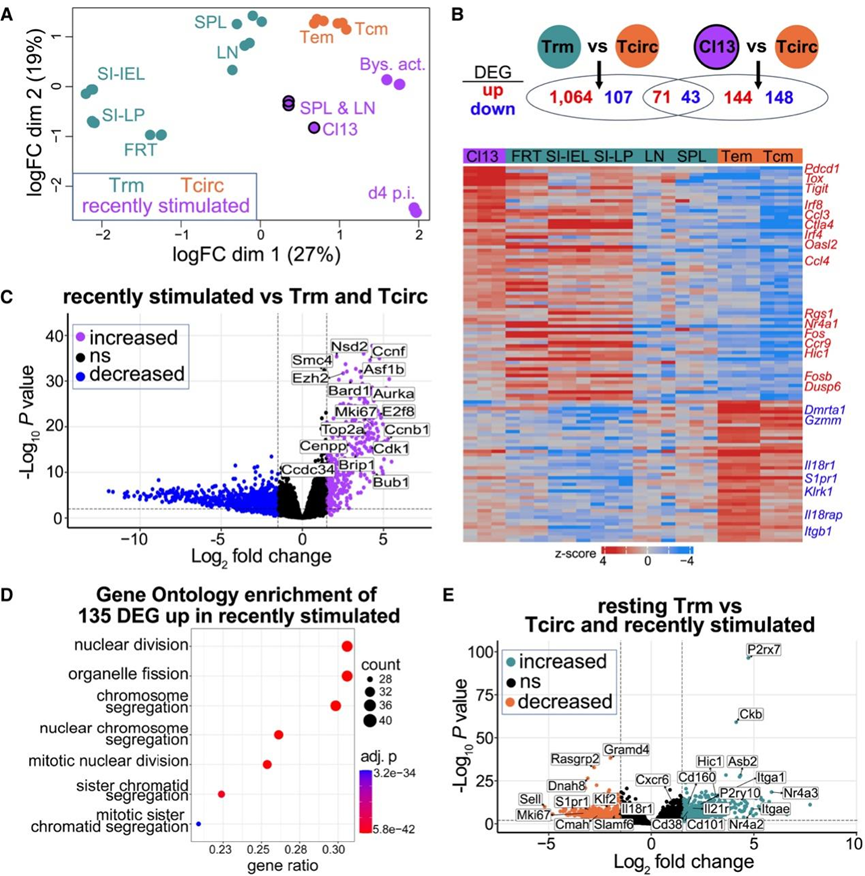
图3. 静息 CD69+ Trm 细胞在转录上是不同的(基于RNA-seq数据)。
(A) 静息 CD69 + Trm 细胞在转录上是不同的。(B) 差异表达基因 (DEG) 分析。(C) 火山图突出显示了最近受到刺激的群体中表达增加的一些基因。(D) 富集分析的结果。(E) 火山图突出显示了通过将静止 Trm 细胞群体与所有其他细胞群体进行比较而确定的 DEG。
04
高维分析更好地区分迁移特性
到目前为止,这些研究结果共同表明:(1) 驻留可以存在于各种环境中(包括慢性感染),(2) 表型因位置而异,以及 (3) 近期刺激和短暂的环境扰动可以暂时诱导通常用于推断持久驻留的标志物的表达。接下来,他们专注于 SPF 小鼠中的单一病毒感染模型,在其中他们分析了各种细胞表面标志物组合的表达与不同解剖位置的驻留之间的相关性。
为此,在 LCMV Arm 感染 70 天后,同源性不同的 P14 免疫嵌合体经历了 40 天的异体共生(图 4 A)。在体内血管内抗体标记后,从组织中分离淋巴细胞,并与假定的 Trm 细胞标记物以及定义细胞谱系、异体共生体来源和已识别血管内和血管外群体的标记物的抗体共染色。将来自所有小鼠和组织的宿主和配对衍生的 P14 细胞合并进行分析(图4B)。PhenoGraph 算法根据 12 种细胞表面标记物的表达识别出 16 个不同的亚群(图4C-H)。
接下来,他们确定了每个亚群的组织和共生体起源。PhenoGraph 明确区分了一些组织驻留细胞群(聚类 1-6)(图 4 D-E)和平衡群体(宿主和配对衍生细胞数量大致相等)(聚类 9-16)(图 4 D-E)。一些 Trm 细胞表型是组织特异性的,特别是在唾液腺内,而一些(例如聚类 6;CD69 + P2RX7 + CD49a + CXCR6 + CD62L−)是许多组织所共有的,包括脾脏(图4D-F)。然而,单个组织中的 Trm 细胞可以表现出广泛的异质性(图 4 G)。此外,有些聚类(例如聚类 7 和聚类 8)同时包含驻留细胞和平衡细胞。因此,在 SPF 小鼠中 LCMV Arm 感染的背景下,这 12 个标记物虽然有用,但不足以完全区分持久的 Trm 细胞和在异体共生平衡阶段到达组织的配对衍生细胞(称为“新来者”)。额外的标记物比单独的 CD69 更有效。例如,P2X 嘌呤受体 7 (P2RX7) 和 L-选择素 (CD62L) 进一步分辨了骨髓中的驻留细胞和平衡 CD69 +细胞(图 4 I-J)。然而,P2RX7 并未在唾液腺中的许多 Trm 细胞上表达(图 4 K)。

图4. 流式细胞分析鉴定识别Trm细胞。
(A)实验方案。(B)数据比较和整合。(C) PhenoGraph 定义的细胞聚类。(D) 每种组织的宿主和配对衍生细胞。(E-F) 每种组织的宿主和配对衍生细胞。(G) Trm 细胞占主导地位的聚类中各组织细胞的百分比。(H) 用于聚类输入标记的表达直方图。(I-J) 骨髓来源的 P14 细胞的指定亚群的特征表达图和宿主与配对百分比。 (K) 唾液腺 (SG) 衍生的 P14 细胞的典型表达图。
05
Trm 细胞表型分析
为了直接研究局部和全身病毒感染对记忆性 CD8+ T 细胞表型的影响,他们将 PR8 和 ip LCMV Arm 感染中的免疫小鼠配对,并让副共生体休息 29 天,然后进行表型分析(图 5 A)。来自 12 个不同解剖位置(包括血管外和血管内)的 P14 细胞的 PhenoGraph 聚类揭示了 14 个亚群(图5A-F)。
虽然一些 Trm 细胞表型是组织特异性的,但其他表型(聚类 5 和 6)在许多组织中是常见的(图 5 B-F)。几种 Trm 细胞表型在很大程度上是感染特异性的,其中聚类 2(CD69+ CD103+ P2RX7 −)主要与 PR8 相关,而聚类 4(CD69 +CD103−P2RX7+)主要源自 LCMV Arm(图 5 B-F)。虽然 CD69 表达是驻留细胞的一致特征(图 5 D-5F),但聚类 11 中的平衡细胞为 CD69 +。与全身 LCMV Arm 感染相比,CD103 和 P2RX7 的表达对局部 PR8 的反应不同(图5G-H)。然而,CD49a 与 CD69 结合的表达在各种感染中的 Trm 细胞中保持一致(图 5 H)。
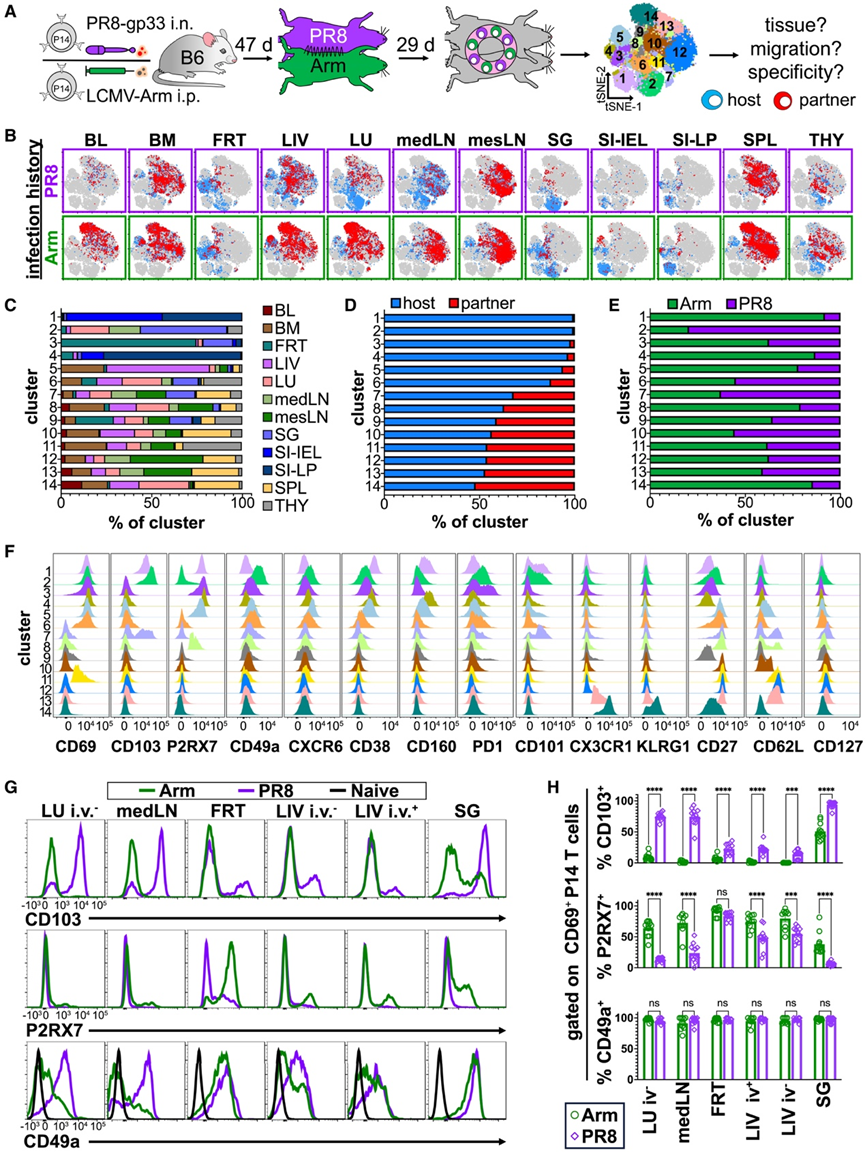
图5. 感染史影响Trm细胞表型。
(A)实验方案。(B) 每种组织和感染的宿主和配对衍生细胞。(C-E) 从最多(上)到最少(下)聚类的百分比。(F) 用于聚类输入标记的表达直方图。 (G) 指示标记的代表性表达直方图。(H) 表达指示标志物的 CD69+ P14 细胞百分比。
06
解剖位置、感染史和迁移特性影响 CD8+ T 细胞转录组
到目前为止,他们已经证明记忆性 CD8+ T 细胞的细胞表面标志物表达受许多变量的影响,包括位置、感染史、迁移特性和环境。这可能会暴露出解释先前转录组研究的局限性,这些研究试图在不结合迁移分析的情况下定义 Trm 细胞的特征,而是依赖于解剖位置或来自不同环境的替代标志物。为了解决这一差距并定义 Trm 细胞独有的特征,他们首先建立了含有 LCMV Arm 或 PR8 诱导的记忆性 P14 细胞的共生体(图 6 A)。然后他们进行了体内血管内抗体标记,从几种组织中分离淋巴细胞,并利用转录组和表位测序 (CITE-seq) 的细胞索引。
对于每种感染,他们首先使用总变分推断 (totalVI) 联合分析了每个细胞的 RNA 和表面蛋白表达。同类基因标记和静脉注射抗体的表达分别用于确定每个细胞的共生体来源和静脉注射抗体状态(以组织为基础)。然后,他们将分析重点放在从肺和脾中分离的 P14 细胞上。为了评估解剖位置、感染史和迁移特性如何影响源自肺和脾的记忆性 CD + T 细胞的转录组,他们使用单细胞 VI (scVI) 仅对 RNA 进行降维并鉴定细胞聚类。UMAP可视化表示主要根据组织来源对记忆性 CD8+ T 细胞进行分层(图 6 B-C)。然而,来自每种组织的细胞可分成几个不同的聚类。
虽然一个肺特异性聚类(聚类 3)几乎完全是血管外的,但与脾脏特异性聚类相比,静脉注射抗体染色没有明显差异(图 6 D)。他们接下来评估了共生体的起源和感染史,聚类 3、6 和 9 是 Trm 细胞(图 6 E)。其余聚类是组织平衡 (Teq) 细胞,因为它们显示出宿主细胞和配对来源细胞的混合。然而,在 Trm 细胞聚类中可以明显看到一些配对来源的细胞,一些肺来源的新细胞表达了一些以前与 Trm 细胞相关的基因,例如Pdcd1(编码PD - 1)和Cxcr6(图 6 F)。Trm 细胞按组织分类,脾脏来源的 Trm 细胞主要分布在聚类 6 中,肺脏来源的 Trm 细胞分布在聚类 3 中(图 6 C-E)。Teq 细胞也根据组织来源大致分为转录不同的聚类(图 6 C-E)。
此外,在每个组织中,PR8 或 LCMV Arm 感染后基因表达差异明显。总的来说,除了迁移特性外,各种因素都会影响记忆性 CD8+ T 细胞的基因表达谱,包括血管定位、感染史和分离器官。他们检测了将所有迁移测定定义的 Trm 细胞与 Teq 细胞进行比较是否会产生一组全面而可靠的明确迁移相关标记(图 6 I)。当记忆 T 细胞仅分为两类(驻留和平衡)时,根据所识别的基因推断迁移是一个挑战(图 6 J)。这些基因在所有肺源细胞(包括 Teq 细胞)中富集,但在脾脏 Trm 细胞中没有富集。因此,识别通用 Trm 细胞特征的挑战可能是由于来源组织对基因表达的显著影响而产生的。
为了直接评估之前的 Trm 细胞特征是否受到组织相关的、非迁移相关的基因“污染”,他们进行了两个单独的差异表达测试(图 6 K)。首先,比较脾脏和肺 Teq 细胞(组织间测试)以确定与组织位置相关的基因。其次,比较肺 Trm 和 Teq 细胞(组织内测试)以确定与驻留在肺部相关的基因。接下来,他们分析了从这些测试中鉴定出的基因与公开数据中的 Trm 细胞基因特征的交集(图6 L)。许多之前报道的 Trm 细胞相关基因,包括 Vps37b、Bhlhe40 和 Dusp5,在肺Trm和Teq细胞之间没有差异表达。然而,这种方法验证了一些 Trm 细胞相关基因,包括Itgae、Rgs1、Xcl1以及低Klf2和S1pr1表达(图6 L-M)。
他们分析了已发表的人类 CD3 + T 细胞单细胞转录组谱。与小鼠肺部分离细胞(与迁移无关)相关的基因在人类肺部细胞中重现(图 6 N)。
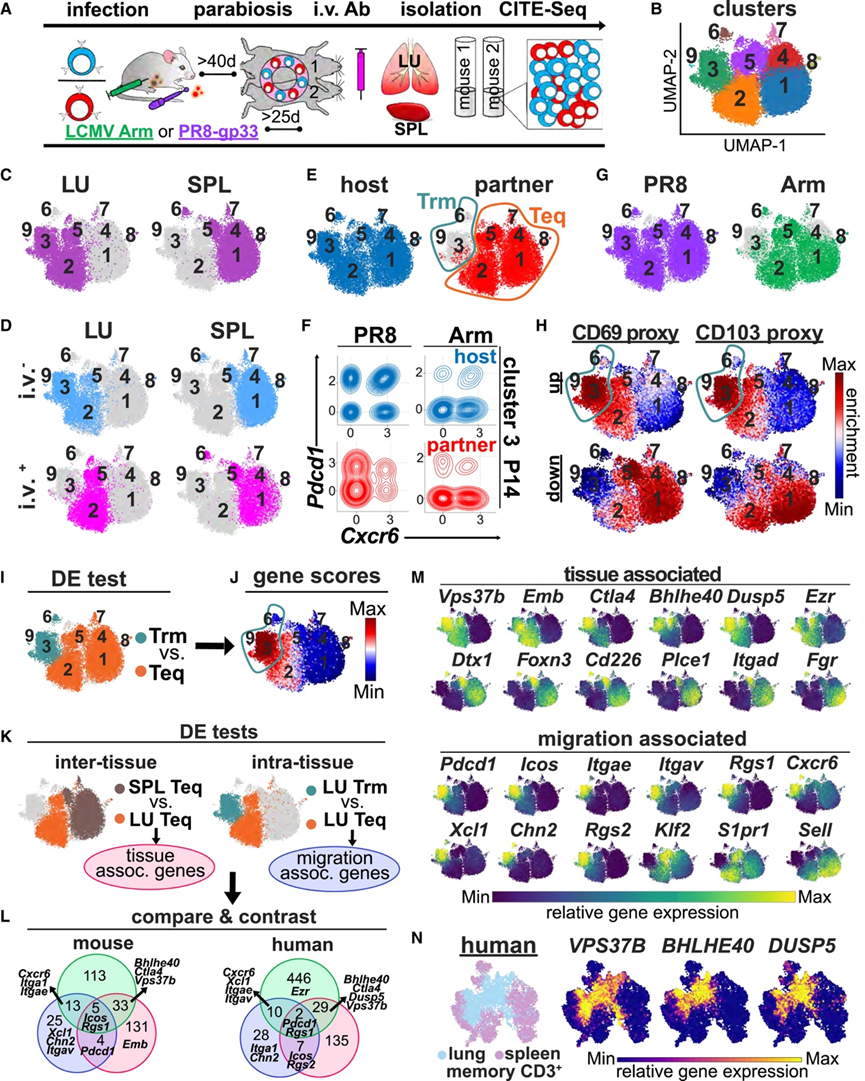
图6. 通过实验辨别组织相关基因和迁移相关基因。
(A) 实验方法。(B-E)UMAP可视化。(F) 肺 Trm 细胞中Pdcd1和Cxcr6基因表达。(G) 每个细胞的感染史过程。(H) 通过比较来自不同组织的不同表型的细胞确定的假定 Trm 细胞中先前确定表达增加(“上调”)或表达减少(“下调”)的基因的富集得分。(I) 通过 scVI DE 测试比较 PR8 产生的 Trm 和 Teq 细胞,以识别 Trm 细胞更丰富表达的基因。(J) 在(I)中鉴定的基因的富集分数。(K) 两次 DE 检验。(L) Trm 基因特征比较。(M) Trm 基因特征进行了比较。(N)组织来源和肺相关基因的相对表达。
07
利用Trm 细胞可以更好地解析与迁移相关的基因
他们探索了细胞表面蛋白(Ly6C、CD62L、CD103、CD69、CD127、KLRG1 和 iv 抗体)和 RNA 表达的联合分析是否能更好地揭示数据集中所有 Trm 细胞共有的独特特征。在基于数据的联合 totalVI 潜在空间表示进行降维和聚类并考虑组织来源、迁移状态和聚类之间的转录相关性后,再次观察到 Trm 细胞主要分散成两个进化枝,表现出Icos蛋白的差异表达,但 CD103 蛋白的表达没有差异(图 7 A-D)。因此,为了减轻组织来源的压倒性影响并揭示居住性质所独有的特征,他们根据进化枝名称对记忆 CD8 + T 细胞进行了分离(图 7 B-E)。
对于每个进化枝,使用随机森林分类基尼重要性评分对差异表达的蛋白质和基因进行排序,排序依据是它们预测细胞是否驻留的准确度(图 7 F)。虽然进化枝之间存在差异,但两个进化枝都具有 18 个增加的 Trm 细胞预测基因和 6 个减少的 Trm 细胞预测基因,统称为“泛 Trm 基因”。CD69 蛋白表达(但不是Cd69基因)对确定细胞驻留的预测准确性因组织而异(图 7 F)。与Icos hi Trm 细胞相比,CD69 表达对Icoslo的预测准确性较低。此外,静脉注射抗体染色的缺失对Icos hi Trm(包括肺来源)具有高度预测性,但对Icoslo Trm 细胞(包括肝脏和脾脏来源)则不然(图 7 F)。
虽然从联合数据(图 7)和仅 RNA数据的潜在空间表示中鉴定出不同的预测基因,但有共同的基因表现出预测准确性,可用于识别Icos hi和Icos lo Trm 细胞。具体而言,两种分析都表明,Rgs1、Chn2、Xc11、Gpr34、Igflr1、Itga1、Ckb、P2rx7、Cxcr6和Fgl2的表达增加以及Klf2、S1pr1、Sell、Aff3和Sidt1的表达降低可高度预测细胞为驻留细胞。与使用图 3 中鉴定的基因相比,通过两种分析鉴定出的泛 Trm 基因在将细胞分类为驻留细胞或平衡细胞方面表现出更好的性能(图7G-I)。
来自骨髓、淋巴结、肺和脾脏的一部分细胞富集了 Trm 细胞基因,但没有富集 Teq 细胞基因。通过考虑 Trm 细胞中表达增加和减少的基因,可以更好地推断迁移特性。例如,许多来自肺部的细胞表现出 Trm 细胞基因的富集。然而,这些细胞中的一部分也表达了特征性的 Teq 细胞基因,例如KLF2、S1PR1、KLRG1和CX3CR1(聚类 4)(图 6 M)。此外,这些结构揭示了从淋巴结(特别是肠系膜淋巴结 (mesLN))和脾脏中分离的 Trm 细胞之间的转录异质性,其中一些表达CCR9(CC 趋化因子受体 9 型)和CD160 ,而另一些则不表达。此外,这些结果表明,中枢记忆(CD62L + CCR7 +)CD8 + T 细胞(基于 CD69 表达)可能是 Teq 细胞,这可能导致重新解释幼稚 CD8+ T 细胞在人类淋巴结中驻留。
接下来,他们试图探究是否可以应用本项研究结果来开发一种流式细胞分析策略,预计该策略与驻留时间的相关性比单独的 CD69 更好。到目前为止,观察到许多 Trm 细胞表达 CXCR6、CD38 和 CD49a 蛋白质和基因。虽然 CXCR6 和 CD38 在最近激活的 CD8+ T 细胞(包括脾脏和血液中的细胞)上高度表达,但 CD49a 却没有,这表明它可能是识别非 SPF 环境中 Trm 细胞的更可靠标记(图 7 J)。
为了探索识别 Trm 细胞的潜在更可靠的流动策略,他们利用同窝培养小鼠共生体作为的实验(非 SPF)模型来评估不同 CD8 + T 细胞的迁移特性和表型。他们对同窝培养小鼠共生体 CD8 + T 细胞的分析有意忽略抗原特异性和血管内抗体染色状态,以便更好地与未进行四聚体和血管内染色的情况联系起来。
他们首先使用现有的流式细胞术抗体评估了泛 Trm 细胞标志物的表达(图7A-F)。使用单个标志物,他们观察到组织中不同程度的平衡(图 7 K)。因此,他们接下来利用多维流式细胞技术来分析 14 个不同解剖位置内和之间的泛 Trm 细胞表面和细胞内标志物组合。通过这项工作,他们提出了一种细胞表面标志物组合和分析策略,可在组织中鉴定 Trm 细胞。该策略需要识别缺乏 CX 3 CR1 和 CD62L 并表达 CD69 的记忆性(CD44high)CD8+T 细胞(图 7 L-M)。为了减少与最近激活的 CD8+ T 细胞的混淆,还应用了 CD49a 或 CD103,即使这些标志物因位置而异(图 7 M)。CD62L − CX 3 CR1 − CD69 + CD49a +表型在鉴定SLO、肺和骨髓中的CD8 + Trm 细胞方面优于单独的 CD69 表达(图 7 N)。虽然该组合提高了排除 Teq 细胞的准确性,但它也导致排除了 NLT(例如 PANC、FRT)中一些迁移测定定义的 Trm 细胞,其中一些真正的 Trm 细胞不表达 CD69(图 2 F,图7 L)。
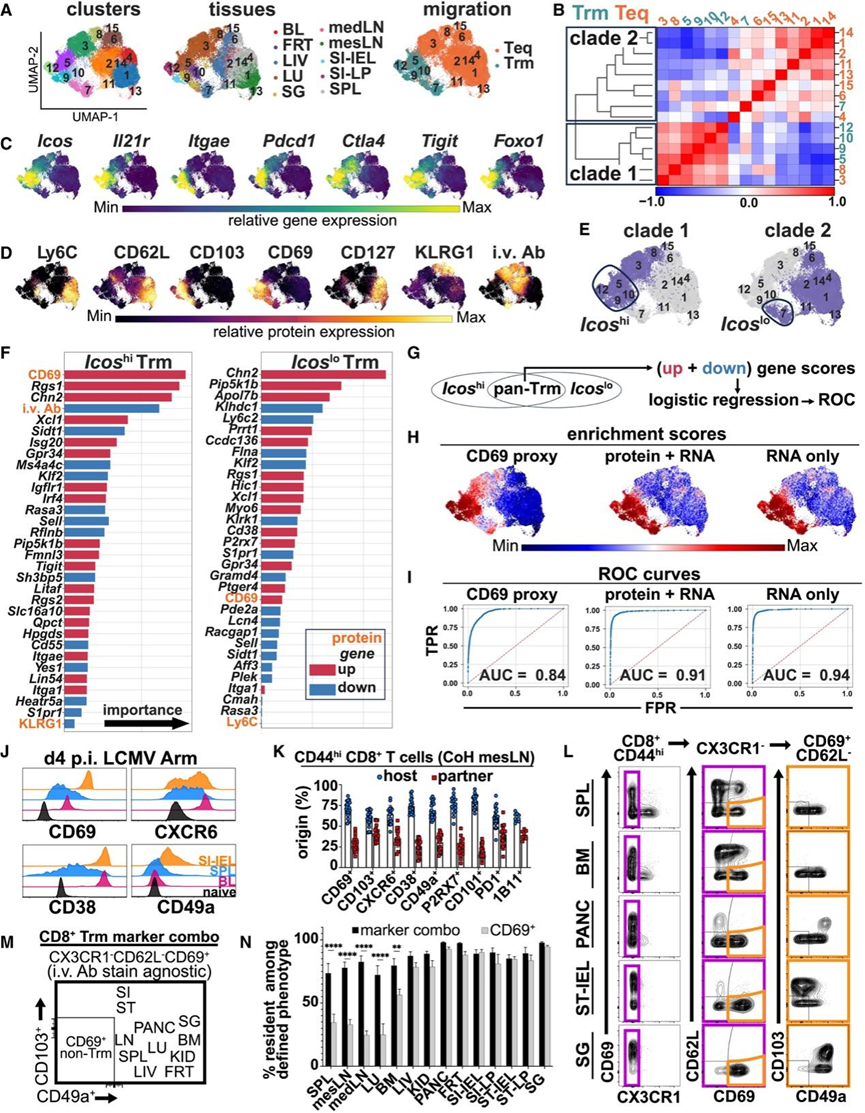
图7. 更准确地辨别 Trm 细胞的特征和策略。
(A)UMAP可视化。(B) 皮尔逊相关系数和细胞聚类的层次聚类。(C-D) 基因和蛋白质的 totalVI 表达。(E) UMAP 图描绘了进化枝名称。(F) 差异表达蛋白和基因按通过为每个进化枝生成随机森林分类器模型获得的基尼重要性得分进行排序。(G)分析方案。(H) 富集分数的 UMAP 图。(I) 真实阳性率(TPR)与假阳性率(FPR)的 ROC 曲线图。(J) 对 LCMV Arm 感染后第 4 天的小鼠的 P14 细胞和未感染小鼠的幼稚 CD8+ T 细胞进行了指示标志物的表达评估。(K) 对共居 (CoH) 共生体中的记忆性 CD8+ T 细胞进行了指示标记评估。(L) 用于识别各种组织中的 Trm 细胞的筛选策略。(M) 针对评估组织的流动表型分析策略摘要。(N) 针对评估组织的流动表型分析策略摘要。
+ + + + + + + + + + +
结 论
本项研究通过整合小鼠异体共生、多器官取样、血管内染色、急性和慢性感染模型、脏小鼠和单细胞多组学来评估驻留代理的有效性和普遍性。记忆 T 细胞整合了一系列输入——位置、刺激历史、抗原持久性和环境——导致无数分化状态。因此,当前的 Trm 定义方法具有隐含的局限性,并且可能不存在通用的驻留特定特征。然而,本研究定义了所测试的广泛条件下的组织驻留更紧密相关的基因和表型。这项研究揭示了 T 细胞对各种刺激和环境输入的广泛适应性,并为评估 Trm 细胞提供了实用建议。
+ + + + +



 English
English


