文献解读|Bone Res(12.7):小鼠骨髓信号景观的空间转录组学分析
✦ +
+
论文ID
原名:Spatial transcriptomic interrogation of the murine bone marrow signaling landscape
译名:小鼠骨髓信号景观的空间转录组学分析
期刊:Bone Research
影响因子:12.7
发表时间:2023.11.06
DOI号:10.1038/s41413-023-00298-1
背 景
骨骼干细胞和祖细胞 (SSPC) 的自我更新和分化是受到严格调控的过程,SSPC 失调会导致进行性骨病。这种严格的 SSPC 调节的破坏与导致进行性骨质流失(例如骨质疏松症)的代谢性骨疾病的发生有关。SSPC 调节的破坏通常是由骨髓生态位内的局部变化引起的。目前缺乏对骨内干细胞生物学复杂性的了解,需要深入了解驱动这种多样性的机制。
实验设计

结 果
01
通过空间转录组学分析成年小鼠矿化骨
研究者团队首先将成年小鼠的股骨平分,并在4℃的缓冲福尔马林中固定过夜。然后样品在EDTA中脱钙2周,每2天添加新鲜的贴膜。然后将脱钙股骨进行标准石蜡包埋处理。组织学切片放置在Visium空间基因表达玻片上,该玻片包含空间上独特的捕获寡核苷酸。在染色和成像后,使用小鼠全转录组探针对组织切片进行杂交,定位到约20000个基因。探针连接和冲洗后,特异性杂交探针通过通透性从组织中释放并由Visium玻片寡聚体捕获。随后对H&E染色图像进行测序、比对和配准,可获得骨内原始2D位置内的基因表达信息。排除周围软组织和生长板上的软骨后以评估转录恢复效率(图1a)。为了确定组织特异性基因变化,他们手动将空间样本分割为皮质骨(橙色)、小梁骨(蓝色)和骨髓(洋红色)(图1b)。综合起来,他们的评估显示每个点平均有 172 ± 154 个(皮质)、194 ± 96 个(小梁)和 233 ± 131 个(骨髓)独特基因,总计有13115个(皮质),9605个(小梁)和17524个(骨髓)独特基因。值得注意的是,空间点分配给每个点内最具代表性的组织,因此,可能部分包含来自邻近组织区域的细胞。基因表达谱用于确认捕获转录本的成功空间描绘(图1c)。
皮质骨和小梁骨均显示出高水平的成熟成骨转录本(Col1a1、Bglap),另外骨膜(Postn)和骨祖细胞(Sp7、Runx2)基因分别富集于皮质骨和小梁骨中。相比之下,造血标记(Ptprc,编码CD45)、红细胞生成标记(Hba-a2)和增殖标记在骨髓内大量富集(图1c)。这些数据首次表明在完全矿化的成年小鼠的长骨组织中进行空间转录组学的技术可行性。
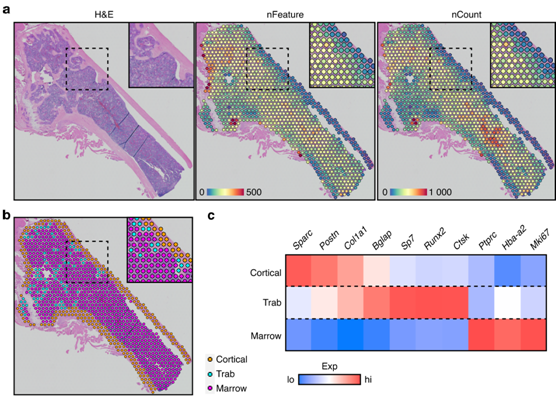
图1. 股骨的空间转录组分析。
(a) H&E 染色切片的空间特征图。(b) 通过组织学形态手动分割皮质骨、骨小梁和骨髓空间点。(c) 标记基因在每个分段区室中表现出丰富的表达。
02
使用 scRNAseq 计算空间点反卷积
骨髓的高度复杂性体现在彼此接近的细胞类型的多样性,加上空间转录组学的有限空间分辨率,使得将空间基因表达谱分配给单个细胞类型具有挑战性。为了克服这个问题,他们利用单细胞转录组分析(scRNA-seq) 通过计算将空间点反卷积为其细胞成分(图2)。在本项研究中,将来自骨源性细胞和骨髓源性细胞的多个 scRNAseq 数据集组合起来,生成包含骨髓所有主要细胞类型的单个对象(图3a)。Seurat、CellTrek 和 Cell2Location 方法均提供了每个空间点内存在感兴趣的 scRNA-seq 聚类的概率(图3b)。
对所有聚类进行预测建模,并将其映射到空间数据的所有区域。然后通过计算所有聚类中单个空间点内预测分数的标准差来确定每个预测模型的辨别能力(较大的值表示区分单个细胞类型富集程度高于随机混合的能力增强)(图3c)。接下来,根据细胞在不同空间隔室内的位置来分析预测值(图3d)。使用Seurat,他们在皮质骨 (65%) 和小梁骨 (44%) 以及骨髓 (49%) 内发现了相对较高丰度的间充质谱系 (MesLin) 细胞。相反,Cell2Location显示骨髓内造血细胞丰度高,但在皮质和小梁骨区域内平滑肌细胞丰度不成比例。与 Seurat 和 Cell2Location 相比,CellTrek 在将 MesLin 细胞分配到骨室和将造血细胞分配到骨髓方面表现得更为合理(图3d)。为了克服每个预测方法中的限制,他们创建了一个组合的预测管道。为 3 个预测模型中的每一个选择预测值的上 2 个四分位数内的所有空间点,并进行比较以确定每种方法之间的重叠水平(图 3e)。使用他们联合的预测管道进行的细胞分布显示,MesLin细胞到骨皮质(53%)和造血细胞到骨髓室(83%)的强烈映射(图3e-f),这与这些组织的已知细胞组成一致。
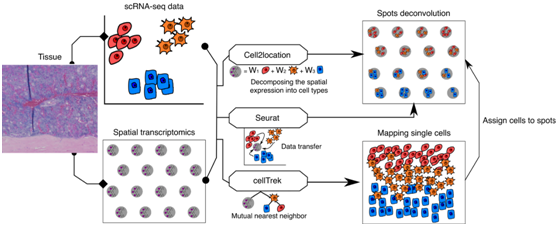
图2. 使用 scRNAseq 进行空间点反卷积。
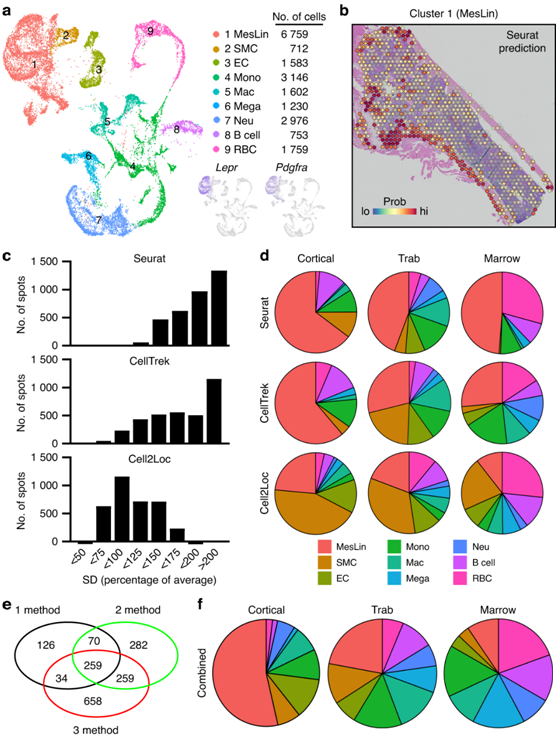
图3. 使用 scRNAseq 对空间点进行成分反卷积。
(a) 骨髓scRNAseq数据集的UMAP。(b)空间点包含 MesLin 细胞的概率。(c)每个空间点内每个细胞聚类的预测值的标准偏差 (SD)。值越高表示预测值的变化越大,并且对每个空间点内的细胞类型的辨别力越大。(d)饼图显示使用三个指示的预测包将每个指示的细胞类型分配给每个空间区域的概率。(e) MesLin 细胞的空间点的预测方法(Seurat、CellTrek 和 Cell2Location)之间存在重叠。(f)饼图显示使用组合预测管道将每种指定细胞类型分配给每个空间区域的概率。
03
SSPC 亚型定位于空间上不同的骨骼区域。
通过这种分析流程,MesLin 细胞在皮质内显示出增加的预测概率,并在较小程度上显示出小梁空间点(图4a),这可能与骨内成骨细胞和骨细胞的高度富集相对应。他们从骨髓中分离出MesLin空间点(图4a),并计算MesLin骨髓点相对于MesLin-骨髓点的差异表达基因。DEG的通路分析显示,MesLin点内与基质产生/组织、骨骼发育和骨化相关的富集,而MesLin-点在红细胞生成、免疫细胞和细胞增殖方面高度富集(图4b)。为了进一步细化scRNAseq集群的空间定位,他们接下来重新分析并亚聚MesLin细胞(图4c)。
标记基因的表达模式(图4c)显示了成熟的成骨细胞(OB)和早期骨细胞(Ocy),以及之前提出的两个异质性SSPC群体,PαS细胞[这里定义为高水平表达Pdgfra和Ly6a(编码SCA1) (PαS)],以及富含Cxcl12的网状(CAR)细胞,这里通过Cxcl12和Lepr的表达界定。为了表征这些 SSPC 聚类的空间分布,他们应用了如上所述的类似预测建模工作流程,其中 MesLin +空间点进一步分为这两种 SSPC 细胞亚型,并以成熟的成骨细胞作为对照(图4d)。亚型分布的定量分析表明,PαS细胞在皮质骨内高度富集,特别是沿着与骨膜一致的外皮质表面(图4d-e)。相比之下,CAR 细胞主要存在于骨髓中,与骨髓 SSPC 一致。成骨细胞主要与小梁空间点相关,在皮质空间点内的程度要小得多,这与小梁室内经常观察到的骨重塑一致。本项研究的组合预测流程方法证明了空间转录组学和 scRNA-seq 的联合优势,可以克服空间分辨率的限制,并将 PαS 和 CAR 细胞分别空间定位到骨膜和骨髓。
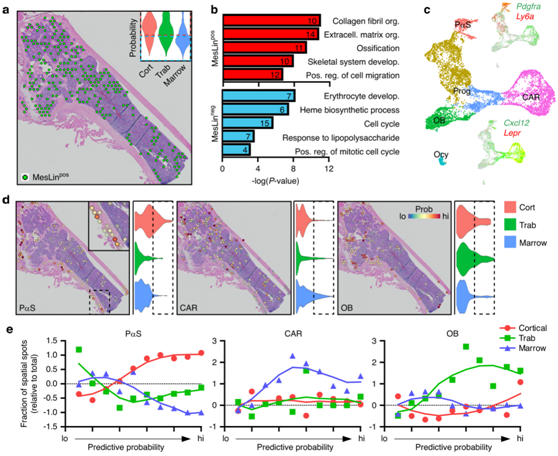
图4. SSPC 亚型定位于空间上不同的骨骼区域。
(a) 骨髓内含有 MesLin 细胞的空间点。插图显示了 MesLin 细胞定位于每个空间区域的概率。(b)在 MesLin +和 MesLin −空间点中富集的骨髓 DEG 的通路分析。 (c) MesLin 亚聚类的 UMAP。 (d) 所示单细胞聚类在空间点上的预测模型。(e) 将指示的 MesLin 亚聚类在分段空间数据上进行预测建模量化。
04
定义骨髓 SSPC 生态位的细胞成分
通过计算得出骨髓内这种异质Cxcl12+ Lepr+ SSPC 群体的空间位置后,他们接下来研究了骨髓 SSPC 生态位中存在的其他细胞成分,结合了每个细胞聚类的预测管道数据(图3f)。接下来,他们进行相关分析以确定SSPC和每种指示的细胞类型存在于相同空间点内的概率(即,经常发现哪些细胞类型存在于与SSPC相同的空间位置内)(图5a)。使用所有三个预测建模方法(Seurat、CellTrek、Cell2Location)的相关性用于量化 SSPC 和感兴趣的细胞类型之间的空间相关性的斜率(以对数尺度)以及这种相关性的显著性(图 5b)。这些结果表明,骨髓内的Cxcl12 + Lepr + SSPC 最常在空间上与平滑肌细胞、内皮细胞、巨噬细胞以及较小程度的巨核细胞相关。相反,SSPC与红细胞表现出强烈的负空间相关性(图5c)。
为了进一步细化骨髓Cxcl12+ Lepr+ SSPC 生态位中存在的细胞成分,他们对内皮细胞(图5d-g)和巨噬细胞(图5h-k)单细胞群进行亚聚类并重新分析它们与含SSPC的空间斑点的关联。内皮细胞亚聚类分为3个转录独特的亚群(EC1-3)(图5d)。EC1富集了血管标记基因,EC3富集了小动脉标记基因。EC2在每种血管类型中均有中等表达,但在血管生成尖端细胞和茎内皮细胞中富集。这3个内皮细胞亚群表现出与本研究的空间数据的差异映射,其中EC1与皮质骨表面最密切相关,EC2主要与骨小梁相关,EC3与骨髓以及较小程度的骨小梁相关(图5e)。差异表达基因(DEG)和通路分析显示EC1中BMP信号传导、EC2中TGFβ和缺氧相关信号传导以及EC3中Notch信号传导的丰富激活(图5f)。相关斜率的计算表明,EC3与含有SSPC的骨髓空间点呈显著正相关,而EC1和EC2亚群分别表现出强负相关和弱正相关(图5g)。对巨噬细胞 (Mac1-4) 进行了类似的亚群分析(图5h),空间映射显示 4 个巨噬细胞亚群中每个亚群的不同富集区域(图5i)。通路分析显示与细胞功能和炎症状态相关的多个通路的独特富集(图5j)。计算相关斜率表明Mac2与含有SSPC的骨髓空间点呈显著正相关(图5k)。Mac3 细胞与包含 SSPC 的斑点呈正相关,与总巨噬细胞群相似,但由于预测方法之间的相关斜率差异较大,因此未发生显著富集,而 Mac1 和 Mac4 均发现相关性不显著(图5k)。
这些数据证明了使用单细胞预测方法与空间转录组学相结合来识别干细胞生态位中经常存在的异质细胞类型群体的可行性。此外,这些结果表明,这些细胞类型可以通过基因表达谱进行分割,并在空间上进行细分,以量化 SSPC 生态位内的富集。
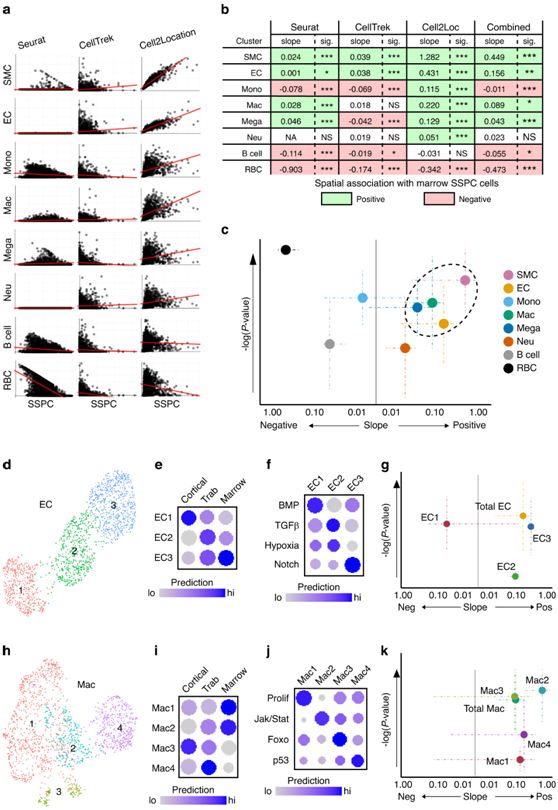
图5. 微环境驻留细胞的鉴定。
(a) 概率相关性表明细胞类型存在于骨髓Cxcl12+Lepr+SSPC 空间点内的可能性。(b) 统计分析显示干细胞微环境中存在指定细胞的可能性。(c) 气泡图显示预测在生态位内的细胞类型。(d) EC亚聚类的UMAP可视化。(e) 点图显示每个 EC亚聚类映射到每个空间转录组区域的预测值。(f) 点图显示每个 EC亚聚类内通路激活的模块化评分。 (g) 气泡图显示预计位于 SSPC 生态位内的 EC 亚聚类。(h) Mac亚聚类的 UMAP。 (i) 点图显示每个 Mac亚聚类映射到每个空间转录组区域的预测值。(j)点图显示每个 Mac 亚聚类内通路激活的模块化评分。(k)气泡图显示预计位于 SSPC 生态位内的 Mac 亚聚类。
05
剖析 SSPC 生态位内的细胞间相互作用
对含有 SSPC 的骨髓点内富集的基因进行的通路分析揭示了几种成熟的形态发生通路的富集表达,包括 WNT、Notch 和 TGFβ 信号传导(图6a)。他们结合了单细胞数据和空间数据来细化总空间和单细胞聚类的DEG列表,这些基因表达已知的配体或受体,通过CellChat预测,这些基因在细胞类型之间存在相互作用,最终在他们预测的SSPC+生态位空间点中富集表达(图6b-c)。
虽然不能区分更精细的空间组织,但是scRNA-seq和空间转录组学的组合方法可以识别在预测的SSPC位置周围55µm区域(每个空间点的大小)内富集的基因。对这些不同类型的重叠DEG的探测使他们能够识别(i)局限于生态位但在多种细胞类型中广泛表达的生态位信号因子(空间受限),(ii)在细胞类型中富集但不局限于生态位的基因(细胞类型受限),以及(iii)同时显示细胞类型和空间受限表达的基因(空间和细胞类型受限)(图6d)。使用 RNAscope 对Lepr SSPC周围表达Cd44-、Cd74-和Ryr1的细胞分析也获得了类似的结果(图6e)。这些体内量化结果表明,虽然Cd44+和Ryr1+细胞在空间上限制在Lepr+ SSPC的几微米范围内,但Cd74+细胞更普遍分散(图6f)。
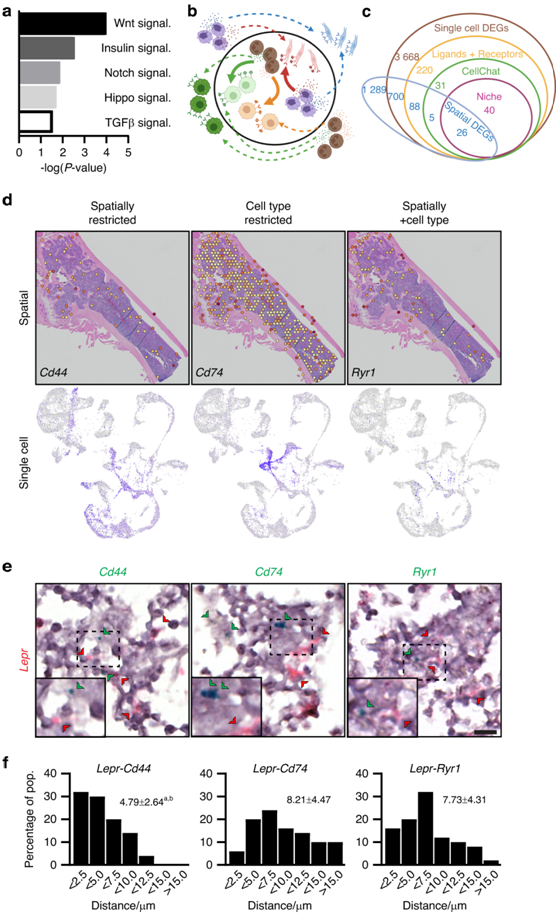
图6. 利用空间转录组学研究干细胞生态位内的信号传导。
(a) 骨髓中富含生态位空间点的DEG相对于其他空间点的通路分析。(b)细胞与细胞相互作用的示意图。(c) 使用单细胞空间转录组学预测细胞间相互作用。(d) 从细胞-细胞相互作用中鉴定出的样本基因在空间上局限于生态位,但在许多不同的细胞类型中表达(Cd44),仅在选择细胞类型中表达但在整个骨髓中存在的基因(Cd74),以及在空间和细胞类型上都受到限制的基因(Ryr1)。(e) RNAscope 显示表达Lepr的 SSPC(红色)和Cd44(左)、Cd74(中)和Ryr1(右)(绿色)。(f) 所示生态位细胞标记与Lepr+ SSPC 之间的距离分布。
06
信号梯度在骨髓内建立结构域
除了SSPC生态位中存在局部信号轴外,他们进一步假设骨髓中存在更广泛的信号梯度,这些信号梯度在骨髓腔中建立了结构域。他们对骨髓空间点进行了时空分析(图7),利用手动指定的参考线,然后测量每个空间点与沿该参考表面的最近点之间的距离。首先,空间点根据其与最近的血管、小梁骨或皮质骨表面的相对接近程度进行对齐(图7a)。然后鉴定出其表达随着其与参考表面的接近程度而波动的基因(图7b),接着使用通路分析来识别相对于参考组织的距离而改变的主要调控网络。
为了观察与最近的血管、小梁或骨皮质表面的距离有关的整个时空通路激活情况,他们进行了模块评分,计算从已知的KEGG通路中提取的基因表相对于背景的平均表达。
对与生物能学相关的基因进行评分,他们观察到紧邻血管、紧邻且远离小梁表面以及远离皮质骨表面的糖酵解基因表达水平高(图7c)。相比之下,与氧化磷酸化(OxPhos)相关的基因主要位于远离血管以及距小梁骨和皮质骨表面中间的空间骨髓点中。最后,发现脂肪酸(FA)代谢主要与皮质骨表面和距骨小梁表面中等距离相关(图7c)。除了代谢调节之外,通路分析还确定了与主要形态发生通路相关的信号激活梯度的变化(图7d)。
血小板源性生长因子 (PDGF) 信号传导在血管附近和远处以及骨小梁表面附近均高度活跃。紧邻血管且远离小梁和骨表面的WNT信号传导高,而相反地,远离血管且邻近小梁和骨皮质表面的WNT信号传导低(图7d)。骨形态发生蛋白(BMP)和转化生长因子β(TGFβ)信号在小梁和皮质表面附近表达较高,而在更远的骨髓点处表达较低(图7d )。组织学验证证实了皮质和小梁表面附近的TGFβ信号传导(由p-SMAD3染色表示)的优先激活,以及小梁血管表面附近的PDGF受体α(PDGFRα)的优先染色(图7e)。总体而言,这些结果证明了信号梯度、细胞功能和代谢的微结构域,以响应与血管和骨表面的距离。
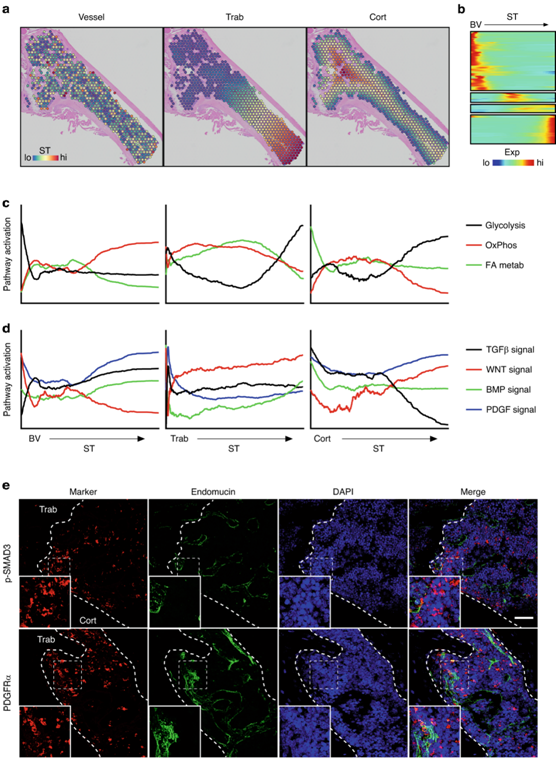
图7. 时空分析揭示了源自血管的信号梯度。
(a) 空间距离计算显示每个骨髓空间点到最近血管(左)、小梁骨表面(中)和皮质骨表面(右)的最小距离。 (b) 鉴定在骨髓中受差异调节的基因。(c) 模块评分显示骨髓空间点内指定代谢通路的激活相对于它们到最近的血管(左)、小梁(中)或皮质(右)表面的距离。(d) 模块评分显示骨髓空间点内指定形态发生通路的激活相对于它们到最近的血管(左)、小梁(中)或皮质(右)表面的距离。(e) 小鼠长骨中 TGFβ 激活 (p-SMAD3) 和 PDGFRα 的免疫荧光染色。
+ + + + + + + + + + +
结 论
本项研究将空间转录组分析和scRNA-seq结合起来分析成年小鼠股骨,以探索SSPC 的内源性微环境。这种组合方法将 SSPC 亚型定位于骨骼的特定区域,并确定了生态位内的细胞成分和信号网络。此外,利用空间转录组学能够识别骨髓腔内建立微域的脉管系统和骨表面的代谢和主要形态发生信号梯度的空间限制激活。总的来说,本项研究首次证明了将空间转录组学应用于完全矿化组织的可行性,并提出了一种组合的空间和单细胞转录组学方法来定义干细胞生态位的细胞成分,识别细胞间相互作用,并最终全面了解钙化组织内的变化。
+ + + + +



 English
English


