文献解读|Nature Communications(16.6):使用原代细胞重建人 PDAC 揭示肿瘤发生时的致癌转录组特征
✦ +
+
论文ID
原名:Reconstitution of human PDAC using primary cells reveals oncogenic transcriptomic features at tumor onset
译名:使用原代细胞重建人 PDAC 揭示肿瘤发生时的致癌转录组特征
期刊:Nature Communications
影响因子:16.6
发表时间:2024.01.27
作者/通讯作者:Yi Xu/ Pei Wang
单位:德克萨斯大学圣安东尼奥健康科学中心细胞系统与解剖学系
DOI号:10.1038/s41467-024-45097-2
背 景
胰腺导管腺癌(PDAC)是胰腺癌最常见的组织学亚型。这种恶性肿瘤是最致命的人类癌症之一。目前对人类细胞中早期 PDAC 进展的了解仍然非常有限,一些基本问题仍不清楚,包括 PDAC 的细胞起源是什么以及在 PDAC 进展过程中正常外分泌细胞如何响应环境提示转化为恶性细胞和致癌事件。
实验设计
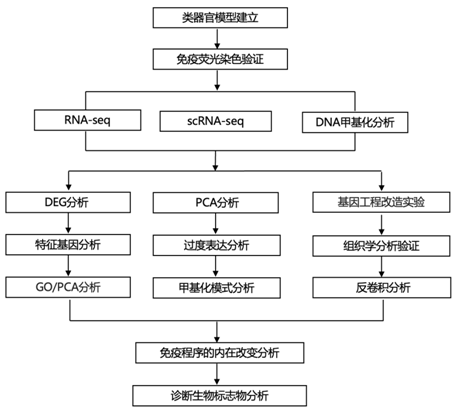
结 果
01
长期 3D 腺泡细胞培养模拟体内损伤诱导的化生
研究者团队从人体器官捐献者获得无病的胰岛耗尽的胰腺腺泡部分,并对已知的腺泡标记物AMY2和导管标记物KRT19进行染色,这揭示了腺泡和导管谱系的存在和腺泡的特征(图 1a)。对来自 5 个独立供体的分选细胞的 RNA-seq 分析揭示了 2087 个腺泡高基因和 1906 个导管高基因的差异表达,包括 273 个差异表达的转录因子 (TF)(图 S1a-b)。正如预期的那样,腺泡群体中表达最高的基因包括许多消化酶(图 S1c)。富集程度最高的通路包括细胞质翻译、核糖体组装、消化和蛋白质分泌,证实了腺泡的正常功能(图 1b)。相比之下,导管细胞表达高水平的小管形态发生相关基因和多种信号通路,包括WNT通路和转化生长因子(TGF)-β通路。
为了建立腺泡和导管培养模型,他们在依赖WNT的三维类器官系统中分别培养了分选的细胞。有趣的是,导管衍生的类器官最初增殖迅速,但在4代内停止增殖(图1c)。另一方面,腺泡衍生的类器官在传代早期增殖速度慢得多,然后开始迅速扩张,可以连续传代6个月以上并冷冻保存。培养的腺泡类器官呈典型的环状形态,并表达MUC5AC, MUC5AC是KRAS诱导的腺泡化生的标志物(图S1d)。来自6个独立供体的腺泡衍生类器官(体外培养至少6周)的转录组学特征与新鲜的腺泡细胞和新鲜的导管细胞不同(图S1e)。
对新鲜腺泡、新鲜腺泡导管和培养腺泡类器官表达数据进行全面的三组比较,发现三组中有超过10000个差异表达基因(DEG)(图1d)。对2087个腺泡特征基因的分析显示,类器官失去了大多数腺泡谱系特征,这些特征主要涉及正常的腺泡功能(图S1f)。另一方面,培养的类器官只获得了一部分导管基因,包括一些导管特异性转录因子(图S1g),这突出了它们没有向导管谱系转分化。
最近的小鼠胰腺损伤研究表明,在腺泡-导管化生(ADM)过程中,腺泡细胞可以转化为多个化生群体。人类慢性胰腺炎样本中出现聚类细胞和 Mucin5B/导管细胞群。这些化生细胞群体的许多基因标记在腺泡衍生的类器官中上调(例如AQP5、TFF2、MUC6、PGC、CLDN18、MUC5AC、TFF1、MUC5B等)(图 1e),表明本项研究的 3D 培养系统准确地模拟了体内胰腺腺泡损伤。
为了对培养的腺泡细胞与参考化生细胞群进行基因表达比较,通过整合来自单细胞转录组 (scRNA-seq) 数据的读取计数。主成分分析(PCA)表明,培养的腺泡类器官与小鼠和人类胰腺疾病模型中鉴定的chief-like细胞、pit-like细胞以及Mucin5B/导管细胞具有很大的相似性(图1f)。
为了研究培养的腺泡细胞的潜在异质性,他们使用多受试者单细胞反卷积 (MuSiC) 方法进行了bulk RNA 反卷积分析。通过使用包含正常和化生腺泡细胞的小鼠 scRNA-seq 数据集作为参考,反卷积分析推断约 90% 的新鲜腺泡细胞为正常腺泡细胞,证明了分析的稳健性(图 S1h)。
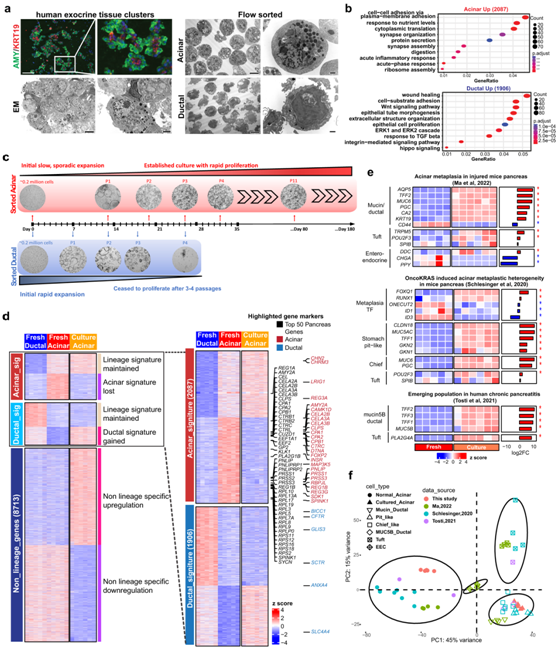
图1. 与化生特征相关的原代人类 3D 腺泡培养。
(a) 左:淀粉酶和 KRT19 的免疫荧光染色。右:流式分选的腺泡和导管细胞的电子显微镜图像。 (b)GO分析。(c) 已建立的长期 3D 腺泡培养的明场图像和示意图。 (d) 3 组样品中所有差异表达基因的表达热图。 (e) 培养的腺泡细胞与新鲜腺泡细胞中列出的腺泡化生基因的表达热图。(f) 主成分分析(PCA)。
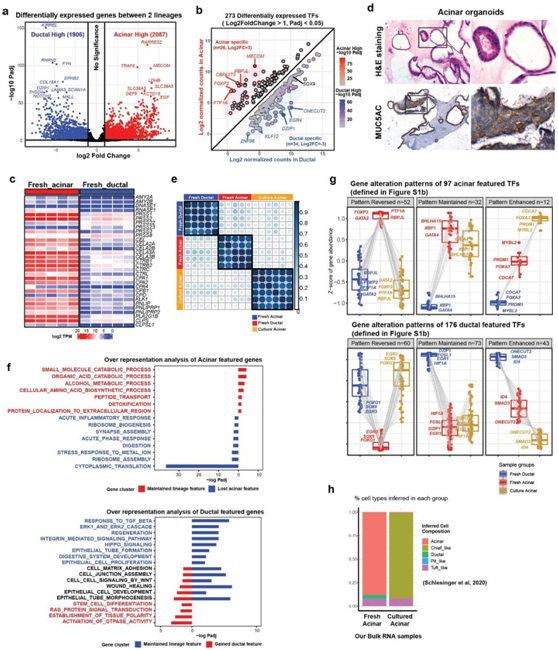
图S1.新鲜和培养人原代胰腺外分泌细胞的分子谱分析。
(a) 新鲜腺泡与新鲜导管细胞差异表达基因的火山图。 (b) 273个差异表达转录因子在分选的新鲜腺泡和导管细胞中的平均归一化表达。(c) 已知胰腺消化酶的基因在分选新鲜细胞中的表达热图。(d) 培养的腺泡类器官H&E染色和MUC5AC染色。(e) 新鲜腺泡细胞、新鲜导管细胞和培养的腺泡类器官中基因表达的Pearson相关图。 (f) 腺泡特征基因聚类和导管特征基因聚类中两个基因亚群的基因本体过表示分析。(g) 腺泡特征基因聚类和导管特征基因聚类中两个基因亚群的GO分析。 (h) 新鲜和培养的腺泡样本中推断的细胞类型组成的条形图,使用scRNA-seq数据集作为参考。
02
培养的胰腺外分泌细胞保持了可识别的谱系相关 DNA 甲基化特征
实质性的转录和形态学变化使得培养的类器官的谱系起源变得模糊。他们假设 DNA 甲基化可能保持相对稳定,可用于验证谱系身份。为此,进行简化代表性亚硫酸氢盐测序以评估新鲜分选的腺泡和导管细胞的 DNA 甲基化。在给定谱系的样品中,所有分析的 CpG 位点的 DNA 甲基化相关性要高得多(图 2a)。根据基因型组织表达(GTEx)数据,在胰腺中表达最高的基因中,与翻译机制相关的基因的启动子在两个谱系的新鲜细胞中均低甲基化,而与胰腺消化酶相关的基因的启动子在新鲜腺泡细胞中低甲基化并在新鲜导管细胞中高度甲基化(图 2b)。
为了验证已建立的培养物的谱系真实性,他们对五个腺泡 3D 和四个导管 2D 独立培养物进行了 DNA 甲基化分析。层次聚类分析表明,培养的腺泡和培养的导管细胞分别与其新鲜对应物密切相关(图 2a)。此外,尽管胰腺消化酶的基因表达在培养的腺泡类器官中丢失,但其中许多的启动子甲基化模式得以保留(图 2b)。
在 5410 个 β 值差异至少为 0.8 的新鲜腺泡低甲基化位点中,2691 个(49.7%)得以维持,1916 个在培养的腺泡细胞中发生甲基化,803 个(14.8%)在培养的导管细胞中失去甲基化(图 2c)。对这些位点相关基因的GO分析显示,维持的甲基化模式在很大程度上与起源细胞的正常功能相关,而改变的DNA甲基化模式与应激反应相关。每种甲基化模式中位点的基因组分布与给定谱系中所有低甲基化位点的分布相似,这意味着DNA甲基化的变化不是DNA甲基化维持酶普遍失效的结果(图2d-e)。这些数据证实了本项研究所建立的培养的谱系特性,这支持了人类原代腺泡细胞可以在体外培养作为研究胰腺疾病的模型的结论。
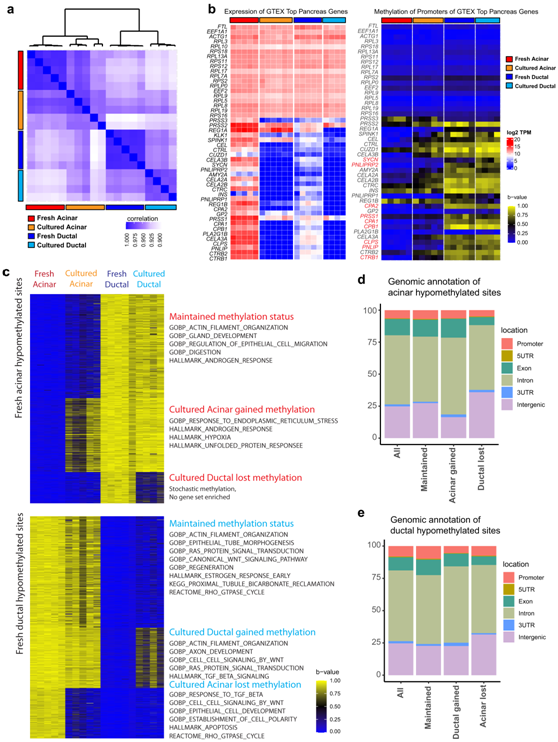
图2. 通过 DNA 甲基化状态验证培养细胞的身份。
(a) 新鲜腺泡、培养腺泡、新鲜导管和培养导管细胞的DNA甲基化谱与所有甲基化位点的相关矩阵。 (b) 启动子的表达热图(左)和 DNA 甲基化状态(右)。(c) 新鲜细胞和培养细胞中大多数高度腺泡低甲基化位点(上)和导管低甲基化位点(下)的 DNA 甲基化状态。(d-e) 中每个位点亚组的分布,参考近端基因组特征。
03
人原代腺泡和导管细胞均可形成PDAC
致癌KRAS突变的获得是人类 PDAC 中最早且最普遍的遗传改变。为了分析PDAC启动背后的分子事件,他们首先通过慢病毒感染含有KRASG12V- mCherry的载体,在野生型腺泡类器官(简称KRAS类器官)中过表达致癌KRASG12V。令人惊讶的是,致癌性KRAS的获得只导致了两个DEG变化,包括KRAS和ST3GAL1, ST3GAL1是小鼠PDAC中由致癌性KRAS驱动的代谢重编程的已知介质(图3a)。有趣的是,他们发现未经修饰的野生型腺泡类器官在小鼠模型中表现出KRAS诱导的PDAC转录特征升高,如糖酵解、类固醇生物合成和O-聚糖生物合成途径(图3b)。此外,野生型腺泡类器官在独立于致癌KRAS的情况下高水平表达MUC5AC(图S1d),而在小鼠ADM中诱导MUC5AC表达需要致癌KRAS。
接下来,他们使用CRISPR/Cas9系统敲除腺泡KRAS类器官中的p16/CDLN2A (P)、TP53 (T)和SMAD4 (S)基因,并与导管-KPTS 2D培养进行比较(图3c)。值得注意的是,通过与谱系特异性小鼠PDAC模型进行比较,他们确定了一组在人腺泡- KPTS细胞和小鼠腺泡源性肿瘤中显著高表达的基因,包括MUC5AC、TFF1、TFF2、CLDN18和REG1A(图3d)。同样,他们发现了一组在人类导管-KPTS细胞和小鼠导管源性肿瘤中均显著高表达的基因,包括EREG、WNT7B、EDL3、GATA3和KCNAB1(图3d)。为了评估来自不同供体和培养状态的样本之间的异质性,他们对收集的新鲜、培养、基因修饰的腺泡和导管样本进行了PCA分析。结果显示,不同的供体来源不同,不同的培养状态会导致不同的样本聚集(图3e)。
由于缺乏人类疾病中腺泡转化的直接证据,他们将腺泡和导管KPTS培养物皮下移植到免疫缺陷NSG小鼠体内,以评估其致瘤性。结果表明,两种携带致癌基因KPTS突变的谱系均可再生地产生肿瘤(图3f)。导管源性肿瘤通常比腺泡性肿瘤大。组织学分析显示,腺泡和导管源性肿瘤组织均具有导管样结构,腔内乳头和突出的透明化或结缔组织增生间质,与早期人类PDAC形态相似(图3f)。此外,典型的胰腺上皮内瘤变(PanIN)病变常见于腺泡源性肿瘤切片,人类特异性抗体STEM121和mCherry的免疫荧光染色证实了癌症病变的人类起源(图3g)。所有肿瘤组织都有高水平的MUC5AC表达(图3f),他们还观察到KRT19和pERK在两个谱系的肿瘤中表达(图3g)。
通过这些结果,他们证明了人类腺泡和导管谱系都能够转化为具有非常相似表型的恶性细胞。
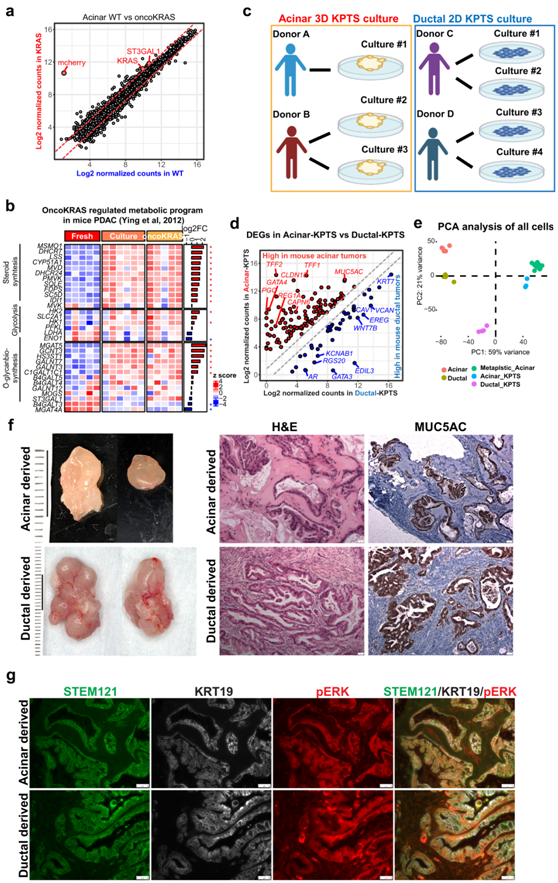
图3. 通过基因工程改造人类原代腺泡和导管细胞以形成 PDAC。
(a) 表达腺泡类器官的野生型和致癌KRAS中标准化基因表达的散点图。 (b) 腺泡来源的新鲜、培养的野生型和培养的 KRAS 细胞中所列基因的表达热图。(c) 建立腺泡-KPTS 3D 培养和导管-KPTS 2D 培养的示意图。(d) 腺泡-KPTS 和导管-KPTS 细胞之间差异表达基因的标准化表达。(e) 在本工作中产生的所有新鲜、培养和转基因的腺泡和导管样本的基因表达PCA分析。(f) 左:源自工程化腺泡和导管培养物的异种移植肿瘤的代表性照片。右:异种移植肿瘤的 H&E 和 MUC5AC IHC 染色。 (g) 对腺泡源性和导管源性肿瘤切片的人类特异性 STEM121、KRT19 和 pERK 进行免疫荧光染色。
04
腺泡和导管 KPTS 细胞中的转录重编程
为了将本项研究的细胞与人类 PDAC 样本进行比较,他们分析了 RNA-seq 数据中参考的细胞类型特异性基因表达(图 4a)。在参考的人 PDAC 样本中,>99% 的新鲜腺泡细胞为正常腺泡细胞,约 80% 的新鲜导管细胞为导管样 1 细胞,证实了此类分析的稳健性(图 4b) 。培养的腺泡类器官获得了与疾病相关的化生特征,约 85% 的培养的化生腺泡类器官被推断为导管样 2 细胞,在参考研究中归类为恶性 PDAC 细胞的主要来源(图4b)。
有趣的是,本项研究的腺泡-KPTS细胞几乎都为PDAC细胞群,而本项研究的导管-KPTS样本含有一小部分PanIN和导管样1细胞(图4b)。每个谱系的KPTS细胞中DEG的基因集过代表性分析揭示了致癌细胞中不同的转录变化,包括常见的和谱系特异性的变化(图4c-d)。例如,细胞周期相关的基因集在两个谱系的KPTS高基因中都富集,这表明在致癌细胞中有共同的增强的增殖潜力(图4c)。来自这两个谱系的KPTS细胞也都有增强的HALLMARK E2F靶基因表达(图4e)。有趣的是,与端粒维持相关的基因集只在腺泡-KPTS-high基因中富集,而在导管-KPTS-high基因中不富集(图4c)。仔细观察端粒基因集的 REACTOME 延伸发现,参与该程序的许多基因(包括TERT)在腺泡-KPTS 细胞中高表达,但在导管-KPTS 细胞中低表达(图 4f)。
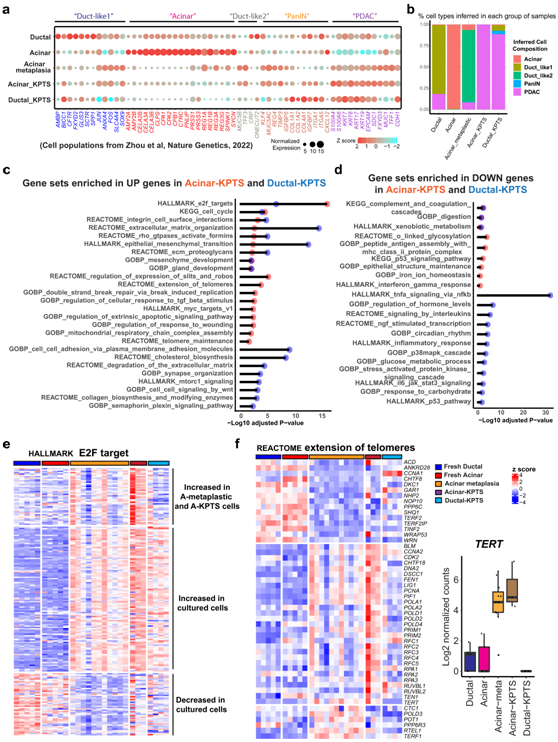
图4. 源自腺泡和导管谱系的致癌细胞中的转录组重编程。
(a) 新鲜细胞、化生细胞和 KPTS 细胞(行)中指定细胞类型特征基因(列)的表达。(b) 细胞类型组成的条形图。(c) 对腺泡-KPTS 细胞(与腺泡化生细胞相比)和导管-KPTS 细胞(与新鲜导管细胞相比)中上调基因的过度表达分析。 (d) Acinar-KPTS 细胞(相对于腺泡化生细胞)和 Ductal-KPTS 细胞(相对于新鲜导管细胞)中下调基因的过度表达分析。(e) HALLMARK E2F 靶基因在新鲜细胞、化生细胞和 KPTS 细胞中的表达热图。 (f) 左:新鲜细胞、化生细胞和 KPTS 细胞中端粒基因组 REACTOME 延伸中基因的表达热图。右:所有样本组中TERT表达的箱线图。
05
腺泡和导管 KPTS 细胞免疫信号的内在改变
DEG的基因组分析揭示了腺泡-KPTS细胞中免疫相关途径的下调(图 4d)。对参与抗原加工和呈递的基因的全面比较揭示了参与抗原呈递过程不同部分的基因的不同表达模式(图 5a)。培养后,在两个谱系中均诱导了一组参与细胞外抗原内吞作用的Rab GTP酶(图 5a-b)。溶酶体中编码组织蛋白酶家族的基因仅在培养的腺泡细胞中发生诱导,而在导管细胞中则不然。此外,MHC I途径中的关键成分B2M和TAP1/2的基因表达在腺泡-KPTS细胞中也发生下调(图 5a-b)。有趣的是,编码多个MHC-I分子以及PD-L1(CD274)的基因被发现在来自腺泡或两个谱系的KPTS细胞中下调(图 5c)。
他们使用流式细胞分析证实了与配对化生腺泡类器官相比,腺泡-KPTS细胞中MHC I表达降低(图5d)。在没有免疫压力的情况下抗原呈递通路的动态变化提示了早期 PDAC 肿瘤发生过程中上皮细胞免疫调节的可能内在机制。
他们还注意到腺泡和导管-KPTS细胞中涉及补体级联的基因普遍下调,包括C3、C4、C1R和C1S(图 5e)。

图5. 致癌腺泡和导管细胞中免疫程序的内在改变。
(a) 新鲜细胞、化生细胞和 KPTS 细胞中 GOBP 抗原加工和呈递基因组中基因的表达热图。 (b) 培养的腺泡和导管细胞中抗原加工和呈递途径中关键基因变化的示意图。(c) 所有样本组中MHC I 类和 PD-L1 ( CD274 ) 基因的 RNA 表达箱线图。(d) 左:MHC I 分子和小鼠 IgG 同型对照的代表性流式细胞术分析3 个独立配对的化生和 KPTS 腺泡类器官。右:MHC I 的定量是指来自 3 个独立配对的化生和 KPTS 样品的荧光。(e) 新鲜细胞、化生细胞和 KPTS 细胞中 KEGG 补体和凝血级联基因组中基因的表达热图。
06
对早期人类 PDAC 模型的分析确定了潜在的诊断生物标志物
由于目前人类 PDAC 的转化研究主要集中在癌细胞系和患者来源的肿瘤样本,因此他们利用独特的早期 PDAC 模型来识别早期诊断标记物。为此,他们首先鉴定了与正常细胞和化生细胞相比,在腺泡-KPTS类器官中显著上调的140个基因(图6a)。类似地,鉴定出 696 个基因在导管 KPTS 细胞中显著上调(图 6b)。然后,他们筛选了 2802 个基因,与 GTEx 正常胰腺数据集相比,这些基因在 TCGA PDAC 样本中显著高表达。对所有三组基因进行比较,发现了 51 个重叠基因,其中包括 26 个编码细胞外蛋白和膜蛋白的基因,这些基因具有作为早期诊断标记候选者的潜力(图 6c-d)。
为了验证确定的潜在生物标志物的临床相关性(图6e),他们首先对KPTS肿瘤和人胰腺囊性肿瘤及其邻近正常组织进行了选定基因的免疫组织化学(IHC)染色。结果表明,所有测试的蛋白(AHNAK2, AREG, SEMA3A, SNCG和WNT10A)在KPTS肿瘤和人胰腺囊性肿瘤中都高表达,但在邻近正常组织中不表达(图6f-g)。通过对包含28例患者配对肿瘤和邻近正常区域的人类PDAC组织芯片进行免疫组化染色进行更全面的验证(图6h-i)。与此一致的是,AHNAK2蛋白在PDAC患者肿瘤区域的阳性表达率为25/28,而在癌旁正常区域的阳性表达率仅为1/28。
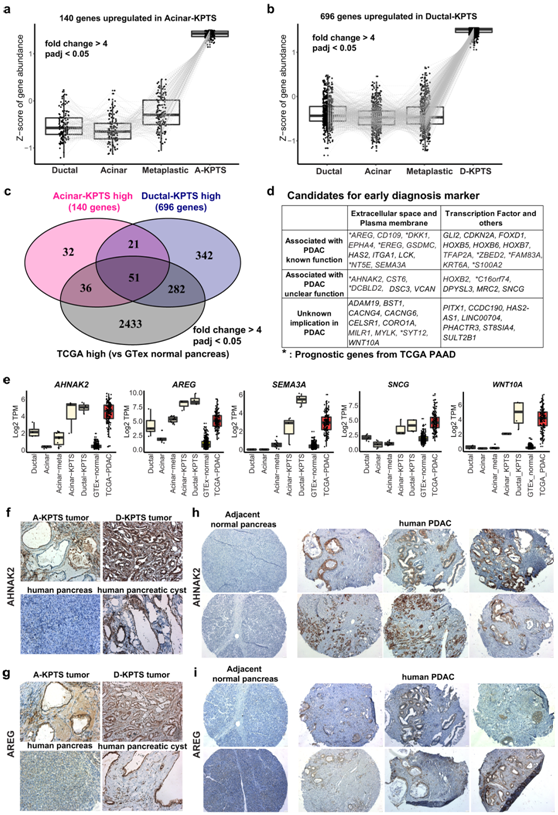
图6. 谱系特异性早期 PDAC 模型揭示了候选诊断标记物。
(a) 与新鲜导管细胞、新鲜腺泡细胞和腺泡化生细胞相比,在腺泡-KPTS 细胞中显着过表达的 140 个基因的表达。 (b) 与新鲜导管、新鲜腺泡和腺泡化生细胞相比,导管-KPTS 细胞中显著过表达的 696 个基因的表达。(c) 140个腺泡的-KPT-high基因、696个导管-KPTS-high基因和2805个TCGA基因的交叉维恩图。 (d) 51个重叠基因的注释。 (e)样本中的基因表达分析。(f-i)免疫组织化学分析。
+ + + + + + + + + + +
结 论
本项研究将分选的人类腺泡细胞扩展为 3D 类器官,并通过引入常见的 PDAC 突变对它们进行基因改造。腺泡类器官经历了巨大的转录改变,但仍保持可识别的 DNA 甲基化特征。腺泡类器官的转录组与疾病特异性细胞群的转录组相似。单独的致癌KRAS不会转化腺泡类器官。然而,腺泡类器官在获得这种疾病的四种最常见的驱动突变后可以在体内形成 PDAC。同样,具有这些基因突变的分选导管细胞也可以形成PDAC,从而通过实验证明PDAC起源于人类腺泡和导管细胞。
RNA-seq 分析揭示了从正常腺泡细胞向 PDAC 的转录转变,其中包括增殖增强、代谢重塑、MHC 分子下调以及凝血和补体级联的改变。通过将 PDAC 样细胞与正常胰腺和 PDAC 样本进行比较,本项研究鉴定了一组在早期转化过程中表达升高的基因,这些基因代表了潜在的早期诊断生物标志物。
+ + + + +



 English
English


