文献解读|Genome Med(12.3):乳腺癌的基因组和转录组分析确定了与新辅助化疗反应相关的新特征
✦ +
+
论文ID
原名:Genomic and transcriptomic analysis of breast cancer identifies novel signatures associated with response to neoadjuvant chemotherapy
译名:乳腺癌的基因组和转录组分析确定了与新辅助化疗反应相关的新特征
期刊:Genome Medicine
影响因子:12.3
发表时间:2024.01.12
DOI号:10.1186/s13073-024-01286-8
背 景
新辅助化疗(NAC)已成为乳腺癌(BC)的标准治疗策略。然而,由于这些肿瘤的高度异质性,尚不清楚哪些患者群体最有可能从 NAC 中受益。多组学提供了一种改进的方法来揭示 BC 中 NAC 前后的基因组和转录组变化,并识别与 NAC 敏感性相关的分子特征。
实验设计
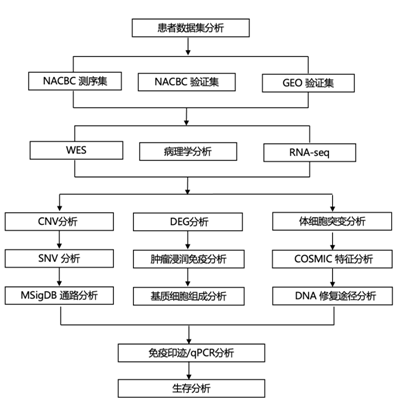
结 果
01
患者群体和样本收集
这项研究包括四个数据集:三个数据集纳入了接受 NAC 的 BC 患者[NACBC 测序集、内部 NACBC 验证集和外部基因表达综合 (GEO) 验证集],第四个数据集纳入了接受辅助化疗的 BC 患者[外部癌症基因组图谱 (TCGA) 验证集]。在 NACBC 测序集中,符合条件的诊断为原发性 BC 的患者于 2013 年 3 月至 2019 年 8 月期间在山东大学第二医院接受 NAC 治疗,随后进行手术(图1A)。
将收集的组织浸泡在RNAlater中或直接冷冻在液氮中等待进一步使用。在这一组中,来自50名患者的样本用于全外显子组测序(WES)和转录组分析(RNA-seq)。采用WES对47例治疗前和44例治疗后的肿瘤样本及匹配的种系DNA样本进行分析。采用RNA-seq对治疗前和治疗后的50例肿瘤样本进行分析(图1B)。NAC后,根据Miller-Payne (MP)组织学分级系统评估原发乳腺肿瘤床部位残留肿瘤细胞的丰度。他们将肿瘤分为三组:浸润性癌细胞明显减少90%,只有较小聚类或广泛分散的单个癌细胞,或原始肿瘤床部位没有浸润性癌细胞(MP评分:4或5)时定义为应答;中等反应是指癌细胞减少30%至90% (MP评分:3);无反应的是那些肿瘤细胞减少0到30%的患者(MP评分:1或2)(图1C-D)。收集患者的临床病理特征,包括初诊年龄、肿瘤组织学类型、肿瘤大小、淋巴结状况、组织学分级、新辅助治疗,以及雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2 (HER2)和Ki-67水平。采用免疫组化(IHC)方法评估ER和PR状态,阳性定义为≥1%的肿瘤细胞免疫染色阳性。采用免疫组化和原位杂交(ISH)分析评估HER2状态。HER2阳性的判定标准为IHC评分为3 +(超过10%的肿瘤细胞具有强烈、完整和均匀的HER2膜染色)或ISH阳性。
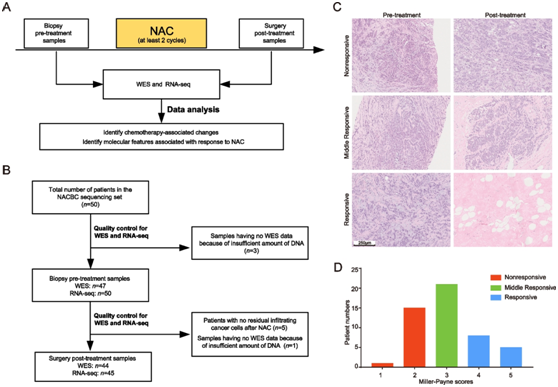
图1. 本项研究概述。
(A) 新辅助化疗 (NAC) 背景下的样本采集示意图,随后进行全外显子组测序 (WES)、RNA 测序 (RNA-seq) 和数据分析。(B) NACBC 测序集中用于分析的最终样本数量。 (C) 通过苏木精-伊红染色获得的有反应、中等反应和无反应患者的代表性肿瘤病理图像。 (D) 不同 Miller-Payne 评分患者在有反应组、中等反应组和无反应组中的分布。
02
配对治疗前和治疗后肿瘤之间体细胞突变和拷贝数变异的变化
44 个配对的治疗前和治疗后肿瘤之间的肿瘤纯度没有统计学差异(图 2A)。他们进一步分析了肿瘤之间响应 NAC 的体细胞突变和拷贝数变异 (CNV) 景观变化。在治疗前的肿瘤中鉴定出 15499 个体细胞 SNV和 598 个体细胞小插入缺失(中位数:4),在治疗后的肿瘤中鉴定出 27458 个核苷酸取代(中位数:134)和 770 个小插入缺失(中位数:5)肿瘤。单核苷酸变异体(SNV)分析表明,在所有肿瘤中,C > T 取代比任何其他 SNV 发生的频率更高,并且 NAC 后颠换突变 (C > A) 的比例降低。
总共,在 44 个配对的治疗前和治疗后肿瘤中分别鉴定出 4433 个和 6767 个非同义突变。队列中的突变负荷没有统计学上显著的变化(图2B),NAC 前后样本中最常改变的基因是TP53、TTN和MUC16(图2C)。然而,与治疗前的肿瘤相比,仅在化疗压力下的治疗后肿瘤中观察到CNR2、KIAA1549和CCDC168基因突变。接下来,他们对标志基因集的分子特征数据库 (MSigDB) 进行了基因集富集分析,并发现三个途径受到突变的显著影响。治疗后肿瘤中DNA修复和蛋白质分泌途径的突变率显著降低。在 44 个配对的治疗前和治疗后肿瘤中,29 个治疗前和 16 个治疗后肿瘤含有 DNA 修复途径中的基因突变(图 2D),而治疗前有 14 个肿瘤,治疗后有 4 个肿瘤存在DNA 修复通路基因突变(图 2D)。
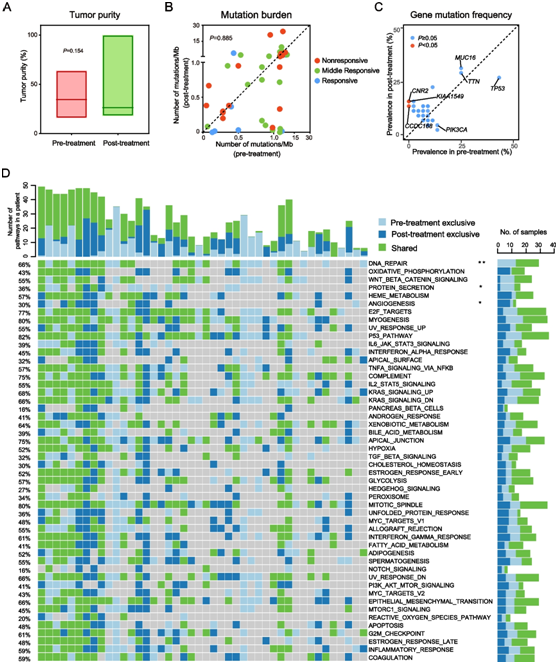
图2. 配对治疗前和治疗后肿瘤样本之间基因突变、突变负荷和 MSigDB 通路的变化。44 个配对治疗前和治疗后肿瘤之间的肿瘤纯度
(A) 和突变负荷 (B) 的比较。(C) NAC前后突变最频繁的基因。(D) 治疗前和治疗后肿瘤中与 MSigDB 通路相关的突变。
03
NAC后基因表达和细胞组成的变化
配对治疗前和治疗后肿瘤之间的差异基因表达分析确定了 1130 个差异表达基因 (DEG),其中包括 705 个上调基因和 425 个下调基因(图3A)。与治疗前的肿瘤相比,基因富集分析显示,与细胞周期进展和 DNA 修复相关的基因集显著下调,而与缺氧/HIF1A 靶点反应相关的基因集和 KRAS 信号传导在治疗后肿瘤中上调(图3B)。
他们使用xCell算法进一步分析了每个肿瘤的细胞组成,并基于Wilcoxon符号秩检验比较了治疗前和治疗后肿瘤之间的变化。结果表明,NAC后,B细、活化树突状细胞(aDC)和γδT细胞(γδT细胞)的分数减少(图 3C),而 治疗后肿瘤中 M2 巨噬细胞和内皮细胞的分数有所增加(图3D)。在治疗后的肿瘤中,大部分与抗原加工和递呈相关的基因(70%)和γδT细胞活化的正调控基因显著下调,而与血管生成途径相关的基因上调(图3E-G)。
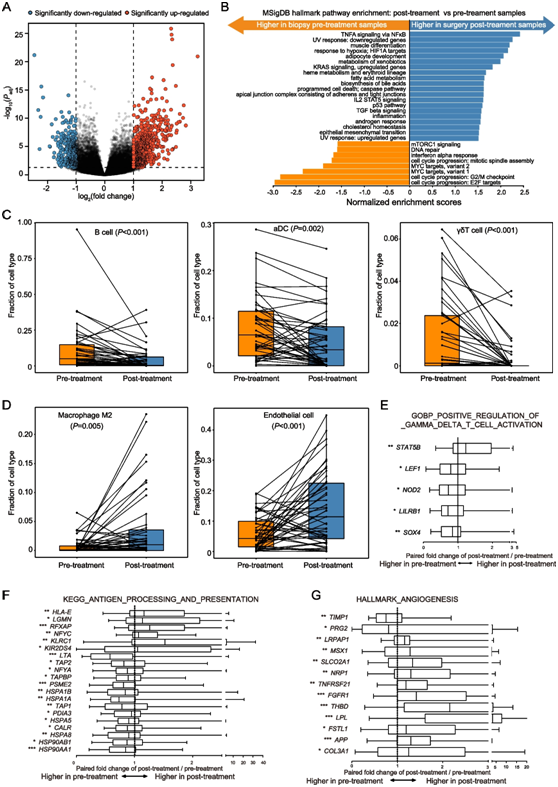
图3. NAC 后基因表达、肿瘤浸润免疫和基质细胞组成的变化。
(A) 火山图显示匹配的治疗前和治疗后肿瘤之间的差异表达基因 (DEG)。(B) NAC 之后显著下调和上调的通路。(C-D) 治疗前和治疗后肿瘤中 B 细胞、M2 巨噬细胞、活化树突状细胞 (aDC)、内皮细胞和 γδT (γδT) 细胞的分数。 (E-G) DEG的表达与治疗前后肿瘤之间γδT 细胞活化、抗原加工和呈递以及血管生成的正向调节显著相关。
04
体细胞突变分析发现CDKAL1 P409L突变降低 BC 中的 NAC 敏感性
为了筛选与 NAC 敏感性相关的分子特征,他们通过分析 WES 数据比较了治疗前肿瘤的无反应组和反应组之间的基因组差异,他们观察到两组之间的突变负荷没有统计学上的显著差异(图 4A)。在六种可能的碱基对替换中,响应组中 C > T 替换的比例 (39.35%) 低于无响应组,特别是当替换位点为两侧为 C 和 G(图4B)。COSMIC标记的突变特征权重分析表明,无应答组与应答组相比,与同源重组DNA双链断裂修复失败相关的标记3的权重较低;然而,差异无统计学意义(图4C)。通过分析RNA-seq数据,他们进一步比较了无应答组和应答组之间DNA修复途径相关基因的表达差异。在无反应组中,大多数DNA修复相关基因的表达显著上调(图4D)。

图4. 治疗前肿瘤中的突变特征。无反应组和反应组之间肿瘤突变负荷
(A) 和核苷酸取代 (B)的比较。(C) 47 个治疗前样本中不同 NAC 反应组中 10 个主要 COSMIC 特征的分布(左)。无响应组和响应组之间特征 3 的相对权重比较(右)。(D)与治疗前有反应和无反应的肿瘤之间的 DNA 修复途径显著相关的 22 个基因的热图比较。
由于种系突变可能影响病理反应,他们分析了28种癌症易感基因的致病性种系变异的存在。他们在NACBC序列集中检测到其中三个突变(图5A):无反应组中有一个BRCA1变异,反应组中有一个BRCA2变异,中反应组中有一个BRCA1变异和一个PALB2变异。
接下来,他们使用MuSiC2分析WES数据,并在47例治疗前肿瘤中鉴定出43个显著突变基因(SMG)(图5A)。为了确定与BC化疗敏感性相关的突变基因,他们比较了无反应组和反应组的差异突变基因。CDKAL1、ALPK2、EMILIN3、CENPT、OR51M1、THAP8、TTLL2和ZFPM1基因的突变主要在无应答组检测到,而在应答组中未检测到。这些突变发生在至少2个无反应的肿瘤样本中。他们进一步进行了SIFT 4G和provan分析,以预测这些基因突变变异是否会影响蛋白质功能。他们将CDKAL1错义变体P409L (p.Pro409Leu, c.1226 C >T)和CENPT错义变体R122G (p.Arg122Gly, c.364A >G)和P442L (p.Pro442Leu, c.1325 C>T)预测为具有“有害的”功能影响。这些潜在的有害突变也在至少2个无反应的肿瘤样本中存在(图5B)。他们随后进行了体外研究,以验证有害的CDKAL1和CENPT突变对BC细胞对化疗的反应性的影响。他们使用Cancer cell Line Encyclopedia (CCLE)在线数据库检测了不同BC细胞系中CDKAL1和CENPT的突变。
除了MDA-MB-453和BT-474细胞分别有无义和错义的CENPT突变外,所有的细胞系都没有非同义突变。Western blot结果显示CDKAL1和CENPT蛋白在所有细胞系中均有表达(图5C)。CDKAL1选择HCC1806和MDA-MB-231细胞,CENPT选择MDA-MB-231和BT-549细胞进行基因过表达研究。Western blot和real-time PCR证实了基因在感染BC细胞中的表达效率(图5D)。
用CCK-8测定感染的BC细胞对化疗药物的敏感性。结果表明,过表达p.Pro409Leu CDKAL1变异体(CDKAL1P409L)的HCC1806细胞比过表达野生型CDKAL1 (CDKAL1WT)的细胞对多西紫杉醇的敏感性降低,多西紫杉醇对CDKAL1P409L和CDKAL1WT细胞的IC50分别为3.50±0.45 nM和1.69±0.11 nM(图5E)。在MDA-MB-231细胞中观察到类似的结果,尽管与HCC1806细胞相比,内源性CDKAL1WT的表达更高(图5E)。

图5. CDKAL1 P409L突变降低了癌细胞对多西他赛治疗的敏感性。
(A) 47 个治疗前肿瘤中的体细胞和种系突变以及匹配的种系 DNA。(B) 无反应和有反应预治疗组中CDKAL1和CENPT潜在有害突变的分布(左)。代表潜在有害突变的蛋白质结构域的图表(右)。(C-D) 免疫印迹和qPCR分析。(E)细胞活力分析。
05
SCNA分析表明,ADRB3或ADGRA2扩增可导致更差的NAC反应和BC预后
他们使用GISTIC2.0对配对的肿瘤和正常样本进行了SCNA分析,以确定无应答和应答的预处理样本基因组之间的拷贝数扩增或缺失峰。在无应答组中发现了一个独特的扩增峰,位于8p11.23,其中包含ADGRA2和ADRB3基因。此外,在应答性肿瘤中观察到一个独特的3p13缺失峰,其中包含癌症相关基因FOXP1(图6A)。接下来,他们通过分析治疗前肿瘤的RNA-seq数据,研究基因拷贝数的变化是否影响ADGRA2、ADRB3和FOXP1的mRNA表达。结果显示,反应组ADGRA2、ADRB3和FOXP1 mRNA水平显著下调(图6B-D)。
先前的一项研究表明,细胞质FOXP1在BC中的表达与较差的预后相关。这与他们观察到的含有3p13区域的FOXP1在nac敏感的肿瘤中缺失是一致的。为了验证ADGRA2和ADRB3表达在化疗反应和预后中的作用,他们使用了NACBC验证集,其中包括156例接受NAC治疗的BC患者的治疗前肿瘤样本,并分析了随访信息。通过免疫组化检测TMAs上ADGRA2和ADRB3蛋白的表达。根据ADGRA2或ADRB3的染色评分分为低表达组和高表达组(图6E)。接下来,他们在内部NACBC验证集、外部GEO和TCGA验证集中确定ADGRA2和ADRB3的表达是否与生存率相关。在本项研究的NACBC验证集中,Kaplan–Meier生存曲线分析显示,较高(与较低)的ADGRA2蛋白水平与DFS和BCSS的概率显著降低有关,而高水平的ADRB3表达与较差的DFS有关(图6F)。
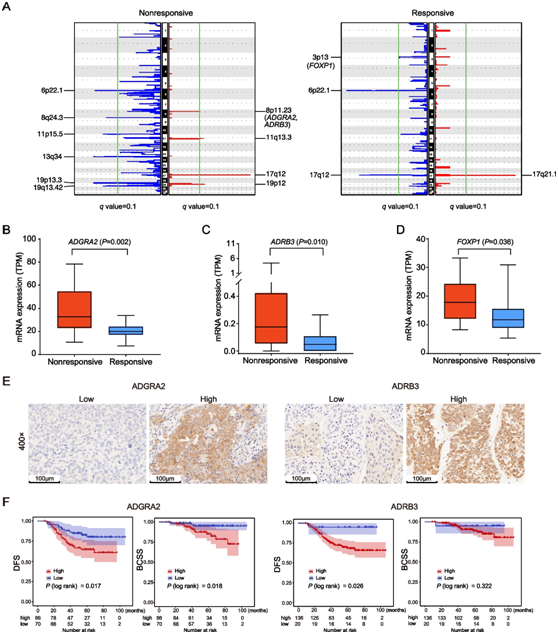
图6. ADGRA2 或 ADRB3 高表达与 BC 患者较差的 NAC 反应和预后相关。
(A) GISTIC2.0 在治疗前无反应和有反应的肿瘤中识别出的 SCNA 信号图谱。RNA-seq 数据中无反应和有反应的治疗前肿瘤中ADGRA2 (B)、ADRB3 (C) 和FOXP1 (D)的 mRNA 表达水平以每百万转录本 (TPM) 表示。(E) NACBC 验证集中 ADGRA2 和 ADRB3 低表达和高表达的肿瘤的代表性免疫组织化学染色。 (F) Kaplan-Meier 对 NACBC 验证集中的 DFS 和 BCSS 进行分析。
+ + + + + + + + + + +
结 论
本项研究证明了在治疗前和治疗后的肿瘤中,最常改变的基因是TP53、TTN和MUC16。与治疗前的肿瘤相比,治疗后的肿瘤中C>A颠换突变显著减少。 NAC显著降低了DNA修复途径的突变率和该途径的基因表达水平。NAC还显著改变了免疫检查点基因的表达水平以及肿瘤浸润免疫和基质细胞的丰度,包括B细胞、活化的树突状细胞、γδT细胞、M2巨噬细胞和内皮细胞。此外,NAC 无反应性肿瘤中的 C > T 取代率高于有反应性肿瘤,特别是当取代位点两侧是 C 和 G 时。重要的是,在 8p11.23 处有一个独特的扩增区域(包含ADGRA2和ADRB3)以及NAC无反应性和反应性肿瘤中3p13处的缺失区域(包含FOXP1)。CDKAL1错义变体P409L(p.Pro409Leu,c.1226C>T)降低了BC细胞对多西他赛的敏感性,ADGRA2或ADRB3基因扩增与BC患者较差的NAC反应和不良预后相关。
+ + + + +



 English
English


