文献解读|Cell Death Dis(9.0):人类多原发性肺癌细胞组成和空间结构的多向表征
✦ +
+
论文ID
原名:Multidirectional characterization of cellular composition and spatial architecture in human multiple primary lung cancers
译名:人类多原发性肺癌细胞组成和空间结构的多向表征
期刊:Cell Death & Disease
影响因子:9.0
发表时间:2023.07.25
DOI号:10.1038/s41419-023-05992-w
背 景
肺癌是全球癌症发病和死亡的主要原因之一,多原发性肺癌 (MPLC) 是指肺部多个原发肿瘤同时生长。高达 15% 的肺癌患者存在第二原发性肺部病变, 然而,临床上区分MPLC和肺内转移 (IPM) 仍然很困难,特别是在组织学相似的情况下。全世界都在努力探索新的、准确的方法来识别多个单独的肺肿瘤病灶之间的复杂关系。
实验设计

结 果
01
单细胞转录组学驱动的 MPLC 细胞组成
为了在单细胞水平上研究细胞异质性和 MPLC 的构建模块,研究者团队综合分析了多个数据,包括 MPLC 样本的单细胞转录组分析 (scRNA-seq) 和空间转录组(ST) 数据、独立肺癌队列的 scRNA-seq 和bulk RNA-seq 数据集,以及有关 MPLC 的免疫组织化学 (IHC) 数据、侵袭性 MPLC 肺腺癌 (LUAD)和 IPM 样本(图1a)。
他们收集了四名MPLC患者(一名鳞癌和三名腺癌)的19份组织样本,每名患者都有两个独立的肺部肿瘤病灶。对于前两名患者(P1 和 P2),他们从每个肿瘤病灶收集了一份组织样本。对于第三名患者(P3),为了了解病灶内的异质性,从每个肿瘤病灶收集了两个重复的组织样本。对于最后一名患者(P4),他们收集了来自一个较大肿瘤病灶的两个组织样本和来自另一个小肿瘤病灶的一个组织样本。对所有收集的 19 个样本进行了 scRNA-seq,获得了33923个细胞的转录组图谱,每个样本中大约有5000-9000个细胞(图1b)。
聚类分析鉴定出了七种主要细胞类型,包括上皮细胞、内皮细胞、成纤维细胞、骨髓细胞、肥大细胞、B 细胞和 T&NK 细胞(图1c)。这些样本在细胞类型组成方面表现出显著差异(图1d),并且来自同一患者的不同肿瘤样本之间的差异显著高于正常样本之间的差异(图1e)。P4样本中T&NK细胞较少,可能是因为两个病灶均为原位腺癌 (AIS),免疫浸润较少。
他们整合了来自另一个肺癌队列 (GSE131907) 的独立 LUAD 和正常肺组织的 scRNA-seq 数据,他们观察到,来自同一肿瘤病灶的组织或同一患者的两个正常组织可以聚集在一起(例如TS1_L_P4和TS2_L_P4、NI_L_P4和NS_L_P4),但同一患者的不同肿瘤病灶是分开的(例如TI_R_P1和TM_R_P1)(图1f)。
同一MPLC患者 (T-Within) 内病灶之间的细胞组成相似性显著低于匹配的正常样本(N-Within)之间的细胞组成相似性,但与完全独立的肿瘤组织(T-independent)之间的细胞组成相似性没有观察到显著差异(图1g)。此外,不同病变的肿瘤组织在基因表达谱上的相似性也低于正常组织(图1h)。总之,MPLC 在细胞组成和基因表达方面表现出高度的病变间异质性。
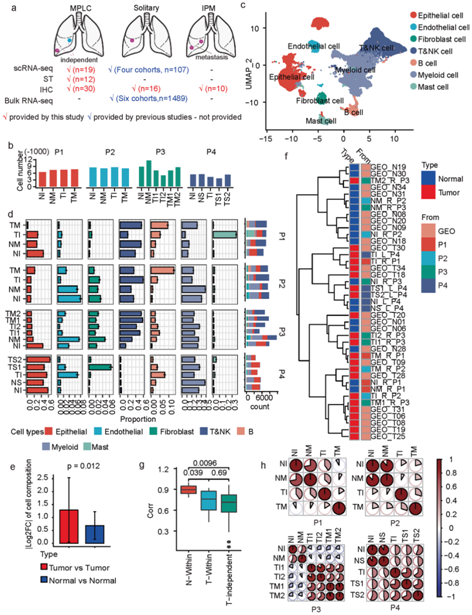
图1. 基于 scRNA-seq 的 MPLC 肿瘤异质性概述。
(a) 综合数据。(b) 每个样品中的细胞数。 (c) 基于 scRNA-seq 数据的均匀流形近似和投影 (UMAP)。(d)每个测量样本中不同细胞类型的比例。(e) 同一 MPLC 患者内不同肿瘤病灶(红色)或肿瘤邻近组织(蓝色)的样本之间细胞类型比例的变化。(f) 基于细胞类型组成之间的Spearman相关性,将本研究收集的样本与另一项独立研究(GEO数据集ID: GSE131907,肿瘤和正常样本n = 11)的其他LUAD肿瘤和邻近正常组织样本进行聚类。 (g) 不同类型样本之间相关性的箱线图。(h) 同一 MPLC 患者内不同样本之间的相似性。
02
CLDN2 + AT2是一种特异性的MPLC细胞类型
他们首先从 scRNA-seq 数据(以 T&NK 细胞作为参考)推断染色体拷贝数变异 (CNV),并鉴定恶性和非恶性上皮细胞。肿瘤组织中鉴定出的大多数上皮细胞都是恶性的(图2a),不同的肿瘤组织具有不同的细胞CNV模式。例如,仅在 P1 的下叶病变 (TI) 的肿瘤组织中观察到染色体 (Chr) 3 的拷贝数增加,而在中叶病变 (TM) 中未观察到。每个患者总是有一个特定于一个肿瘤病变的CNV相关聚类(图2a),MPLC患者不同的肿瘤病变可能源于不同的染色体变异。
接下来,他们鉴定了上皮细胞的亚群(图2b),除了常见的上皮细胞亚群,包括肺泡I型(AT1)和II型(AT2)、club 细胞、基底细胞和表达典型上皮标志物的纤毛细胞之外,他们还定义了一个之前未报告的亚群,并将该亚群注释为CLDN2+ AT2细胞,该细胞具有高水平的CLDN2、CXCL14、CEACAM5、CEACAM6和MDK,以及AT2细胞标志物(例如MUC1和SFTPD)(图2b-c)。收集的样本显示上皮细胞亚群组成的高度异质性(图2d),AT2 和CLDN2 + AT2 类型在这些亚群中占主导地位(图2d)。基底细胞是人肺鳞癌(LUSC)的候选起源细胞。值得注意的是,特别是在 P1(MPLC-LUSC 患者)中,肿瘤组织的基底细胞比例远高于正常组织。
Claudin-2 (Cldn-2) 是一种紧密连接蛋白,介导细胞水或离子运输。CLDN2+ AT2细胞在肿瘤组织中的比例显著高于正常组织(图2e),尤其是在3例MPLC-LUAD患者中(图2d)。
为了探讨CLDN2 + AT2 细胞类型是否具有特异性,他们对 GSE131907 和四名 MPLC 患者的上皮细胞进行了综合分析,将它们重新分类为多个聚类,并根据前15的标记基因计算了CLDN2 + AT2 特征(图2f)。聚类5显示出最高的CLDN2 + AT2特征得分,并且它主要由MPLC上皮细胞组成(图2g)。同时,在聚类5中,MPLC上皮细胞在CLDN2中的表达也显著高于GSE131907(图2h)。此外,CLDN2在P2和P3的肿瘤组织中过表达,并且特异性定位于AT2细胞的细胞膜上(图2i)。他们在更大的样本集中检测并比较了 CLDN2 蛋白表达,其中包括 30 名 MPLC、10 名 IPM 和 16 名的 LUAD 患者。结果显示,MPLC 肿瘤组织中的 CLDN2 IHC 评分显著高于 IPM 和 LUAD 肿瘤组织。同时,MPLC中肿瘤组织中CLDN2的表达显著高于正常组织(图2j)。

图2. MPLC 中上皮细胞的亚分类和表征。
(a) 根据每位患者肿瘤病变的 scRNA-seq 估计的 CNV 概况热图。(b) UMAP 图按上皮细胞亚群着色。(c)上皮细胞亚群标记基因表达的点图。(d)每个测量样本中上皮细胞亚群的 bootstrap 比例的条形图。(e) 四位 MPLC 患者的肿瘤病变(红色)或邻近正常组织(蓝色)中的上皮细胞亚群比例。(f) 来自 MPLC 患者和数据集 GSE131907 的上皮细胞的聚类结果(左)和CLDN2+ AT2 特征(右)的 UMAP 视图。(g) (f)中聚类5单元格的饼图。(h) MPLC 患者细胞和 GSE131907 细胞之间CLDN2差异表达的箱线图。(i) MPLC 样本上 CLDN2 表达的免疫组织化学 (IHC)。(j) MPLC、IPM 和孤立 LUAD 中差异 CLDN2 IHC 评分的箱线图。
03
CLDN2 + AT2 细胞具有静止状态
为了进一步表征上皮亚型,他们对上皮细胞进行了伪时间分析。细胞沿预测的伪时间轨迹排列,他们以此来识别不同的细胞状态(图3a-b)。总体而言,AT2和CLDN2+ AT2细胞的富集状态相似,但不同于club细胞、纤毛细胞、基底细胞和AT1细胞(图3c)。比较肿瘤组织中的AT2和CLDN2+ AT2细胞,他们发现CLDN2+ AT2细胞的伪时间明显晚于AT2细胞(图3d)。同时,这些亚型标记基因的表达也随着伪时间的变化而变化,其中CLDN2+ AT2标记基因CLDN2、MDK、CEACAM5、CEACAM6和CXCL14的表达在伪时间内显著增加(图3e)。
接下来,根据过表达的亚型标记基因的通路富集分析,人民发现不同的亚型主要与不同的通路相关(图3f)。CLDN2+ AT2细胞的标记基因在细胞衰老过程中表现出特异性富集(图3f),表明CLDN2+ AT2细胞是一种衰老的上皮细胞,这与CLDN22+后期的伪时间结果一致。ITPR2、MDM2、KRAS和CDK4在CLDN2+ AT2细胞中的表达也最高(图3g),在肿瘤来源的CLDN2+ AT2细胞中的表达也高于正常细胞(图3h)。细胞衰老是指不可逆的细胞周期停滞状态,表明CLDN2+ AT2细胞处于静止状态,不能无限分裂,因此可以阻止MPLC中癌细胞的转移。
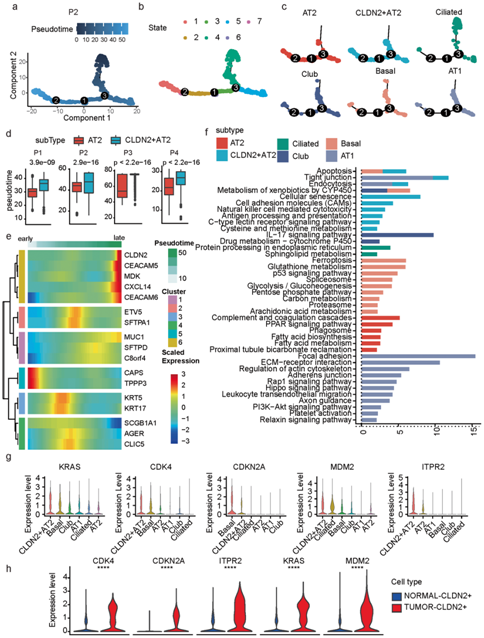
图3. CLDN2+AT2 细胞具有静止状态。
(a-b) 患者 P2 中恶性上皮细胞的伪时间轨迹由伪时间分析。(c) 患者 P2 中按上皮细胞亚型划分的伪时间轨迹。(d) AT2 和CLDN2+ AT2 细胞之间伪时间差异的箱线图。(e) 上皮亚型标记基因的伪时间依赖性表达变化的热图。(f) 基于每种上皮亚型的标记基因的通路富集结果。(g) 表达式的小提琴图不同上皮细胞亚型中CLDN2相关的细胞衰老标记基因。(h) 来自肿瘤和正常组织的CLDN2+ AT2 细胞之间CLDN2相关细胞衰老标记基因的差异表达的小提琴图。
04
CLDN2+ AT2 细胞在细胞间通讯中发挥关键作用
接下来,他们使用CellChat来分析细胞间相互作用。成纤维细胞作为信号发送者(发送者:配体过度表达,接收者:受体过度表达)具有最多数量的配体-受体相互作用,而CLDN2+ AT2细胞作为信号接收者拥有最多数量的相互作用(图4a)。考虑到细胞通讯网络拓扑,成纤维细胞和骨髓细胞分别具有最大的输出和输入度,并且CLDN2+AT2细胞显示出仅次于骨髓细胞和AT1细胞,具有第三高的输入度,并且显示出比AT2细胞更高的输入度和输出度(图4b)。
作为信号发送者,CLDN2+ AT2 细胞主要通过过表达的配体(如 MDK 和 APP)与其他细胞类型相互作用(图4c)。作为信号接收器,CLDN2+ AT2细胞主要接收来自成纤维细胞的信号(图4a),其中过表达的配体主要是胶原蛋白(图4d)。
基于scRNA-seq图谱对成纤维细胞进行进一步聚类,确定了八种亚型(图4e),其中一种亚型在多种胶原蛋白中表现出过度表达,例如COL6A3、COL6A2和COL1A2。由于成纤维细胞与CLDN2+ AT2细胞的相互作用主要是由过度表达的胶原介导的,因此COL6A3+成纤维细胞可能是CLDN2+ AT2细胞的主要信号源。此外,与CLDN2+ AT2细胞一样,这种COL6A3 + 成纤维细胞亚型也比正常组织更显著地在肿瘤组织中富集(图4f)。
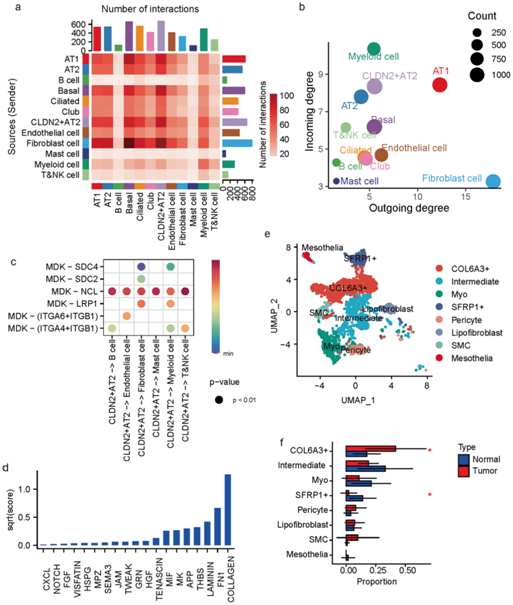
图4. MPLC 中的细胞间相互作用。
(a) 不同细胞类型之间细胞间相互作用的热图。(b) 不同细胞类型相互作用强度的散点图。(c) 源自CLDN2+ AT2 细胞并由 MDK 介导的相互作用的气泡图。(d) 基于成纤维细胞与CLDN2+ AT2 细胞相互作用的信号通路上总结的通信概率的条形图。(e) 成纤维细胞亚群的 UMAP 图。
05
通过 ST 与 scRNA-seq 的集综合数据阐明 MPLC 的空间结构
为了进一步了解不同细胞类型的空间组织和 MPLC 的相关异质性特征,他们对 12 个样本应用了 ST,其中包括来自前 3 名 MPLC 患者的两个肿瘤病灶中每一个的配对肿瘤和肿瘤邻近正常组织 (P1-P3)(图1a)。结果表明,空间斑点标注来7种主要的细胞类型(图5a-b)。上皮细胞或B细胞在肿瘤组织中比在正常组织中更倾向于空间聚集在一起(图5b)。上皮细胞和B细胞主导的斑点在肿瘤组织中的一致性评分明显高于正常组织,内皮细胞主导的斑点呈现相反的变化(图5c),提示这些细胞类型在良恶性转化过程中进行空间重组。对比同一患者两种不同病变时,3例患者B细胞、成纤维细胞和T&NK细胞的一致性评分也有显著差异(P1-P3),其他细胞类型也显示出患者特异性的变化,表明细胞类型在细胞质层析细胞中病变间的空间异质性分布(图5d)。
他们还注释了主要的上皮亚型(图5e),肺泡细胞包括AT1、AT2和CLDN2+AT2细胞的一致性评分明显低于基底细胞、纤毛细胞和club细胞(图5f),表明基底纤毛细胞和club细胞比肺泡细胞更具空间聚集性。同时,所有这些亚型在MPLC患者的肿瘤组织和正常组织之间的一致性评分均表现出显著变化。肺泡细胞在肿瘤组织中表现出明显更高水平的空间聚集,而其他三种亚型则表现出相反的改变(图5g),这些差异再次表明细胞空间结构在良性-恶性转化过程中发生了显著的变化。
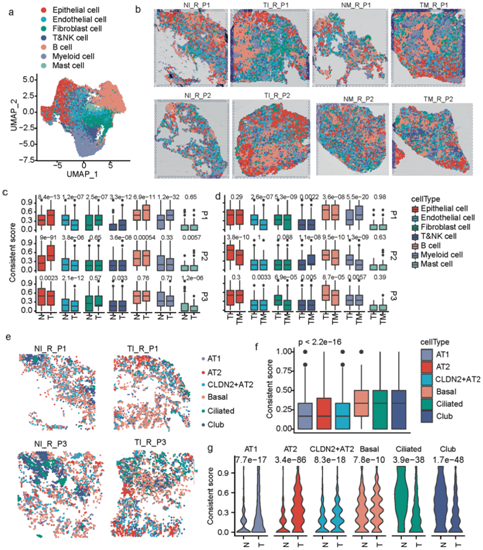
图5. MPLC 中不同细胞类型的空间特征。
(a) 由细胞类型着色的 37616 个空间点组成的 UMAP 图。(b) 来自患者 P1 和 P2 的样本的空间 RNA-seq 条形码斑点,由预测的细胞类型标记。(c) 同一患者的肿瘤和正常组织中不同优势细胞类型的一致斑点得分差异的箱线图。(d) 同一患者不同肿瘤病灶的斑点一致得分在不同优势细胞类型方面差异的箱线图。(e)由预测的主要上皮细胞亚型着色的空间点。(f)不同上皮细胞亚型主导的空间点一致得分差异的箱线图。(g) 根据不同的优势上皮细胞亚型,肿瘤和正常组织的一致斑点分数差异的小提琴图。
06
LUAD 组织病理学模式的空间和细胞特征
根据WHO的最新分类,将MPLC-LUAD患者的恶性区域(P2和P3)进一步分为鳞状(PR1)、腺泡(PR2)、微乳头状(PR3)、微创(MIA和PRm)和原位腺癌(AIS和PRa)(图6a)。将这些区域映射到空间分辨的细胞类型上显示,这些区域主要由上皮细胞组成,也有免疫细胞和间充质细胞,并且细胞类型比例随病理亚型和肿瘤组织而变化(图6b)。值得注意的是,CLDN2+ AT2 细胞在组织病理学模式中显示出比多个亚型更高的比例(图6c),但 AT2 细胞显示出显著高于纤毛细胞的比例,这意味着CLDN2+AT2细胞代表恶性上皮亚型。
PDZK1IP1(也称为MAP17)是一种ROS依赖性癌基因,其表达水平可以预测LUAD患者对铂类治疗、EGFR抑制剂和蛋白酶体抑制剂的敏感性。本研究将它确定为 MPLC-LUAD 中鳞状模式的一种潜在标志物,因为它在所有三个样品中在 PR1 中的表达高于 PR2 和 PR3(图6d)。PDZK1IP1的高表达与LUAD更好的预后相关(图6e)。基于TCGA-LUAD的bulk RNA-seq数据,共享的PR3标记基因不仅在PR3区域中的表达量高于PR1和PR2区域(图6f),而且大多数在肿瘤组织中的表达量也显著高于正常组织。RANBP1、MDH2、LSM5这3种基因的高表达与LUAD患者预后不良相关(图6h-h)。
此外,他们还检测了组织病理模式的周围环境,即根据空间斑点选择的组织病理区域周围最近的三个圆圈(图6i)。周围环境的细胞组成与组织病理区域明显不同,上皮细胞较少,内皮细胞、成纤维细胞、髓样细胞、B细胞和T&NK细胞较多(图6j)。
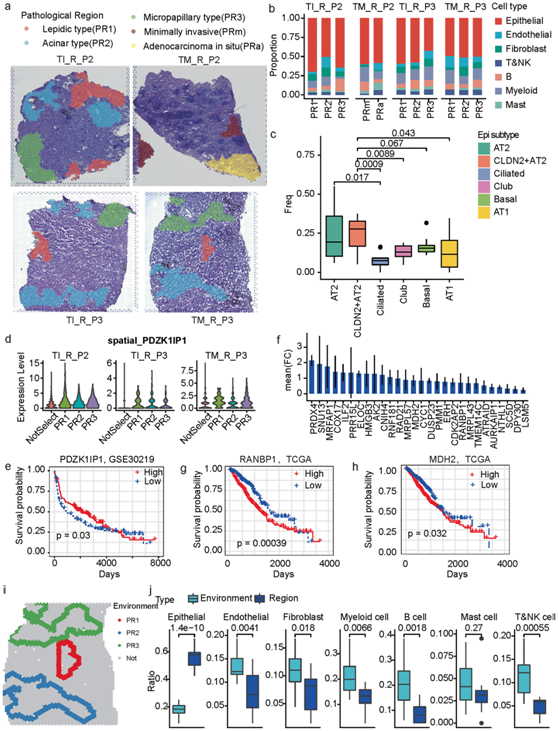
图6. MPLC-LUAD 中不同组织学模式的细胞和分子谱。(a) 恶性区域的病理学分类为组织学模式,包括鳞屑型(PR1)、腺泡型(PR2)、微乳头型(PR3)、微创型(PRm)和原位腺癌(PRa)。 (b) 四个研究样本病理区域的主要细胞类型组成。(c) 所有研究样本的病理区域中不同上皮细胞亚群比例的箱线图。(d) PR1 区域中PDZK1IP1空间分辨高表达的小提琴图。(e) GSE30219中患者的生存曲线的KM图。(f) 三个观察样本共有的 PR3 标记基因的平均倍数变化的条形图。 (g-h) TCGA-LUAD 患者生存曲线的 KM 图。 (i) 恶性区域的空间邻居(最近的三个点圆)。(j) 恶性区域和相应空间邻居之间细胞组成差异的箱线图。
07
MPLC患者不同病变的分子共性及差异性研究
他们首先将 TI 细胞的基因表达谱与其相邻正常样本 (TIVSNI) 进行比较,计算平均 log2FC (avg_logFC) 和 p 值,并对同一患者的其他病变 (TOthersVSNOthers) 进行计算。每个基因分配两组差异表达分析结果,基于TIVSNI和TOthersVSNOthers计算的avg_logFCs分别用x和y轴表示(图7a)。落在第一和第三象限的散点主要代表两个病灶具有相似表达变化的基因,而其他象限的散点则表现出相反的变化。将基因进一步分为五种类型,包括Same(不同病灶基因表达变化趋势相同)、NotSig(不显著)、OP(不同病灶基因表达变化趋势相反)、TI(基因表达变化是 TI 特有的)和 TOthers(基因表达变化是 TOthers 特有的)。更多的基因鉴定为OP、TI或TOthers型,而不是Same型(图7b)。值得注意的是,在所有4例MPLC患者中,只有G蛋白信号1 (RGS1)和CD82两个基因归为同一类型,并且在肿瘤组织中表达高于正常组织(图7a)。同样,OP、TI和其他类型的病变也比相同类型的病变多(图7c),这再次表明同一MPLC患者的不同病变具有高度的分子异质性。各种基因明显改变,如CD79B CLDN2, SPP1和IGHG3标记基因,可能是由于肿瘤样本中细胞组成的高度异质性(图7d)。
他们还注意到两种病变的上皮细胞和 T&NK 细胞中WIF1和TNFRSF18的表达水平分别降低或升高。此外,ALOX15B、LCN2、PRSS12、CD79B和ITSN2显示所有四名患者的肿瘤病变特异性变化。基于TCGA-LUAD bulk RNA-seq数据,上述7个基因也显示出肿瘤和正常组织之间显著的表达变化(图7e)。
在MPLC样品的T&NK细胞中,TNFRSF18在Treg、Tfh和Th1样细胞中高表达(图7f)。同时,基于scRNA-seq数据(图7g)和空间转录组学(图7h),TNFRSF18在肿瘤组织的T&NK细胞中的组成性表达水平高于正常组织。因此,TNFRSF18可以成为不可切除的骨髓间质干细胞免疫治疗的一个有希望的靶点。
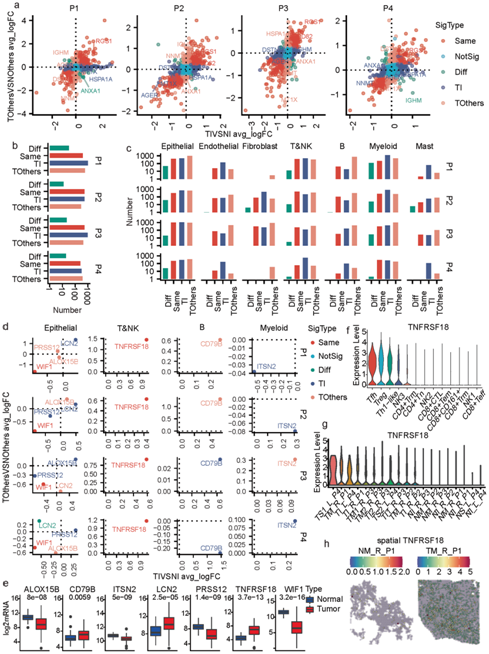
图7. 同一 MPLC 患者病变之间的分子和细胞共性和差异。
(a) 四位 MPLC 患者中两个不同肿瘤病变与相应邻近正常组织中基因表达差异的散点图。 (b) 根据每位患者确定的不同重要类型基因的数量。(c) 根据每种细胞类型和每位患者识别的不同重要类型基因的数量。(d) 七个基因在所有四名 MPLC 患者的某些细胞类型中显示出表达变化。(e) 基于 TCGA-LUAD 数据集的正常组织和肿瘤组织中七个基因表达的箱线图。(f) T&NK 细胞亚群中TNFRSF18表达的小提琴图。 (g) 所有样本中TNFRSF18表达的小提琴图。(h) P1 的两个样本中TNFRSF18表达的空间特征图。
+ + + + + + + + + + +
结 论
本项研究结合scRNA-seq和空间转录组学探究 MPLC 的细胞和空间结构,鉴定了一种先前未发现的上皮细胞亚群,称为CLDN2+ II 型肺泡 (AT2),它在 MPLC 中高度富集,该亚型具有相对静止状态,在细胞通讯中发挥关键作用,在肿瘤组织中空间聚集,并主导恶性组织病理学模式。CLDN2蛋白表达有助于区分MPLC与肺内转移癌和孤立性肺癌。此外,细胞表面受体-TNFRSF18/GITR在 MPLC 的 T 细胞中高表达,表明 TNFRSF18 是 MPLC 中的一种潜在免疫治疗靶点。同时,在 MPLC 中观察到病灶间高度异质性。这些发现将为诊断生物标志物和治疗靶点提供新的理论依据,并增进对 MPLC 的细胞和空间结构的理解。
+ + + + +



 English
English


