文献解读|Cell(64.5):婴儿微生物和代谢物导致儿童神经发育障碍
✦ +
+
论文ID
原名:Infant microbes and metabolites point to childhood neurodevelopmental disorders
译名:婴儿微生物和代谢物导致儿童神经发育障碍
期刊:Cell
影响因子:64.5
发表时间:2024.03.27
DOI号:10.1016/j.cell.2024.02.035
背 景
神经发育障碍 (ND) 对中枢神经系统的成熟产生深远而持久的影响,通常在儿童时期出现。它们包括自闭症谱系障碍 (ASD)、注意力缺陷/多动障碍 (ADHD)、智力障碍和沟通障碍等疾病。然而,微生物组破坏对 ND 病因学和病理生理学的确切作用仍不清楚。
实验设计
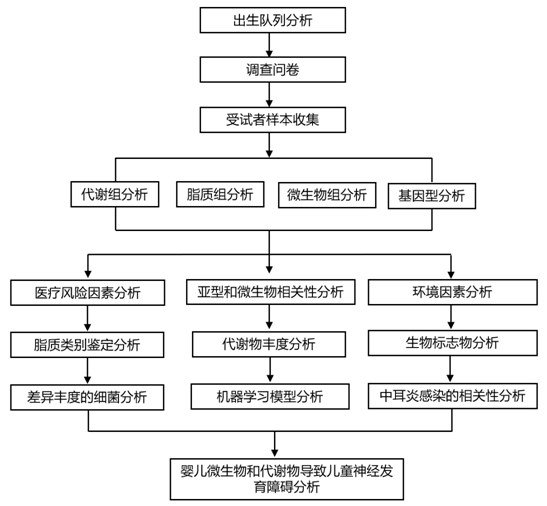
结 果
01
调查问卷揭示了生命早期的许多ND风险因素
ABIS调查问卷的数据是从参与儿童的父母在几个时期获得的,从怀孕开始,一直持续到整个童年。研究者团队在更广泛的ABIS材料中分析了出生直到5岁的数据(图1A-C),包括感染和抗生素事件、化学物质暴露、家族史、其他医疗问题和严重的生活事件。幼儿期(出生至5岁)的感染与ADHD或asd的高风险显著相关,最明显的是第一年的中耳炎和反复湿疹。在此期间经历三次或三次以上青霉素需用感染的患者未来容易出现ND,例如语言障碍或智力残疾。在此期间,未来患有ASD的儿童也更有可能使用非青霉素类抗生素,而未来患有智力残疾的儿童中有23.8%使用青霉素以外的其他抗生素。经常发生中耳炎的儿童,以后诊断为智力障碍、自闭症谱系障碍 (ASD) 或多动症 (ADHD) 的可能性分别增加 1 倍。母亲在怀孕期间吸烟会累积患 ND以及 ASD和 ADHD 的风险。同样,母亲在怀孕期间使用镇痛药会增加 ADHD和 ASD的风险。
父母有哮喘、乳糜泻 (CD) 或 1 型糖尿病 (T1D) 家族史的孩子患 ND 的风险增加。
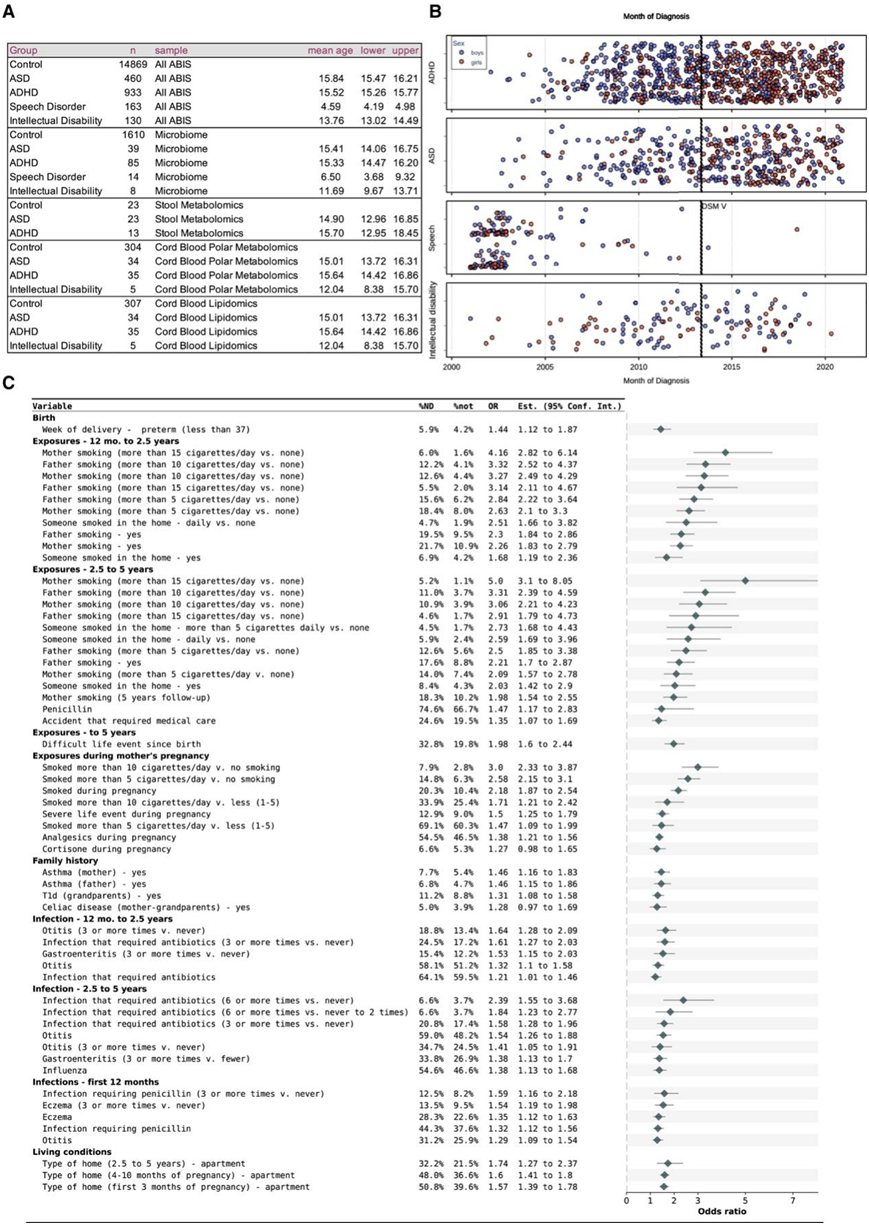
图1. 与神经发育障碍 (ND) 相关的早期环境和医疗风险因素。
(A) ABIS 队列中的 ND,具有平均诊断年龄和 95% 置信区间。(B) ABIS 中所有 ND 诊断的时间线,按病情和生物性别分层,红色和蓝色分别代表女性和男性。(C) 风险因素,包括出生时的生活方式、家庭、医疗和环境因素以及 1 年、3 年和 5 年问卷调查。
02
其他医疗问题
早期胃肠道问题和情绪问题在较小程度上在未来患有ND的儿童中很明显。通过主成分分析(PCA)将2.5岁和5岁时的症状分为“情绪和不安”、“儿童成长”和“胃肠道问题”成分,解释了2.5岁时57.7%和5年时58.3%的累积方差(图2A-B)。在2.5岁时,情绪和不安症状与未来的ND相关,这在未来的智力残疾中尤为明显(图2C)。在胃肠道问题群中,21.3%的未来智力残疾患者出现胃痛、胃胀气或便秘等症状。在5岁时,与对照组相比 “胃痛”在未来ND中更为普遍,并且在未来的ASD/ADHD合并症中尤为突出。易怒或暴躁的情绪在未来的ASD或ADHD中更常见,尽管比胃肠道症状更少。
从出生到5岁的严重生活事件(如分居/离婚、家庭成员死亡、严重疾病/事故或失业)使未来ND的可能性增加1.98倍,影响32.8%的儿童,而对照组为19.8%。怀孕期间的严重生活事件也与未来的多动症有关。值得注意的是,在母亲在怀孕期间吸烟的孩子中,85%的未来自闭症儿童在5岁时经历了这样的事件,而对照组只有40%。早产婴儿未来诊断ND的可能性增加1.4倍。此外,智力残疾组与早产有很大的联系,早产率为15.2%,而对照组为4.2%。在2.5岁有胃肠道问题的儿童中,变形菌群是正常儿童的2.0-2.2倍。Coprococcus和Slackia isoflavoniconvertens表现出保护趋势(图2D),与肠胃问题和情绪不安呈负相关。
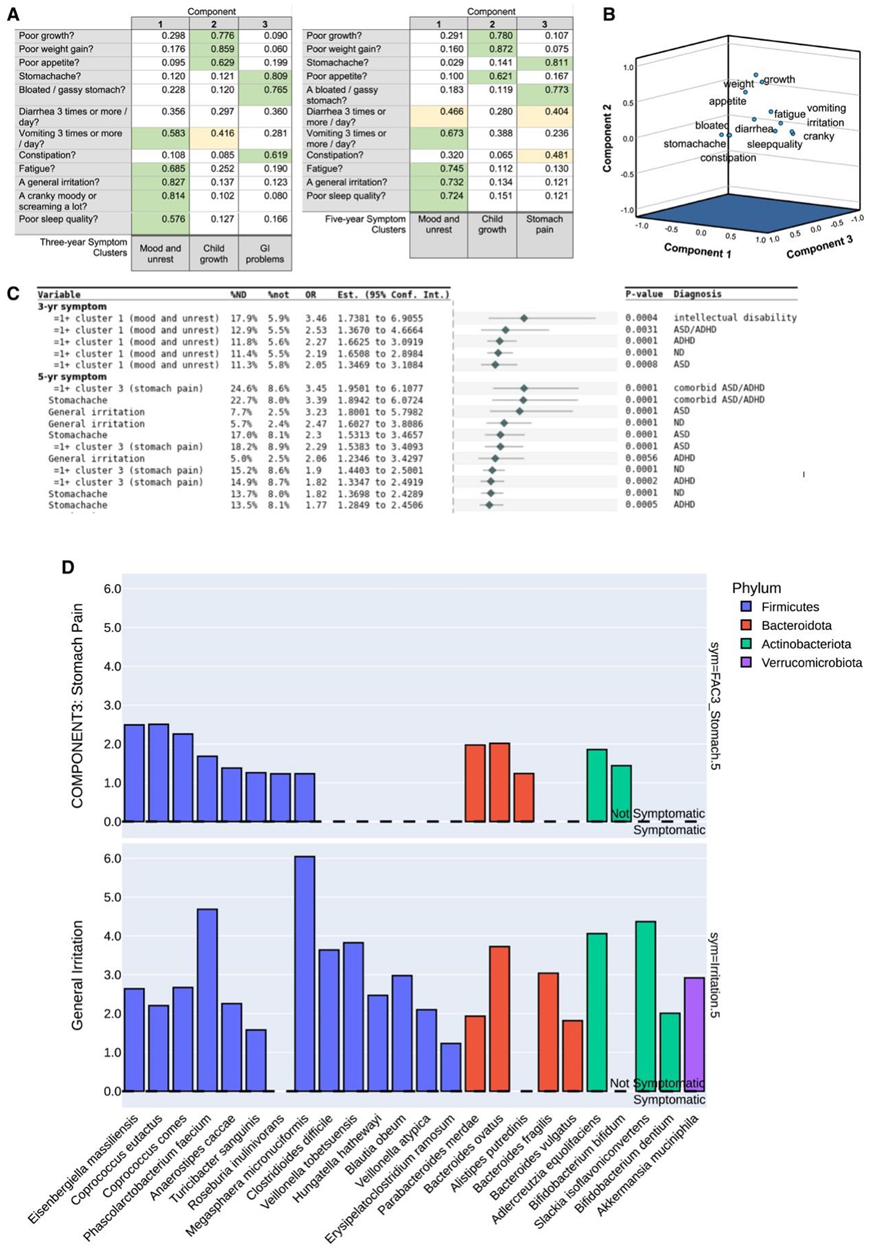
图2. 2.5 年和 5 年的症状群及其与第 1 年微生物物种丰度的关联。
(A) 2.5 年和 5 年症状的主要成分,以及与每个症状相对应的成分权重。(B) 3 年时的症状聚集。(C) 3 年和 5 年报告的症状对未来 ND 可能性的影响,以比值比 (OR) 以及相应的 95% 置信区间和 p 值表示。(D) 5 年时与症状相关的主要微生物物种的相对丰度。
03
脐带血清代谢组和脂质组分析
他们收集了出生时的脐带血清和平均 1 岁时的粪便样本,为了评估脐带血清脂质和代谢组的差异,使用倾向评分匹配来控制产前风险因素,包括母体感染、吸烟、压力/严重生活事件、饮食、维生素/补充剂和咖啡摄入,以及父母的教育和胎龄,以选择未来ASD病例的匹配对照(图3A-K)。在产前因素匹配后,亚麻酸(LA)与未来ASD呈最强负相关(图3A)。相反,全氟癸酸(PFDA)与未来ASD的正相关最为显著(图3B)。Zealarone在未来的ASD中也更高(图3C)。对照较高的是3-羧基-4-甲基-5-丙基-2-呋喃丙酸酯、C16:1、癸酸和棕榈酸(图3D-G)。在匹配的对照组中,辛酸、油酸和熊去氧胆酸(UDCA)和未来ASD相关性更高(图3H-I),而在未来ASD中,牛磺酸-β-muricholic acid(TbMCA) 和未来ASD相关性更高(图3I)。脂质组学显示,对照组脐带血清中有8种甘油三酯(TG)富集。在检测到的22种脂肪酸中,观察到两个显著的差异。ABISASD更可能缺乏棕榈油酸(16:1)。相反,ABISASD中粪便中棕榈酸的摩尔百分比(16:0)高出42.6%(图3L)。
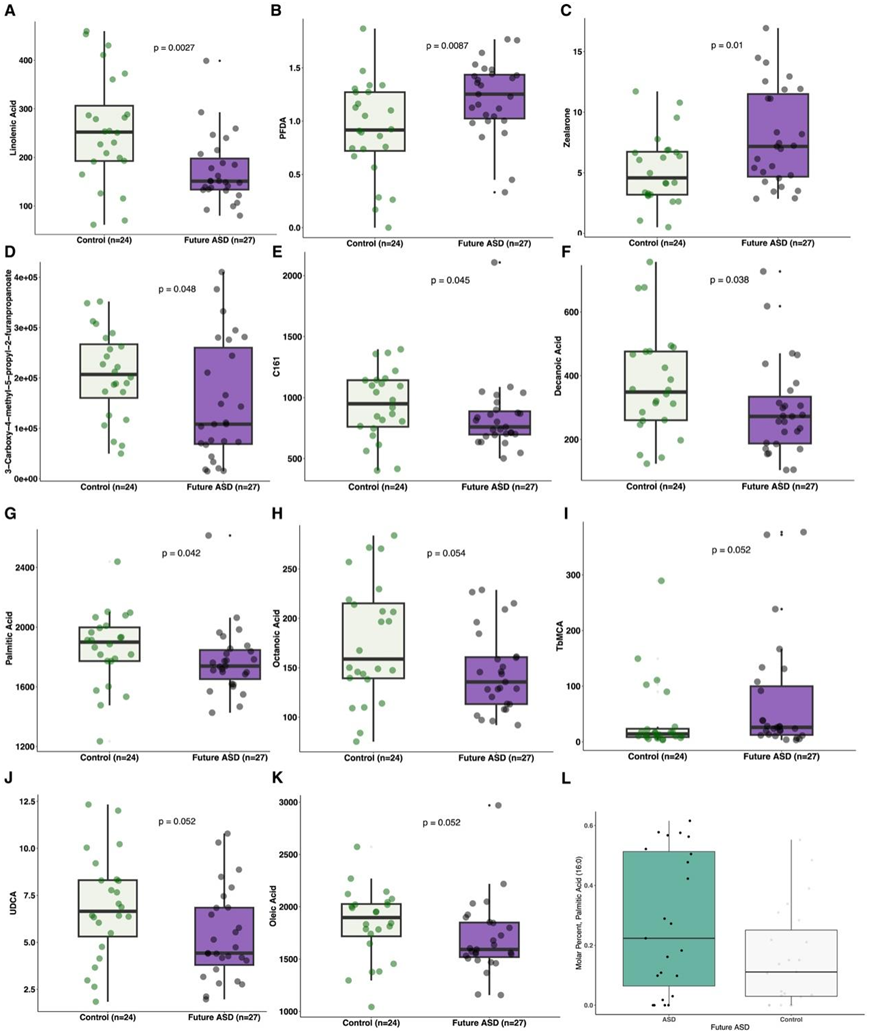
图3. 未来ASD的脐血代谢组学和粪便脂肪酸差异(ABISASD) 。
(A-K)与对照组相比, ABIS ASD的脐带血清中极性代谢物显著富集/减少。(L) ABISASD和匹配的 ABIS对照1 岁时粪便样本中棕榈酸 (16:0) 摩尔百分比的比较。
04
婴儿肠道微生物组分析
从 1748 名 11.9 ± 2.9 个月大的婴儿身上采集粪便,平均读取次数/样本为 61994 次。未来的 ND 状态可通过个体分类群(图 4 A)和常见细菌核心来区分(图S2)。在对照组中富集的细菌包括Akkermansia muciniphila、Akkermansia muciniphila、Erysipelotrichiaceae UCG-003 spp、Adlercreutzia equolifaciens、Alistipes putredinis、Phascolarctobacterium和Phascolarctobacterium(图4A)。一些核心菌种是稳定的(图S2),而另一些则是独特的,包括单形拟杆菌和普通拟杆菌(全部四种ND)、小韦荣球菌(ASD和ADHD)、埃希氏志贺氏菌(ASD、ADHD和智力残疾)和肠杆菌(ASD和智力残疾)。
混杂调整后的微生物差异表明,在ABISND-Match和匹配的对照组中,核心微生物群落存在差异(图4C-D)。在60%的微生物流行率时,观察到匹配组之间的分离(图4C)。对照组中富集了乳杆菌科、Akkermansiaceae、Christensenellaceae、Erysipelotrichaceae UCG-003、AV-81 Bifidobacterium breve和AV-81 Bifidobacterium breve等,而ABISND-Match中富集了拟杆菌科、肠杆菌科、Prevotella 9、拟副杆菌科和Barnesiellaceae等细菌(图4D)。在ASD、ADHD、语言障碍和多重ND中,核心微生物组在亚型上存在显著差异(图4E)。
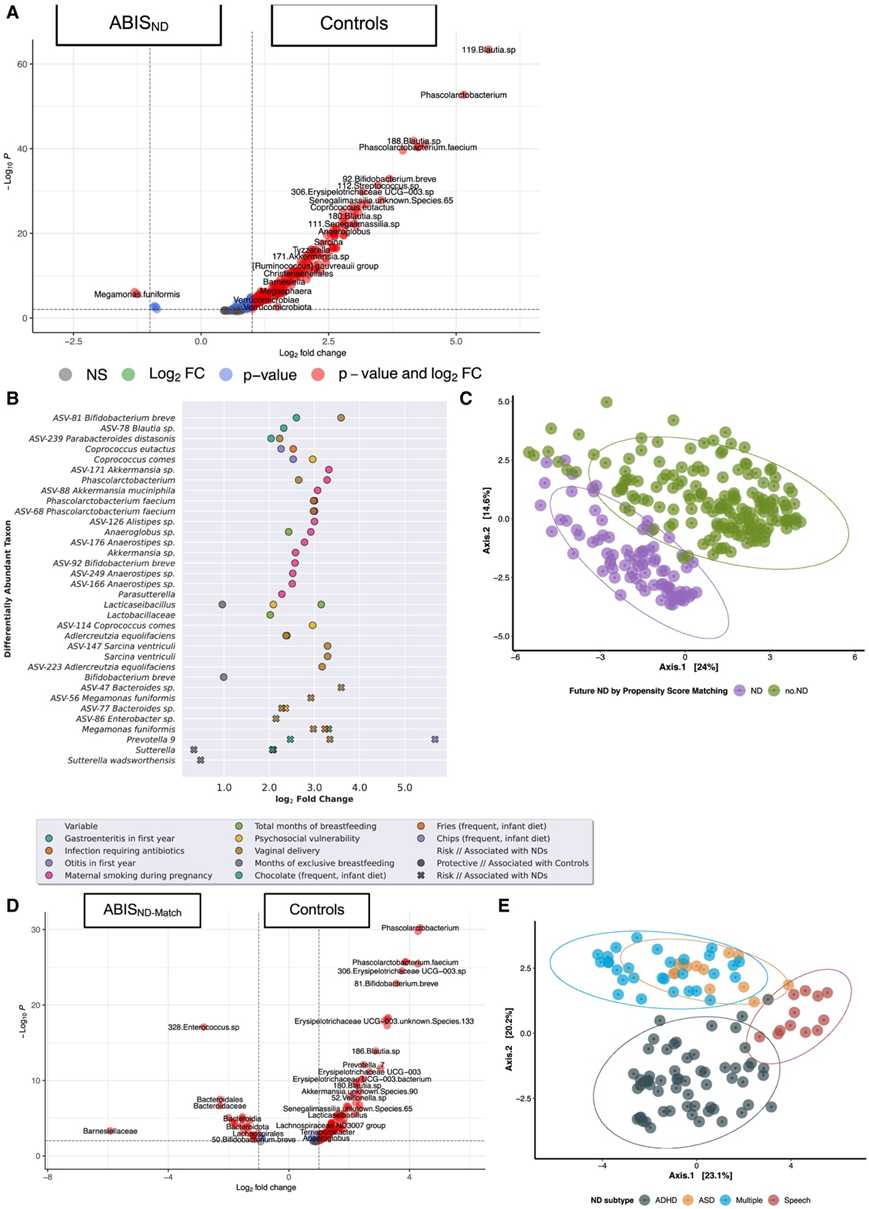
图4. 所有ABIS对照与未来ND ABISND在微生物混淆和ND危险因素(ABISND- match)匹配前后的分类和核心微生物组差异。
(A)所有ABISND与未来ND ABISND在微生物混淆和ND危险因素(ABISND- match)匹配前后的分类和核心微生物组差异。(B) FDR 校正后,物种和扩增子序列变异 (ASV) 差异丰度与第一年或出生调查的风险因素之间的关联。(C) ABIS ND-Match和匹配对照中肠道微生物群落的流行率为 60%。(D) ABIS ND-Match 和匹配对照子集的差异丰度。(E) 神经发育障碍 (ND) 亚型(包括 ADHD、ASD、言语障碍或多种 ND)的肠道微生物群落患病率阈值为 65%。

图S2. 2.5 年时的症状以及 1 年时与微生物丰度的关联。
05
婴儿肠道微生物组分析
为了解决核心变异性,他们将对照组与未来的 ASD、ADHD、言语障碍或多种 ND 分别进行比较(图5A-D)。在所有亚型中,178 种细菌(主要是梭状芽胞杆菌)在对照组中含量更高。值得注意的是,在未来的ND中,无论是何种亚型,Akkermansia muciniphila、Phascolarctobacterium faecium、Roseburia hominis、Coprococcus eutactus、Coprococcus comes、卵形拟杆菌、短双歧杆菌和Alistipes putredinis的数量都一直较少。ASV-184 Blautia sp.和ASV-155 Bacteroides sp.在ABISSpeech中较高。ABISASD中肉杆菌科和ASV-86肠杆菌含量较高,而ABISASD中统一大单胞菌和ASV-77拟杆菌含量较高(图S3A-E)。
在没有DR4-DQ8或DR3-DQ2的个体中,与对照相关的细菌更为丰富。DR3-DQ2/DR4-DQ8杂合子表现出较高的acidaminococaccae和Christensenellaceae。在DR4-DQ8纯合子中,他们观察到与对照相关的细菌丰度较低,包括Roseburia spp、Phascolarctobacterium faecium、eutacus Coprococcus and comes、Alistipes putredinis、Alistipes finegoldii和Adlercreutzia equolifaciens(图5E-F)。
两株密歇根克雷伯菌(asv -120和-318)在ABISmultiple (48.3%)和ABISASD(43.6%)中较对照组(21.7%)更为常见,在频繁使用抗生素的对照组中尤为常见(27.1%)。患有ASV的婴儿发生ASD或多重ND的几率更高,与母乳喂养至少8个月且最少使用抗生素的婴儿相比,这一几率更高。ASV的存在与并发ASD/ADHD的风险增加3.60倍相关,暴露于抗生素或尼古丁/酒精会进一步增加风险。两种asv的存在增加了ASD/ADHD合并症的风险(ABISASD占23.1%,ABISmultiple占24.1%,对照组占8.3%)。沙门氏菌相关肠道细菌在未来的ND中明显增加(图5G)。
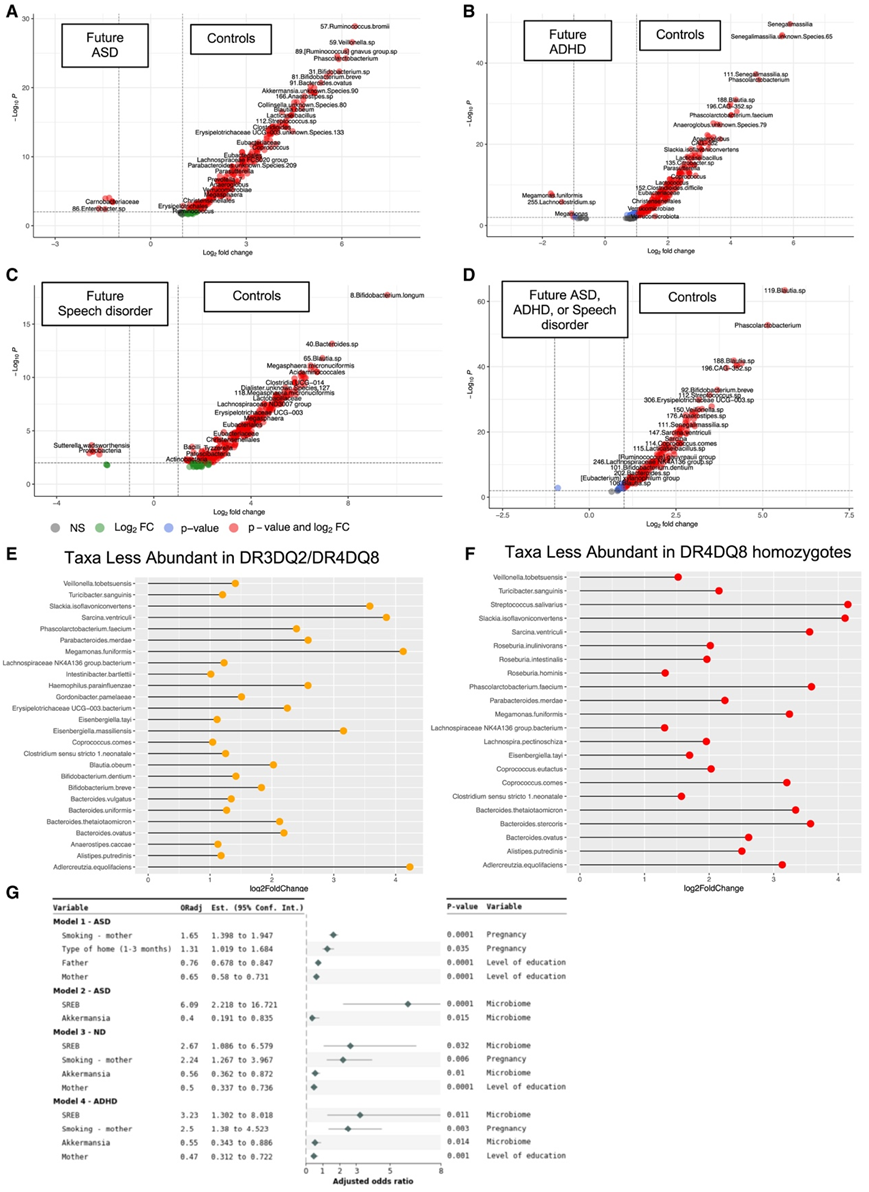
图5. 未来神经发育障碍 (ND) 亚组和 HLA 风险单倍型之间的肠道微生物组差异。
(A–C) ND 亚型未来病例与对照的差异丰度结果。(D) 所有 ND 亚型之间共有的差异。(E)物种与DR3DQ2/DR4DQ8缺失强相关,比较杂合子与没有任何风险等位基因的个体。(F) DR4DQ8 纯合子和没有 DR4-DQ8 的儿童之间丰度最高的物种。(G)使用Python 3.11.4中的多分类logistic回归,对危险因素(母亲在妊娠期间吸烟、母亲在妊娠1-3个月期间居住的家庭类型和父母的教育水平)和Akkermansia或SREB患病率进行回归后的校正比值比(ORadj)。给出了各模型的显著性和95%置信区间。
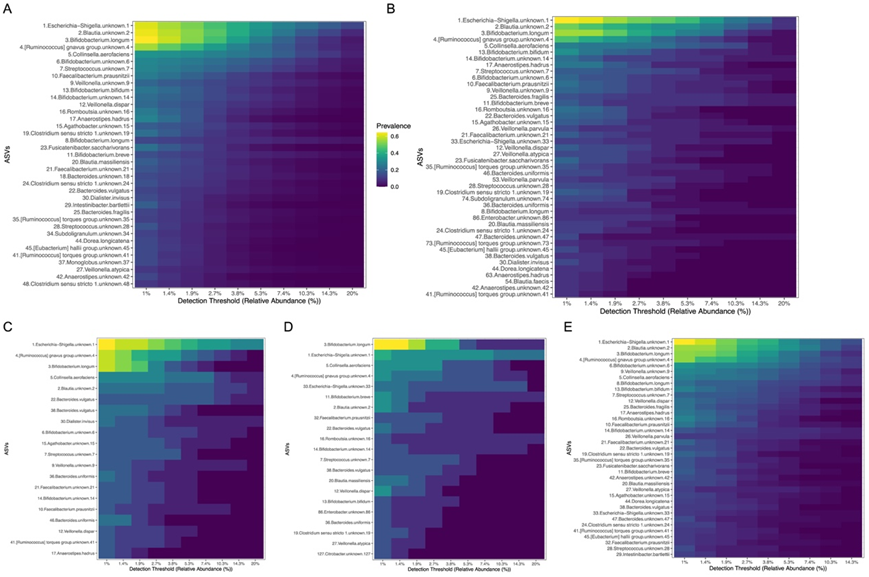
图S3. 对照和神经发育障碍 (ND) 的核心微生物群。
(A-E)对照和神经发育障碍 (ND) 的核心微生物群。
06
婴儿粪便代谢组分析
通过生物学性别和城市的倾向评分匹配选择,在未来ASD的一个子集中观察到粪便代谢组与对照组的差异(图6A-D)。阳性模式鉴定出19种代谢物,阴性模式鉴定出124种代谢物。未来的ASD表现出较高水平的3-异丙基苹果酸酯和喹酸酯,而对照组则表现出较高水平的2-羟基苯乙酸、l -赖氨酸和戊二酸酯。
阿克曼菌和ASV-88阿克曼菌粘蛋白的总16S rRNA拷贝与粪便代谢产物呈正相关,包括戊二酸、阿拉伯糖、吡啶酸、L-苯丙氨酸、L-异亮氨酸、L-丝氨酸、亮氨酸以及血清素和儿茶酚胺前体D-色氨酸和L-酪氨酸(图6D-E)。粪原球菌与核黄素、黄嘌呤、尿嘧啶、阿拉伯糖、胸腺嘧啶、4-羟基苯甲酸盐正相关,与3-异丙基苹果酸和脱氢抗坏血酸负相关,后者在未来ASD中表达也更高(图6F)。
为了将粪便中的代谢组学和微生物差异联系起来,他们使用机器学习提取了负离子模式下的前20种代谢物,预测了本研究中五个最显著属的细菌丰度,并与所确定的相对丰度(双歧杆菌、Roseburia、Faecalibacterium、Akkermansia和Coprococcus)的相关性(图6G-K)。双歧杆菌与2-脱氧-D-半乳糖-果糖、3,4-羟基苯乳酸、3-羟基苯乙酸、N-乙酰-D-乳糖胺、L-阿拉伯糖醇、2-脱氧-D--葡萄糖和6-脱氧-L-乳糖呈正相关,而xanotosine和丙二酸单乙酯呈负相关。L-精氨酸与Roseburia呈正相关,而丙二酸则呈负相关。Shikimate与粪杆菌和球菌均呈负相关。粪杆菌还与尿苷呈正相关,与3-磺酰-L-丙氨酸、牛磺酸、5-羟基吲哚乙酸盐、肌酸和L-肉碱呈负相关。阿克曼菌与3,4-二羟基-苯基丙酸呈正相关。
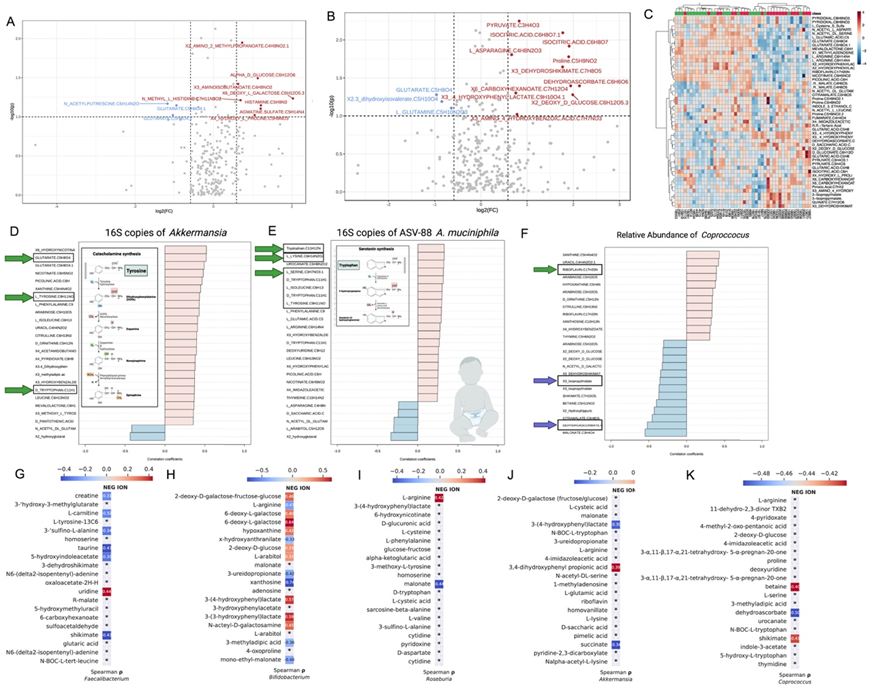
图6. 粪便代谢物与未来 ASD 以及1 年时的阿克曼氏菌和粪球菌丰度密切相关。
(A–C) 未来自闭症谱系障碍 (ASD) 中的代谢物在正和负模式下显著富集或减少。 (D 和 E) 粪便代谢物与Akkermansia和 ASV-88 Akkermansia muciniphila的总 16S rRNA 基因拷贝数的相关性。(F) 粪便代谢物与粪球菌的相对丰度相关。(G–K) 粪便代谢物浓度与 ABIS 对照中更丰富的五个属(粪杆菌属、双歧杆菌属、罗斯伯利亚属、阿克曼氏菌属和粪球菌属)的相对丰度之间的Spearman相关性。
07
环境因素分析
接下来,他们研究了在早期生活因素降低或增加未来ND风险的背景下,不同数量的细菌(图7A-B)。在对照组中,保护性的早期生活因素与较高的细菌相关,而ABISND较高的因素与剖腹产、抗生素使用、感染和婴儿饮食相关。在怀孕期间母亲不吸烟的婴儿中,嗜粘杆菌、卵形拟杆菌、粪相结杆菌、阿利斯特菌和短双歧杆菌的感染率较高。Coprococcus、adlercreutzens、lactoaseibacillus和Bifidobacterium的得分越高,心理社会脆弱性得分越低。在从未接触过抗生素的婴儿中,只有5个类群与对照组相关,包括瘤球菌CAG-352、梭菌UCG-014和Coprococcus eutactus。
在探索早期中耳炎和ND预后之间的联系时,Citrobacter、Coprococcus和Phascolarctobacterium也表现出明显的差异。患有柠檬酸杆菌的婴儿发生ABISND伴早期中耳炎的可能性是无中耳炎对照组的2.35倍(图7A-C)。相反,只有10%的ND伴有中耳炎,而34%的对照组无中耳炎。此外,仅15.7%的ABISND患儿中观察到Coprococcus,其中78.6%的患儿在第一年经历过中耳炎。调整变量,包括分娩方式,产前抗生素和吸烟暴露,以及母乳喂养,证实了这些关联(图7C-F)。
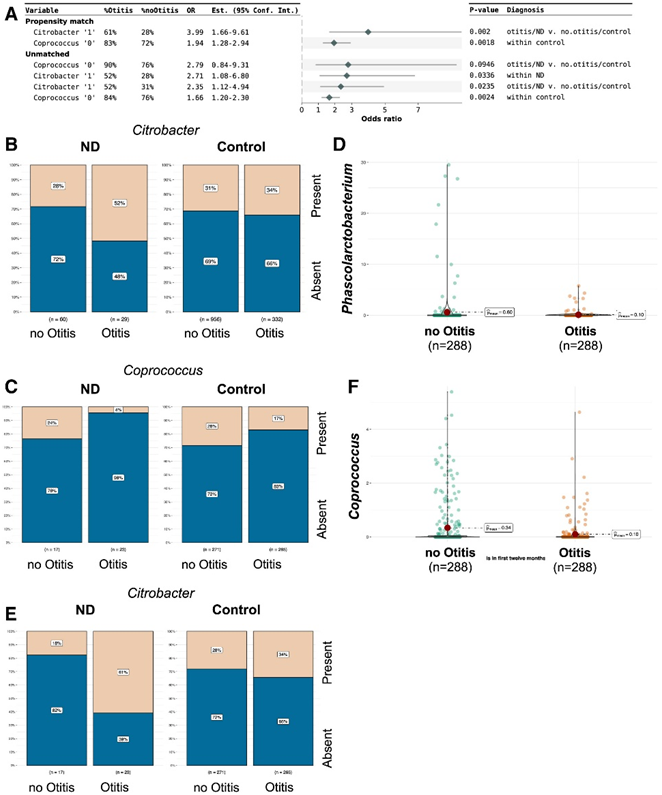
图7. 柠檬酸杆菌和粪球菌的患病率以及葡萄杆菌丰度与早期中耳炎感染和未来神经发育障碍 (ND) 结果的关联。
(A)早期中耳炎和未来ND 引起的柠檬酸杆菌和粪球菌患病率的比值比。(B)完整数据集中柠檬酸杆菌的患病率,按中耳炎病史和未来 ND 划分。(C-E)考虑到早期中耳炎和未来的 ND,匹配数据集中粪球菌和柠檬酸杆菌的患病率。(D-F)基于早期中耳炎感染,匹配数据集中棕褐色细菌和粪球菌相对丰度的差异。
+ + + + + + + + + + +
结 论
本项研究对出生队列进行了 20 多年的跟踪,以寻找与ND诊断相关的因素。详细的早期生命纵向调查问卷记录了感染和抗生素事件、压力、产前因素、家族史等。评估了包括脐带血清代谢组和脂质组、婴儿微生物群和粪便代谢组在内的生物标志物。在长期追踪的 16440 名瑞典儿童中,有 1197 名患有 ND。总体上,未来 ND 诊断和特定 ND 亚型(包括智力障碍、言语障碍、注意力缺陷/多动障碍和自闭症)之间存在显著关联。这项研究揭示了微生物组与未来诊断以及早期出现的情绪和胃肠道问题的联系。研究结果表明,这与免疫失调和新陈代谢有关,再加上压力、早年感染和抗生素的影响。在这项针对大规模人群的前瞻性纵向研究中,婴儿生物标志物和危险因素的融合为早期生命预测和神经发育干预奠定了基础。
+ + + + +



 English
English


