文献解读|Nature(64.8):小鼠全脑脊髓投射神经元的转录组分类学
✦ +
+
论文ID
原名:A transcriptomic taxonomy of mouse brain-wide spinal projecting neurons
译名:小鼠全脑脊髓投射神经元的转录组分类学
期刊:Nature
影响因子:64.8
发表时间:2023.12.13
DOI号:10.1038/s41586-023-06817-8
背 景
大脑通过脊髓投射神经元(SPN)控制几乎所有的身体功能,这些神经元将命令信号从大脑传递到脊髓。然而,仍然缺乏全脑 SPN 的全面分子表征。
实验设计
结 果
01
SPN 转录组图谱的生成
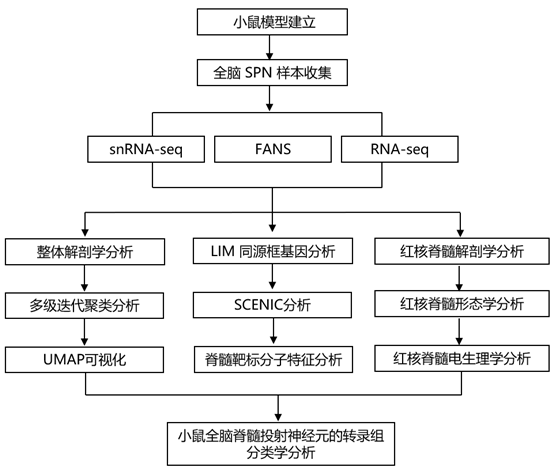
由于其复杂的解剖分布和脆弱性,全脑 SPN 很难以单细胞分辨率进行表征。为了解决这个问题,研究者团队开发了一种管道,可以有效地标记、成像和转录分析整个成年小鼠大脑中的 SPN 核(图1a)。他们通过将重组逆行腺相关病毒(rAAV2/retro-Syn-H2B-荧光蛋白)注射到以颈部[绿色荧光蛋白(GFP)]和腰部(mScarlet)脊髓为中心的多个节段来逆行标记SPN。在小鼠出生后第 56 天(P56),他们通过串行双光子断层扫描(STPT)评估了SPN在整个小鼠大脑中的解剖分布(图1b)。正如预期的那样,SPN在小鼠大脑中广泛分布,但主要集中在皮质 (CTX)、下丘脑(HY)、中脑(MB)、小脑(CB)、脑桥头端(PONS)和桥脑延髓尾侧(MED)。
为了生成转录组分类,他们进行了高通量荧光激活核分选 (FANS) 和单细胞核转录组分析 (snRNA-seq)。他们使用多级迭代聚类方法生成 SPN 的转录组分类(图1c)。在整体树状图的第一级(图1c)中,将SPN分为三个部分:(1)CTX、MB和CB中的谷氨酸能神经元(“CTX MB CB 谷氨酸”,34565个神经元,占所有SPN的53.18%);(2) MB 和后脑 (HB) 中的谷氨酸能和 GABA/甘氨酸能神经元 (“MB HB 谷氨酸或 GABA 能/甘氨酸能”,);(3) 皮质下调节神经元(“调节”)。 第二级聚类将这些大类划分为 13 个亚类,第三级将这些亚类划分为由差异表达标记基因定义的 76 个类型。均匀流形近似和投影(UMAP)空间中的无监督聚类和可视化揭示了来自不同感兴趣区域 (ROI)富集解剖的细胞核在很大程度上是分离的,但具有一些重叠类型,可能反映了多个大脑区域的解剖连续性和/或转录组相似性(图1d)。分裂和亚类跨越多个大脑区域,表明细胞类型的分离是区域和分子特性的结合(图1e-f)。
这种方法有效地将 SPN 类型分配到传统定义的脊髓投射群体中,例如 CTX 衍生的 CSN、CB 衍生的小脑脊髓神经元 (CbSN)、红核衍生的 RuSN、脑干衍生的 ReSN 和调节群体,例如下丘脑脊髓神经元和中缝脊髓神经元。
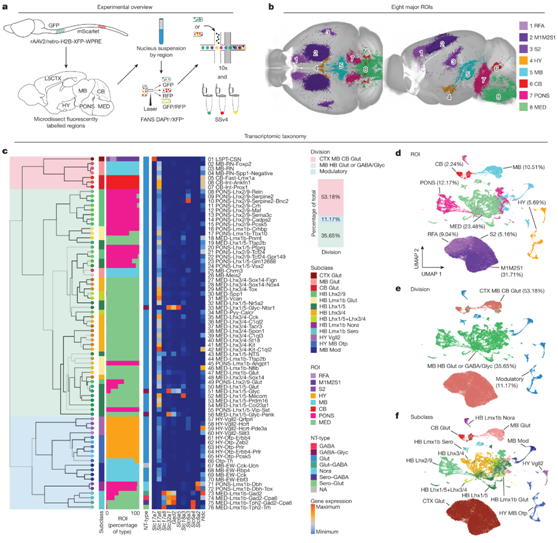
图1. 全脑脊髓投射神经元的解剖学转录组图谱。
(a) 通过脊髓注射逆行 AAV 构建体来标记 SPN,该逆行 AAV 构建体将荧光蛋白表达定位于细胞核,以进行平行解剖和转录组分析。 (b) 使用 STPT 成像的分段和配准 SPN 核的 WB 重建显示 SPN 存在于 CTX(RFA、M1M2S1 和 S2)、HY、MB、CB、PONS 和 MED 中。 (c) 多级迭代聚类揭示了 76 个 SPN 转录组“类型”。 (d-f) SPN 的聚类和 UMAP 空间中的可视化。
02
SPN 的转录组景观
通过转录组和空间注释,所有 SPN 可以分为三个主要部分(图1c),代表脊柱投射通路的三个关键组成部分。CTX、MB和CB中的谷氨酸能神经元区(第1区,1-7型)仅包括具有集中解剖位置的谷氨酸能SPN(即L5CTX、MB红核和小脑深部核)和向脊髓的聚集性投射(即皮质脊髓束、红脊髓束和小脑脊髓束)。这个分类有三个子类和七个类型(图1c,图2a)。“CTX glut”子类对应于皮质脊髓神经元(CSN),它表达Slc17a7(也称为 Vglut1),并且如预期的那样,表达其的第 5 层标记(例如Fezf2、Bcl11b 和Crym)(图2b-c)。这些 CSN 出现在前肢吻侧区域 (RFA)、初级和次级运动 CTX/初级体感 CTX (M1M2S1) 和次级体感 CTX (S2)(图1b)。这个分区中的“MB glut”子类包括三种与RuSN相对应的类型。这些类型表达Slc17a6 (Vglut2)和标记物Rreb1和Emx2(图2d-e)。它们的snRNA-seq谱映射到AIBS WB MERFISH数据上,将这三种类型定位到MB细胞核(图2d)。最后,具有三种类型的“CB glut”子类对应于 CbSN。与 RuSN 一样,它们表达Slc17a6 (Vglut2) 和Rreb1(图2b-e)。
第 1 区神经元的另一个共同特征是它们的体位位置和脊髓投射。在所有脑区中,1区的群体表现出GFP和mScarlet细胞的明显分离(图2f)。
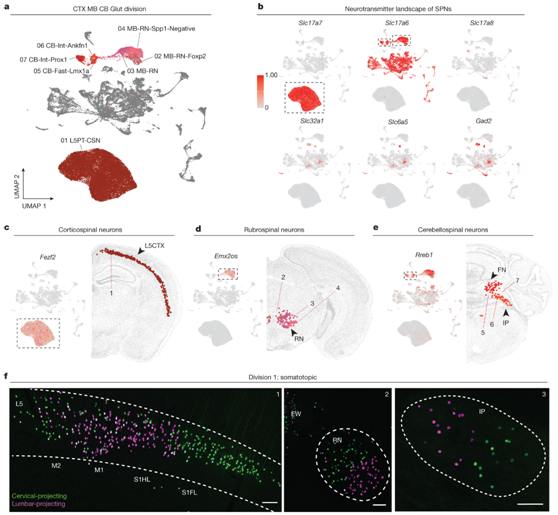
图2. 来自皮质第 5 层、红核和小脑的 SPN 在转录和解剖学上都是离散的。
(a) 所有 SPN 的 UMAP,按分类学部门 1 内的类型着色。 (b) 神经传递机制选定基因的表达。 (c-e) 皮质脊髓神经元、红核脊髓神经元和小脑脊髓神经元的选定标记基因(上)和代表性 MERFISH 切片(下)的表达。 (f) 共聚焦显微镜图像。
皮质下调节神经元包含5个亚类和20种类型,分布在HY、MB和HB,但不包括第1分支神经元所在的大脑区域(图3a)。与第 1 分支和第 2 分之中的 SPN(主要由快速作用神经传递标记物定义)相比,“调节”分支与神经肽和/或慢速神经递质相关。这些调节输入可以放大和/或延长快速命令,是“情绪运动路径”, 在不同的生理和病理条件中起作用。下丘脑脊髓神经元主要起源于室旁 HY 和下丘脑外侧区,分别包含“HY MB Otp”和“HY Vgll2”亚类(图3b-c)。这里定义的所有下丘脑脊髓神经元都是兴奋性的 (Slc17a6+)。然而,它们的特点在于各种神经肽的高表达,如精氨酸抗利尿激素(Avp)、食欲素(Hcrt)、生长激素释放激素(Ghrh)和催产素(Oxt)。此外,“HY MB Otp”亚类中的“Otp-Th”型由酪氨酸羟化酶(Th)表达定义(图3b)。该细胞群主要存在于富含MB的夹层中,但在富含HY的夹层中也有一小部分,表明该细胞群存在于HY-MB边界。基于MERFISH的空间映射和Th-Cre小鼠系中Cre依赖的逆行标记,这种类型很可能是A11组神经元(图3b)。除Slc17a6外,该型还表达Th、多巴脱羧酶(Ddc)和囊泡单胺转运蛋白2 (Slc18a2),表明其具有单胺能活性;然而,有趣的是,“Otp-Th”型缺乏其他单胺转运蛋白如多巴胺转运蛋白(Slc6a3)的表达。
其余四种MB类型包括“MB Mod”亚类,起源于EW细胞核(图3d)。“MB-EW-Cck-Ucn”型在分子上是相当不典型的:这些神经元缺乏兴奋性或抑制性神经传递的标记,而是富含一组编码神经肽的基因,包括Cck、cartt和Ucn(图1c,图3d)。
相比之下,MB-EW-Cck型表达神经肽Cck和cartt(但不表达Ucn)和谷氨酸能标志物(Slc17a6)。有趣的是,MB-EW-Cck-Ucn型表达调节性神经肽,而没有检测到速效神经递质机制的表达。PONS和MED也有调节性SPN。这些类型分别属于“HB Lmx1b Nora”和“HB Lmx1b Sero”亚类,分别对应于单胺能蓝斑和髓质中缝核(图3e)。
Slc17a8的稀疏表达也存在于其他皮层下类型中,例如来自孤立束核的spn (NTS;MED-Lhx1/5-NTS)(图3f)。MED-Lhx1/5-NTS虽然不属于“调节性”分支,但它高度表达神经肽胰高血糖素(Gcg)。由于NTS是一个主要的副交感感觉核,它的SPN成分表明内脏和脊髓回路之间有直接的棘上通讯。
双重或部分神经递质类型机制的证据并不是“调节性”分类所独有的。例如,PONS和MED中的GABA/Glyc群体表达Slc6a5 (GlyT2)和GABA和甘氨酸的常见囊泡转运蛋白Slc32a1 (Vgat)。此外,MED-Lhx1/5-NTS型的谷氨酸能Slc17a6+神经元也表达Gad2,但Slc32a1表达低或缺失,表明它们可能不使用GABA进行突触传递(图3f)。该类型定位于AIBS WB图谱中的4361聚类,位于NTS和中间网状核,同样显示Slc17a6和Gad2共表达,Slc32a1低表达。
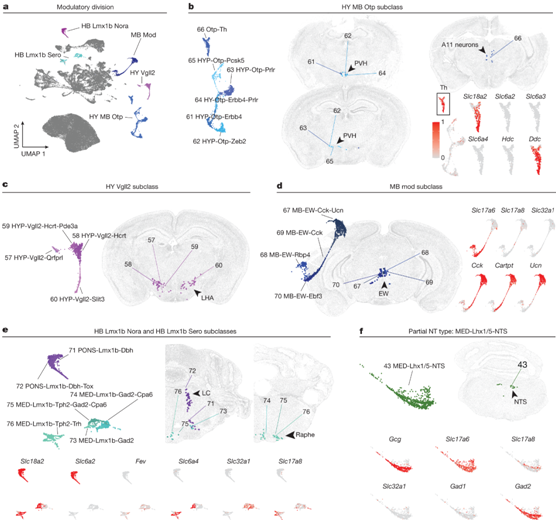
图3. SPN 的不同神经递质特性。
(a) 所有 SPN 的 UMAP,按分类学部门 3 中的子类着色。(b) HY MB Otp 子类中类型的子集 UMAP(左)和 MERFISH 表示(右)。(c) HY Vgll2 子类中类型的子集 UMAP(左)和 MERFISH 表示(右)。(d) MB Mod 子类中类型的子集 UMAP(左)和 MERFISH 表示(中)。选择标记基因的表达(右)。(e-f) 与(d)相同,但适用于 HB Lmx1b Nora 和 Sero 子类中的类型以及 MED-Lhx1/5-NTS 类型。
03
成年ReSN的LIM转录因子代码
解剖结构和转录结构最复杂的一类SPN是源于桥脑延髓网状结构的ReSN,其中包括2区的大部分SPN和3区的去甲肾上腺素能和5 -羟色胺能SPN。作为网状结构向脊髓的下行输出,ReSN在调节自主运动、不自主姿势和步态控制以及自主神经功能等多种功能中发挥着重要作用。
为了在最终的SPN分类中定义53种桥髓网状形成类型(图1c),他们将PONS-和MED -富集解剖的核共同重新分析。基于LIM同源盒基因在ReSNs中的显著表达模式,他们将所有桥延髓ReSN分为五个“LIM组”,每个“LIM组”特异性表达Lmx1b或一对同源LIM同源盒基因(Lhx2和Lhx9、Lhx3和Lhx4、Lhx1和Lhx5)(图4a-b)。在最终的分类中,Lmx1b组根据主要的神经递质分为三个亚类(HB Lmx1b Nora、HB Lmx1b Sero和HB Lmx1b Glut)(图1c)。只有三种类型(MED-Pyy、MED-Spp1和MED-Vcan)不完全由一对LIM同源盒基因定义,并分类为Lhx1/5 Lhx3/4组。值得注意的是,Chx10 (Vsx2)是ReSN的常用标记物,与Lhx3/4基团表达几乎完全一致。这些结果表明,存在一个用于分类成年ReSN的“LIM代码”,这可能反映了LIM基因在建立和维持神经元特性方面的作用。单细胞调控网络推断和聚类(Single-cell regulatory network inference and clustering, SCENIC)也显示这些LIM基因是最主要的类型特异性转录因子。
将ReSN类型与AIBS WB MERFISH数据集相结合,确定了LIM定义类型的解剖分布(图4c)。具体来说,HB Lmx1b Nora亚型和HB Lmx1b Sero亚型分别定位于蓝斑座和中缝髓核。Lhx1和Lhx5的广泛表达表明,HB Lhx1/5亚类的类型可能出现在广泛的解剖结构域,因此可能与其他LIM定义的区域的解剖结构域一致,也可能不一致。例如,广泛存在的桥髓甘氨酸能类型属于HB Lhx1/5亚类。将这些结果与Cre依赖的逆行标记结果统一,将LIM组分配到广泛的解剖区域(图4d)。综上所述,本文提出的LIM定义的类型全面定义了ReSN的细胞组成,并提示了其异质性和HB的解剖起源的转录过程。

图4. LIM 同源框基因将网状脊髓神经元分割成空间和转录上不同的子集。
(a) 来自PONS和med富集切片的细胞核亚群和重新嵌入。 (b) 点图显示按五个 LIM 组分组的Lmx1b、Lhx2、Lhx9Lhx3、Lhx4、Lhx1和Lhx5的表达。 (c) ReSN 类型的代表性 MERFISH 部分,每个部分由各自的 LIM 定义的子类着色。 (d) 使用对应于LIM定义的亚类的转基因系中Cre依赖的逆行标记核的代表性冠状重建总结了LIM定义的亚类的解剖分布。
04
脊髓靶点的分子特征
SPN根据其特定功能在不同脊柱水平上的投射模式不同。为了了解脊髓投射特性的转录组分类,他们分析了投射到颈和/或腰椎的SPN的差异。首先,他们分析了76种经转录定义的SPN类型的投射类型组成(图5a),方法是检测UMAP空间中的分布(图5b),并确定每种SPN类型中颈部和双/腰背部投射神经元的比例(图5c)。大多数类型由混合投射靶点的SPN组成,但少数类型仅投射到颈脊髓(如HB Lhx1/5 Glyc Penk)。桥髓网状结构的类型含有高比例的双和/或腰椎突出的SPN。
接下来,他们通过差异表达分析研究了具有不同脊髓靶点的SPN的转录特征。值得注意的是,Epha4、Epha6、Epha7和Efna5是在所有ROI中宫颈和双/腰突出SPN之间差异表达的基因(图5d-g)。最后,通过分析更高测序深度的SSv4数据,他们确定了CSN和RuSN中颈椎和腰椎/双突出神经元之间的一组差异表达基因(图5g)。GO分析确定了几个相关的通路,包括与轴突引导、轴突长度和神经传递相关的通路(图5h)。因此,颈椎和腰椎突出的CSN和RuSN之间的一些分子差异可能与它们的功能调节和结构维持有关。
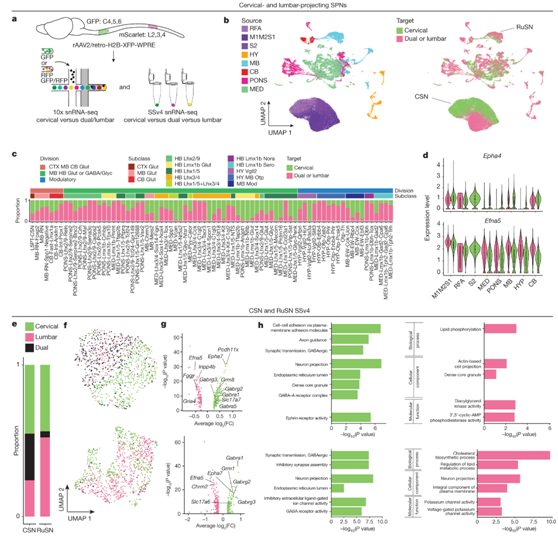
图5. 终止于不同脊柱靶点的 SPN 之间的转录组差异。
(a) 实验流程图。(b) 所有 SPN 的 UMAP 可视化。(c) SPN转录组类型中颈椎(绿色)与双椎或腰椎(粉色)的比例。 (d) 所有 SPN 中差异表达基因Epha4和Efna5的小提琴图,按 ROI 分组。(e) SSv4 CSN 和 RuSN 数据集中颈椎、双椎和腰椎投射神经元的比例。(f) CSN(上)和 RuSN(下)的 SSv4 UMAP。 (g) 差异表达基因的火山图。(h)GO分析。
05
快速发射 SPN 的独特特性
通过分析 SPN 类型中顶级标记和活动相关基因的表达,他们确定了一个显著的基因表达模式:Pvalb和Kcng4在大多数 RuSN 和 CbSN 以及 ReSN 子集中表达,并且这些神经元强烈共表达Spp1。通过对RuSN的关注,他们发现Pvalb/Kcng4/Spp1在不同类型的RuSN中表达不同,MB-RN和MB-RN- foxp2型高表达,MB-RN-Spp1-阴性型低表达(图6a)。正如预期的那样,Spp1阳性(Spp1+)和阴性(Spp1−)rusn之间的差异表达分析显示,差异表达最多的基因支持电生理(如Pvalb、Kcng4、Kcnip4、Hpca、Kcnn3、Kcnc4和Gabrb1)和细胞大小(如Spp1、Nefh、Nefm、Nefl和S100b)差异(图6a)。逆行标记组织中SPP1的免疫组化显示SPP1−rusn主要存在于喙侧红核(可能对应于旁细胞红核),而SPP1+rusn大量存在于内侧红核(可能是大细胞红核)(图6b-d)。
为了评估它们的电生理特征,他们在脑切片中对逆行标记的SPP1+和SPP1−rusn进行了松散细胞贴附和全细胞记录。记录后的免疫组化(图6e)和对SSv4数据的分析显示,SPP1+群体中记录的rusn的体细胞数和每个细胞核的基因数量更大(图6f-g)。在细胞贴附记录中,SPP1+ rusn的动作电位峰波形负相明显缩短,表明它们具有支持快速动作电位的膜生理过程(图6h)。在全细胞记录中,他们同样发现SPP1+rusn具有更窄的动作电位(图6i)和更高的平均自发放电率(图6j-k)。此外,与SPP1−RuSN相比,SPP1+ RuSN的输入电阻更小,可激性更差(图61-m)。超极化后动作电位阈值、幅度、峰值和快后无显著性差异。
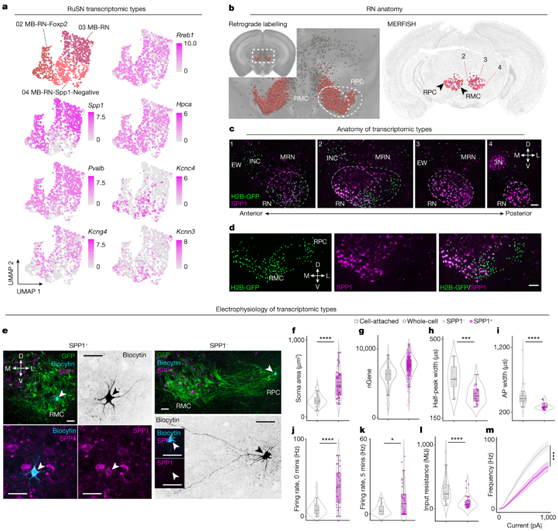
图6. 红核脊髓类型的解剖学、形态学和电生理学。
(a)UMAP可视化。 (b) 左图,用 STPT 成像的 RuSN 的冠状重建。右图,MERFISH 映射描绘了类型 02-04。 (c-d) 逆行标记的 RuSN 上 SPP1 的代表性 IHC 结果。(e) 细胞附着记录切片中代表性 SPP1+和 SPP1− RuSN 的共焦图像。(f) 从细胞贴壁和全细胞记录中量化体细胞大小。 (g) RuSN 中检测到的基因数量。(h) 自细胞贴壁记录的尖峰波形的半峰宽度。 (i-m) 动作电位宽度,0分钟和5分钟时的自发放电率,输入电阻和全细胞记录的频率电流注入。
+ + + + + + + + + + +
结 论
本项研究对总共 65002 个 SPN 进行了转录分析,鉴定了 76 个区域特异性 SPN 类型,并将这些类型映射到整个小鼠大脑的伴随图谱中。该分类揭示了 SPN 的三部分组织:(1)来自皮质、红核和小脑的分子同质兴奋性 SPN,具有适合点对点通信的体位脊髓末端;(2)网状结构中的异质群体具有广泛的脊髓终止模式,适合传递与整个脊髓活动相关的命令;(3) 调节神经元在下丘脑、中脑和网状结构中表达慢效神经递质和/或神经肽,用于脑脊髓信号的“增益设置”。此外,该图谱还揭示了 LIM 同源框转录因子代码,该代码将网状脊髓神经元分为五个分子上不同且空间隔离的群体。最后,本研究发现了具有较大胞体尺寸的 SPN 子集的转录特征,并将其与快速放电的电生理特性相关联。总之,这项研究建立了全脑 SPN 的综合分类法,并深入了解 SPN 在调节大脑对身体功能的控制中的功能组织。
+ + + + +



 English
English


