文献解读|Nat Cancer(23.5):单细胞转录组图揭示嗅神经母细胞瘤亚型和肿瘤内异质性
✦ +
+
论文ID
原名:Single-cell transcriptomic landscape deciphers olfactory neuroblastoma subtypes and intra-tumoral heterogeneity
译名:单细胞转录组图揭示嗅神经母细胞瘤亚型和肿瘤内异质性
期刊:Nature Cancer
影响因子:23.5
发表时间:2024.11.14
DOI号:10.1038/s43018-024-00855-5
背 景
嗅神经母细胞瘤 (ONB) 是一种罕见的恶性肿瘤,已知其起源于嗅觉上皮。ONB 是一种罕见的恶性肿瘤,起源于鼻腔。它仅占所有鼻腔鼻窦恶性肿瘤的 5-6% ,发病率较低,为每年每百万人出现 0. 4 例。最近发现ONB 起源于鼻裂4中的嗅觉黏膜 (OM) ,这种病理的复杂肿瘤生态系统仍不清楚。
实验设计
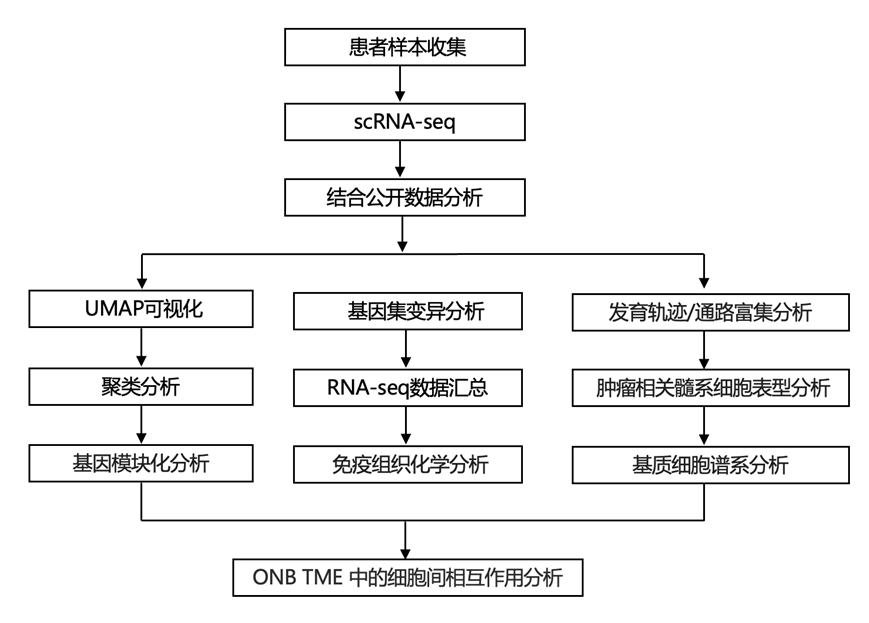
结 果
01
ONB 和正常成人 OM 的单细胞转录组图谱
为了破译ONB肿瘤的细胞图谱,研究团队按照简单的工作流程(图1a)使用了内镜肿瘤切除术中获得的10个ONB样本的scRNA-seq图谱,以及从基因表达综合(GEO)数据集(GSE139522)中检索到的1个成人OM样本。总共获得了96,325个细胞的转录谱,包括来自10个ONB样本的85452个细胞和来自对照OM样本的10873个细胞。
基于主成分分析,然后进行基于图的聚类,他们确定了 11 个主要细胞聚类(图1b-c)。根据 CellMarker 数据库中的典型标记和嗅觉神经元标记对细胞亚型进行注释。细胞聚类可分为七种免疫谱系,包括巨噬细胞、树突状细胞、单核细胞、肥大细胞、浆细胞、T 细胞和 B 细胞,三种非免疫基质谱系,包括成纤维细胞、内皮细胞和平滑肌细胞,以及一个以经典上皮标志物为标志的上皮聚类,包括 EPCAM、CLDN 和细胞角蛋白。
然后,他们采用了一种主要基于推断的拷贝数变异(CNV)水平的两步法来识别上皮聚类内的恶性细胞。首先,根据基因组间隔内的平均表达模式推断上皮聚类中每个单细胞的大规模染色体 CNV。选择所有上皮细胞作为输入,并提取 OM 数据集中鉴定的所有成纤维细胞作为对照。其次,分别对从 OM 数据集中选择的成纤维细胞和来自每个 ONB 肿瘤样本的上皮细胞的 CNV 谱进行层次聚类。来自 ONB 数据集的表现出多倍体 CNV 模式的上皮细胞是恶性细胞,而与来自正常 OM 的成纤维细胞聚集在一起的细胞是非恶性的。
接下来,他们对每种主要细胞类型(恶性细胞、髓系细胞、T 细胞和自然杀伤细胞、成纤维细胞和内皮细胞)进行提取和重新聚类,以识别亚群。包括细胞丰度、基因数量和唯一分子标识符以及每个患者亚群比例分布在内的属性在不同组织来源和患者之间差异很大(图1d),结果显示 ONB 肿瘤微环境(TME)具有高度异质性。
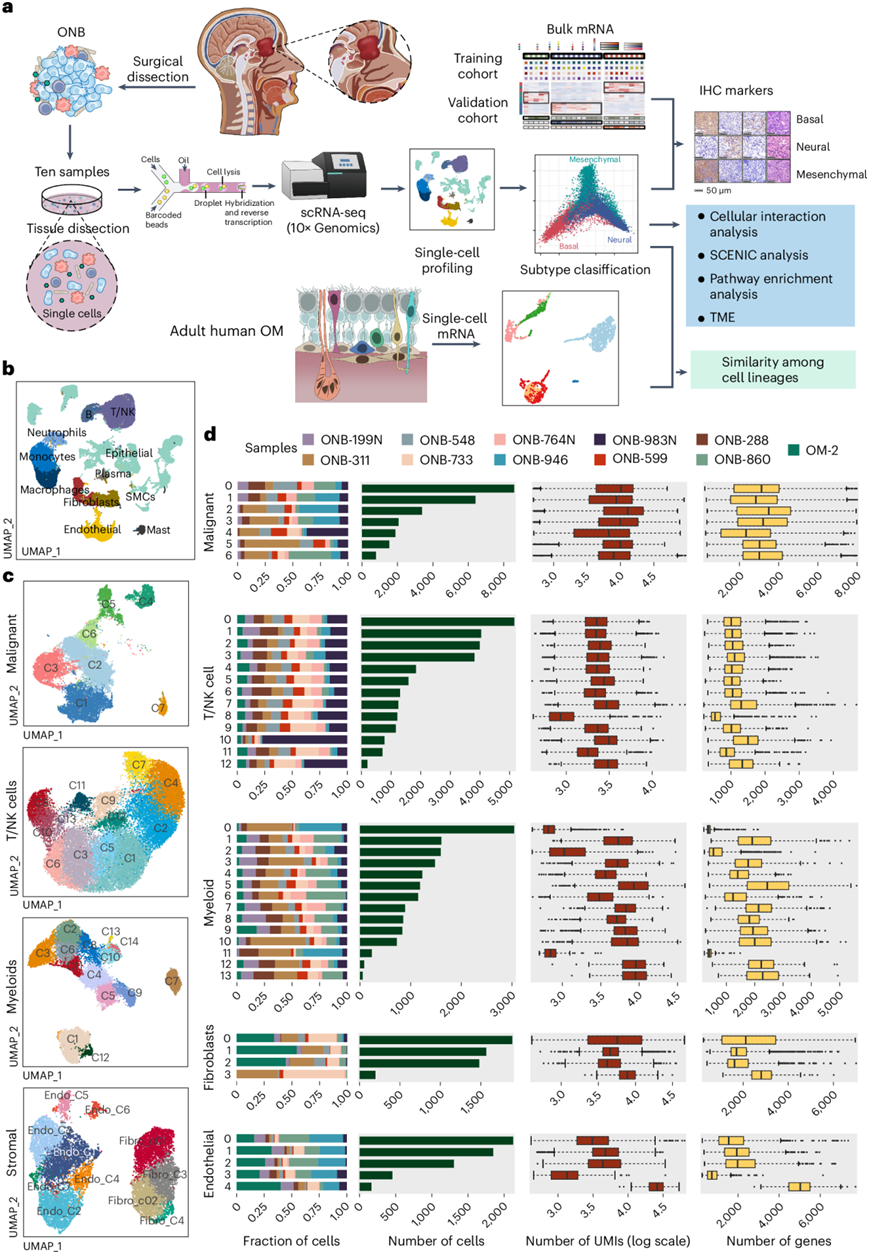
图1. ONB 中多种细胞类型的单细胞转录组图谱。
(a)实验流程。(b) UMAP 可视化,按不同的主要细胞类型着色。(c) UMAP显示不同细胞类型。(d) 来自11个样本的详细细胞成分数据。
02
ONB恶性细胞的肿瘤内表达异质性
为了分析ONB 恶性区内的细胞多样性,他们筛选出共 24686 个 ONB 癌细胞并将其重新聚类为 7 个恶性亚组(图2a)。根据对 ONB 的多组学研究,该肿瘤的两种亚型,即基底亚型和神经亚型,可以通过独特的分子表达模式和不同的临床病理学特征来区分,可能具有来自嗅觉上皮不同层的多种细胞来源。他们通过评估多组学研究中提供的基底和神经特征的表达水平,在单细胞分辨率下验证了 ONB 的这种二元分类,并通过特征图中显示的分数评估亚型特异性表达(图2b)。初步结果表明,神经和基底评分优先分布在肿瘤均匀流形近似和投影 (UMAP) 图的不同区域,表明存在基底和神经样恶性细胞,他们发现某些恶性亚组 (C4-C7) 具有独特的表达模式(图2b)。
从每个肿瘤数据集中提取四个程序以生成40个肿瘤内程序的矩阵,经过相关性层次聚类后将其提炼为五个主要的元基因模块(图2c)。五个元基因模块显示出不同的细胞功能,如使用每个元程序的最高得分基因进行的基因本体通路分析所注释的(图2d)。基于这些不同表达模式(每个ONB恶性细胞的模块得分),他们能够将恶性ONB亚组分为四类(图2e-f)。总体而言,他们确定了富含嗅觉神经发育(元程序 1:CHGB、HES6、NEUROD1)和细胞循环(元程序 2:MKI67、TOP2A、UBE2C)通路的元程序,它们反映了经典神经和基底 ONB 亚型(分别为亚组 C1-C2 和亚组 C3)的表达特征。他们发现元程序 4( CAPS、TPPP3、PIFO )与纤毛运动和组织(亚组 C7) 有关。此外,功能分析揭示了两个 NMF 模块(元程序 3:NRG1、WNT10A;元程序 5:BMP7、LAMA1)与肿瘤间充质(亚组 C4-C6)之间的关系。因此,他们将这些元程序命名为 Mes-1 和 Mes-2,因为它们富集了包括细胞外结构组织、间充质细胞分化、对 TGF-β 和成纤维细胞生长因子的反应以及代谢相关过程等通路。
间充质样恶性亚群的鉴定激发了他们对进一步了解 ONB 肿瘤内异质性的兴趣。基底亚群的细胞比例与更高的 Hyams 分级呈正相关(Hyams III 和 IV)(图2g)。他们进行了基因集变异分析 (GSVA) 以揭示恶性亚群的功能作用(图2h)。基底亚群(C3)细胞富含增殖通路和高水平的细胞周期评分,神经亚群(C1和C2)参与神经发生和嗅觉转导,间充质亚群(C4-C6)表现出与TME中的细胞活动相对应的多种功能,包括血管生成、上皮-间质转化(EMT)和细胞外基质重塑为mTOR信号传导、炎症反应和趋化因子分泌以及嗅球中间神经元发育(图2h)。他们分析了恶性神经、基底和间质 (NBM) 细胞之间的差异表达基因 (DEG),并使用前 50 个上调的 DEG 来评估每个 ONB 肿瘤细胞中的恶性评分。发现推断的 CNV 评分在 NBM 亚群中的分布模式不均匀。例如,推断的 CNV 与神经评分之间呈正相关,反之,恶性 ONB 细胞中的间质和基底评分与 CNV 水平呈负相关。考虑到先前报道的基底亚型突变率较高,这些结果表明,在不同的 ONB 亚型中评估时,推定的拷贝数改变的程度可能与突变负荷不一致。
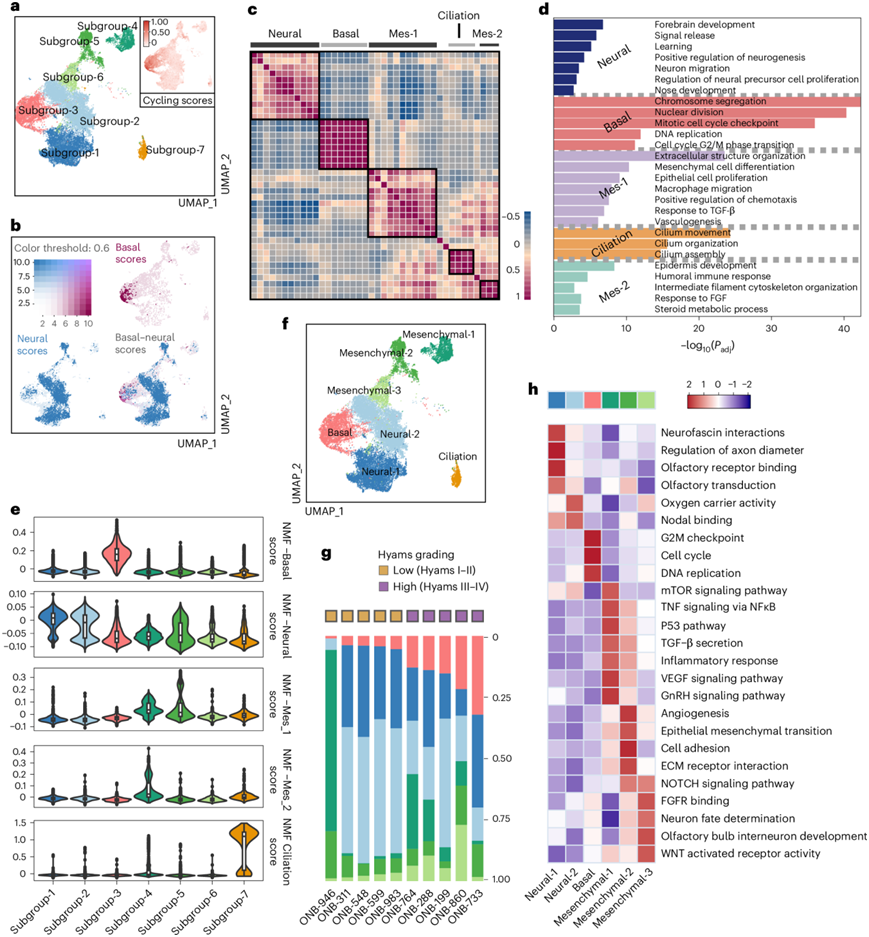
图2. ONB 的瘤内异质性。
(a) UMAP 表示由亚聚类恶性上皮细胞生成的七个亚组。(b) UMAP 描绘了恶性上皮细胞中典型基底和神经 ONB 亚型的特征评分。(c) 来自十个 ONB 肿瘤的 40 个肿瘤内 NMF 程序的成对相关性。(d)GO分析。(e) 小提琴图显示七个恶性亚聚类中五个 NMF 元程序中的每一个的模块分数。(f) UMAP显示七个 ONB 恶性亚组的注释表型。(g) 堆叠条形图表示在十个 ONB 样本中发现的每个恶性亚组的细胞比例。(h) 热图显示ONB 恶性亚组中富集的代表性通路。
03
NBM 特征对大量 ONB 队列进行分层
为了进一步说明在单细胞水平上反映单个 ONB 样本内混合细胞状态的光谱,他们创建了一个三元图,其中除纤毛亚群 (C7) 以外的恶性细胞根据其在 NBM 分类基因方面的相对得分放置在图上,不同类别(NBM 亚群)用不同颜色标记(图3a)。总体而言,这些的三元图证实了 ONB 恶性细胞中细胞表型的三部分结构。然而,当分割三元图以显示每位 ONB 患者的 NBM 细胞组成时,他们发现一些肿瘤比其他类别更倾向于特定的细胞状态,显示出三种可区分的模式(图3a)。
他们结合了另一个由 23 名接受手术切除的 ONB 患者组成的队列,该队列样本经过了转录组分析(RNA-seq),并采用该组作为衍生队列以进一步研究 ONB 表型。使用前 50 个上调的 DEG 作为恶性 NBM 细胞的分类标记,他们进行了半监督聚类,将 23 名 ONB 患者分为三大组(图3b)。第 2 组和第 3 组的特点是分别富集神经和基底特征。然而,根据 NBM 特征的表达对样本进行分类显示一组肿瘤仅含有间充质特征。这些样本还使用 NBM 前 50 个基因集作为半监督聚类的标记,分为三个聚类,类似于衍生队列中的三类类别。最终,由于 ONB 的这种未表征亚型富含间充质基因标记,因此归类为间充质。
将 scRNA-seq 分析建立的 NBM 评分系统投影到 RNA-seq 样本上(图3b)。衍生队列中 NBM 评分的表达模式与 scRNA-seq 三元图中观察到的三部分结构相似。他们注意到大多数基础 ONB 样本的神经和间充质评分较高,一些神经亚型患者的间充质评分也很高。然而,在间充质 ONB 病例中,肿瘤仅表现出高间充质表达。这一发现表明,这种独特的 ONB 亚型的特点是神经-基底特征的双阴性表达。这些结果也增加了他们对经典的神经-基底二元分类的认识,因为确定基底亚型优先于神经亚型。
为了进一步验证在蛋白质表达水平上的发现,他们对由 30 名患者组成的 ONB 队列进行了免疫组织化学 (IHC),以评估代表 NBM 亚型的生物标志物的蛋白质组表达(图3c)。通过结合公开文献里的标志物和本研究 scRNA-seq 分析中上调排名前 50 位的 NBM 分类基因,分别选择 Ki-67和 CHG(包括 CHGA 和 CHGB)作为基底 ONB 和神经 ONB 的标记。综合考虑肿瘤组织特异性、生物学意义和蛋白质组表达水平,从间充质 ONB 上调排名前 50 位的 DEG 中选出了编码结缔组织生长因子 (CTGF) 的 CCN2 。基底组具有高比例的 Ki-67 表达 (≥25%),而神经组则普遍表现出高水平的 CHG。他们通过识别少数既没有阳性 CHG 表达也没有高 Ki-67% 水平但肿瘤细胞中普遍表达 CTGF / CCN2的病例,证实了间充质 ONB 的存在,这与scRNA-seq 和RNA-seq 结果一致(图3d)。
基于以上发现,并通过三个表达平台(包括 scRNA-seq、RNA-seq 和 IHC 定量分析)验证,他们建立了一个流程图,使用一种适用于临床实践的方法将 30 个 ONB 样本分为三个亚型。首先根据高 Ki-67 水平对肿瘤进行分类(如果 Ki-67 ≥ 25%,则为基底亚型),然后根据神经生物标志物 CHG 的普遍阳性表达(如果CHG 的H评分≥ 75,则为神经亚型),然后根据其仅高表达 CTGF / CCN2进行分类(如果 Ki-67 < 25%, CHG 的H评分< 75 和CTGF / CCN2的H评分 ≥ 75,则为间质亚型)。这些研究结果表明 ONB 亚型与肿瘤的分化状态之间可能存在相关性。 Hyams 分级反映间充质、神经及基底 ONB 呈依次增加的去分化趋势(图3e)。按 NBM 亚型分层的无病生存分析也显示,不同亚型 ONB 的预后结果存在统计学差异,其中间充质亚型的生存结果最为乐观(图3f)。
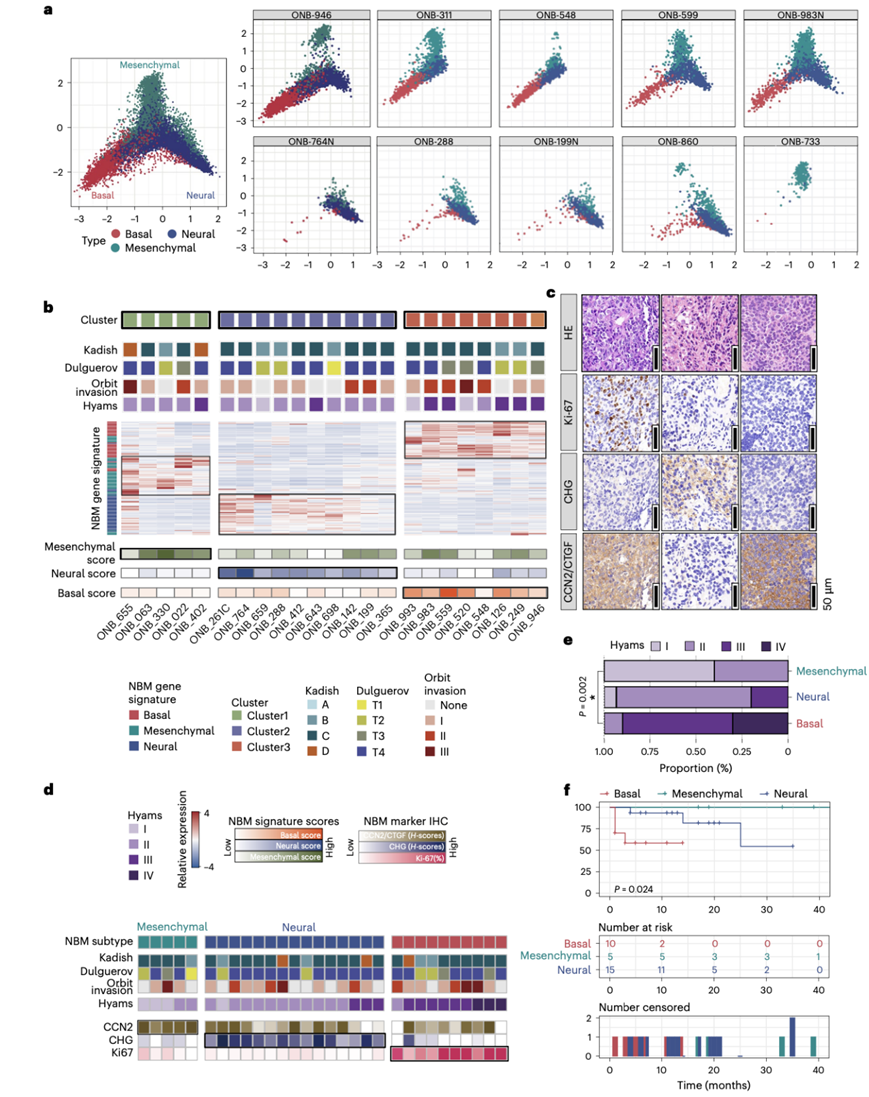
图3. 基于scRNA-seq分析的三种ONB亚型的特征。
(a) 三元图描绘了ONB的每个恶性单细胞的NBM评分和来自10个ONB样本的恶性上皮细胞的NBM评分。(b) 将scRNA-seq NBM恶性特征投射到分层的23例ONB样本中。(c) ONB样本的代表性IHC图像。(d) 基于IHC评分对30例有石蜡切片标本的ONB患者进行亚组预测。(e) 条形图显示根据 IHC 评分进行亚组预测的肿瘤组之间 Hyams 等级值分布的比较。 (f) 30 名患者的 ONB 队列总生存曲线,按根据 IHC 评分预测进行分类的 NBM 肿瘤组分层。
04
来自嗅觉谱系的ONB亚型的细胞起源
已知 OM 在成年期保持持续神经发生的能力,这是由球状基底细胞 (GBC) 的持续增殖和分化维持的。OM 还保留了在严重损伤后通过条件性激活水平基底细胞 (HBC) 再生的能力,并且几乎所有的嗅觉细胞谱系都可以重建。因此,他们首先使用成人 OM (GSE139522) 的 scRNA-seq 数据集研究了正常嗅觉谱系的亚聚类,以进一步分析 ONB 亚型的假定细胞来源,并获得了 11348 个细胞,包括成人嗅觉上皮的细胞成分。根据人类和鼠 OM 的多个已知标记基因分配细胞类型。鉴定出六个与嗅觉干细胞谱系相对应的聚类,包括 HBC(TP63、KRT5)、GBC(ASCL1、HES6)、支持细胞(CXCL17、CYP2J2)、未成熟和成熟神经元亚群(iORN 和 mORN;GNG8、GNG13)和直接神经元前体(INP;LHX2、NEUROD1)。针对这些细胞进行的第二轮聚类产生了 HBC、GBC、嗅觉神经元细胞(INP、iORN 和 mORN)和两个由未成熟和成熟聚类组成的支持谱系,这些聚类由嗅觉上皮发育的典型标志物定义(图4a-b)。轨迹分析显示了一种二分结构,其中维持细胞通过从 HBC 直接命运转换而发育,而神经元谱系则通过 GBC 和 INP 祖细胞的增殖而扩增,类似于在小鼠 OM 中观察到的发育路径(图4c)。
接下来,为了寻找 ONB 亚型的不同起源,他们比较了 NBM 亚群和成体嗅上皮细胞之间的转录组谱,发现 GBC 表达基础亚型特征,而嗅觉神经元谱系(INP、iORN 和 mORN)富含神经亚型特征。出乎意料的是,在支持谱系中观察到了间充质亚型特征,这证实了评估嗅觉谱系中 NBM 特征表达分数的结果(图4d)。Pearson相关系数表明恶性基底细胞类似于 GBC,并揭示了神经亚群与从 INP 到 iORN 再到 mORN 的神经元嗅觉谱系之间的联系,同时也说明了间充质亚群与支持谱系之间的相似性,特别是包括 HBC 和两个支持聚类,它们是 HBC 的直接分化产物,不需要细胞分裂(图4d)。
为了证明正常嗅觉谱系和恶性 ONB 细胞之间的转录差异,他们进行了差异表达分析,比较了恶性 NBM 亚群及其相应的疑似正常细胞来源(图4e)。与正常嗅觉上皮细胞相比,ONB 细胞的主要特征是与神经发生和肿瘤促进相关的标志物的表达上调,包括TUBB3、HES6、VIM和NME2。这些发现表明,虽然正常嗅觉谱系和 ONB 肿瘤细胞之间存在明显的发育关系,但癌细胞已经获得了支持恶性转化的独特表达模式。例如,通过 IHC 染色证实 30 名 ONB 患者中有 28 名强烈表达 TUJI/ TUBB3 (长春新碱耐药标志物),而 12 名鼻窦黑色素瘤患者中有 10 名表达 TUJ1/ TUBB3较低,其中包括一名在术前病理诊断中误诊为 ONB 的患者。这些结果可能有助于发现这种不寻常病理的治疗靶点和诊断标志物。他们将正常嗅觉谱系 (OM2) 与样本 ONB-311 中的恶性细胞整合在一起,并进行了伪时间分析,结果显示 HBC 呈现出双分支分化轨迹,一个分支代表嗅觉神经发生的正常发育,另一个分支主要由 ONB 肿瘤细胞组成(图4f),增殖表达的细胞位于发育轨迹的分叉点。这些结果在单细胞分辨率下证实了 ONB 与正常嗅觉上皮之间的发育关系。然后,他们探索了 ONB 恶性转变背后的可塑性和转录特征。肿瘤细胞表现出与 EMT(VIM和TWIST)、血管生成(VEGFA)和 NOTCH 通路相关的分子的高表达水平,而EPCAM的表达降低。ERCC1 (非小细胞肺癌顺铂耐药标志物)和NME2 (5-FU 耐药标志物)表达的增加揭示了可能有助于治疗决策的潜在靶点(图4g)。热图显示了嗅觉发育轨迹和向 ONB 恶性转变的动态表达变化。与正常嗅觉上皮相比,肿瘤细胞表现出血液凝固伤口愈合、P53类介质、泛素蛋白转移酶活性和WNT信号等信号通路的富集(图4h)。
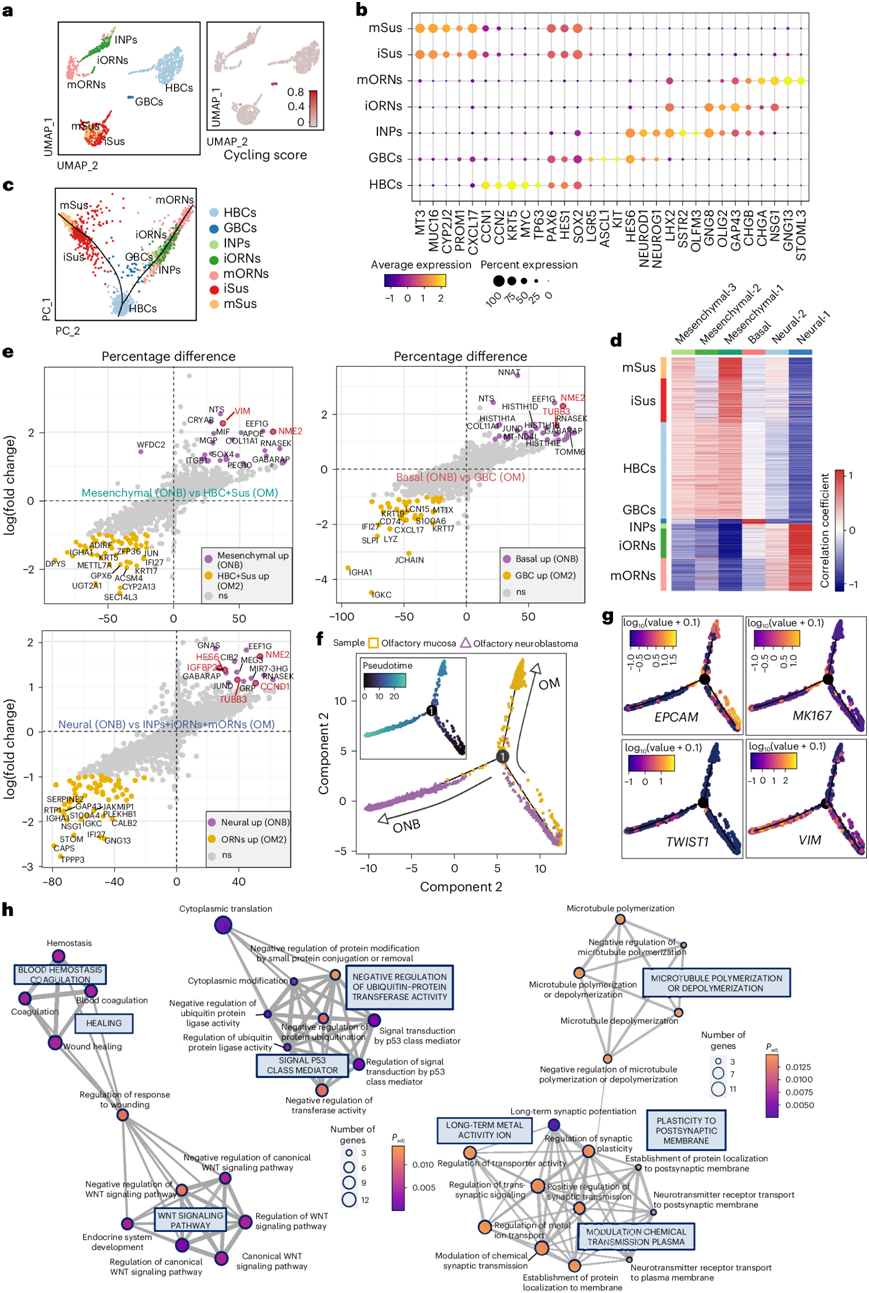
图4. 探索嗅觉上皮谱系和 ONB 恶性细胞之间的相似性和转录多样性。
(a) UMAP可视化。(b) 嗅觉神经元和支持谱系标记表达水平的点图。(c) 基于 Slingshot 预测的主成分分析的基因表达谱的二维表示。(d) 热图显示恶性 ONB 亚群(列)和嗅觉上皮细胞(行)之间表达谱的 Pearson 相关性。(e) 散点图显示 NBM 肿瘤细胞和与这些恶性亚型对应的嗅觉上皮亚聚类之间的 DEG。(f) 伪时间轨迹分析。(g) 来自 ONB-311 的嗅觉上皮细胞和恶性细胞的发育轨迹。(h)网络分析。
05
ONB TME 中 T 细胞亚群的多样性和动态
众所周知,肿瘤浸润 T 细胞 (TIL) 在 TME 中起着核心作用,主导着免疫治疗相关反应等关键临床特性。自然杀伤细胞和 T 细胞的重新聚类揭示了三大分类,包括五个 CD4 + T 细胞亚聚类、五个 CD8 + T 细胞亚聚类、两个自然杀伤细胞亚聚类和一个由低质量细胞组成的未定义亚群(图5a)。他们发现 CD8-GZMH、CD8-PDCD1 和 NK-FGFBP2 细胞主要分布在 TME 中(图5a)。根据已报道的 T 细胞功能相关基因集(图5b)他们注释了几组 CD8 + T 细胞(GZMH 效应细胞、GZMK 效应记忆细胞、ZNF683 驻留记忆细胞和 PDCD1 耗竭细胞)、常规 CD4 + T 细胞(CCR7 幼稚细胞、IL7R 中央记忆细胞和 IL21 滤泡辅助细胞)以及 FOXP3 静息细胞和 CTLA4 免疫抑制 CD4 +调节性 T 细胞(Treg)群的身份。
伪时间轨迹分析揭示了 CD4 +和 CD8 + T 细胞分化的二分结构,这反映了先前研究提出的 T 细胞发育动力学的经典观点(图5c -d)。他们在 ONB 样本中鉴定了效应记忆(CD8-GZMK)T 细胞,其呈现出功能障碍前状态,特征是 GZMK 高表达以及PDCD1和LAG3中等表达。推断轨迹末端耗竭的 CD8-PDCD1-T EX细胞具有最高的伪时间得分,它们作为活化 T 细胞表现出稀释的细胞毒性,这表明 ONB 中的肿瘤免疫反应诱导的功能障碍(图5d)。伪热图进一步显示了ONB中CD8 + T细胞表达模式的转变,除了免疫抑制受体(LAG3 、 CTLA4和PDCD1)外,耗竭的CD8+ T细胞还表达促血管生成(HIF1A)和免疫调节(TIGIT)特征。
CD4 + T 细胞的分支发育轨迹始于幼稚 CD4 + T 细胞(CD4-CCR7-TN),并分为滤泡辅助T 细胞(CD4-IL21-TFH)或免疫调节表型(Treg-FOXP3-静息和 Treg-CTLA4-抑制)(图5e)。CTLA4 抑制性 T reg细胞代表一个成熟的亚聚类,具有最低的幼稚度和最高的 T reg细胞评分(图5f)。CTLA4、LAYN、BATF 和 TNFRSF 等免疫抑制和共刺激特征的表达谱不断增加,反映了 ONB 中 Treg细胞的逐渐激活。
他们比较了肿瘤浸润性 T 细胞和正常组织来源的 T 细胞中CD8+的细胞毒性和耗竭评分以及CD4+ T 细胞的幼稚和 Treg细胞评分(图5g)。来自 ONB 肿瘤的基底和神经亚型的 TIL 表现出较高的细胞毒性评分,而来自基底亚型的 TIL 仅表现出较高的耗竭评分,这表明患有基底亚型 ONB 的患者可能对免疫检查点抑制剂有更好的反应。
进行 SCENIC 分析以研究不同 T 细胞亚型之间的转录网络(图5h)。据报道,IRF9可诱导PDCD1和ETV1(靶向耗竭标志物TOX),这些转录因子在耗竭 T 细胞亚群中具有高度调控子特异性,这表明这些转录因子的潜在作用是触发 CD8+ T 细胞向耗竭状态的转变。他们还观察到CD4-IL21-TFH细胞中NFATC1的转录活性升高,据报道 NFATC1 可调节 PD-1 表达,这表明 TFH 细胞可能协助 ONB 中的 T 细胞功能障碍。
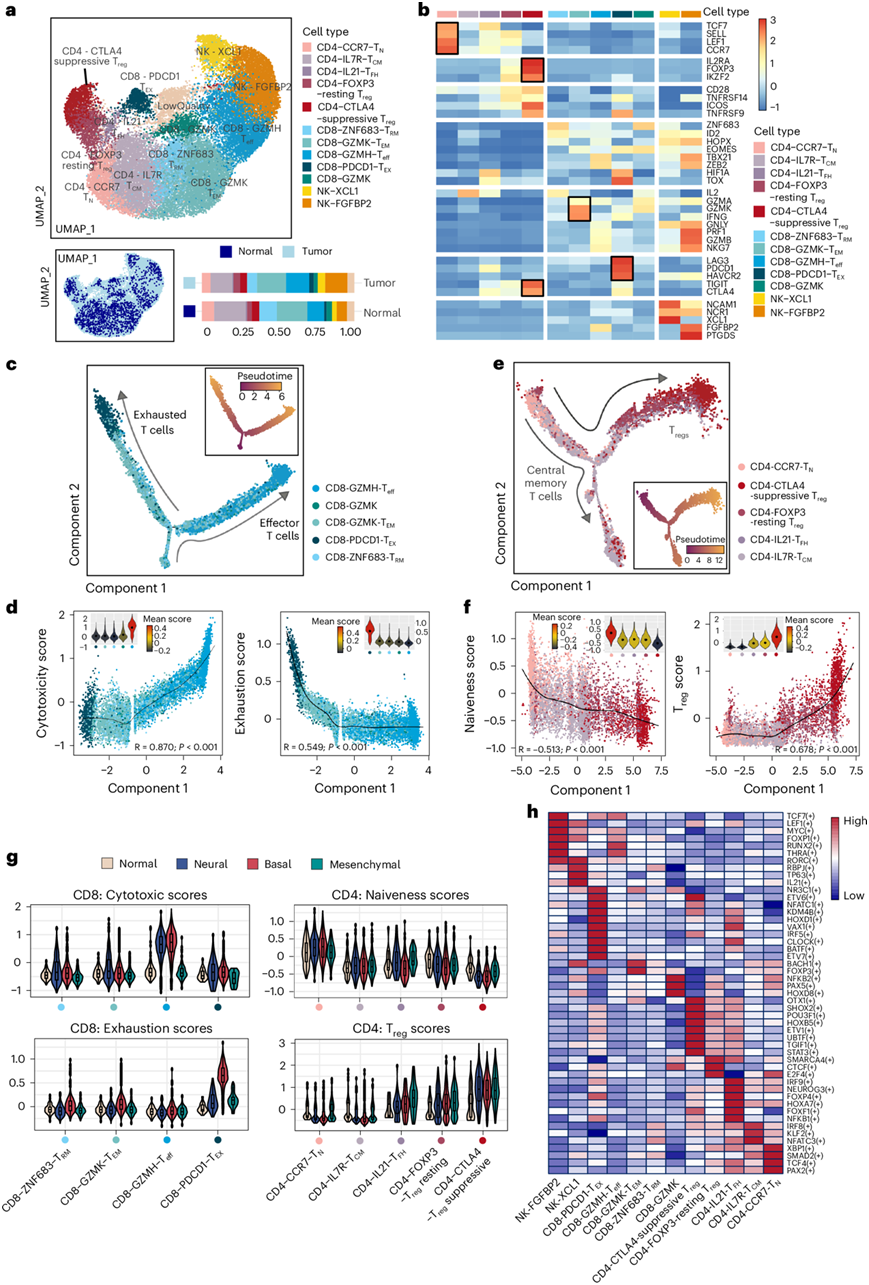
图5. ONB TME中不同功能状态和T细胞亚型的鉴定。
(a) UMAP可视化显示了五种CD4和五种CD8 T细胞亚型和两种NK细胞亚型的形成。(b) 每个T细胞聚类中选定功能相关基因的Z-score标准化平均表达。(c) 推断CD8+ T细胞的分化轨迹。(d) 描绘了沿Monocle2组分CD8 T细胞功能特征(耗竭和细胞毒性评分)的不同表达水平的示踪图。(e) 推断CD4+ T细胞分化轨迹。(f) CD4+ T细胞功能特征表达水平变化的示踪图。(g) 四个CD8+ T细胞亚群的衰竭评分和细胞毒性评分的分布,以及按组织来源分层的五个CD4+ T细胞亚群评分和Treg评分的分布。(h) 热图显示转录因子(TF)在每种T/NK细胞亚型中的活性。
06
肿瘤相关髓系细胞表型
为了描述 ONB 中肿瘤浸润性髓系的多样性,他们对 14951 个髓系细胞进行亚聚类,分为 5 类,包括 14 个亚群,基于经典髓系标志物注释为肥大细胞(Mast-CPA3)、树突状细胞(DC-CD1C、DC-CLEC9A、DC-LAMP3)、巨噬细胞(Macro-C1QA、Macro-CD163、Macro-GPNMB、Macro-RGS1、Macro-SPP1)和中性粒细胞(Neu-CSF3R、IFN 反应)(图6a-b)。不同髓系亚群的细胞比例在正常嗅觉和 ONB 肿瘤组织来源之间表现出差异(图6a)。 GSVA揭示了肿瘤相关巨噬细胞(TAM)的多种功能作用,包括Macro-C1QA中的补体激活、Macro-RGS1中的抗原呈递和免疫细胞募集以及Macro-SPP1中缺氧、血管生成和细胞外基质形成相关通路的上调,表明组织重塑和促血管生成活性与肿瘤促进有关。
巨噬细胞的经典和替代激活,即M1和M2细胞的极化,长期以来以不同的转录组模式为特征。在Macro-RGS1和Macro-SPP1亚聚类中分别观察到M1和M2特征的高水平表达,而大多数巨噬细胞显示M1和M2评分增加,没有明显的偏好,表明M1-M2激活状态耦合(图6c)。Pearson相关性分析显示吞噬作用和血管生成评分之间呈显著负相关(图6c)。此外,轨迹分析显示吞噬和促血管生成表型之间存在不同的分化状态,来自正常OM的巨噬细胞主要位于吞噬作用的分化分支(图6d)。有人认为 Macro-C1QA 具有吞噬聚类的功能,具有终末分化状态和增强的吞噬功能表达,而 Macro-SPP1 是 ONB 中的典型 TAM 亚组,主要来源于肿瘤组织,且富含血管生成和免疫抑制功能调节因子,以 VEGFA 和 SPP1 为标志(图6e)。他们发现ONB 来源的巨噬细胞中S100A4表达升高(图6d),最近已发现 S100A4 可增强 TAM 38中的促肿瘤 (M2) 极化。免疫荧光测定证实了 ONB 微环境中存在 S100A4+和 VEGFA+ TAM(图6f),表明 M2 耐受性和促血管生成功能状态存在重叠。根据本研究中的 NBM 分类,巨噬细胞根据不同的样本亚型(正常 OM 和 NBM 亚型)分为四组。来自肿瘤样本的巨噬细胞的 M1 和 M2 评分以及吞噬作用和血管生成评分均高于来自正常 OM 的巨噬细胞。值得注意的是,来自基底 ONB 的巨噬细胞表现出吞噬活化水平较低和促血管生成标志物表达升高的趋势。
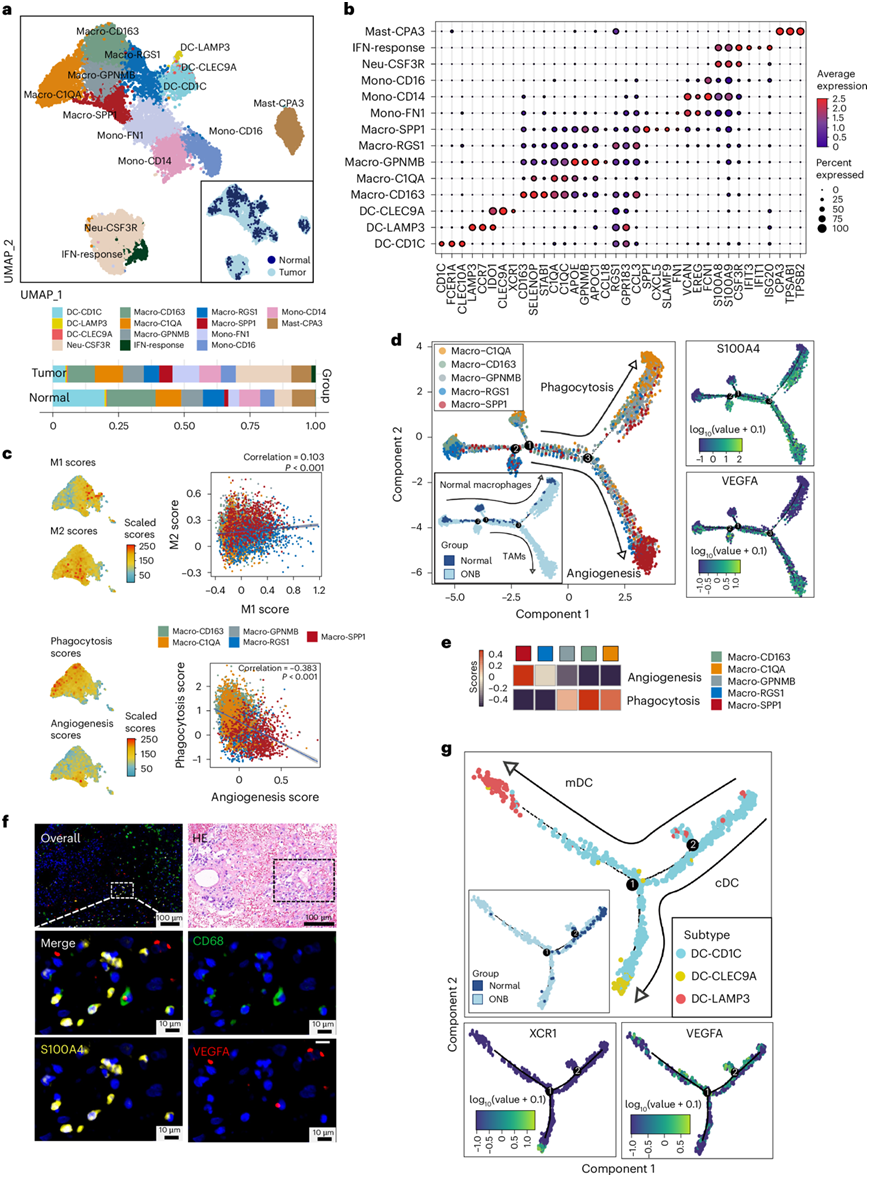
图6. ONB TME中骨髓细胞的多种功能和亚群的特征。
(a) UMA P可视化。(b) 标记基因在14个髓细胞亚群中的表达水平。(c) UMAP图显示巨噬细胞的M1和M2评分水平,吞噬和血管生成评分,Pearson相关性的散点图。(d) 推断巨噬细胞的发育轨迹。(e) 热图显示ONB巨噬细胞亚群中吞噬相关和血管生成相关特征基因的不同表达模式。(f) ONB组织巨噬细胞特征蛋白的免疫荧光染色。(g) 树突状细胞(DC)的发育轨迹。
07
ONB 中基质细胞谱系的细胞异质性
为了描述 ONB TME 中基质谱系的细胞异质性,总共提取了 11698 个基质细胞进行重新聚类并注释为内皮细胞(用PECAM1和PLVAP标记),分为五个亚组和 3246 个成纤维细胞(COL1A1、COL1A2),由四个亚聚类组成(图7a-b)。已知内皮细胞与肿瘤的生长和进展有关,并且在已发表的研究中报道了由独特标记标记的亚群(图7c)。
成纤维细胞长期以来在促进TME中的肿瘤发生中具有重要作用。Fibro_c01 细胞在癌症相关成纤维细胞 (CAF) 中占较大比例,而 Fibro_c04 细胞仅存在于肿瘤基质中(图7a)。通过研究每个成纤维细胞亚聚类中功能分子的表达模式,Fibro_c01 聚类表现出活化 CAF 的多种特征,包括炎性 CAF(DLK1、C5AR2和MME)(图7d)和肌成纤维细胞 CAF(CTHRC1和MMP11)并表现出与单核细胞募集、侵袭和迁移相对应的多能性(图7d)。 Fibro_c04 细胞显示与趋化因子分泌(CXCL1和CXCL8)和抗原呈递(HLA-DRA和HLA-DRB1)相关的分子表达上调。RNA 速度推断的终末发育状态表明 Fibro_c04 细胞可能是由肿瘤发生诱导的 CAF 转化而来,以参与肿瘤免疫反应(图7e)。GSVA 通路分析进一步揭示了 Fibro_c01 聚类的多种作用,包括促血管生成和 EMT,以及 Fibro_c03 中的 MHC-IB 受体活性(图7d)。
正常 OM 和 TME 中的内皮细胞和成纤维细胞亚聚类的基因集富集分析显示,ONB 中的基质细胞的细胞外基质重塑过程和免疫调节以及血管生成增强(图7f)。他们通过 CD34 的 IHC 染色评估了微血管密度 (MVD) 水平,该水平在富含肿瘤的内皮细胞 Endo_c02 和 Endo_c03(图7c)以及标记的微血管中上调(图7g)。与癌旁鼻黏膜相比,肿瘤基质显示出增加的血管化。尽管在 ONB 样本的 NBM 亚型中 MVD 水平仅有轻微的统计学显著差异,但在 Hyams IV ONB 样本中发现 MVD 水平显著下降,表明存在潜在的缺血效应和可能的治疗耐药性,并表明一些分化良好的肿瘤对抗血管生成疗法具有潜在的脆弱性。
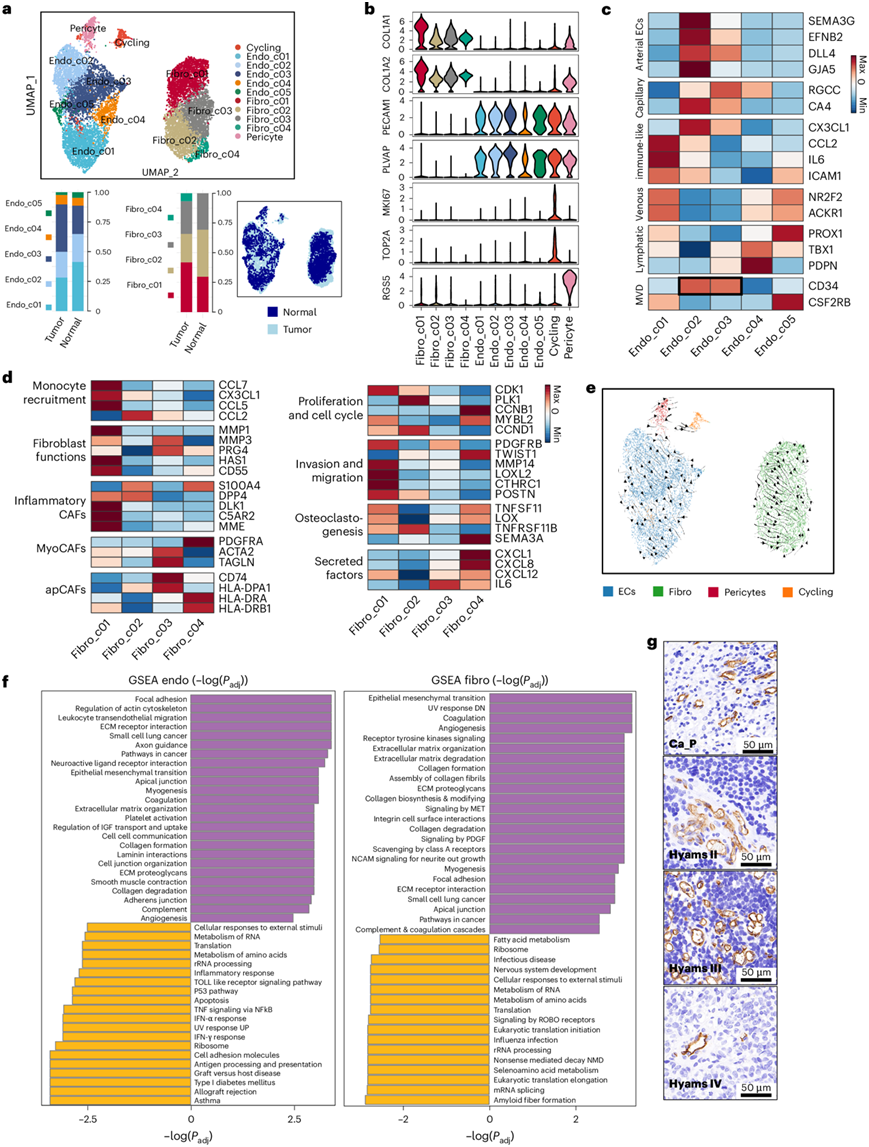
图7. 内皮细胞的细胞异质性和成纤维细胞的动态功能状态。
(a)UMAP可视化。(b) 小提琴图显示ONB TME基质亚群中标记基因的表达水。(c) 热图显示已知内皮细胞(EC)亚型在每个EC亚聚类中的典型标记基因表达水平。(d) 热图显示了四个成纤维细胞亚群中与典型成纤维细胞亚型和基质细胞功能相对应的基因集的表达水平。(e) ONB微环境下基质细胞的RNA速率轨迹。(f) 恶性和非恶性组织源性内皮细胞(左)和成纤维细胞(右)之间基因集富集分析的通路活性差异。(g) 不同Hyams分级的癌周黏膜和ONB肿瘤标本中CD34标记MVD的代表性免疫组化染色图像。
08
参与 ONB 的细胞间相互作用的表征
他们进行了细胞间相互作用分析,以揭示 ONB 中恶性区室、免疫细胞和基质细胞之间复杂的细胞相互作用网络(图8a)。与基底和神经肿瘤细胞相比,恶性间充质细胞与几乎所有 TME 成分都表现出显著的相互作用,尤其是内皮细胞、成纤维细胞和平滑肌细胞。此外,髓样细胞在细胞通讯中起着核心作用(图8b-c)。
因此,他们通过分析肿瘤、髓系细胞和基质细胞之间的相互作用对,探索了肿瘤和 TME 细胞在重塑 ONB 生态系统中的作用。确定了代表致癌途径之间相互作用的细胞间相互作用,包括成纤维细胞生长因子、TGF-β 受体和 WNT、PDGF 和 NOTCH 信号通路。值得注意的是,他们发现了与血管生成相关的活跃分子相互作用,包括网络中的 VEGF 和 VEGFR,尤其是在内皮细胞和恶性细胞之间。
通过评估与趋化因子和 T 细胞共刺激和抑制功能相关的分子对的表达水平,对 T 细胞功能相关的细胞相互作用进行了分析(图8d)。除癌细胞外,髓系细胞尤其是巨噬细胞在调节 T 细胞活化和抑制方面发挥着关键作用。值得注意的是,他们发现 T 细胞和肿瘤细胞之间 FAM3C-PDCD1 表达水平高,而 CD274(PD-L1)-PDCD1 和 PDCD1LG2-PDCD1 表达水平低,这可能是由于转录组水平上 PD-1/PD-L1 表达水平低。
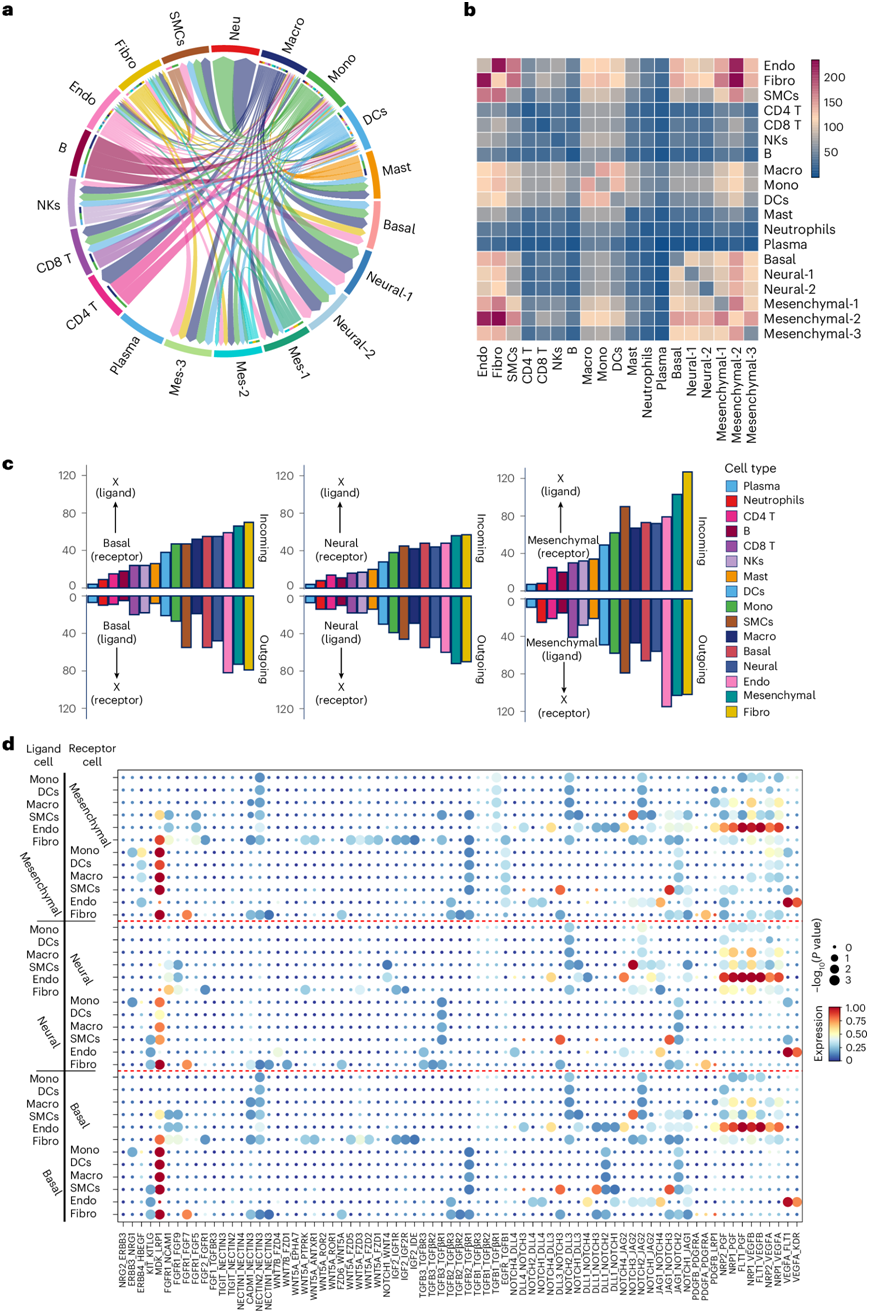
图8. ONB TME细胞间相互作用。
(a) 环状图显示了ONB TME中不同细胞类型之间的细胞间相互作用。(b) 热图显示了CellphoneDB预测的ONB TME中不同细胞类型之间潜在配体-受体对的数量。(c) 条形图描绘了恶性神经细胞、基底细胞和间质ONB细胞和指示细胞类型之间假定的受体-配体相互作用的数量。(d) 点图显示ONB中基质细胞、髓细胞和恶性细胞之间的间充质配体-受体相互作用,按间充质(上)、神经(中)和基底(下)肿瘤亚型分开。
+ + + + + + + + + + +
结 论
本项研究基于单细胞 RNA 谱探索了十个 ONB 肿瘤和一个嗅黏膜样本内的细胞成分,通过识别恶性上皮细胞中的五种独特表达程序展示了肿瘤内的异质性。根据不同的基因表达模式建立了 ONB 的独特三分类系统(神经、基底、间质),阐明了将大量肿瘤分类为未表征亚型的生物标志物,可以根据代表三种肿瘤类型的分子特征谨慎推断对某些化疗方案的不同反应,从而有助于精准化疗。本项研究还分析了肿瘤微环境 (TME) 的亚聚类以及 TME 内不同细胞类型之间的相互作用。免疫抑制肿瘤相关巨噬细胞的相对丰富表明针对巨噬细胞的免疫疗法具有潜在益处。
+ + + + +



 English
English


