文献解读|Nat Commun(14.7):人类胃肠道间质瘤的基因组和转录组图
✦ +
+
论文ID
原名:Genomic and transcriptomic landscape of human gastrointestinal stromal tumors
译名:人类胃肠道间质瘤的基因组和转录组图
期刊:Nature Communications
影响因子:14.7
发表时间:2024.11.03
DOI号:10.1038/s41467-024-53821-1
背 景
胃肠道间质瘤(GIST) 是最常见的肉瘤,通常起源于胃或小肠。大多数 GIST 是由KIT (75–80%) 或PDGFRA (5-10%)中的激活突变引起的。GIST在临床上具有异质性,在个体患者中表现出不同程度的疾病侵袭性,一些低风险病变多年保持稳定,而另一些病变则迅速发展为广泛转移性疾病。揭示导致侵袭性 GIST 发展的分子变化可能为 GIST 生物学和治疗策略提供启示。最近,已有研究利用细胞遗传学方法和全外显子组测序 (WES) 对一小部分 GIST 患者进行了研究,报告了 GIST 中DEPDC5 (17.5%)、DMD (66%)、MAX (32%)、SETD2(11.2% 的高危 GIST)和SDH (9.0%) 10的复发性体细胞变异。目前缺乏对 GIST 的系统性全基因组和转录组研究。
实验设计
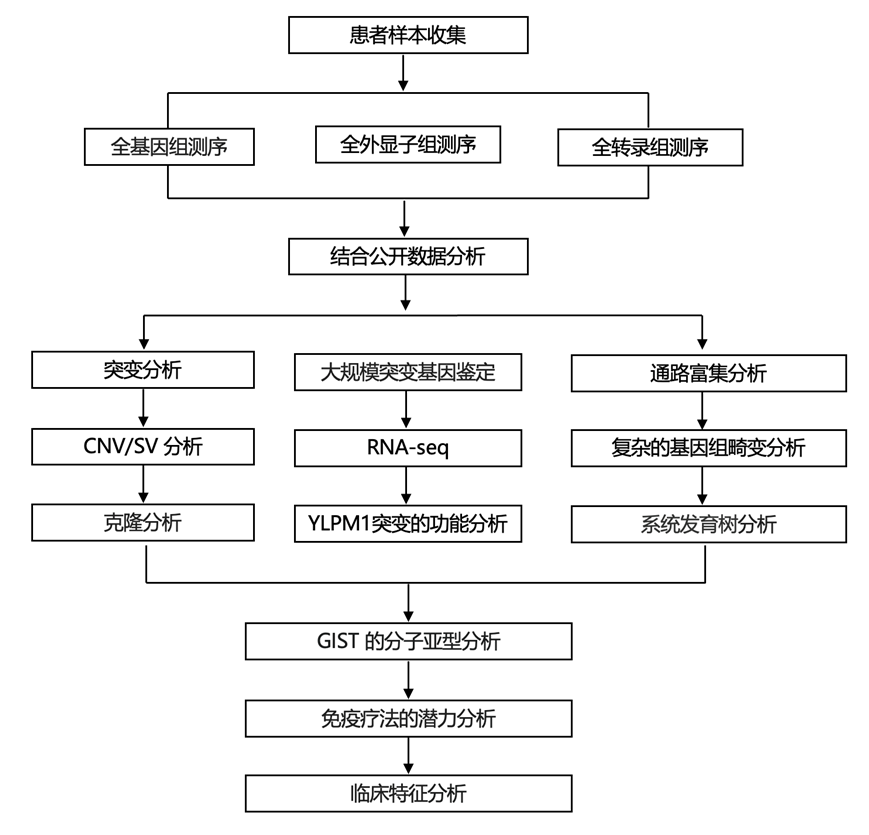
结 果
01
侵袭性胃肠道间质瘤 (GIST) 含有更多基因组畸变
研究团队对 49 名患者的 59 个 GIST 和 49 个匹配正常样本进行了 WES分、全基因组测序 (WGS)和全转录组测序 (WTS)分析。共鉴定出 1729 个编码单核苷酸变异 (SNV) 和小插入/缺失 (indel),涉及 1282 个基因。编码突变率中值为每兆碱基 (Mb) 0.67(范围为 0.15-1.70)(图 1a),与低突变率癌症相当,例如嫌色性肾细胞癌和慢性淋巴细胞白血病。此外,与 TCGA 报告的其他 6 种肉瘤类型相比,GIST 的肿瘤突变负担最低。
与 SNV 和插入/缺失稀少不同,他们观察到 GIST 基因组中拷贝数变异 (CNV) 的负担更高。在整个队列中,总共鉴定出 2126 个拷贝数增加片段和 6246 个拷贝数丢失片段,相当于基因组的平均 19%(范围为 0-78%)(图 1a)。此外,他们检测到 336 个体细胞结构变异 (SV),每个样本的 SV 事件数量范围为 0 到 39(图 1a)。随着风险水平的增加,肿瘤的体细胞编码突变、CNV 和 SV 的总数(或分数)也增加(图 1b-c),表明在 GIST 进展过程中积累了越来越多的改变。基因组复杂性(TMB、CNV 负担)的增加与肿瘤大小和有丝分裂过程呈正相关。此外,克隆分析表明,克隆和亚克隆编码突变在原发性“高风险”GIST和转移性 GIST 中均增加(图 1c),而在高风险/转移性 GIST 中,亚克隆编码突变比克隆编码突变积累更多,表明侵袭性 GIST 更加异质性。
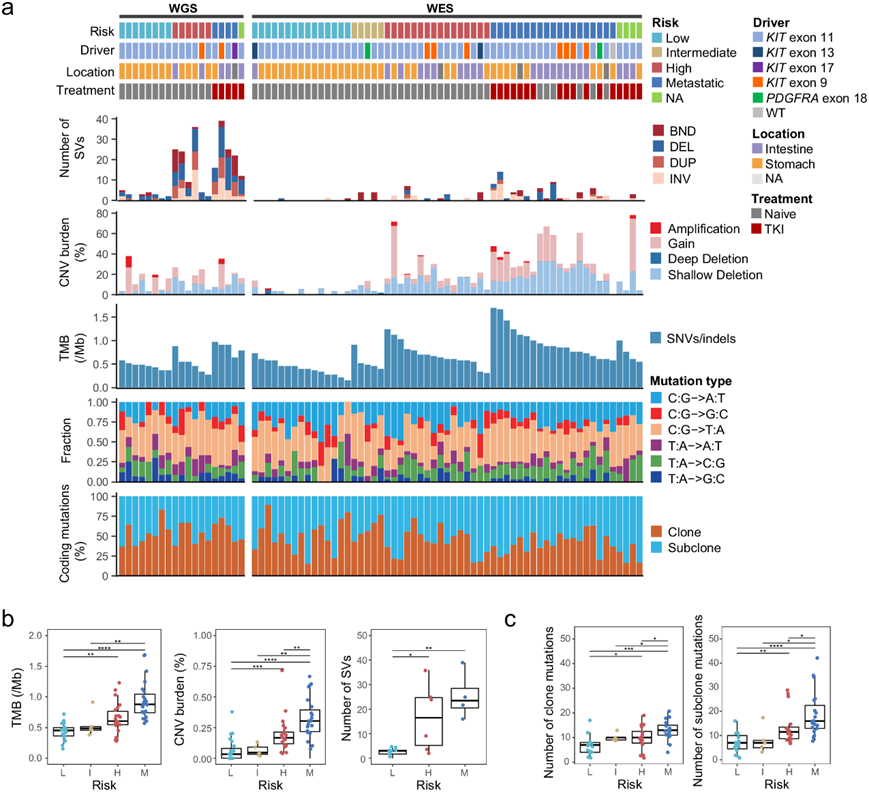
图1. GIST 群体的分子图谱。
(a) 将肿瘤和正常样本配对的患者分为两组:WGS和WES,显示有关临床风险分层、KIT或PDGFRA突变外显子、原发性肿瘤部位和 TKI 治疗信息。(b) 箱线图显示交替负担随着风险分层而增加。(c) 不同风险分层中编码区内克隆(左)和亚克隆(右)突变的数量。
02
鉴定反复突变的基因
在本研究的队列中成功鉴定了已报道的 GIST 驱动基因的功能性改变,包括KIT、PDGFRA、NF1、SDHA、DMD、 RB1、CDKN2A和SETD2(图2a)。然而, MutSigC2V平台预测KIT和YLPM1为显著突变基因。KIT突变主要位于外显子 11、9、13 和 17(图 2a-c)。发现了KIT的一个原发性外显子 9 突变 (A502_Y503insFA) ,该突变具有获得功能特性,对一线和二线 TKI(伊马替尼和舒尼替尼)均敏感。KIT和PDGFRA突变是互斥的(图 2a)。值得注意的是,在本研究队列中,YLPM1 (含 YLP 基序的蛋白 1)是KIT后突变最频繁的基因(图 2a)。所有YLPM1突变都是整个长度的蛋白质截短突变,表明其具有肿瘤抑制因子的潜在作用(图 2c)。在一例KIT/PDGFRA野生型 GIST 中,发现了一个预测有害的SDHA错义突变 (R585Q, NM_004168)(图2a)。SETD2中的所有突变均为失活突变,主要发生在高风险/转移性 GIST 中(图 2a)。他们在一例高风险 GIST 中发现了一个预测有害的错义突变(图 2a)。
除了这些已验证的GIST驱动基因外,他们还鉴定了5个反复突变的基因(≥3例),包括RYR2(6%)、ARID1A(4%)、KIAA1109(4%)、CENPF(4%)和DNAH11(4%)。ARID1A已列入癌症基因普查(CGC v90)。所有ARID1A突变都是截短的(移码突变或无义突变),显示出潜在的肿瘤抑制作用(图2a)。这些数据表明,GIST在突变水平上表现出相当大的异质性,可能是由KIT / PDGFRA突变引起的。GO分析显示,这些突变基因在7个生物学过程中富集:蛋白质磷酸化(KIT、PDGFRA和NF1)、染色体组织(YLPM1、ARID1A和SETD2)、稳态过程(RYR2)、细胞分化调节(KIAA1109)、水解酶活性调节(DEPDC5)和细胞周期(RB1和CENPF),表明这些生物学过程的异常参与了GIST的发病机制(图 2a)。
为了深入了解GIST的病因和突变过程,他们试图破译体细胞突变目录中的突变特征。当仅包括编码区时,WGS和WES之间96个突变类别的突变谱显示出高度相关性,这反映了不同测序平台和亚组之间的一致性。当包括非编码突变时,相关性显著下降,C>A颠换突变减少,而T>C和T>A突变增加。这些结果表明编码区和非编码区的突变过程不同。有趣的是,KIT的突变谱(主要是T>A、T>C)占所有编码SNV的3.7%,与整个突变目录的分布(C>T、C>A)完全不同(图 2d)。KIT的 T > A 突变主要在 GpTpT 背景下富集,这可能与特定的诱变过程有关。
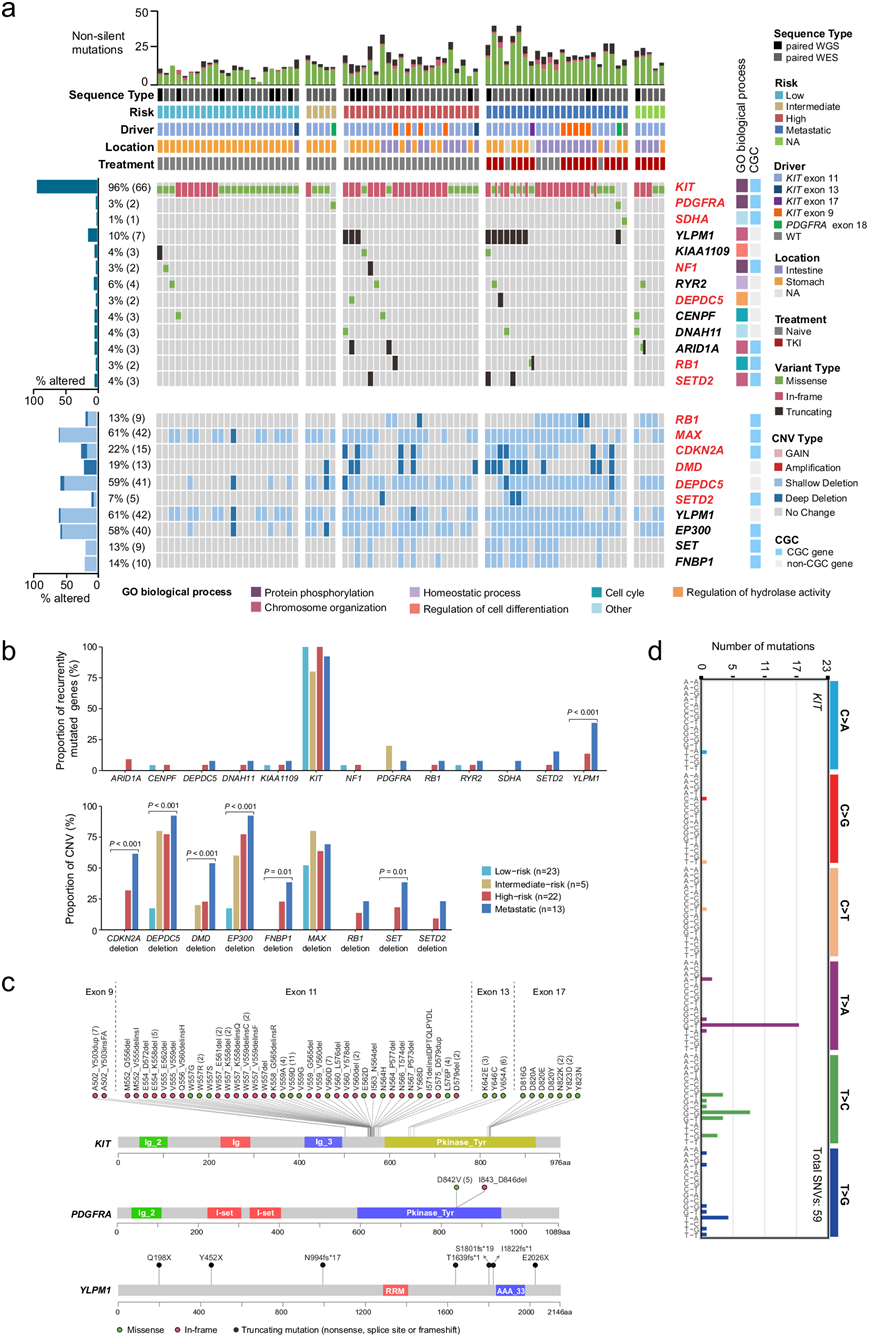
图2. 78 个 GIST 中的基因组改变情况。
(a) 78 个 GIST 的临床和基因组改变的综合图。(b) 条形图说明不同风险下复发性突变基因和拷贝数变异的相对比例。(c) Lollipop图显示KIT、PDGFRA和YLPM1中所有非沉默突变的分布。(d) GIST中KIT突变的96突变谱。
03
GIST中YLPM1失活
在WES/WGS队列中通过Sanger测序验证了体细胞YLPM1纯合突变(SNVs和缺失),通过基因组定量PCR验证了体细胞YLPM1纯合缺失,并通过IGV推断了缺失区域(外显子1 ~ 4)。YLPM1突变在胃 GIST 中更为常见。当 YLPM1失活突变存在于原发性肿瘤中时,它会在随后的转移性 GIST 中持续存在(图3a)并且当存在于任何转移性病变中时,也会在同一患者的其他转移瘤中检测到。在 68 名患者中的 42 名 (61%) 检测到 YLPM1 CNV(图2a)。14q 染色体杂合缺失是 GIST 中最常见的基因组事件之一。人类YLPM1位于 14q24。14q 染色体杂合缺失可能是造成频繁缺失的原因。在9 名患者中 (13%) 发现了纯合YLPM1突变和缺失(图 2a)。YLPM1的基因组改变与端粒长度相关,这与先前的研究一致,即 YLPM1 参与端粒维持。在 TCGA Pan-Cancer Atlas 计划中,253 个非 GIST 肉瘤(3%)和 10953 个泛癌症(3%)中仅偶尔观察到基因组YLPM1畸变,显著低于 GIST 中的频率,表明YLPM1失活选择性地发生在 GIST 中。
他们进一步通过免疫印迹法在 64 例患者的 73 个 GIST 中分析了 YLPM1 在蛋白质水平上的失活频率。无论是否有KIT或PDGFRA突变,64 名患者中 31 名(48%)均证实 YLPM1 蛋白丢失(图 3b)。32% YLPM1 表达缺失患者归类为低风险或中等风险(图 3b-c)。然后,他们进行了免疫组织化学检测以验证 YLPM1 蛋白表达缺失的频率。组织微阵列验证队列中 47%的 GIST 为 YLPM1 表达阴性,其中包括 75 个低风险或中等风险(图 3e),这表明 YLPM1 失活可能是 GIST 发病机制中的早期事件。YLPM1的基因组改变与蛋白质表达相关。鉴于YLPM1 在蛋白质水平上的失活频率高于在基因组水平上的失活频率,他们检测了启动子高甲基化是否导致YLPM1失活。WTS 数据和 DNA 甲基化研究表明,DNA 甲基化失调在 GIST 中 YLPM1 表达调节中并不常见。在 GIST 中也发现了类似的高频率的 DMD 蛋白质丢失和相对较低的DMD基因组变化频率,表明 GIST 中存在非基因组失活机制。非基因组机制(例如转录后修饰)是否导致低风险 GIST 中的 YLPM1 蛋白质丢失值得进一步研究。
利用多种GIST模型研究了YLPM1的生物学功能。他们使用CRISPR/Cas9系统从保留YLPM1表达的GIST-T1细胞中建立了YLPM1敲除(KO)细胞。YLPM1 敲除促进了短期和长期测定中的细胞生长和增殖。相反,在YLPM1KO 同源 GIST-T1 细胞 (GIST-T1YLPM1 KO) 中重新表达 YLPM1 会降低活细胞数量(图 3 f-g)和增殖特性(图 3 h-i)。
为了确定 GIST 中 YLPM1 失活调控的整体基因表达模式,他们对配对细胞系[YLPM1 敲除(KO) 的 GIST-T1 YLPM1 KO, YLPM1 恢复的 GIST-T1YLPM1 KO)进行了转录组分析(RNA-seq)。基因集富集分析 (GSEA) 显示,细胞周期相关基因,包括有丝分裂纺锤体基因,在GIST-T1YLPM1 KO 细胞中上调,而凋亡相关基因在 YLPM1 恢复的 GIST-T1YLPM1 KO细胞中正向富集(图 3m)。与干扰素反应相关的免疫基因在 KO 组中下调。这些结果表明 YLPM1 可能在 GIST 的免疫调节中发挥作用。鉴于 KIT 通路在 GIST 肿瘤发生中的关键作用,他们进一步探索 YLPM1 是否调节致癌 KIT 通路。YLPM1 不调节 KIT 通路,也不调节 GIST 对 KIT 抑制剂的敏感性。他们在裸鼠中生成了 4 个异种移植模型,体内实验表明,YLPM1KO 在一定程度上促进了肿瘤生长,而 YLPM1 恢复明显减弱了肿瘤生长,尽管肿瘤含有致癌KIT突变(图3j-l)。总之,这些结果表明 YLPM1 失活促进了 GIST 增殖和生长。
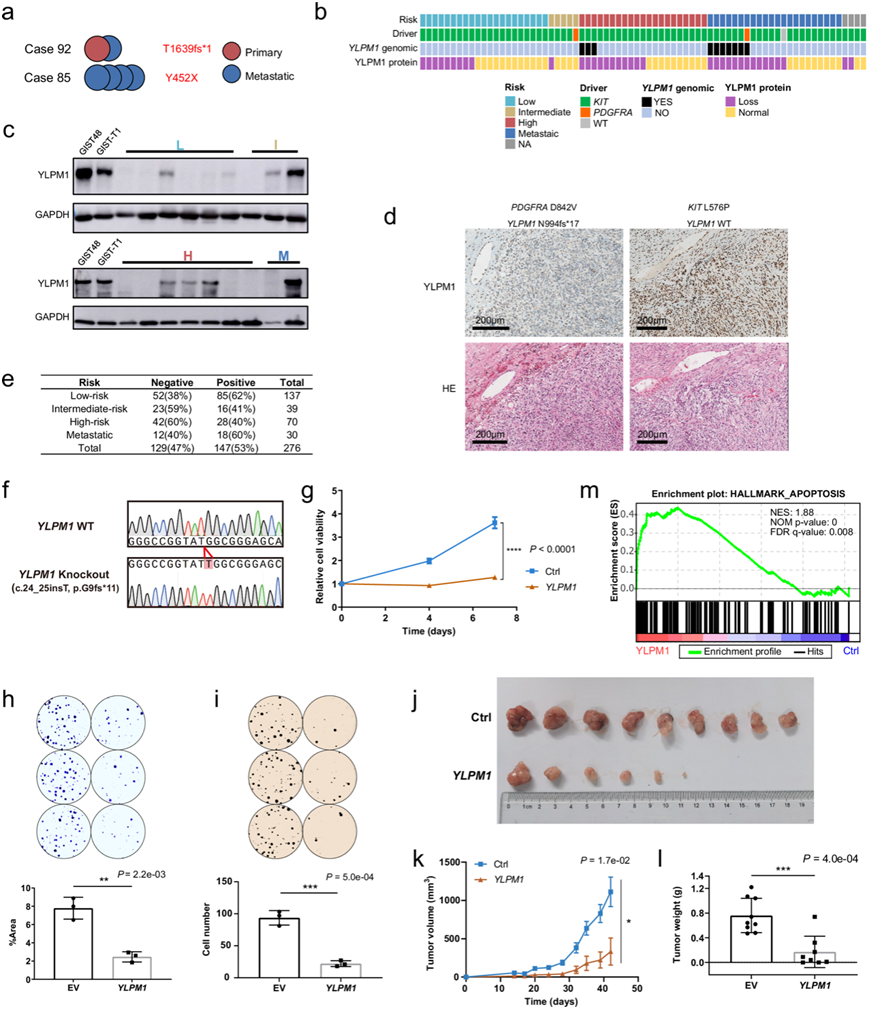
图3. YLPM1失活在GIST中的频率较高,且YLPM1失活在体内和体外促进肿瘤的生长和增殖。
(a) 来自同一患者的多个肿瘤具有相同的YLPM1突变。(b) 73 个 GIST 中的 YLPM1 基因组和蛋白质畸变总结。(c) 免疫印迹分析。(d)免疫组织化学(IHC)分析。(e) 通过IHC评估的组织微阵列验证队列中的 YLPM1 表达总结。(f-m) YLPM1 的恢复抑制了YLPM1失活 GIST中的肿瘤生长和增殖。
04
胃肠道间质瘤中普遍存在的拷贝数变异
为了识别 GIST 中的 CNV 标记,他们提取了 GIST 中 CNV 的拷贝数、片段大小和杂合状态的 CNV 标记,并识别了 8 个 CNV 标记,其中 COSMIC_CN1 和 COSMIC_CN9 存在于超过 50% 的 GIST 中。COSMIC_CN1 的特征是杂合片段,总拷贝数 (TCN) 为 2,大小超过 40 Mb,而 COSMIC_CN9 具有二倍体背景下染色体不稳定性的特征,在转移性 GIST 中表现出升高的水平。接下来,他们尝试使用癌症重要靶点的基因组识别 (GISTIC) 2.0 算法来分析复发的 CNV 事件。在臂级 CNV 中,22q(57%)、1p(39%)、9q(26%)、9p(23%)和 13q(20%)的缺失以及 19q(21%)和 20q(22%)的扩增更常见于转移性 GIST(图 4a)。
在局部 CNV 中,共检测到 15 个峰区域(涉及 211 个基因),缺失明显多于扩增(图 4b)。复发性缺失包括几个已知的肿瘤抑制基因(CDKN2A、DEPDC5和DMD),这些基因主要发生在高风险或转移性 GIST 中(图4b)。局部 CNV 峰中的其他癌基因包括SET和FNBP1(9q34.11 缺失),也在高风险或转移性 GIST 中富集。
由于拷贝数的增加和丢失往往伴随着基因表达的相应变化,他们进一步通过 MVisAGe 32推断了 CNV 与 mRNA 表达 (CN/GE) 之间的 Pearson 相关系数。许多在广泛和局灶区域内的基因在转移性 GIST 中表现出比在原发性 GIST 中更高的相关性(图 4c)。观察到几个众所周知的 GIST 驱动因素具有较高的 CN/GE 相关性(图 4d),例如CDKN2A、DEPDC5和SETD2。FNBP1、EP300及其周围基因均显示出适度的 CN/GE 相关性(图 4d)。
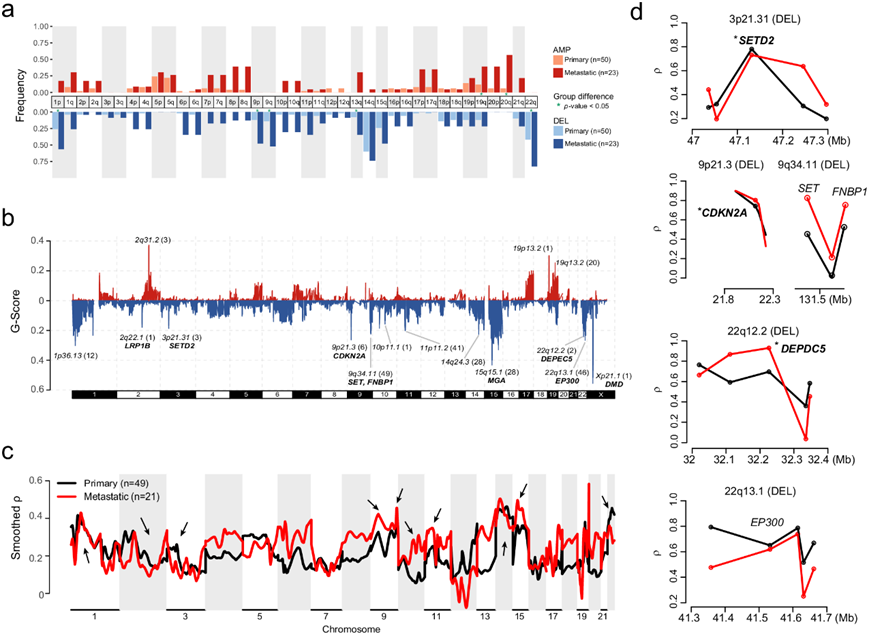
图4. 基因组失衡。
(a) 73 个 GIST 的不同风险分层中染色体臂水平的 CNV 频率。(b) GISTIC 2.0 检测到的 1-22 和X染色体上的局部水平拷贝数增加和丢失。(c)不同风险组中 CNV 和基因表达的定量检测之间的关联。
05
染色体碎裂事件发生于侵袭性胃肠道间质瘤
他们接下来扫描了19个GIST的WGS数据中的基因组,以寻找GIST中很少报道的两种复杂畸变:(1)染色体碎裂,其中大量断裂的片段同时发生,聚集在一条或几条染色体上,随机地将得到的碎片缝合在一起,导致2个或有时3个状态之间连续的拷贝数振荡;(2) kataegis:一种在短距离内识别的超突变模式,突变偏向单个DNA链,与重排共定位。10.5 % (19个中的2个)的GIST鉴定为具有染色体碎裂区域(图 5a),包括一个未接受TKI治疗的胃GIST和一个接受伊马替尼治疗的GIST。他们还在 3 个 GIST 中发现了 4 个 kataegis 事件(图 5b),其中包括 2 个肠道 GIST(1 个未接受 TKI 治疗,1 个接受 TKI 治疗)和 1 个接受伊马替尼治疗的胃 GIST。这些结果表明,GIST 中染色体碎裂和 kataegis 的发生与解剖位置无关,也与 TKI 治疗无关。在这 3 个具有 kataegis 区域的 GIST 中,69T 和 91T 在 TpC 环境中主要存在 C > T 或 C > G 突变,这是一个典型特征,可能是由 APOBEC 活性引起的。值得注意的是,所有这 5 个伴有染色体碎裂或变形的 GIST 均为侵袭性 GIST,可能表明染色体碎裂和变形事件在 GIST 进展中发生较晚。
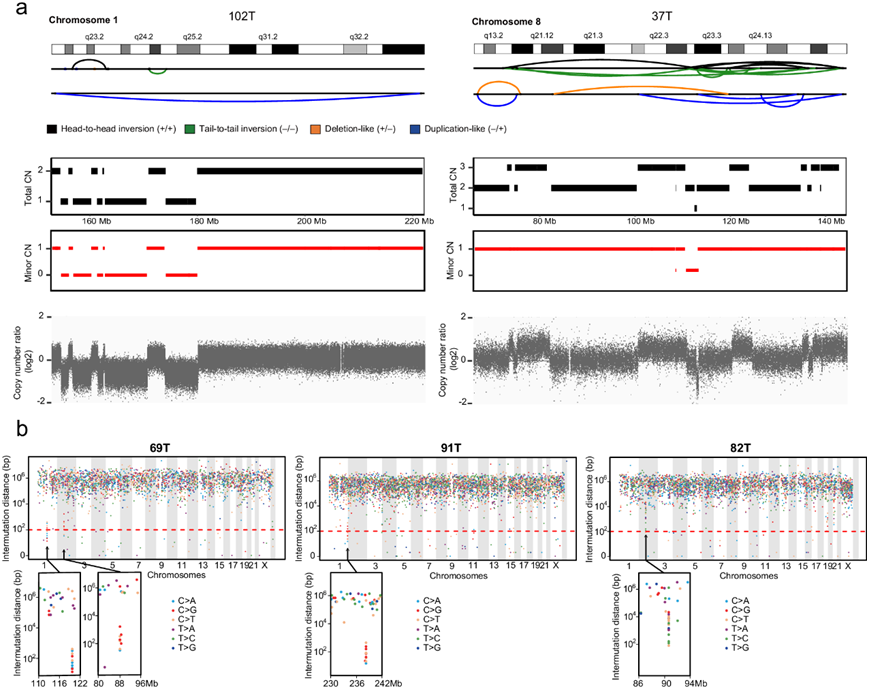
图5. 复杂的基因组畸变。
(a) 两例具有染色体碎裂 CN 振荡特征的侵袭性病例的SV和 CNV 谱。 (b) 显示具有局部超突变的 3 个 GIST 的突变间距离与基因组位置的关系。
06
克隆进化
为了了解GIST的亚克隆结构,更准确地区分早期和晚期驱动事件,他们对4例有多处病灶的转移性病例进行了克隆进化分析。病例80、84和85有4个不同部位的病灶,病例92有纵向病灶(图 6a)。这4例病例中有2例(病例84和92)未接受任何TKI治疗,而病例80接受伊马替尼治疗19个月,病例85在复发后先后接受伊马替尼和舒尼替尼长期治疗(图 6a)。每个病例的病变共有的突变较少(病例 80、84、85 和 92 分别为 36%、27%、16% 和 44%)(图 6b),而更多的突变(分别为 62%、69%、67% 和 56%)仅限于单个病变(图 6b),这意味着转移性患者的单个病变具有多克隆起源。每个病例的CNV 事件较多(病例 80、84、85 和 92 分别为 65%、94%、48% 和 51%)(图 6c)。有趣的是,他们发现病例 85 中病变间共有的突变和 CNV 比例最低(图 6b-c),而分析出的肿瘤异质性最高。
接下来,他们利用所有非沉默突变构建了这些肿瘤的系统发育树,并将共有的臂级 CNV 映射到主干上。基于此分析,他们将这些畸变分为两类:(i)主要的截短畸变,包括KIT原发突变、14q 丢失、22q 丢失、1p 丢失和YLPM1失活突变。这些畸变发生在所有主干上,很可能是启动肿瘤增殖和 GIST 早期发展所必需的;(ii)亚克隆畸变,它们占畸变的大多数,并且总是发生在分支上,表明它们对 GIST 进展过程中的肿瘤适应很重要(图 6d)。值得注意的是,经过 TKI 治疗后,对伊马替尼敏感的KIT原发突变仍然位于病例 85 的主干上,并且许多不同的KIT次要突变发生在分支上。在这些突变中,V654A和Y823D是平行进化过程中的克隆突变,而D816G,Y646C和Y823N则特异性存在于单个病灶中,反映了TKI治疗引起的肿瘤异质性(图 6d)。正如预期的那样, GIST中的KIT原发突变是基于癌细胞分数评分40的克隆性的,进一步证明了KIT作为早期驱动的作用。除KIT之外,一些发生功能性突变的癌基因也可能在分支进化中发挥作用,例如ERBB2( R678Q),SETD2( E119X)和KMT2C(K2797fs)(图 6d)。此外,主干和分支之间6个碱基突变的相对贡献显示出显著差异,表明不同的突变过程参与了GIST的进展(图 6e)。
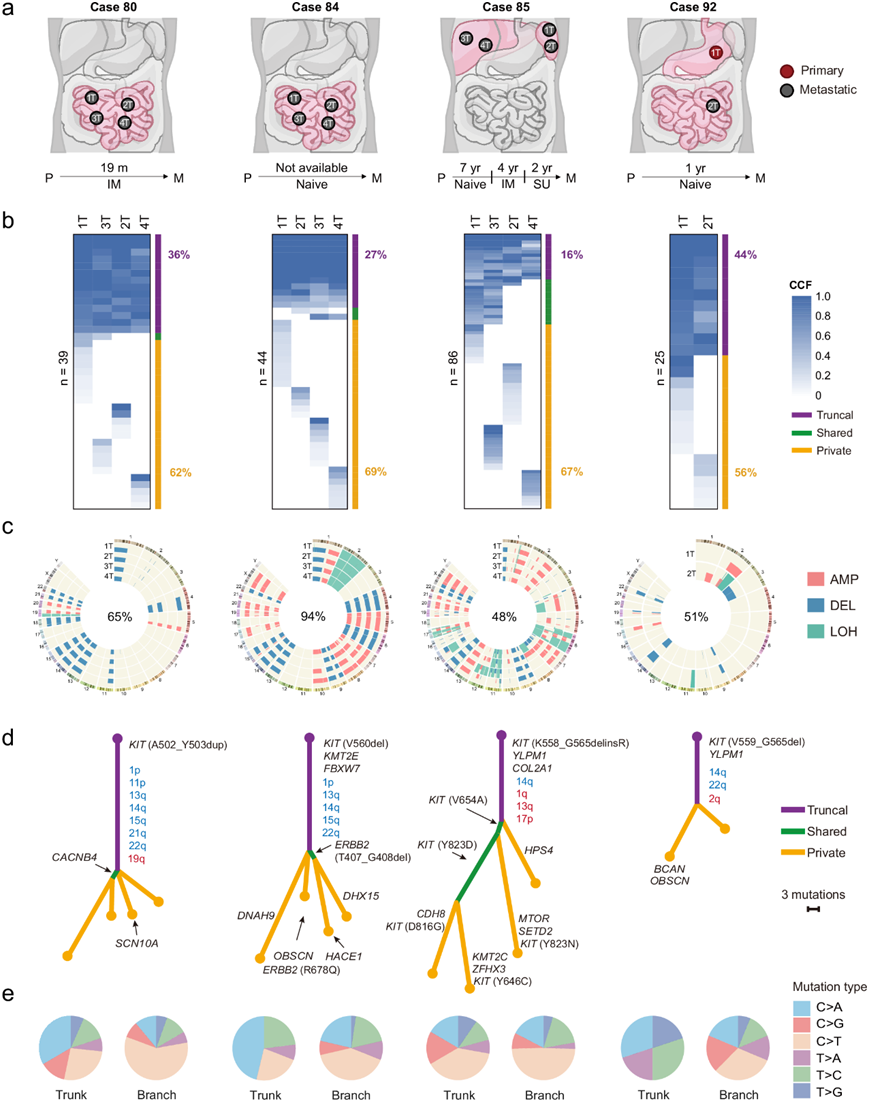
图6. GIST 转移性演变的描述。
(a) 转移灶、复发时间和 TKI 靶向治疗的图表。(b) 热图显示 4 名患者每个病变中非静默突变的癌细胞分数 (CCF)。(c) 4名患者每个病变中已识别的 CNV 和拷贝中性 (CN-LOH) 区域。(d) 基于所有非静默突变的 4 名患者的系统发育树。(e) 6 个碱基突变的相对贡献。
07
GIST 的分子亚型
他们总共鉴定了 520 个差异表达基因(DEG),对这 520 个基因进行无监督聚类表明 4 种 mRNA 亚型(C1-C4)之间的内在异质性(图 7a)。几种驱动基因的表达水平在不同亚型之间有所不同。KIT在 C1-C3 中表达较高,在 C4 中表达最低,而PDGFRA在 C4 中表达最高。为了进一步说明差异,他们使用来自分子特征数据库 (MSigDB) 的标志性通路进行了基于排序的 GSEA,以鉴定在 4 种亚型中差异过度表达的通路。免疫相关干扰素应答相关基因(INTERFERON-ALPHA RESPONSE、INTERFERON-GAMMA RESPONSE 等)在 C1 中表达上调,细胞周期相关基因(G2M CHECKPOINT、E2F TARGETS 等)表达下调,而 C3 则恰恰相反。此外,两组代谢相关基因组 OXIDATIVE PHOSPHORYLATION 和 GLYCOLYSIS 的表达在 C2 中分别上调和下调。在 C4 中未检测到阳性富集,但与 CHOLESTEROL HOMEOSTASIS、E2F TARGETS 和 ANDROGEN RESPONSE 相关的基因表达显著下调。
免疫疗法已成为许多难以治疗的癌症的临床验证治疗方法,具有巨大的发展潜力。临床前研究报告称,伊马替尼联合免疫疗法可提高 GIST 小鼠模型中靶向药物的抗肿瘤活性,但在未经选择的 GIST 患者中,免疫疗法的疗效有限。因此,他们分析了CIBERSORT、ESTIMATE 和几个免疫治疗相关指数以确定哪种亚型可能受益于免疫治疗。CIBERSORT分析显示,浸润最多的免疫细胞为M2巨噬细胞,其次是CD4+记忆性静息T细胞和CD8T细胞,其余19种免疫细胞所占比例都很低。免疫抑制细胞(M2巨噬细胞)在C2中浸润最低,在C3中最高;相反,CD8+T细胞的富集程度在C2中最高,在C3中最低(图 7b)。免疫组化染色也证实C3中CD8+T细胞的浸润最低,这与mRNA表达分析的结果一致。此外,C3中CD4+ 记忆性静息T细胞的数量也最低(图 7b)。ESTIMATE的结果与CIBERSORT的结果一致,C3表现出最低的免疫浸润,提示C3为免疫沙漠亚型(图 7b)。此外,与其他亚型相比,C3中免疫检查点基因(PD-1和PD-L1)和免疫抑制分子的表达水平显著下调(图 7b)。这些发现支持C3具有免疫沙漠表型,不太可能从免疫治疗中获益。虽然C1、C2和C4的免疫评分没有差异,但M2巨噬细胞的比例在C2中最低,而代表免疫浸润细胞溶解活性的CYT评分和C2的CD8+ T细胞比例高于C1和C4(图 7b)。有趣的是,伊马替尼联合免疫治疗的协同作用均发生在自发性小肠GIST的KIT V559del转基因小鼠中,表明 C2(主要为小肠 GIST)最有可能受益于 TKI 联合免疫疗法。
此外,还建立了模拟分子亚型的患者来源细胞模型,以研究潜在的治疗策略。C1亚型患者在完全手术切除后甚至未接受任何 TKI 治疗也显示出良好的预后(图 7d)。GIST 原代细胞培养物(GIST-CN16)是从 C2 亚型 GIST 建立的。他们已经用 T 细胞介导的肿瘤细胞杀伤试验评估了 C2 亚型,进一步将 GIST-CN16 与人外周血单核细胞(PBMC)共培养,它对免疫细胞的杀伤比 C3 亚型细胞(GIST-T1)更敏感(图 7e)。在6名长期受益超过6个月的患者中,5名患者的肿瘤起源于小肠,而第6名患者的肿瘤来源不明。C3亚型频繁出现9p缺失,这影响了CDKN2A。GIST原代细胞培养物(GIST-CN2)是从C3亚型GIST(94 T,CDKN2A缺失)建立的。在这种C3衍生的GIST模型中观察到瑞普替尼(KIT抑制剂)和ibrance(CDK4/6抑制剂)的强协同作用(图 7f)。C4亚型含有PDGFRA突变。从PDGFRA D842V突变体C4 GIST建立的GIST-CN10原代细胞对avapritinib有反应,但对伊马替尼或舒尼替尼有耐药性(图 7g)。此外,avapritinib 的临床数据证实了其对由PDGFRA突变驱动的转移性 GIST 的 C4 患者有活性的证据(图7h),这代表了先前针对 PDGFRA 突变型 GIST 的药物治疗策略的验证。
结合基因组变异、表达谱、免疫特征和临床信息,他们总结了 4 种 mRNA 亚型的主要特征并提出了治疗策略的假设(图 7i):C1(基因组稳定亚型),主要由低风险或中等风险的胃 GIST 组成,主要具有KIT外显子 11 突变,仅进行完全手术切除后预后良好(图 7d);C2(CD8+炎性亚型),主要由高风险/转移性的肠道 GIST 组成,最终可能对 TKI 联合免疫疗法有潜在反应(图 7e);C3(免疫沙漠亚型),几乎是高风险/转移性的 GIST,主要具有KIT外显子 11 突变,可能无法从免疫疗法中受益,但可能是使用 CDK4/6 抑制剂和 TKI 治疗的潜在候选者(图 7f); C4(PDGFRA驱动亚型),所有PDGFRA突变的GIST,应考虑使用PDGFRA抑制剂avapritinib治疗(图 7g-h)
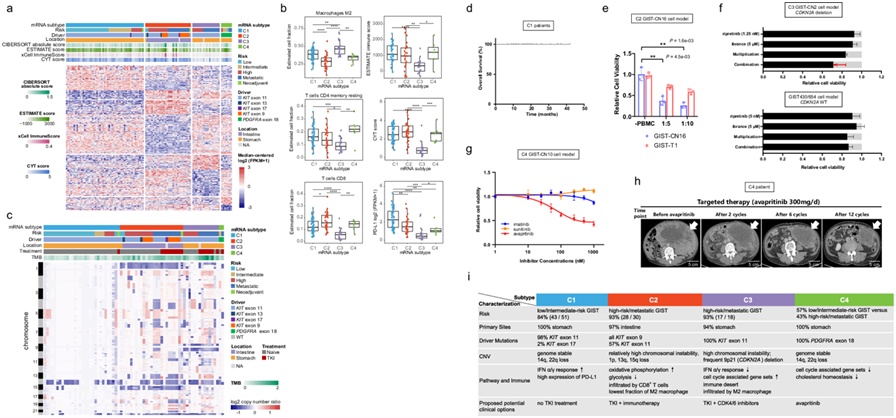
图7. GIST 的分子亚型。
(a) 热图显示4种亚型之间的520个差异表达基因。C1、C2、C3和C4亚型的肿瘤数量分别为51、30、18和7。显示了临床风险分层、驱动突变、位置、来自CIBERSORT、ESTIMATE和xCell的免疫评分以及细胞溶解(CYT)评分。(b) 箱线图显示4种亚型之间的估计细胞分数、免疫评分、CYT评分和PD-L1表达。(c)热图显示整个基因组的拷贝数比率。(d) C1患者的总体生存率。(e) C2 亚型细胞中的T细胞介导的肿瘤细胞杀伤试验。(f) 细胞活力测定揭示了 KIT 抑制剂和 CDK4/6 抑制剂的协同作用。(g) 从 PDGFRA D842V 突变体、C4 亚型建立的 GIST-CN10 原代细胞对 avapritinib 有反应,但对伊马替尼或舒尼替尼有耐药性。(h) avapritinib 的临床数据证实了转移性 C4 亚型 GIST 患者的活动证据。(i) GIST 亚型的基因组特征、表达谱、免疫特征和潜在治疗策略。
+ + + + + + + + + + +
结 论
本项研究全面分析了 117 个 GIST 的基因组和转录组景观,其中包括来自 105 名患者的 31 个低风险、18 个中风险、29 个高风险、34 个转移性和 5 个新辅助 GIST。GIST 的肿瘤突变负担明显较低,但拷贝数变异广泛。侵袭性 GIST 的基因组畸变明显多于低/中风险 GIST。复杂的基因组改变、染色体碎裂和 kataegis 选择性地发生在侵袭性 GIST 中。虽然突变很少,但已鉴定出复发性失活YLPM1突变在高风险/转移性 GIST 中富集,功能研究进一步表明YLPM1失活促进 GIST 增殖、生长和氧化磷酸化。来自单个患者的空间和时间分离的 GIST 在转移性 GIST 中表现出复杂的肿瘤异质性。最后,提出了四种突出的亚型,它们具有不同的基因组特征、表达谱、免疫特征、临床特征和亚型特异性治疗策略。
+ + + + +



 English
English


