文献解读|Nat Immunol(30.5):CXCR6 协调大脑 CD8 + T 细胞驻留并限制小鼠阿尔茨海默病病理进展
✦ +
+
论文ID
原名:CXCR6 orchestrates brain CD8+ T cell residency and limits mouse Alzheimer’s disease pathology
译名:CXCR6 协调大脑 CD8 + T 细胞驻留并限制小鼠阿尔茨海默病病理进展
期刊:Nature Immunology
影响因子:30.5
发表时间:2023.09.07
DOI号:10.1038/s41590-023-01604-z
背 景
炎症和异常免疫是阿尔茨海默病 (AD) 和其他神经退行性疾病的标志,小胶质细胞可以通过触发神经炎症来促进 AD,而适应性免疫细胞也会在 AD 患者中发生表型改变,但适应性免疫系统的功能和机制效应仍不清楚。
实验设计
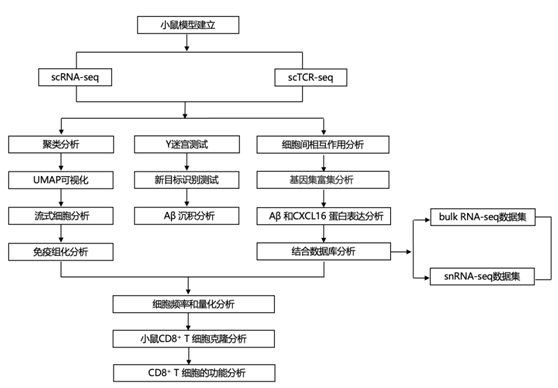
结 果
01
CD8+ T 细胞保护小鼠免受 AD 相关病理的影响
因此,研究者团队对来自5xFAD和非转基因(Non-Tg)对照小鼠脑实质(以下称为脑)或硬脑膜和蛛网膜组织(以下称为脑膜)的CD45int/+CD11b+(主要是小胶质细胞)和CD45+CD11b -(非小胶质细胞免疫细胞)细胞进行了单细胞转录组分析(scRNA-seq)。UMAP可视化和聚类分析确定了 12 个不同的免疫细胞聚类,其中与疾病相关的小胶质细胞 (DAM) 仅限于 5xFAD 小鼠(图1a-c)。值得注意的是,5xFAD 小鼠中 CD8 + T 细胞的频率升高,但 CD4 + T 细胞或 γδ T 细胞的频率没有升高(图1c)。
流式细胞术分析显示,与Non-Tg小鼠相比,5xFAD小鼠大脑中CD3 TCRβ T细胞的频率和数量增加,这主要归因于CD8 T细胞的积累(图1d)。与Non-Tg小鼠相比,在5xFAD小鼠中,CD3+或CD8+ T细胞(而不是CD4+ T细胞)呈现出更明显的年龄依赖性积累(图1e-f)。
他们将5xFAD小鼠与主要组织相容性复合体I类分子β2微球蛋白缺乏的小鼠杂交,在4月龄和10月龄时观察到Aβ沉积增加(图1g)。与5xFAD/B2m+/+小鼠相比,4月龄的5xFAD/B2m -/-小鼠区分迷宫臂和区分熟悉和新奇物体的能力下降,表明认知记忆功能受损(图1h-i)。
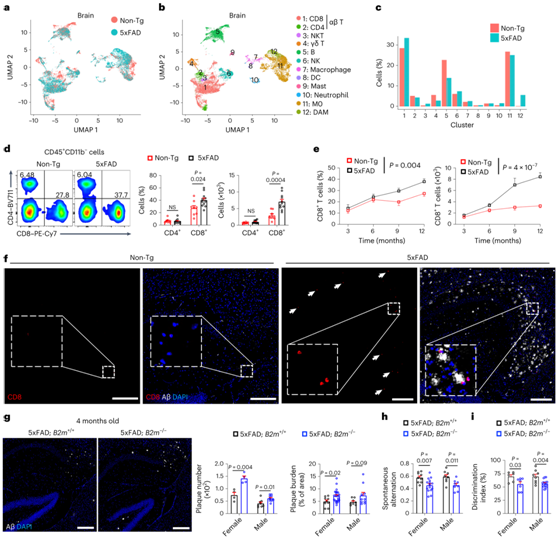
图1. CD8 + T 细胞在 AD 中积聚并保护小鼠免受 AD 相关病理的影响。
(a-c) 来自8月龄Non-Tg或5xFAD小鼠大脑的CD45int/+CD11b+(主要是小胶质细胞)和CD45+CD11b -非小胶质细胞免疫细胞的scRNA-seq分析。(d) 来自10月龄Non-Tg和5xFAD小鼠的脑CD4+和CD8+ T细胞。 (e) 3、6、9和12月龄时的脑CD8+ T细胞。(f) 12月龄小鼠海马中CD8+ T细胞、Aβ和DAPI的图像。(g) 免疫组织化学分析。(h) Y迷宫测试。(i) 新目标识别测试的量化辨别指数。
02
CXCL16–CXCR6 协调小胶质细胞-CD8+ T 细胞之间的相互作用
他们预测小胶质细胞和CD8 T细胞之间趋化因子-趋化因子受体相互作用的数量比其他细胞类型之间更多(图2a),表明小胶质细胞和CD8 T细胞之间可能存在细胞间通讯。对单个趋化因子配体-受体对的分析表明,CXCL16-CXCR6 是5xFAD 小鼠中小胶质细胞和 CD8+ T 细胞之间排名最高的对(图2b)。因此,Cxcl16和Cxcr6分别在小胶质细胞和T细胞聚类中高度表达(图2c)。他们发现 5xFAD 小鼠的小胶质细胞中 CXCL16 表达适度增加(图2d)。
在AD患者中,小胶质细胞的激活或炎症状态与Aβ的进行性积累和认知能力下降相一致。与这些效应相关的是,晚期AD个体死后脑组织中CXCL16的表达上调(图2e-f)。对bulk RNA-seq 数据集和scRNA-seq 数据集的分析表明,CXCL16基因表达主要在小胶质细胞中上调(图2g)。人类中发生了 AD 相关的 CXCL16 表达变化,表明小鼠 AD 模型和人类之间 CXCL16 的保守调控。
接下来,他们检测了 CXCR6 的组织特异性调节和功能重要性。与脾脏相比,大脑中表达 CXCR6的 CD8+ T 细胞比例要大得多,并且 5xFAD 小鼠的大脑(但其他组织)中 CXCR6+ CD8+ T 细胞的频率和数量增加(图2h)。
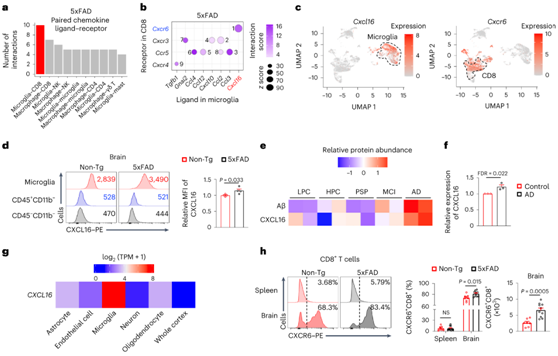
图2. CXCL16-CXCR6细胞间通讯轴和cxcr6依赖性CD8+ T细胞在AD中的积累。
(a) 根据 5xFAD 小鼠的 scRNA-seq 数据中趋化因子配体-受体对的表达预测细胞间相互作用。 (b) 气泡图分别描绘了小胶质细胞和 CD8 + T 细胞之间排列的趋化因子配体-受体相互作用。(c) UMAP可视化。(d) CXCL16在10月龄Non-T和5xFAD小鼠的小胶质细胞(CD45int/+CD11b+)、非小胶质免疫细胞(CD45+CD11b-)和非免疫细胞(CD45- CD11b-)中的表达。(e) 不同神经退行性疾病个体中 Aβ 和 CXCL16 蛋白表达的热图。(f) AD 个体与健康个体中 CXCL16 蛋白的相对丰度。(g) 从人脑中分离出的跨细胞类型或全脑皮层的CXCL16表达。(h) 来自 10 个月大的 Non-T和 5xFAD小鼠脾脏和大脑的CD8+ T 细胞上的CXCR6 表达。
03
CXCR6 缺失加剧 5xFAD 小鼠认知能力下降
为了检测CXCR6是否影响小鼠AD相关CD8+ T细胞在大脑中的积累,他们生成了CXCR6缺陷的5xFAD小鼠(5xFAD/CXCR6-/-),并将其与5xFAD/CXCR6+/+小鼠的大脑免疫细胞谱进行了比较(图3a-b)。在5xFAD/Cxcr6 -/-小鼠中,脑内CD8+ T细胞或CD3+ T细胞减少(图3c-d)。从机制上讲,CD8+ T 细胞来自 5xFAD 的大脑或脑膜; Cxcr6 –/–小鼠表现出细胞死亡增加,但增殖状态正常(图3e)。因此,CXCR6对于 5xFAD 小鼠大脑中CD8 + T 细胞的积累和存活很重要。
免疫染色结果显示,雌性5xFAD/Cxcr6 -/-小鼠的Aβ沉积加重,对脑组织匀浆的免疫印迹分析也观察到雌性小鼠的变化(图3f-g)。雌性和雄性5xFAD/Cxcr6 -/-小鼠大脑皮质中可溶性和不可溶性Aβ1-40和Aβ1-42的浓度以及海马中可溶性Aβ1-40的浓度均增加(图3h)。此外,两性5xFAD/Cxcr6 -/-小鼠的认知记忆功能均受损(图3i-j),但运动能力没有改变。
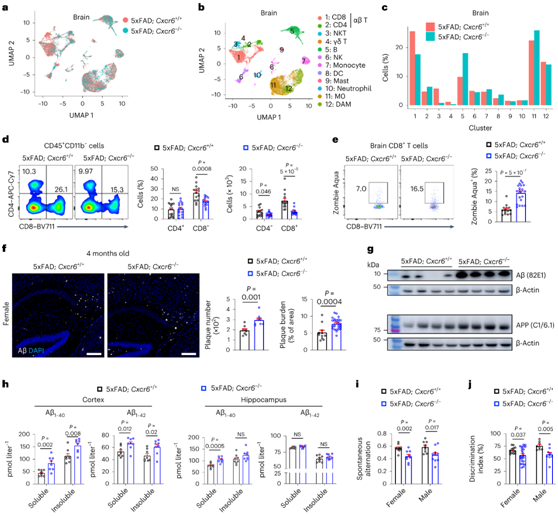
图3. CXCR6 的缺失会加剧 5xFAD 小鼠的认知能力下降。
(a-b) 8 个月大 5xFAD 大脑中小胶质细胞和非小胶质细胞免疫细胞的 scRNA-seq 分析。(c) 每个聚类中的细胞频率。(d) 10月龄5xFAD Cxcr6+/+小鼠和5xFAD Cxcr6-/-小鼠脑CD4+和CD8+ T细胞。(e) 非活的(Zombie Aqua+) CD8+ T细胞。(f)免疫组化染色。(g) 免疫印迹分析。(h) 海马和皮质中Aβ1-40和Aβ1-42蛋白的可溶性和不可溶性含量。 (i) Y 迷宫测试自发交替的量化。(j) 新目标识别测试的量化辨别指数。
04
CXCR6 协调大脑 CD8+ T 细胞的克隆扩增
CD8+ T 细胞的表型和功能特性受到免疫和局部环境信号的影响。为了剖析 5xFAD 小鼠大脑中 CD8 + T 细胞积累的分子过程,他们进行了配对 scRNA-seq 与 单细胞 T 细胞抗原受体 (TCR) 测序 (scTCR-seq) ,以识别 5xFAD 和Non- Tg 小鼠大脑和脑膜中克隆扩增的 T 细胞群。与脑膜相比,大脑中的克隆扩张有所增加,5xFAD 小鼠大脑中的 T 细胞进一步进行克隆扩张,尤其是 αβ+ T 细胞。此外,在5xFAD小鼠中,高度扩增的CD8+ T细胞克隆,特别是克隆型大小>20的CD8+ T细胞克隆占脑CD8+T细胞总数的较大比例(图4a)。
大脑 CD8 + T 细胞的亚群识别出八个亚群(图4b-c),通过离散的基因特征进行区分。许多这些亚聚类包含以高Pdcd1表达为标志的扩展克隆型,尤其是亚聚类 2(图4d-e)。此外,5xFAD小鼠的脑PD-1+ CD8+ T细胞显著增加(图4f),进一步验证脑内疾病相关克隆扩增(图4a)。此外,影像学分析显示CD8和PD-1在5xFAD小鼠和AD患者的大脑中共表达(图4g-h)。
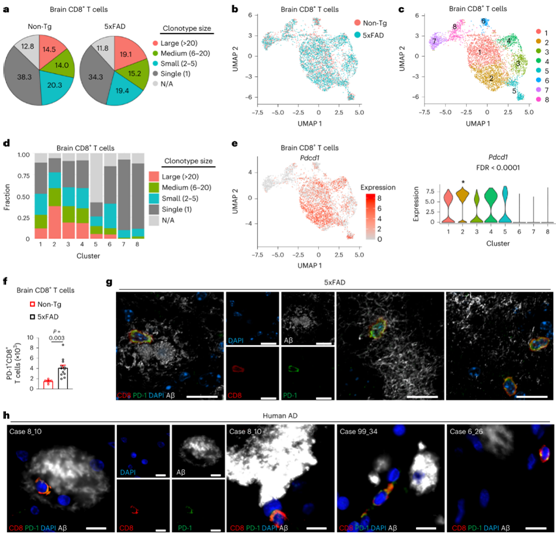
图4. CXCR6协调脑CD8+ T细胞克隆扩增。
(a) 饼图总结了年龄匹配的Non-Tg 和 5xFAD 小鼠中大脑 CD8 + T 细胞克隆型大小的百分比。(b-c) 按基因型或亚群着色的脑 CD8+ T 细胞亚群的 UMAP 图。 (d) 条形图显示CD8 + T 细胞聚类的克隆型大小分布。 (e) 脑CD8+ T细胞中的Pdcd1表达。(f) 10月龄Non-Tg和5xFAD小鼠脑内PD-1+CD8+ T细胞的数量。 (g) 在12个月大的5xFAD小鼠中,三个独立的成像场描绘了共表达PD-1(绿色)并接近Aβ(白色)的脑CD8+ T细胞(红色)。(h) 四个独立的成像场描绘了共表达PD-1(绿色)并靠近Aβ(白色)的脑CD8+ T细胞(红色)。
05
CXCR6促进脑组织CD8+ T细胞驻留
与Non-Tg小鼠相比,来自5xFAD或APPNL-G-F小鼠的脑CD8+ T细胞表达核心组织驻留记忆 T 细胞(TRM)标记物CD69和CD103,而不是CD4+ T细胞(图5a-b),表明疾病条件下脑CD8+ T细胞的TRM细胞表型增强。静脉注射藻红蛋白(PE)偶联的抗CD45来评估脑CD8+ T细胞是来源于循环(PE+)还是驻留于脑(PE -)后,他们发现大多数脑CD8+ T细胞是PE -细胞(图5c),表现为PD-1相对于PE+细胞的表达升高。此外,与Non-Tg小鼠相比,这些PE-CD8 + T细胞在5xFAD小鼠大脑中增加(图5c-d)。
他们验证了这些分子在脑CD8+ T细胞上的共表达,与Non-Tg小鼠相比,CXCR6+PD-1+CD8+ T细胞的频率和数量在5xFAD小鼠中增加(图5e),尤其是在6月龄后。接下来,他们应用scTCR-seq分析确定CXCR6是否协调5xFAD小鼠脑中CD8+ T细胞的克隆扩增,并发现CXCR6缺失后克隆扩增的CD8+ T细胞显著减少(图5f)。Cxcr6缺失也降低了总CD8+ T细胞中表达Pdcd1亚聚类(1-5)的比例(图5g)。此外,在没有CXCR6的情况下,克隆扩增的CD8+ T细胞(图5h)在很大程度上与Pdcd1表达重叠,表现出大、中等水平扩增的克隆型显著减少(图5i)。
因此,在5xFAD/Cxcr6 -/-和APPNL-G-F/Cxcr6-/-小鼠中,PD-1+CD8+ T细胞减少(图5j),从而表明CXCR6在AD小鼠模型大脑中克隆扩增的PD-1+CD8+ T细胞中发挥重要作用。更重要的是,在5xFAD/Cxcr6-/-小鼠的克隆扩增的Pdcd1+CD8+ T细胞中,核心TRM细胞特征发生下调(图5k)。5xFAD/Cxcr6-/-和APPNL-G-F/Cxcr6-/-小鼠CD8+ T细胞中CD69+、CD103+和CD69+CD103+亚群比例降低(图5l)。
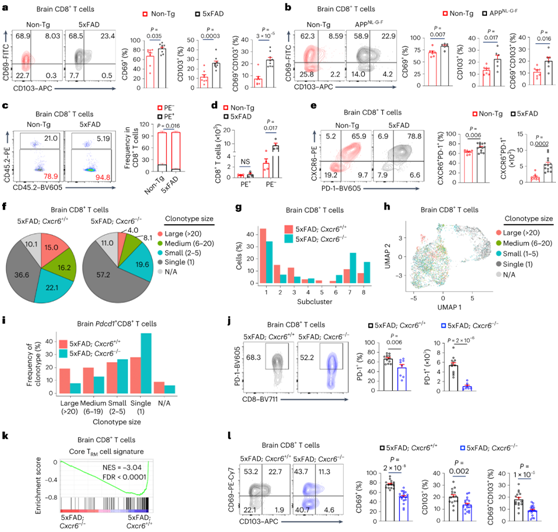
图5. CXCR6控制脑CD8+ T细胞的组织驻留。
(a-b) 10月龄Non-Tg和5xFAD小鼠和9月龄Non-Tg和APPNL-G-F小鼠脑CD8+ T细胞中的CD69+、CD103+和CD69+CD103+细胞。(c-d) 10月龄Non-Tg和5xFAD小鼠大脑中PE+循环和PE-组织驻留CD8+ T细胞的频率和数量。(e) 10月龄Non-Tg和5xFAD小鼠脑CXCR6+PD-1+CD8+ T细胞。(f) 饼状图总结了脑CD8+ T细胞克隆型大小的百分比。(g) 每个聚类中脑CD8+ T细胞的频率。(h) 脑CD8+ T细胞的克隆型按大小着色。(i) Pdcd1+CD8+ T细胞克隆型大小的频率。(j)小鼠脑PD-1+CD8+ T细胞。(k) GSEA富集图。(l) 脑CD8+ T细胞中的CD69+、CD103+和CD69+CD103+细胞。
06
CD8+ T细胞抑制小胶质细胞的促炎活性
高分辨率共聚焦成像显示5xFAD小鼠中CD8+ T细胞或CD3+ T细胞与Iba1+小胶质细胞共定位在Aβ斑块附近(图6a)。在AD患者的大脑中也观察到CD8+ T细胞与Aβ和IBA1+小胶质细胞的这种密切关系(图6b-c)。因此,在小鼠模型和人类中,CD8+ T细胞与小胶质细胞或Aβ共定位是一种保守现象。
来自5xFAD/B2m-/-和5xFAD/Cxcr6 -/-小鼠的小胶质细胞显示TNF-α和IL-1β前体表达增加或有增加趋势(图6d-e),表明这些小鼠的小胶质细胞炎症状态增加。此外,它们对5xFAD/Tcra+/+和5xFAD/Tcra-/-和5xFAD/B2m+/+和5xFAD/B2m -/-小鼠的小胶质细胞进行了scRNA-seq(图6f-g)。尽管M0和DAM的比例基本正常(由DAM特征基因鉴定),他们在5xFAD/Tcra -/-和5xFAD/B2m -/-小鼠的两个小胶质细胞亚群中发现干扰素特征的富集(图6i-j)。此外,TNF-α信号通路在5xFAD/Tcra-/-小鼠的两个小胶质细胞亚群和5xFAD/B2m-/-小鼠的M0小胶质细胞中富集(图6i-j)。
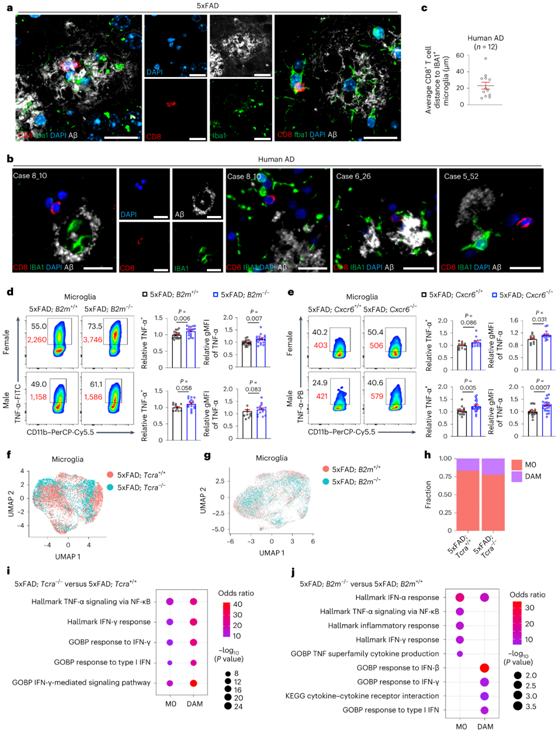
图6. CD8+ T细胞与AD小胶质细胞共定位,抑制5xFAD小鼠小胶质细胞的促炎活性。
(a) 在10个月大的5xFAD小鼠中,三个独立的成像场描绘了脑CD8+ T细胞(红色0靠近Aβ(白色)和Iba1+小胶质细胞(绿色)。(b) 四个独立的成像场描绘了AD大脑中靠近Aβ(白色)和IBA1+小胶质细胞(绿色)的脑CD8+ T细胞(红色)。(c) AD患者大脑中CD8+ T细胞与小胶质细胞之间的距离。(d-e) TNF-α+小胶质细胞的相对百分比和几何平均荧光强度。 (f-h) 小鼠脑内CD45int/+CD11b+小胶质细胞的scRNA-seq分析。 (i-j) 通过scRNA-seq分析所示小鼠M0和DAM中上调基因的功能富集分析,显示了最高富集通路。
07
5xFAD 小鼠大脑中具有调节功能的CD8+ T 细胞
在病变的CNS中存在具有免疫抑制功能的调节性CD8+ T细胞,他们发现克隆扩增和Pdcd1+CD8+ T细胞显示了这种调节性CD8+ T细胞特征的富集(图7a),与抑制相关分子CD73、LAG3、CD39和TIGIT以及CXCR6的表达增加相关(图7b)。在PD-1+CD44hiCD8+ T细胞存在的情况下,刺激的小胶质细胞中TNF-α和前体IL-1β的表达减少(图7c),这与培养的PD-1+CD44hiCD8+ T细胞中免疫抑制标志物(以及CXCR6)的表达增加一致。5xFAD小鼠脑源性CD8 +T细胞也抑制小胶质细胞产生促炎细胞因子(图7d)。
此外,他们在雌性和雄性5xFAD/B2m -/-小鼠(图7e)以及雌性5xFAD/Cxcr6 -/-小鼠(图7f)中观察到Iba1+小胶质细胞的积累和斑块相关小胶质细胞的增加,每个Aβ斑块中Iba1+小胶质细胞的数量相当,这表明与斑块形成同时存在进行性胶质细胞增生。
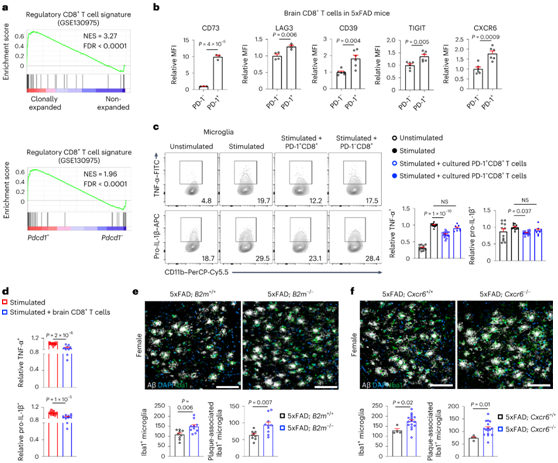
图7. 5xFAD小鼠克隆扩增的脑CD8+ T细胞对小胶质细胞的调控基因表达和功能。
(a) GSEA富集图显示,在克隆扩增的CD8+ T细胞和非扩增的CD8+ T细胞以及Pdcd1+和Pdcd1- CD8+ T细胞中,调节性CD8+ T细胞特征上调。(b) 5xFAD小鼠脑内PD-1+与PD-1 - CD8+ T细胞上指示标记物的相对表达。(c) 小胶质细胞中TNF-α+和前il-1β+细胞与体外扩增的脾源性CD8+ T细胞群共培养。 (d) 单独培养或与来自5xFAD小鼠的新分离的脑CD8+T细胞共培养后,来自5xFAD小鼠的小胶质细胞中的TNF-α+和前IL-1β+细胞。(e-f) Iba1+小胶质细胞或aβ-斑块相关Iba1+小胶质细胞。
+ + + + + + + + + + +
结 论
本项研究鉴定了大脑驻留的 CD8 + T 细胞,它们共表达 CXCR6 和 PD-1,并且接近人类和小鼠 AD 大脑中的斑块相关小胶质细胞。他们还确定 CD8+ T 细胞限制 AD 病理,包括 β-淀粉样蛋白沉积和认知能力下降。配体-受体相互作用分析确定了小胶质细胞和 CD8 + T 细胞之间的 CXCL16-CXCR6 细胞间通讯。此外,Cxcr6缺陷会损害大脑 PD-1 +CD8 + T细胞的积累和克隆扩增。Cxcr6或 CD8 + T 细胞的缺失最终会增加小胶质细胞促炎细胞因子的产生,其中 CXCR6 协调大脑 CD8 + T 细胞-小胶质细胞的共定位。总的来说,本项研究揭示了大脑 CD8 + T 细胞和 CXCR6 在小鼠 AD 发病机制中的保护作用,并强调了微环境特异性的细胞间通讯协调组织稳态和防止神经炎症。
+ + + + +



 English
English


