文献解读|Cell(64.5):阿尔茨海默病进展中的人类小胶质细胞状态动态
✦ +
+
论文ID
原名:Human microglial state dynamics in Alzheimer’s disease progression
译名:阿尔茨海默病进展中的人类小胶质细胞状态动态
期刊:Cell
影响因子:64.5
发表时间:2023.09.28
DOI号:10.1016/j.cell.2023.08.037
背 景
小胶质细胞状态的改变会影响神经炎症、神经变性和疾病,但人们对它的了解仍知之甚少。然而,阿尔茨海默病 (AD) 小鼠模型的研究结果很难与人类联系起来,因为小鼠模型和 AD 患者大脑中富集的小胶质细胞特征之间的疾病相关小胶质细胞 (DAM) 状态可能存在很大差异。
实验设计
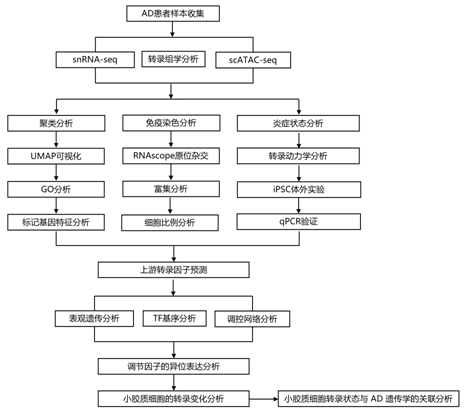
结 果
01
小胶质细胞转录状态的表征
为了表征小胶质细胞的状态,研究者团队分析了 217 名 AD 患者(138 名早期患者和 79 名晚期患者)和 226 名对照个体的 6 个大脑区域(包括前额叶)的死后大脑样本中的 152459 个单个小胶质细胞核的转录组,同时利用已知的标记基因从脑单细胞核转录组分析 (snRNA-seq)的数据集中收集了174420个免疫细胞,分为16个聚类,包括12个小胶质细胞聚类(聚类0-8和10-12,由CSF1R、CD74和C3标记),1个脑相关巨噬细胞聚类(BAM:聚类9,由MRC1、CD163和LYVE1标记),一个T细胞聚类(聚类13,由CD3E和CD3G标记),以及2个其他脑细胞类型聚类(聚类14和15)(图S1A-B)。
他们根据其分子特征和功能将这 12 个聚类定义为不同的小胶质细胞状态(图1A-B,S1C-G),注释了高表达稳态标记物P2RY12和CX3CR1的稳态小胶质细胞 (MG0) ,以及高表达神经递质受体的神经元小胶质细胞 (MG1)(图 S1 F),发现 MG3 对核糖体生物合成表现出最强的富集(图 S1 G),他们将 MG4 注释为基于脂质稳态的富集和胆固醇流出的调节的脂质加工状态。由于吞噬作用和受体介导的内吞作用的显著富集,他们将MG5注释为吞噬状态。值得注意的是,与BAM相比,MG5对吞噬基因的富集相对较低(图S1C)。他们将 MG6 注释为基于对未折叠蛋白的显著富集的应激相关状态,将MG7 注释为糖酵解状态,将 MG11 注释为抗病毒状态。他们还发现三种炎症状态(MG2、MG8 和 MG10)显示多种细胞因子和细胞因子受体(CCL3、IL1B、IL15、IL4R、IL17R和IL10RA )的高表达,以及免疫反应的强大功能富集,包括细胞因子介导的信号通路和炎症反应的调节。他们进一步将 MG2 注释为炎症 I ( CPEB4 / TMEM163/IL4R ),将MG8 注释为炎症 II ( LRRK2 / SPON1/FOXP1 ),将MG10 注释为炎症 III ( IL1B / CCL3/RELB )。
接下来,他们将这 12 个小胶质细胞状态与之前发布的数据集进行了比较,并发现 MG3(核糖体生物发生)、MG6(应激相关)、MG10(炎症 III)、MG11(抗病毒)和 MG12(循环)状态在研究中显示出强烈且显著的一致性,而 MG0(稳态)状态显示出较弱但显著的一致性(图 S1 H-I)。此外,与小鼠小胶质细胞转录状态进行比较,发现了几种跨物种的一致性和保守状态(图S1J)。
他们发现,脂质加工 MG4 和炎症 MG8 在 AD 中的分数显著增加,而MG1 在 AD 中的分数显著降低(图 1 C)。接下来,他们试图通过免疫组织化学和 RNAscope原位杂交来实验验证 AD 人脑中关键转录状态的富集,对 8 名 AD 受试者的 P2RY12 进行了免疫组织化学分析,结果显示高水平的 P2RY12 免疫反应性(图 1D)。他们仅在脑实质内观察到一小群 IBA1 阳性、P2RY12 阴性细胞,这可能反映了中枢神经系统浸润的巨噬细胞(图 1 D)。因此,他们推断 P2RY12 是用于原位杂交分析的引人注目的小胶质细胞特异性标记。他们进行了在 4 名 AD 和 4 名非 AD 个体中检测P2RY12,发现 AD 受试者的P2RY12表达细胞核比例相对较低(图 1 E)。
他们发现 AD 受试者中PPARG+ P2RY12+细胞的比例相对于对照组显著增加(图 1 F)。此外,他们还观察到这些受试者中FOXP1+ LRRK2+小胶质细胞的富集,这是一种标志着 MG8 炎症状态的表达模式(图 1G)。
MG3 中的疾病相关小胶质细胞(DAM)特征基因的具有最强富集,在 AD 中比例不变(图 1H)。值得注意的是,MG3 DAM 富集主要是由核糖体蛋白基因的重叠驱动的。此外,他们还观察到小鼠 DAM 特征在多个 MG 状态下有显著但相对较低的富集,包括脂质加工 MG4 和炎症 MG10。
GO分析显示了核糖体生物发生MG3状态中富集的基因,鉴定了一系列富集细胞因子产生和小胶质细胞激活途径的炎症基因(如HLA-A、CD74、C1QB和APOE),揭示了胆固醇和脂质稳态基因的富集(例如PPARG、APOE、ABCA1和TREM2)(图1I)。
小胶质细胞高表达APOE是DAM和小胶质细胞神经退行性表型(MGnD)的状态标志。为了确定是否可以将较高水平的APOE表达区分为离散细胞群体,他们使用针对APOE、PPARG和小胶质细胞标记物P2RY12的探针进行了 RNAscope分析(图 1 J)。虽然绝大多数PPARG+小胶质细胞表达高水平的APOE,但一部分APOE+小胶质细胞表达低水平的PPARG(图1K)。
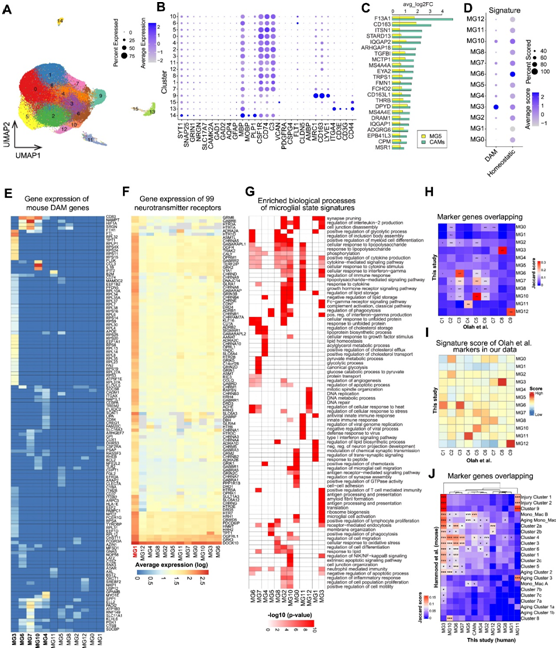
图S1. 老年人大脑中的小胶质细胞转录状态。
(A) 174420 个来自人类死后脑组织的计算机分选免疫核的UMAP,在 snRNA-seq 数据中标记为 16 个聚类。(B) 脑细胞类型和免疫细胞类型的典型标记物的表达模式。(C) 23 个 MG5 和 C9 共享标记基因的 log2foldchange 的平均值。(D) 点图显示每个小胶质细胞转录状态下 DAM 和稳态基因的特征得分。(E) 热图显示每个小胶质细胞状态中 DAM 基因的表达。(F) 12 个小胶质细胞状态中神经递质受体的表达水平。(G) GO分析。(H) 热图显示标记基因的显著重叠。(I) 热图显示标记基因的特征得分。(J) 热图显示标记基因的显著重叠。
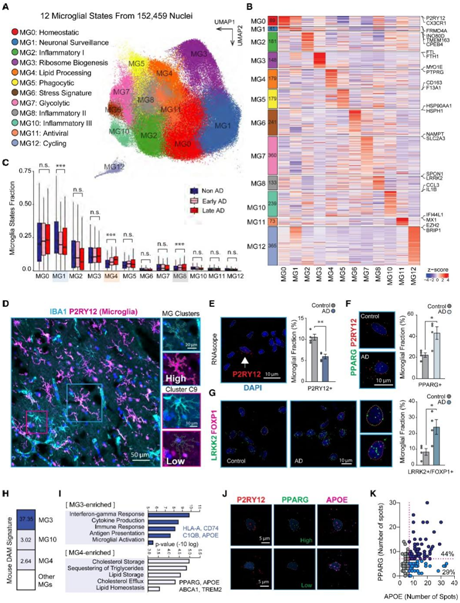
图1. 老年人大脑中小胶质细胞的转录状态。
(A) 152459 个小胶质细胞核的 UMAP,并在 snRNA-seq 数据中注释了小胶质细胞状态。(B) 热图显示 12 个小胶质细胞状态下的 2228 个高表达基因。(C) AD 病理组中的细胞分数分布。(D)免疫染色。(E) 死后前额皮质组织的 RNAscope原位杂交。(F) P2RY12 +的小胶质细胞部分与共同检测的 MG4 标记PPARG。(G) P2RY12 +的小胶质细胞部分与共同检测的 MG2 标记物LRRK2和FOXP1。(E-G) 8 位受试者的量化结果。(H) 跨人类小胶质细胞状态的小鼠 DAM 特征的富集分析。(I)GO分析。(J) 使用 RNAscope 对 4 名 AD 受试者的P2RY12 +小胶质细胞中的PPARG和APOE进行联合检测分析。(K)大于 7 个点的APOE和PPARG检测揭示了离散的APOE+细胞群体。
02
老年人大脑中独特的炎症状态
细胞比例分析还揭示了 AD 受试者中炎症 MG8 状态的富集(图 1 C)。不同炎症状态的存在反映了不同促炎症刺激激活的替代转录程序(图2A)。然而,炎症聚类显著富集的通路显示了炎症状态降低的模式(MG10 > MG2 > MG8),表明这些聚类可能代表炎症进展过程中的状态(图2 B)。为了确定这些聚类是否代表人脑内的不同细胞群体,他们使用巨噬细胞标记物 IBA1 对固定的前额皮质大脑切片进行免疫染色,并使用 Imaris 的 3D 渲染来构建细胞痕迹,在空间上描绘这些切片内的小胶质细胞体(图 2C),同时分析了 4 名 AD 受试者中 9 个靶标的表达,以剖析 MG8 的左右(MG8 是一种弱炎症状态,在 AD 中富集,与其他炎症状态相关)(图2D)。他们利用针对P2RY12、CX3CR1和IBA1的探针,确定了小胶质细胞核身份,并随后评估了MG8标记物LRRK2和FOXP1、MG2标记物CPEB4和TMEM163以及MG10标记物CCL3和RELB的水平(图2E)。对于表达多种炎症标志物的细胞,他们发现炎症程序在很大程度上是重叠的,23%的炎症小胶质细胞中MG2特征(CPEB4和TMEM163)渗入MG8和MG10状态(图2F)。MG8 和 MG10 标记物的表达是相关的,如所有细胞定量的分层聚类所描绘的树状图所示(图 2 F)。事实上,他们能够在一小部分非重叠的小胶质细胞群体中检测到 MG8 和 MG10 标记的表达,而很少检测到非重叠的 MG2 状态(图 2F-G)。
接下来,他们研究了这些标志物与炎症的转录动力学。为此,根据既定方案从诱导多能干细胞(iPSC)中衍生出小胶质细胞样细胞(iMGL),并通过短暂地将这些细胞暴露于不同的促炎刺激物,如组织坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、细菌脂多糖(LPS)或预先形成的淀粉样β(1-42)原纤维,进行了脉冲追逐实验。然后,在96-120小时内评估炎症性MG2、MG8和MG10标志物的表达(图2H-J)。MG2 ( CPEB4、LIMK2和FAM129A)和 MG8(LRRK2、GPR155和CYP27A1)表现出持续激活(图2G)。他们发现了富集的转录反应其富含炎症通路,并在早期(4小时)和晚期(24小时)聚集。有趣的是,β淀粉样蛋白原纤维没有引起CPEB4转录激活(MG2状态标记物),但再现了IL1B的早期发作和LRRK2的延迟激活(图2K)。
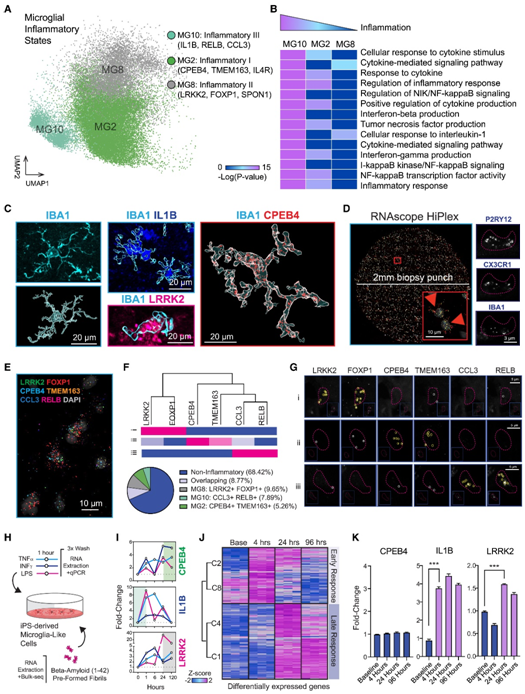
图2. 小胶质细胞炎症状态捕获炎症连续体。
(A) 小胶质细胞三种炎症状态的 UMAP。(B) 三种炎症状态下炎症相关通路的富集。(C) 炎症状态标志物的多重免疫染色。(D) RNAscope 分析。(E) 具有炎症状态探针检测的复合图像的更高放大倍数。(F)对 4 名 AD 受试者的 291 个小胶质细胞进行细胞分数分析。(G) 来自代表性小胶质细胞核的图像,具有离散炎症状态的特征。(H–J) iPSC 衍生的小胶质细胞样细胞 (iMGL) 中炎症状态标志物的转录动力学。(I) 用 TNFα (40 ng/mL)、INFγ (30 ng/mL) 或 LPS (10 ng/mL) 处理 1 小时,并通过 qPCR 进行分析。(J) 用预先形成的β淀粉样蛋白 (1-42) 原纤维进行处理并通过 RNA-seq 进行分析;早期和晚期反应上调基因的热图。(K)响应淀粉样蛋白处理的CPEB4、IL1B和LRRK2表达水平。
03
小胶质细胞状态上游转录因子的预测
接下来,他们进行了单细胞核ATAC-seq (snATAC-seq)分析,获得了41832个高质量的小胶质细胞核,并捕获了三种表观基因组状态,包括一种稳态状态(HOM)和两种激活状态(ACT1和ACT2)(图3A)。尽管P2RY12在所有小胶质细胞中普遍存在可及性,但在激活状态下其可及性信号相对较低,而CCL3在 ACT1 中表现出显著更高的可及性,这表明处于这种表观基因组状态的小胶质细胞可能与免疫反应有关。
小胶质细胞在转录水平上表现出比染色质可及性水平更高的异质性(图1A、3A)。为了研究这些小胶质细胞状态的调控机制,通过在这些表观遗传定义状态的峰值中富集基序来预测转录因子(TF)。尽管几种tf(包括SPI1、IRF8和STAT1)在所有三种状态下都显示出普遍的富集,但这些因子在激活状态下的富集程度要高得多,这可能反映了参与细胞命运维持和炎症程序激活的小胶质tf的动态平衡。
他们发现了 122658 个峰到启动子的链接,涉及 17109 个基因和 46498 个峰,例如处于稳态的CX3CR1附近有一个强信号峰与其启动子相连,CCL3和CSF3R各自在不同的激活状态下具有峰与基因的链接(图 3 B),还通过对小胶质细胞状态标记物远端峰的基序分析,确定了 36 个可以调节小胶质细胞状态的 TF(图 3C)。一些 TF,如炎症 MG8 中的FOXO3,在小胶质细胞状态中显著表达,调节标记基因与其在小胶质细胞炎症激活中的功能相一致(图 3C-D)。同样,HIF1A在 MG7(糖酵解)、MG6(应激)和 MG10(炎症)中高表达并显著调节标记基因,反映了其在糖酵解代谢、小胶质细胞炎症和应激反应中的功能。
为了进一步研究 TF 的调控机制,他们为 HOM MG0构建了 TF 目标调控网络(图 3 E),发现稳态标记通常受到多个转录因子的调节,这表明转录因子可能协同作用,或者转录调控可能是冗余的,以维持系统的稳健性。

图3. TF调控小胶质细胞状态。
(A) 41832 个小胶质细胞核的 UMAP,并在 snATAC-seq 数据中注释了表观遗传状态。(B) 基因启动子和远端峰之间可共同连接的示例,以代表表观遗传状态特异性峰。(C) 与可及峰相关的小胶质细胞转录状态标记基因中的基序富集。(D) 热图显示每个小胶质细胞转录状态下标记基因的 TF 富集。(E) MG0 (HOM) 中的 TF 目标调控网络。
04
人小胶质细胞样细胞稳态主调节因子的异位表达
通过计算iMGL和MG状态的相关评分,他们发现MG12(一种循环状态)和C9(一种代表增殖小胶质细胞的细胞周期基因富集的聚类)之间高度相似(图4A-B)。此外,他们还观察到炎症聚类之间的相似性:MG2和MG10与LPS-富集聚类(C0、C8、C3和C6)有很强的相似性,而MG8与基线时的iMGL(C1和C4)有一定的相似性。正如预测的那样,小胶质稳态MG0状态在imgl中没有表现出来(图4C)。
他们检测了LPS处理对P2RY12水平的影响,并确定LPS显著降低了其表达(图4D),观察到与基线条件相比,用LPS预处理的iMGL对细胞外ATP的反应减弱(图4F)。9 个 TF 的异位表达导致 iMGL 中钙瞬变率显著升高(图 4 F)。与对照组相比,RUNX2和PPARG的过表达减少了iMGL中变形虫样的形状(图4G)。此外,这两种TF与人脑中iba-1阳性细胞中TMEM119的高表达显著相关(图4H-I)。
接下来,他们根据 TF 活性分析测试是否可以通过干扰炎症状态转换的主调节因子来预防小胶质细胞状态动态,推断 LPS 可以诱导状态变化,类似于弱炎症 MG8 到强炎症 MG10 状态(即 iMGL 中的 C1 到 C0)的进展(图 4 A)。
首先从dCAS9-KRAB CRISPRi iPSC细胞系中分化iMGL,并传递总共3对体外转录的小向导rna (sgRNA),靶向模型预测的tf,以驱动炎症从MG8发展到MG10 (FOXO3、HIF1A和FOXP2)。sgRNA传递4小时后,对照(转染的iMGL但没有sgRNA)或CRISPRi(转染MG10 TF的iMGL)细胞用脂多糖(LPS) (10 ng/ml)处理12小时,并进行snrna测序(图4J)。有趣的是,这减弱了MG10炎症特征的表达,以及lps诱导的MG3(核糖体生物发生)、MG5(吞噬)和MG7(糖酵解)特征的富集,但同时获得了MG11(抗病毒)特征的富集(图4K)。通过用iMGL模拟小胶质细胞状态动力学,他们从功能上评估了TF网络活动预测对小胶质细胞状态转变的影响,并为TF驱动的炎症状态进展提供了路线图(图4L)。
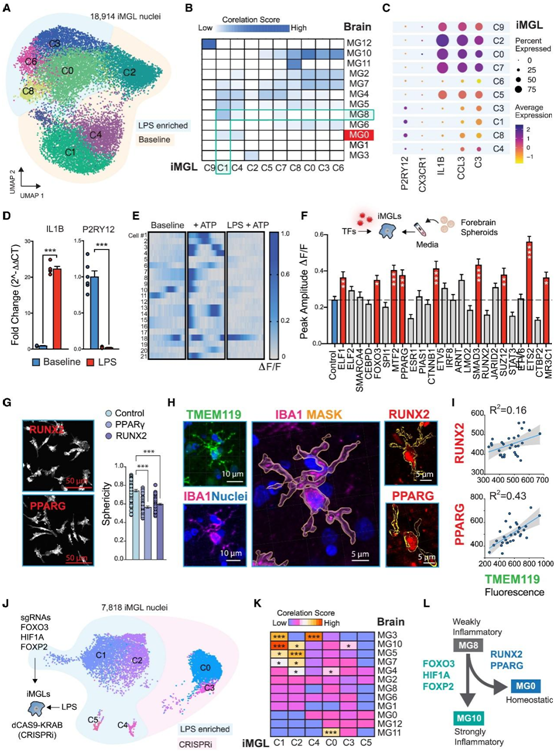
图4. iMGL中TF驱动的小胶质细胞状态动态调节。
(A) 18914 个 iPSC 衍生的小胶质细胞 (iMGL) 细胞核的 UMAP。(B) 从人类死后 snRNA-seq 数据中富集小胶质细胞转录状态中每个聚类的 iMGL 标记基因。(C) 点图显示 iMGL 聚类中标记基因的表达。(D) 10 ng/mL LPS 处理 12 小时后,对 iMGL 中 IL1B 和 P2RY12 表达进行 qPCR 分析。(E)单培养iMGL在基线或在405 nm刺激下ATP释放后钙瞬态的栅格图。(F) 病毒感染后 8 天,暴露于神经元球体 CM 以诱发钙瞬变,进行 TF 过度表达筛选。(G) RUNX2 和 PPARG 过表达和形态学定量的肌动蛋白染色。(H) 人脑组织稳态标记物 TMEM119 和泛巨噬细胞标记物 IBA1 的免疫染色。(I) 将 IBA1 阳性细胞中 PPARG 和 RUNX2 水平与稳态标记 TMEM119 相关的回归分析。(J–K) 来自用 LPS 的靶向FOXO3、HIF1A和FOXP2的 sgRNA 处理的 CRISPRi iMGL 的 UMAP 。(K) 从人类死后 snRNA-seq 数据中富集小胶质细胞转录状态中每个聚类的 LPS 处理的 iMGL 基因。(L) 小胶质细胞状态转变动力学图。
05
AD 中小胶质细胞状态的转录变化
为了研究 AD 进展中小胶质细胞状态的转录变化,他们检测了非 AD 和早期 AD 个体以及早期 AD 和晚期 AD 个体之间的 AD 相关差异表达基因(adDEG)。据效果大小和状态特异性将 1542 个 adDEG 分为 3 个主要类别和 51 个组(图 5 A)。他们发现第6 组中的 473 个差异表达基因(DEG)在至少两种小胶质细胞状态中表现出 AD 阶段特异性变化(图 5B),包括两组在AD进展中上调的组(G1和G2)、在AD早期和晚期下调的组(G25和G26)、一组在AD早期上调和AD晚期下调的组(G49)和一组在 AD 早期下调以及在 AD 晚期上调 (G50)。AD 进展中基因表达的这些阶段特异性变化表明小胶质细胞在 AD 进展过程中具有非线性和动态功能。
接下来,他们对每组进行基因富集分析,并构建基因-基因网络(图 5 C)。他们发现G25中的DEG,包括稳态基因P2RY12和CX3CR1,在AD早期反应的不同小胶质细胞状态下下调,但在晚期反应中没有显著变化(图5B)。这些 DEG 在小胶质细胞迁移、Wnt 信号传导和神经发生的调节中显著富集,表明小胶质细胞 HOM 的损伤可能是 AD 进展的早期事件,还发现 G2 中的 DEG,包括APOE、MSR1和CD74在晚期上调,但在早期没有上调,并且在趋化因子产生、β-淀粉样蛋白清除和胆固醇转运的调节中显著富集,表明与小胶质细胞脂质积累相关的调节功能可能是 AD 的次要效应进展。这些 DEG 在小胶质细胞迁移、Wnt 信号传导和神经发生的调节中显著丰富,表明小胶质细胞 HOM 的损伤可能是 AD 进展的早期事件。他们还发现 G2 中的 DEG,包括APOE、MSR1和CD74在晚期上调,但在早期没有上调,并且在趋化因子产生、β-淀粉样蛋白清除和胆固醇转运的调节中显著富集,表明与小胶质细胞脂质积累相关的调节功能可能是 AD 的次要效应进展。
接下来他们推断这些 DEG 的上游调控因子以研究转录调控机制,总共鉴定了 66 个 TF,其中 41 个在 6 组早期鉴定的 DEG 中显示出显著富集,这些 DEG 在至少两种小胶质细胞状态中显示出 AD 阶段特异性变化(图 5 D)。
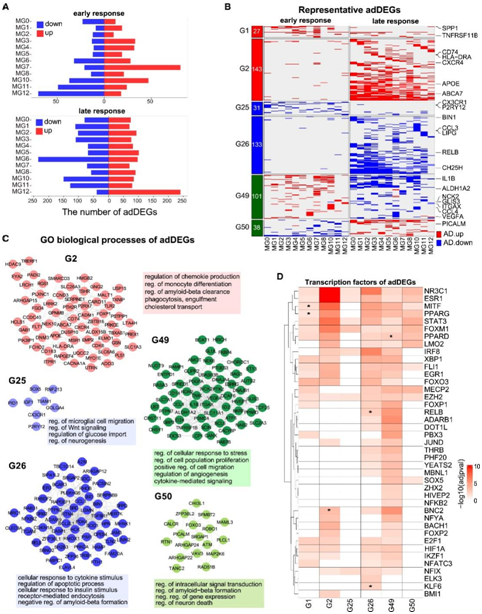
图5. AD中小胶质细胞状态的转录变化。
(A) 条形图显示早期反应和晚期反应中每种小胶质细胞状态下调和上调的 DEG 数量。(B) AD 进展过程中八组中 473 个 DEG 的转录变化。(C)图5B中每组基因的基因-基因网络。(D) 热图显示每组中 DEG 的 TF 富集。
06
小胶质细胞转录状态与 AD 遗传学的关联
炎症性MG8和MG2表现出最显著的富集,MG0(稳态)、MG4(脂质加工)和MG11(抗病毒)也表现出显著的富集(图6A)。值得注意的是,MG4和MG8在AD个体中成比例增加,尽管稳态MG0状态显示细胞比例没有显著变化(图1C),但稳态基因在AD个体中显著下调(图5 B),同时发生炎症和稳态过程下调之间的这种一致性凸显了稳态 MG0、脂质加工 MG4 和炎症 MG8 状态在 AD 进展中的重要性。
除了 AD GWAS 信号中小胶质细胞状态的整体富集之外,他们还发现了 AD 风险基因的小胶质细胞状态特异性表达模式的差异(图6B)。35 个 AD 风险基因在至少一种小胶质细胞状态中高表达(图 6 B)。例如编码脂质受体的TREM2在脂质加工 MG4 中高表达,这与其在 AD 病理学中对小胶质细胞胆固醇代谢的功能一致。
为了检测1542 个 adDEG 是否与遗传变异相关,他们鉴定了小胶质细胞中的单细胞表达 QTL (eQTL),然后进行转录组广泛关联研究 (TWAS),以剖析遗传调控基因表达与 AD 之间的关联。在小胶质细胞中鉴定了 1036 个 TWAS 基因,并发现其中 178 个在 AD 进展中也有差异表达(图 6C),提示这些基因的差异表达可能直接受到遗传因素的调控。基因富集分析显示,这178个基因在细胞内信号转导、细胞迁移、免疫反应和淀粉样蛋白形成的调节方面显著富集(图6D)。
尽管 TWAS 数据将一组 DEG 与 AD 遗传学直接相关,但 TWAS 发现的 AD 风险基因也可能由于间接调控而差异表达。为此,他们测量了每个小胶质细胞状态的早期反应和晚期反应中最重要的 AD 风险和 TWAS 基因的差异表达,并确定了 44 个基因(AD 风险、TWAS)显示差异表达(图6E-F)。在多个状态中,有17个基因在早期阶段表现出差异表达,而34个基因在晚期阶段表现出差异表达,这表明遗传对 AD 基因表达的影响可能是时间敏感的,强调了阶段特异性治疗的潜在意义。
最后,为了研究调节因子之间的潜在调节关系,通过测量两个基因之间的共表达,为潜在的调节因子建立了共表达网络,包括差异AD风险基因(GWAS)、TWAS基因和DEG的上游TF,并将所有比较中的共表达聚合在一起(图 6 F)。他们发现7个调节因子(APOE、BIN1、RELB、PICALM、THRB、ZBTB16和HS3ST1)属于两类(GWAS/TWAS、GWAS/TF或TWAS/TF)。值得注意的是,BIN1 (GWAS/TWAS)和RELB (GWAS/TF)在多种小胶质细胞状态下高度相关并同时差异表达(图6E-F),这与它们作为炎症反应关键调节因子的功能一致。
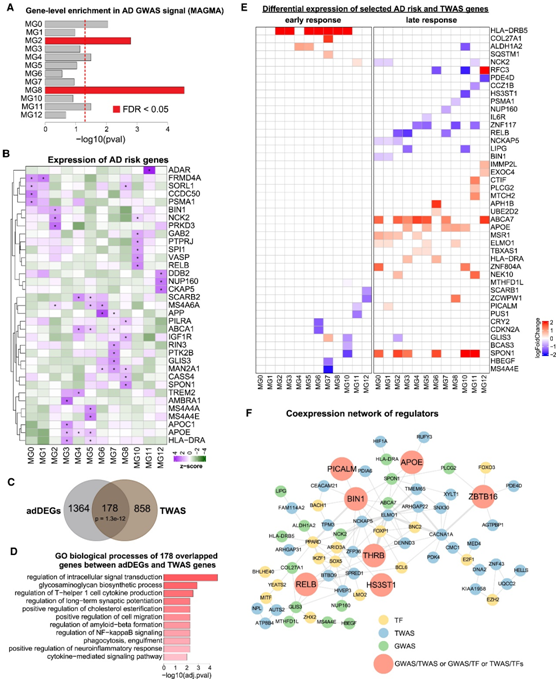
图6. 小胶质细胞转录状态与AD遗传学的关联。
(A) 使用 MAGMA 对 GWAS 信号进行基因水平富集,以将小胶质细胞状态与 AD 遗传学相关联。(B) 12 个小胶质细胞状态中 AD 最高风险基因的表达模式。(C) 维恩图显示 DEG 和 TWAS 基因之间的显著重叠。(D)GO分析。(E) 每个小胶质细胞状态下 AD 早期和晚期 44 个 AD 风险基因或 TWAS 基因的转录变化。(F)调控因子的共表达网络。
+ + + + + + + + + + +
结 论
本项研究分析了 443 名人类受试者和不同AD病理表型的 194000 个单核小胶质细胞转录组和表观基因组,鉴定了 1542 个 AD 差异表达基因,包括小胶质细胞状态特异性和疾病阶段特异性改变。通过整合表观基因组、转录组和基序信息,推断出小胶质细胞状态的上游调节因子、基因调节网络、增强子基因链接和转录因子驱动的小胶质细胞状态转变。稳态激活因子的异位表达会诱导人 iPSC 衍生的小胶质细胞样细胞的稳态特征,同时抑制炎症激活因子可以阻止炎症进展。最后,确定了 AD 风险基因在小胶质细胞状态中的表达以及 AD 风险基因及其调节因子在 AD 进展过程中的差异表达。
+ + + + +



 English
English


