文献解读|Nat Commun(16.6):单细胞分析确定模拟微重力和太空飞行中免疫功能障碍的保守特征
✦ +
+
论文ID
原名:Single-cell analysis identifies conserved features of immune dysfunction in simulated microgravity and spaceflight
译名:单细胞分析确定模拟微重力和太空飞行中免疫功能障碍的保守特征
期刊:Nature Communications
影响因子:16.6
发表时间:2024.06.11
DOI号:10.1038/s41467-023-42013-y
背 景
在低地球轨道 (LEO) 上的宇航员,例如国际空间站 (ISS) 上的宇航员,会经历与微重力环境相关的免疫功能障碍。微重力与免疫功能障碍有关,但其机制尚不清楚。
实验设计
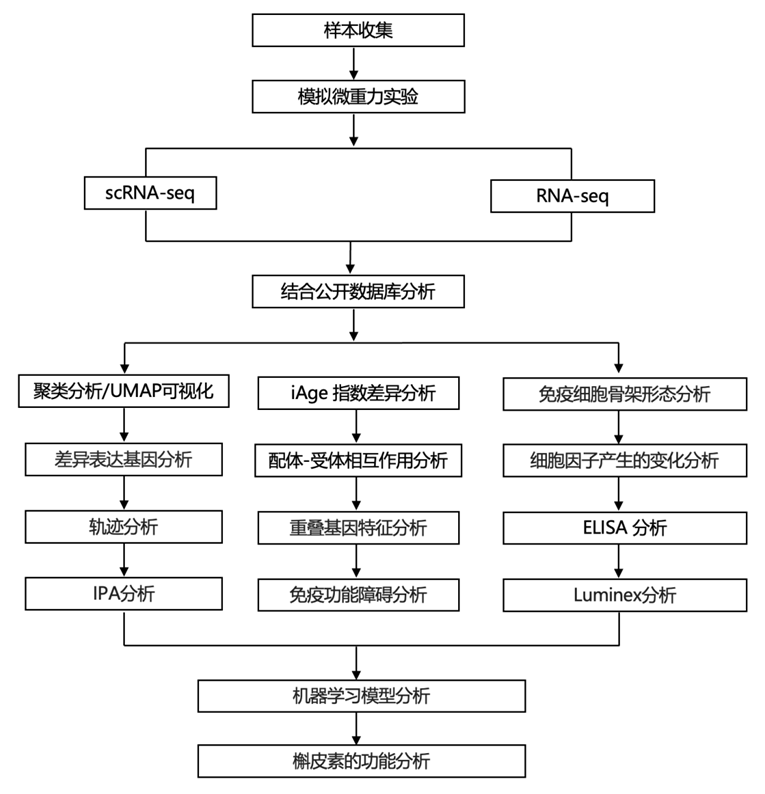
结 果
01
模拟微重力改变单个免疫细胞的转录景观
为了开始了解模拟微重力如何影响免疫细胞功能,研究团队将两名年轻健康捐赠者(一名男性,一名女性)的人类外周血单核细胞 (PBMC)样本装入微重力旋转壁容器 (RWV) 模拟微重力 (uG) 或正常重力 (1G) 静态对照中进行 16 小时的调节。16小时的调节时间点是基于先前的工作选择的,这些工作使用了大约相同的时间,并跟踪了模拟微重力下免疫细胞的转录或蛋白质组学变化。
PBMC要么不受刺激,要么用R848(一种标准TLR7/8激动剂)再刺激9小时。他们选择TLR7/8作为假定的靶点,因为它模拟了病毒感染,并且在大多数人类免疫细胞(包括T细胞)上表达。
在无刺激状态下,经过 25 小时的模拟微重力,通过 UMAP(均匀流形近似和投影)可视化了 28 个免疫细胞聚类,包括粘膜相关不变 T 细胞(MAIT 细胞)、双阴性 T 细胞、γδT 细胞、先天淋巴细胞和浆细胞样树突状细胞等细胞类型,这些细胞类型在模拟微重力下很少研究过(图 1A)。模拟微重力在一定程度上改变了免疫细胞聚类的比例,其中 B 中间细胞和 MAIT 细胞比例受到的负面影响最大,而 CD14 +单核细胞和 CD4 + T 效应记忆 (TEM) 细胞按百分比变化增加最多(图 1B)。在所有免疫群体中,模拟微重力改变了超过4500个基因的表达。该列表细化为一个核心列表,其中包含约 375 个差异表达基因 (DEG),并在火山图上可视化(图1C)。在所有免疫细胞中,模拟微重力下诱导最多的一些基因包括急性反应基因,如s100a8、s100a9、s100a12、thbs1,热休克基因,如hsp90ab1,趋化因子如ccl2、ccl4,铁储存基因(fth1、ftl)和基质金属蛋白酶(mmp9)。模拟微重力条件下减少最多的基因包括干扰素反应 (stat1) 和相关鸟苷酸结合蛋白 (gbp1) 以及冷休克基因(rbm3、cirbp)(图1D)。CD14 +经典单核细胞、CD16 +非经典单核细胞和自然杀伤 (NK) 细胞在主要基因组中表现出最明显的变化,这与短期模拟微重力对先天免疫中最显著的转录变化重编程的直接影响一致。通过单细胞轨迹分析,他们确定了模拟微重力下主要在先天免疫细胞聚类(尤其是单核细胞聚类)中出现的许多轨迹。轨迹分析用于构建描述细胞如何在不同状态下移动的路径,模拟微重力下单核细胞聚类中看到的众多状态可能反映了在模拟微重力下产生不同转录状态的能力增强(图 1E)。
使用从总体群体中选取的 375 个基因核心列表以及主要免疫细胞类型中的 DEG生成的Ingenuity 通路分析 (IPA)(图 1F)表明,单核细胞、常规树突状细胞 2 型 (cDC2)、双阴性 (dn)T 细胞和 NK 细胞表现出最显著的通路改变。模拟微重力在免疫细胞中改变的主要通路包括氧化磷酸化的减少、干扰素信号转导,如干扰素反应中的蛋白激酶 R (PKR)、核受体信号转导 (LXR/RXR、PPAR、AHR)、RHOA 和细胞焦亡信号,以及 BAG2(热休克蛋白 70 相互作用蛋白)信号转导、纤维化信号转导、肌动蛋白运动、RAC、HIF1 信号转导、急性期反应、氧化应激和 sirtuin 信号转导等的增加。
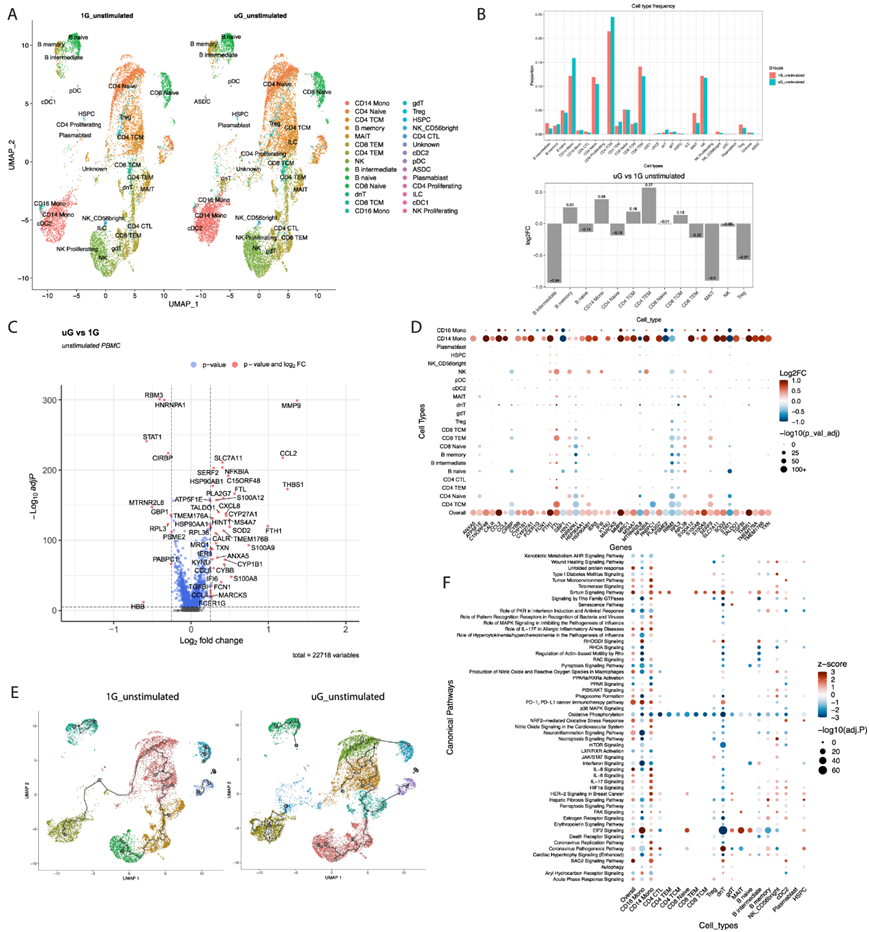
图1. 模拟微重力改变了人类 PBMC的单细胞转录景观。
(a) UMAP可视化。(b) 在模拟 uG 和 1G 条件之间,通过百分比或 log2Fold Change (FC) 对每个单个 PBMC聚类的相对丰度进行量化。 (c) uG 和 1G之间所有免疫细胞类型的差异表达基因 (DEG) 的火山图。(d) 点图显示DEG及其在 22 个免疫细胞群中的表达水平。 (e) 1G 和模拟 uG 未刺激 PBMC的轨迹分析的UMAP。(f) 从Ingenuity Pathway Analysis (IPA) 获得的典型通路富集分析显示在 19 个免疫细胞聚类中。
02
模拟微重力引起免疫细胞的预测性功能改变
鉴于检测到的多种通路与衰老相关的炎症过程有关(即先天免疫力增强而适应性免疫力下降),接下来,他们试图探究暴露于微重力环境是否能刺激细胞的炎症衰老过程,将单个免疫细胞的基因表达特征和整体免疫特征与两个最近开发的衰老炎症特征、炎症年龄 (iAge) 时钟和 SenMayo 衰老相关分泌性炎症产物列表进行了映射。
模拟微重力诱导炎症相关基因显著富集,这与短期模拟微重力可在未刺激的免疫细胞中诱导类似衰老的炎症变化一致(图 2A-B)。其次,由于太空飞行和衰老均与潜伏病毒的再激活相关,因此他们利用元转录组检测器(MTD)管道对单细胞分析中的元转录组进行了挖掘。令人惊讶的是,他们发现仅25小时的模拟微重力就可以诱导潜伏的逆转录病毒和分枝杆菌在人类免疫细胞内的转录,这直接表明微重力本身是潜伏病原体激活的一个触发因素。使用不同的比对工具证实了Meta-转录组的结果,并且仍然可以检测到使用MTD管道观察到的γ -反转录病毒和Mycobacterium canettii转录本的增加。
最后,由于发现与先天细胞(包括具有呈递抗原能力的细胞)相关的基因表达通路发生了强烈变化,他们利用 NicheNet 算法生成了模拟微重力 vs 1G 下人类抗原呈递细胞(APC 加上浆细胞样树突状细胞)和 T 细胞的全面预测配体-受体相互作用组图(图1D-F)。在 APC 供体和受体 T 细胞中,发现了许多显著预测的配体-受体相互作用在模拟微重力 vs 1G 中会升高。例如,单核细胞和树突状细胞诱导 IL-1 蛋白,而一些 B 细胞提供 IL-23A 和 IL-7。所有 APC 都向 T 细胞提供独特的趋化因子信号。Mmp9、ccl2和thbs1是在模拟微重力条件下诱导最显著的基因,这些基因的产物在 T 细胞中显示出不同的预测受体表达(例如 CD44、CD47、ITGB1、CCR4、CCR5),但都显示出 T 细胞中预测的增强靶基因表达。
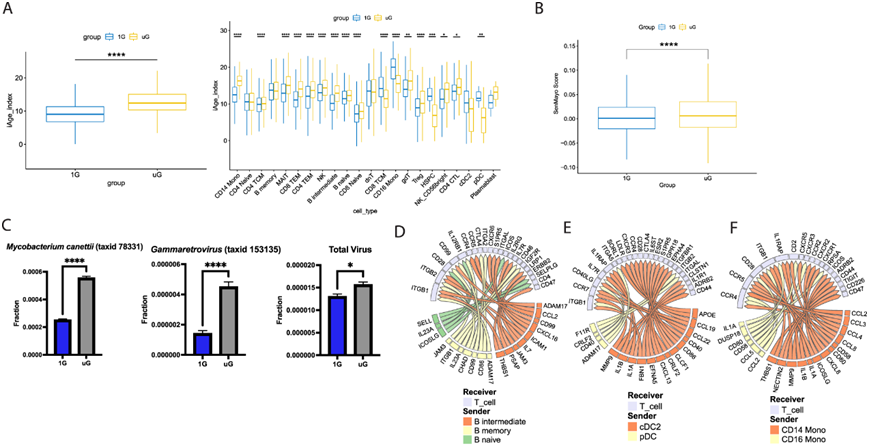
图2. 模拟微重力引起免疫细胞的预测性功能改变。
(a) 1G 或模拟 uG 下所有细胞类型(左)和 22 种单独免疫细胞类型(右)之间的 iAge 指数差异。(b) 根据SenMayo基因集计算的细胞衰老分泌产物评分在1G或模拟uG下所有细胞类型之间的差异。(c) 分枝杆菌、逆转录病毒和总病毒丰度在1G和uG条件下的宏转录组检测。 (d-f) NicheNet 预测在 uG 与 1G 条件下(即在 uG 中诱导超过 1G), 总 T 细胞(接收器)和抗原呈递细胞(发送器)之间的显著配体-受体相互作用。
03
模拟微重力引起的单细胞转录景观
在 1G 和模拟微重力条件下用 TLR7/8 激动剂刺激 PBMC后,他们通过 UMAP 表征了 23 个免疫细胞聚类(图 3A)。与未刺激条件相比,用 TLR7/8 激动剂刺激会诱导 CD4+中枢记忆 (TCM) 细胞的强烈优先扩增(图 3B)。微重力本身会影响对刺激的差异反应。与之前的报告一致,模拟微重力在较小程度上抑制了所有供体的 NK 细胞和 CD8+ TEM 细胞的扩增/反应,以及 MAIT 细胞数量,MAIT 细胞是一种对微重力有先前未知反应的细胞类型。模拟微重力导致 CD14 +单核细胞优先增加,而 1G 对照组则没有,这表明这种细胞类型对模拟微重力和 TLR7/8 激活的结合特别敏感。
在所有细胞类型中,模拟微重力和 TLR7/8 刺激的组合改变了超过 9000 个差异表达基因 (DEG) 的表达。与未刺激数据一样,他们根据 |log2FC| >0.2 将此列表细化为约 317 个 DEG 的核心基因列表。此列表进一步缩小,以在 |log2FC|>0.25 的火山图上可视化(图 3C),仅显示最正向和最负向改变的基因。模拟1G以上微重力条件下,TLR7/8激动剂诱导最多的基因包括细胞因子和趋化因子(如ccl8、ccl4、ccl7、cxcl8和il1b),以及急性反应蛋白(如s100a8、s100a9、s100a11和thbs1)。在模拟微重力条件下诱导的其他基因与色氨酸分解(ido1)、线粒体抗氧化防御(sod2)、细胞骨架(rhoq)和铁储存基因(如fth1、ft1)相关。在 TLR7/8 刺激期间,将模拟微重力与 1G 进行比较时,下调最多的基因包括属于鸟苷酸结合蛋白的基因(gbp1、gbp2、gbp4、gbp5),以及干扰素通路基因(如irf1、stat1、isg20、ifi16)、冷休克基因(rbm3、cirbp)、细胞杀伤基因(prf1、gzmb)和 T/NK 细胞活化标记物如cd69。其中许多基因在没有刺激的情况下仅通过模拟微重力就会发生持续改变,表明反应仍然保守,即使在使用 TLR 配体的额外外源刺激下也是如此。他们还发现了 19 个免疫细胞群中排名靠前的 DEG 的表达(图3D)。CD14+单核细胞、NK 细胞、CD8 + TEM 和 CD4+TCM 细胞在模拟微重力条件下 TLR7/8 激动剂刺激引起的最显著改变基因中表现出最显著的变化。有趣的是,使用单细胞轨迹分析(图 3E),与 1G 对照相比,用 TLR7/8 刺激的模拟微重力中的轨迹更少。这些发现表明,在模拟微重力下,细胞在刺激后表现出较低的分化状态。
使用来自总体人群的大约317个基因的核心列表以及主要免疫细胞类型的DEG产生的IPA结果表明,在微重力和TLR7/8诱导期间,几乎所有的免疫细胞都在许多通路上发生变化(图3F)。
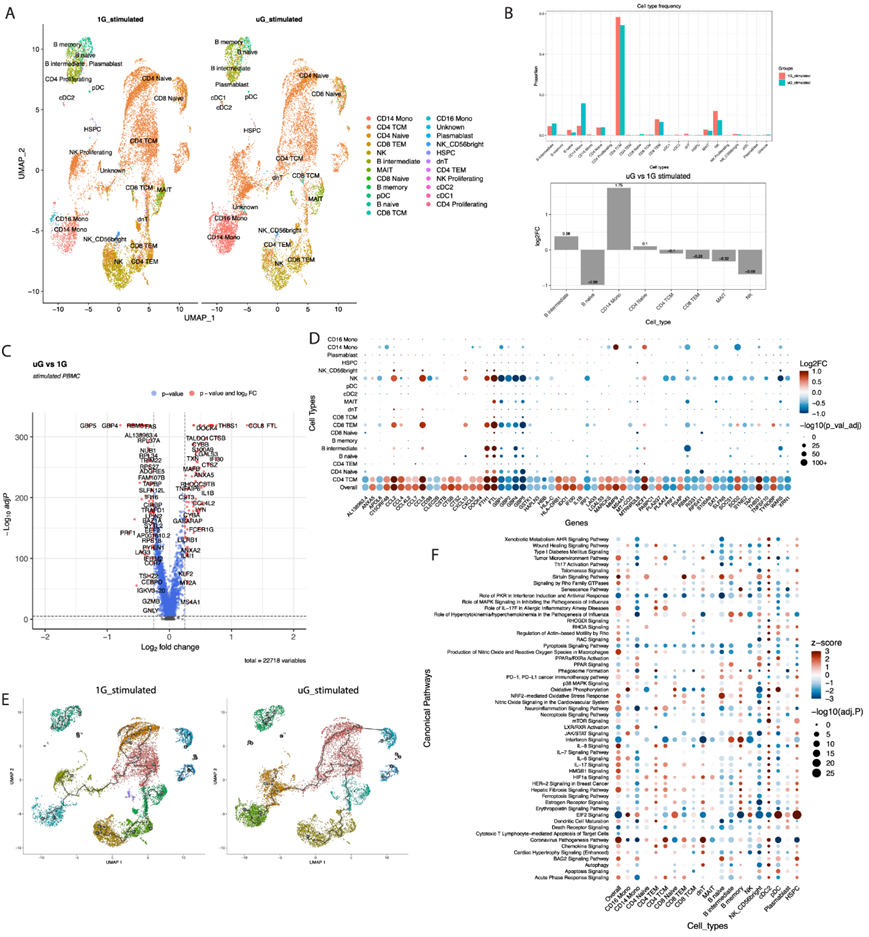
图3. 模拟微重力在 TLR7/8 刺激后诱导人类 PBMC 出现独特的单细胞转录景观。
(a) TLR7/8 激动剂刺激的PBMC 单细胞转录组学的 UMAP 图。(b) 在刺激的 uG 和 1G 条件之间,按百分比或 log2FC 量化每个单个 PBMC聚类的相对丰度。(c) TLR7 /8 激动剂模拟的 uG 和 1G 之间所有免疫细胞类型的 DEG 火山图。(d) 点图显示DEG及其在 19 个免疫细胞群中的表达水平。(e) 1G 和模拟 uG TLR7/8 激动剂刺激的 PBMC 的轨迹分析的UMAP。(f) 从 IPA 获得的 19 个免疫细胞聚类的典型通路富集分析。
在模拟微重力下,大多数免疫细胞中减少的主要通路包括干扰素反应中的 PKR(和相关的 eif2 信号传导)、干扰素信号传导、JAK/STAT 信号传导、细胞焦亡信号传导、细胞毒性 T 细胞介导的靶细胞杀死和死亡受体信号传导。短期模拟微重力诱导的主要途径包括 sirtuin 信号传导、纤维化信号传导、Rho GTPases 信号传导、BAG2(热休克蛋白 70 相互作用因子)信号传导、HIF1α 信号传导、急性期反应和相关的 HMGB1 信号传导等。这些通路与微重力促进先天性炎症相一致,但以干扰素驱动的适应性免疫和适应性免疫效应功能(例如CD8 + T 细胞杀死)为代价。尽管仅在模拟微重力下改变的通路有一些相似之处(图 1F),但与 1G 对照相比,实际上在模拟微重力加 TLR7/8 中检测到所有免疫群体的整体iAge 评分较低(图 4A)。虽然这一发现的原因尚不清楚,但它似乎是由于幼稚 B 细胞、幼稚 CD4 + T 细胞的评分显著降低,以及研究较少的 PBMC 群体、造血干细胞和祖细胞 (HSPC) 和双阴性 T 细胞的减少所致。较低的 iAge 也可能反映模拟微重力下免疫激活的改变,例如在 CD16 +单核细胞中所见(图 4A)。尽管 iAge 有所降低,仍然观察到模拟 PBMC中的 SenMayo 评分增加 (图 4B),说明这两组基因中基因的组成不同。
NicheNet分析了TLR7/8激动剂和1G刺激后T细胞的主要APC类型(图4C-E),说明了TLR7/8刺激后模拟微重力中使用的一些重要的细胞因子、趋化因子、表面分子配体和受体。与未受刺激的相互作用组相比(图2D-F),他们看到使用的炎症细胞因子和趋化因子的产量和多样性增加,再次观察到APC产生IL-1,但也观察到为调节T细胞功能而优先产生的TNF超家族产物增加,如TNF、TNFSF12(TNF相关凋亡弱诱导剂:TWEAK)和TNFSF15(血管内皮生长抑制剂:VEGI)和淋巴毒素(LTA)。
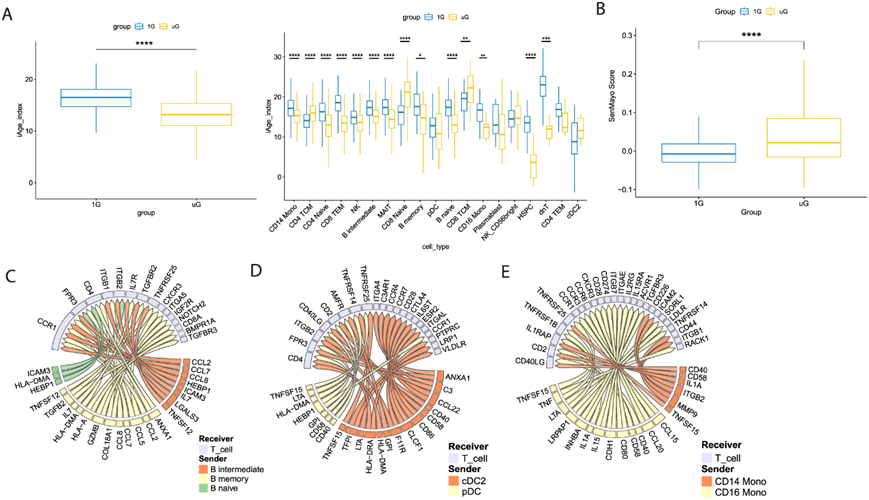
图4. 模拟微重力在 TLR7/8 刺激后引起免疫细胞的预测性功能改变。
(a) 在 1G 或模拟 uG 中 TLR7/8 激动剂激活后,所有细胞类型(左)和 19 种单个免疫细胞类型(右)之间的 iAge 指数差异。(b) 使用TLR7/8激动剂激活1G或模拟uG的所有细胞类型之间,根据SenMayo基因集计算的细胞衰老分泌产物评分的差异。(c-e) NicheNet预测了总T细胞(受体)和抗原呈递细胞(发送者)之间显著的配体-受体相互作用。
04
单细胞验证确定了微重力和太空飞行中免疫功能障碍的核心特征
接下来,为了在模拟微重力下更好地验证不含 TLR7/8 激动剂的单细胞特征中保守的基因和通路,他们将 375 DEG 的核心特征与其他数据集进行了比较。首先,在从年轻捐赠者中新鲜分离的 PBMC 验证队列中重复实验,并将这些 PBMC 旋转 25 小时,然后进行bulk 转录组分析(bulk RNA-seq)。在模拟微重力中旋转的验证样本与 1G 对照之间,他们鉴定了 2149 个差异表达基因(图 5A)。虽然不同捐献者之间不同细胞群的bulk RNA-seq数据本身存在差异,但仍然发现,在 1G 和模拟微重力条件下,数据集之间每个特定基因的标准化基因数存在高度显著的相关性(图 5B)。此外,他们从单细胞分析中发现,所有免疫细胞中超过 28% 的核心特征基因(相同方向性)存在重叠(图5C)。许多诱导的重叠基因与从单细胞数据中发现的最强烈改变的核心通路一致。例如,他们看到在急性免疫反应中诱导的重叠基因(如s100a8、s100a12、thbs1、il1b)、趋化因子(如cxcl8)、热休克蛋白(hsp90aa1、hspa1a、hspb1)、自噬(atg7)和肌动蛋白细胞骨架(rhou)。在模拟微重力条件下,重叠减少的基因包括干扰素反应(stat1、irf1)和相关鸟苷酸结合蛋白(gbp1、gbp2、gbp4、gbp5)以及冷休克基因(rbm3)等。总体而言,核心单细胞 DEG 在验证队列中表现出高度显著的富集和过表达(图 5C)。
接下来,他们试图验证在低地球轨道飞行的小鼠和人类身上的重叠基因。虽然低地球轨道存在多种压力源,但靠近地球以及地球磁场的存在会抵消银河宇宙射线的一些影响,尤其是在国际空间站的高度。因此,微重力在推动低地球轨道表型变化方面起着重要作用。为了实现这一目标,他们首先从 NASA 的 GeneLab 数据库中挖掘数据,研究了在国际空间站飞行的小鼠的主要免疫器官——脾脏。GLDS-420 研究提供了十只在国际空间站居住 33 天的小鼠的脾脏数据,以及十只地面对照小鼠的脾脏数据。从 GLDS-420 数据集中,他们鉴定出 1448 个显著的 DEG(图 5D),其中 50/375(13.3%)与本项研究的单细胞核心列表在同一方向上重叠(图 5E)。有趣的是,许多重叠基因都表示为单细胞数据中改变的核心通路的一部分。例如,在急性免疫反应或补体(如c3)、自噬(atg7)、热休克反应(hsp90ab1、hsp90aa1、hspa1a、hspa1)和细胞骨架(dynll1)中看到了共享的诱导重叠基因。重叠减少的基因包括干扰素反应(stat1)以及冷休克基因(cirbp、rbm3)等。总体而言,他们发现太空飞行的小鼠脾脏中的核心单细胞 DEG 显著富集(图 5E)。
为了更好地将单细胞图谱的实用性转化为载人航天研究,他们将模拟微重力下单细胞的 375 个 DEG 核心列表与Inspiration-4 (I4)机组人员的所有单细胞的变化进行了比较。I4 任务提供了一个引人注目的比较,因为机组人员在低地球轨道上待了三天,这个时间线与本项研究25 小时的时间点相差不大。此外,I4 基因列表也是通过scRNA-seq生成的,使其成为分析的可比技术。然而,值得注意的是,I4 数据集包含一些重要的注意事项。首先,I4 机组人员飞行的高度(585 公里/364 英里) 使宇航员更容易受到比国际空间站通常经历的更高的辐射暴露(408 公里/254 英里高度)。此外,I4 数据集来自于飞行后(在本项研究的案例中为返回后 1 天/R + 1)与飞行前(在本项研究的案例中为发射前 44 天/L-44)PBMC 基因表达比较。由于 I4 单细胞数据的变化代表了涵盖太空飞行影响的变化,以及返回地面,包括短期暴露于超重力,以及返回 1 G重力一天(所有这些都表现为在飞行条件下重力暴露增加),他们认为返回时任一方向重叠的免疫细胞基因都是重力敏感基因。值得注意的是,他们发现模拟微重力下 PBMC 中近 60% 的 DEG 有非常强的重叠,并且在 I4 任务中所有免疫细胞中也发生了显著改变(图 5F)。在 I4 数据中这些显著改变的基因中,122 个改变的方向与 I4 数据相同,88 个改变的方向相反。为了更好地了解重力和太空飞行对免疫系统的影响的通路和机制,他们比较了模拟微重力和整个 I4 数据集之间的通路。
模拟微重力和I4任务途径结果均表明T细胞效应亚群发育减少、氧化磷酸化降低、与先天免疫相关的通路(例如冠状病毒发病机制、单核细胞中的FcR吞噬作用、细胞因子风暴、趋化因子信号传导、巨噬细胞中的ROS产生)以及缺氧和糖酵解代谢(HIF1α信号传导)和细胞应激(例如sirtuin信号传导)。有趣的是,I4任务中观察到的恢复重力逆转了自然杀伤细胞信号传导的减弱,并逆转了与较差的适应性免疫相关的通路,如IL-15信号传导,表明这些途径可能对重力的急性变化敏感(图 5G)。从 I4 数据集中,他们还注意到 I4 数据中的核糖体亚基基因持续减少(图 5F),这可能反映了返回地球后的应激反应和蛋白质翻译减少,并且在模拟微重力条件下只有其中一些基因减少。在提供的 I4 DEG 中,EIF2 信号持续显著减少。在所有通路中,无论方向如何,都注意到许多与细胞骨架或机械细胞外环境有关的通路(例如纤维化、RAC、Rho 家族 GTPases、RHOA、整合素信号、白细胞外渗信号、愈合信号等)会因模拟微重力或太空飞行对免疫细胞的影响而发生改变。
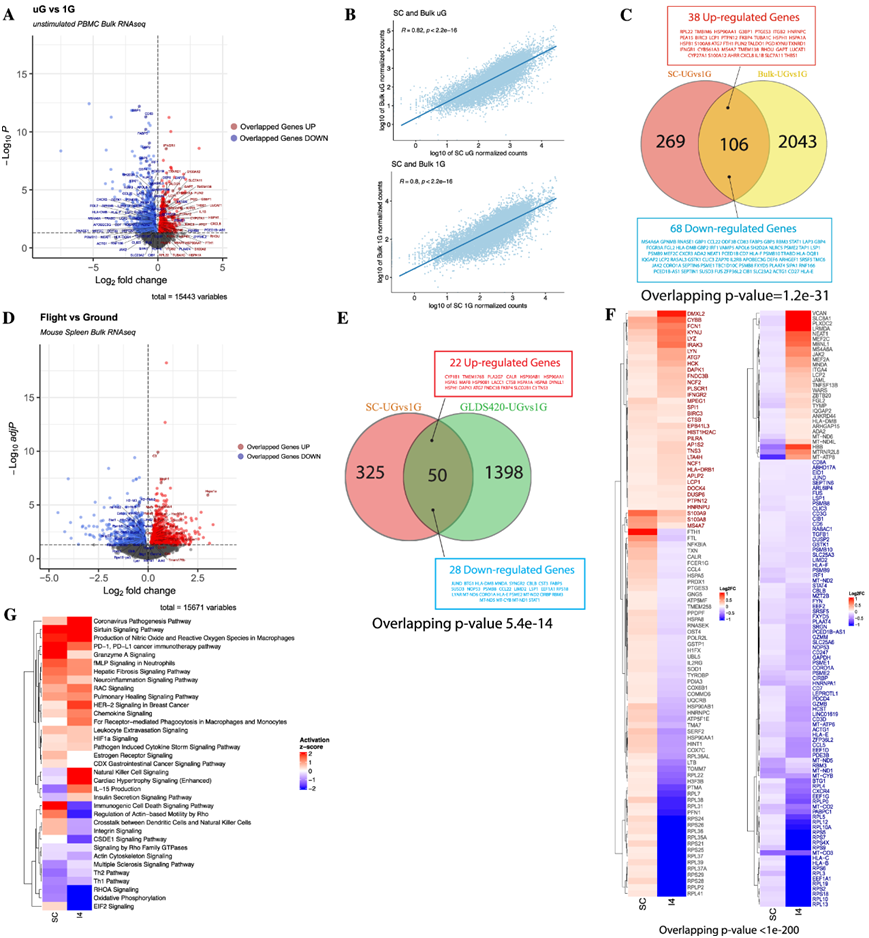
图5. 单细胞特征的验证确定了模拟微重力和太空飞行中免疫功能障碍的重叠特征。
(a) 模拟 uG 与 1G(25 小时)bulk RNA-seq的 DEG 火山图。 (b) 在模拟uG和1G条件下单细胞和bulk RNA-seq之间标准化计数的Spearman相关性。 (c) 维恩图总结了单细胞和bulk RNA-seq之间重叠的 DEG。(d) 飞行与地面小鼠bulk RNA-seq (GLDS-420) 的 DEG火山图 。(e) 小鼠直系同源 DEG 之间的重叠 DEG 。(f) 人类 PBMC数据集之间重叠 DEG 的热图。 (g) 从人类 PBMC SC(单细胞 RNA-seq uG vs 1G)和 I4(n = 4,R + 1 vs L-44)之间的 DEG 中富集的 IPA 典型通路热图。
05
细胞骨架形态和细胞因子产生的明显变化
鉴于在模拟微重力条件下改变的许多通路涉及预测的线粒体功能障碍和/或细胞骨架,他们使用 Airyscan 超分辨率共聚焦显微镜来表征免疫细胞线粒体和肌动蛋白形态网络,以寻找与 1G 对照相比模拟微重力条件下的变化。有趣的是,虽然 25 小时的模拟微重力并没有改变 PBMC 的平均细胞面积,但它确实改变了肌动蛋白粒度参数以及强度和方差,这与急性模拟微重力条件下的细胞骨架变化一致(图 6A-C)。使用三维 (3D) 超分辨率成像,25 小时的模拟微重力不会改变细胞或细胞核体积或细胞核形状,但会增加平均细胞表面积和肌动蛋白尖峰长度,并降低 PBMC 中细胞的球形度(图 6A-D)。值得注意的是,1G 免疫细胞和模拟微重力免疫细胞在 TLR 刺激后表现出肌动蛋白重排的独特光谱变化,因此 TLR 刺激导致 1G 中的肌动蛋白粒度光谱变化模式与模拟微重力下的刺激不同(图 6C)。微重力对未刺激免疫细胞中细胞骨架的影响类似于 1G 中 TLR 激活的影响。在模拟微重力下的 TLR 刺激期间,免疫细胞遵循独特的动态肌动蛋白重排模式,甚至可能逆转在 1G 中通过 TLR 刺激观察到的模式。这些结果表明,模拟微重力本身可能会诱导免疫细胞骨架改变,这可能模拟 TLR 对细胞骨架的连接。短期暴露于模拟微重力显示线粒体 MitoTracker Red 染色强度和方差在未刺激条件下有所增加,而纤维长度、大小或体积没有变化。
由于检测到肌动蛋白网络的形态变化,并注意到多个数据集中多个改变的细胞骨架相关通路的变化,包括“Rho 家族 GTPases 的信号传导”或“Rho 对肌动蛋白运动的调节”通路,接下来他们试图使用 ELISA 技术在更多批次的分离配对 PBMC中筛选活性 GTP 结合 Rho GTPases、Rac1、RhoA 和 Cdc42。在模拟微重力 25 小时后,无论刺激条件如何,他们都看到活性 GTP 结合 Cdc42 水平升高,这与模拟微重力导致的细胞骨架动员和肌动蛋白尖峰(表明存在丝状伪足)的增加相一致(图 6E)。
他们试图研究微重力条件下免疫细胞中 IFN 信号减弱的核心特征(图 6F)。具体而言,他们评估了干扰素信号减弱是否是由于局部干扰素产生减少所致。通过 ELISA 评估了 25 小时未刺激或 9 小时 R848 模拟(总培养 25 小时)PBMC 上清液中的总 IFNα(检测 12 种 IFNα 亚型)和 IFNγ。模拟微重力在 TLR7/8 刺激下显着降低 IFNα 和 IFNγ 的分泌。在基线时,这些细胞因子的水平很低且多变,因此在 1G 和模拟微重力之间没有显著差异。这些发现表明,至少在 TLR 刺激下,模拟微重力下 IFN 的产生减少,这可能是导致转录水平上干扰素信号减弱的一种机制。
与scRNA-seq和RNA-seq数据一致,模拟微重力与主要先天/单核细胞衍生的炎性细胞因子和趋化因子(例如 IL-6、IL-8、IL-12p40、CCL4)的增加或趋势增加有关,同时与 T 细胞活化或增殖相关的细胞因子(例如 IL-2、IL-7、IL-15)的减少相关。Luminex 结果显示,在模拟微重力下,TLR7/8 激动剂刺激后,IFNγ 显著减少,IFNα2 呈趋势减少,这与上述 ELISA 数据一致(图 6F)。在测序数据中通常会诱导的 IL-1 在模拟微重力下也似乎升高,尽管它表现出高度可变性,从而排除了在未刺激状态下的显著性。在刺激状态下,通过 Luminex 分析,IL-1β 在模拟微重力下显著增加。鉴于 Luminex 数据和测序数据中 IL-1β、IL-6 和 IL-8 的细胞因子存在重叠的相似性,他们进一步通过 ELISA 验证评估了这些细胞因子。在模拟微重力下,通过 ELISA 检测,IL-6 和 IL-8 均呈显著或接近显著增加,而 IL-1β 呈趋势增加(图 6G)。
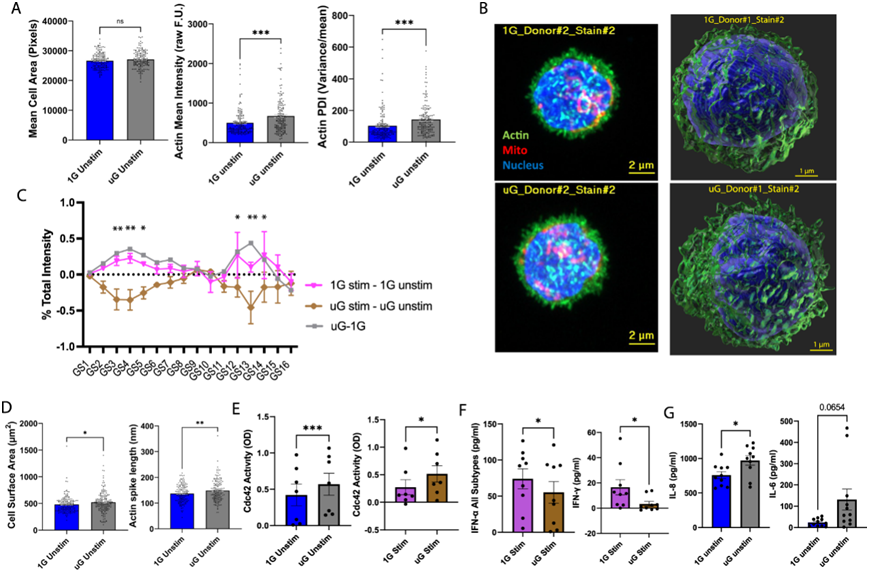
图6. 模拟微重力会引起免疫细胞细胞骨架形态和细胞因子产生的明显改变。
(a) 在 25 小时的 1G 或模拟 uG 之间,对肌动蛋白进行 2D 超分辨率显微镜分析,以了解细胞面积(左)、强度(中)和纹理(右)。 (b) 代表性超分辨率显微镜图像(左图为 2D,右图为 3D)。(c) 用TLR7/8激动剂刺激的PBMC的16通道粒度光谱测量。(d) 在1G或模拟uG的25小时内,超分辨率显微镜分析三维肌动蛋白表面积(左)和肌动蛋白尖峰长度(右)。(e) gtp结合Cdc42活性。(f) 用 TLR7/8 激动剂(16 小时调节 + 9 小时刺激)处理的 PBMC从 1G 和模拟 uG 分泌的 IFN 的 ELISA 水平。(g) ELISA法测定PBMC在模拟uG和1G作用25小时后分泌的IL水平。
06
逆转模拟微重力对免疫系统的影响
他们已经确定了免疫系统中由模拟微重力改变的多个基因和通路;然而,是否有特定的药物或补充剂可以直接靶向微重力对免疫细胞的影响尚不明确。因此,他们利用基于HyperFoods模型的内部复合-基因相互作用组机器学习技术(Gene Compound Enrichment Analysis, GCEA),识别了显著映射到数据集中改变基因的药物和食品补充剂。总的来说,该流程评估了200万基因、药物和食品之间的相互作用,横跨DrugBank、LINCS和FoodDB多个数据库(图7A)。
使用这些算法,他们在整个免疫系统中模拟微重力改变的 375 个 DEG 的核心特征中,鉴定了数百种相关化合物(图 7B)。接下来,他们选择了一种化合物,槲皮素(因为它对于未来的太空旅行者来说非常普遍,并且作为抗衰老补充剂非常突出)以验证它是否可以逆转微重力对免疫系统的转录损伤。PBMC(来自图 5A队列的捐赠者)在模拟微重力下放置 25 小时,加入或不加入槲皮素(50 μM),进行RNA-seq。值得注意的是,在基因水平上,槲皮素逆转了 106 个基因中 70% (74/106) 的表达方向,这些基因是单细胞和RNA-seq数据之间显著重叠的基因(图 7C)。相关性分析表明基因表达逆转是显著的(图 7C),GSEA 富集图也证明了这一点(图 7D)。然后进行 IPA 通路分析以表征槲皮素改变的通路,并与未处理的RNA-seq对照以及其他 3 个主要数据集(包括单细胞测序和太空中的 GLDS-420 脾脏)中改变的通路进行比较。总体而言,所有数据集的通路分析显示模拟和实际微重力对最佳免疫所必需的通路产生一致的影响(图 7E)。在模拟微重力和/或太空中,一些最持续诱导的通路包括“冠状病毒发病通路”(与先天免疫激活有关)、急性期反应、白细胞外渗信号、IL-6 信号、BAG2 信号(与热休克蛋白和蛋白质稳态有关)、sirtuin 信号,以及程度较小的“Rho 对肌动蛋白运动的调节”、RAC 信号、PKA 信号和氧化应激反应。微重力减弱的主要通路与免疫有关,包括抗菌免疫、细胞焦亡信号以及“干扰素信号”(包括 IFN 诱导中的 PKR)。大多数数据集中其他减少的通路包括核受体活化减少(包括 LXR/RXR、PPAR、AHR)和 T 细胞 NUR77(激活)信号减少。有趣的是,他们注意到一些基因在所有数据集中持续减少,尽管在通路分析中没有得到正确的体现。这些基因中最引人注目的是冷休克蛋白rbm3,它在四个微重力数据集以及 I4 和 JAXA 任务(30 天时间点)中均显著减少。在 Twins 研究飞行数据中,所有分类免疫细胞中的Rbm3也减少了,但并未达到显著性。
在模拟微重力环境下注射槲皮素可以逆转模拟微重力对免疫系统引起的许多改变的转录特征(图 7E)。它可以逆转的一些主要途径包括“Rho 对肌动蛋白运动的调节”、白细胞外渗信号转导、RAC 信号转导、LXR/RXR、PPAR 信号转导、T 细胞中的 NUR77 信号转导、“冠状病毒发病机制”(先天免疫)、急性期反应、纤维化、IL-6 信号转导等。在模拟微重力环境下,槲皮素可以降低衰老和与年龄相关的炎症基因输出,这可以通过 SenMayo 和 iAge 指数评分的降低来证明(图 7F)。槲皮素还表现出在模拟微重力 25 小时后降低 ROS 水平的强大能力(图 7G)。

图7. 利用槲皮素逆转模拟微重力对免疫系统的影响。
(a) 微重力和基因相互作用化合物从发现到验证的流程。 (b) 前50 个模拟 uG 改变基因与化合物相互作用候选物的热图。(c) 槲皮素 (50 μM) 逆转了模拟 uG (25 小时)中的核心基因表达特征。(d) 基因 集富集分析 (GSEA)。(e) IPA槲皮素改变的典型途径。(f) 槲皮素可降低衰老和与年龄相关的炎症基因输出。 (g) 槲皮素降低了ROS 水平。
+ + + + + + + + + + +
结 论
本项研究发现微重力会改变最佳免疫的特定通路,包括细胞骨架、干扰素信号传导、细胞焦亡、温度休克、先天性炎症(例如,冠状病毒致病途径和 IL-6 信号传导)、核受体和 sirtuin 信号传导。微重力会影响单核细胞炎症参数,并削弱 T 细胞和 NK 细胞功能。利用机器学习,识别出多种将微重力与免疫细胞转录联系起来的化合物,并证明黄酮醇槲皮素可以逆转大多数异常通路。这些结果确定了微重力下免疫细胞的变化,并为在太空中保持正常免疫力的对策提供了机会。
+ + + + +



 English
English


