文献解读|Nat Commun(16.6):人体皮肤的空间多组学揭示了 KRAS 和航天飞行的炎症反应
✦ +
+
论文ID
原名:Spatial multi-omics of human skin reveals KRAS and inflammatory responses to spaceflight
译名:人体皮肤的空间多组学揭示了 KRAS 和航天飞行的炎症反应
期刊:Nature Communications
影响因子:16.6
发表时间:2024.06.11
DOI号:10.1038/s41467-024-48625-2
背 景
无论是短期还是长期的太空飞行,人体都会暴露于太空环境所特有的各种因素中,包括失重(例如微重力)、辐射增加、隔离和禁闭。皮肤是人体最大的器官,也是另一个对环境变化敏感的关键生理系统。人体皮肤具有多种功能,包括物理和免疫保护、支持微生物群(包括细菌、古菌、真菌和病毒)的稳态、体温调节、液体潴留和新陈代谢。太空飞行可以改变代谢、免疫和生物体内平衡,并引起皮疹和刺激,但其分子基础仍不清楚。
实验设计
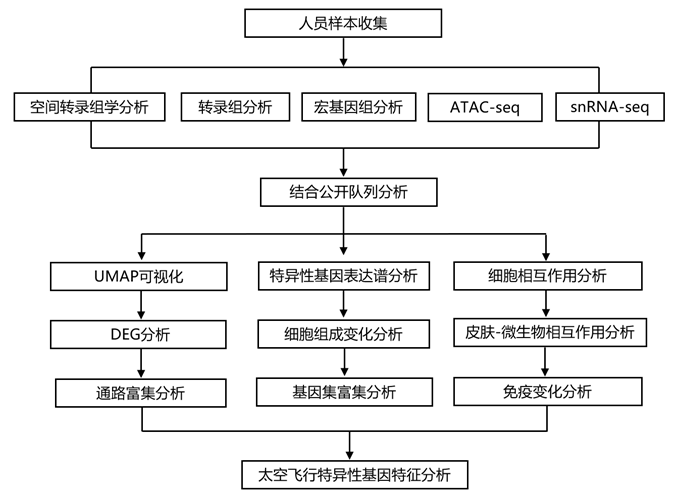
结 果
01
响应太空飞行的转录组范围的变化
为了了解太空飞行对皮肤和组织微环境的影响,研究团队对灵感4号(Inspiration4)机组人员上臂的 4 毫米皮肤穿刺活检样本进行了配对,以进行病理学评估和空间转录组学分析(图 1a)。总共使用 GeoMx 全转录组分析探针组(18422 个探针)在 16 张载玻片上收集了 95 个感兴趣区域 (ROI)进行处理。根据成像结果,选择了四种感兴趣的区域类型,包括外表皮 (OE) 和内表皮 (IE)、外真皮 (OD) 和脉管系统 (VA)。他们还对活检样本进行了皮肤组织病理学分析,结果显示组织形态或大体结构没有明显异常或变化。
从 GeoMx 空间转录组学分析数据来看,所有 ROI 的无监督聚类都显示出围绕区室身份的大量聚类(图1b)。通过比较太空飞行后和太空飞行前的样本,差异表达基因(DEG)分析发现,95 个基因显著上调,包括ARHGAP31、GALNT9、CPNE2、NMB、GPR50、CLDN2、OOSP2,121个基因下调,例如AP3B1、LMNA、COL6A2、VIM、HLA-B、PPP1CB、PABPC1(图 1c)。此外,根据 DEG 分析,与细胞连接和细胞外基质相关的蛋白质[特别是来自波形蛋白(VIM)和角蛋白(KRT)家族的蛋白质]是主要丢失的转录本。
通路分析表明,kirsten 大鼠肉瘤病毒致癌基因同源物 (KRAS) 信号通路具有统计学显著富集,而与细胞连接和蛋白质(即顶端连接、未折叠蛋白反应)相关的转录本减少(图 1d)。根据表达水平,估计每个 ROI 的细胞类型组成并比较各个时间点。他们还观察到主要皮肤细胞类型和免疫细胞(例如黑素细胞、周细胞、成纤维细胞和 T 细胞)的细胞类型相关基因特征具有统计学显著下降(图 1e)。
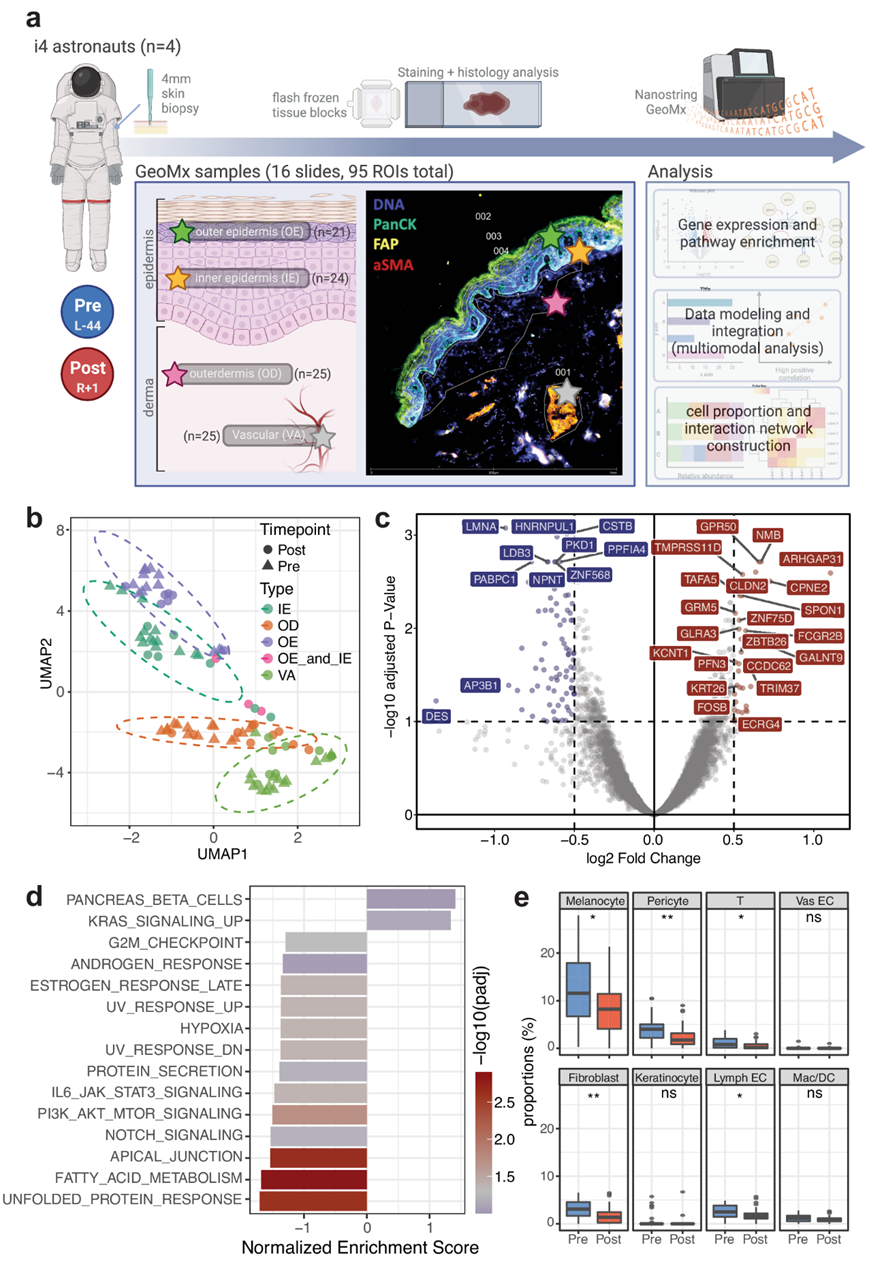
图1. 实验设计和总体前后时间点比较。
(a) 具有代表性组织染色图像的实验设计和工作流程。 (b) 对收集的所有 ROI 进行均匀流形近似和投影 (UMAP)。 (c) 整体太空飞行后与太空飞行前 DEG 的火山图。(d) 比较太空飞行前后皮肤组织的 DEG 的通路富集分析。(e) 太空飞行前后样本之间的细胞比例比较。
02
区域特异性表达和太空飞行引起的变化
然后,他们研究了每个 ROI 类型特征(OE、IE、OD 和 VA)在航天前后样本中的区域特异性表达变化。OE 和 IE 区域分别基于颗粒层和棘层/基底层选择并与其相对应。通过捕获基底细胞层(因此主要是乳头状层)内至少200个细胞来选择OD ROI,而根据上皮细胞(FAP)和成纤维细胞(αSMA)染色收集VA ROI(图 1a),他们观察到了每个 ROI 特征和时间点特有的转录本(图S3b-c)。
对于每种 ROI 类型,他们都进行了DEG分析,比较了飞行后样本和飞行前样本(图 2a)。发现成纤维细胞和连接基因(如DES、ACTA2、TLN1、TAGLN )相关的转录本减少,特别是在血管部位(VA)附近。KRT14以及其他角蛋白家族转录本(KRT1、5 和 10)的丢失主要在真皮层(OD)。通过这些 DEG 的交集来识别跨 ROI 类型的独特和重叠基因,证实了大多数基因重叠发生在彼此相对较近的 ROI 类型内(即 VA 和 OD)(图 2b)。在组织内层(OD 和 VA),他们发现与应激和生长因子相关通路相关的重叠 DEG,例如COL6A2、CRKL、HLA-B。
基因集富集分析(GSEA)显示,KRAS信号和炎症反应在所有区域持续增加,而特定免疫途径如干扰素α和γ反应仅在表皮区域(OE和IE)显示出正向富集(图 2c)。DNA修复、细胞凋亡、紫外线反应、活性氧等通路仅在OE中富集。他们观察到所有区域中与线粒体代谢有关的基因(例如myc靶基因和氧化磷酸化)的下调,特别是在IE和OD ROI中更为明显。此外,肌肉生成途径和EMT相关基因在VA ROIs中的富集得分显示出更大的下降,强调了对太空飞行的区域和层特异性反应。将通路水平的变化与来自同一任务(NASA 双胞胎研究,尽管暴露时间不同)的血液测序数据集进行比较,发现 KRAS 信号传导、上皮-间质转化和血管生成等通路发生了一致的变化。
除了差异分析之外,他们还发现据报道特定于每个皮肤层和细胞类型的标记基因与每个ROI类型中的表达水平相对应,并且与以前的发现一致(图S3b-c)。基于参考数据集,跨ROI类型和时间点比较了反卷积的细胞类型丰度,发现黑素细胞相关基因特征的丢失特别是在中间层(IE和OD),而不是在最外层区域(OE)或真皮层更深的血管区域(VA)。
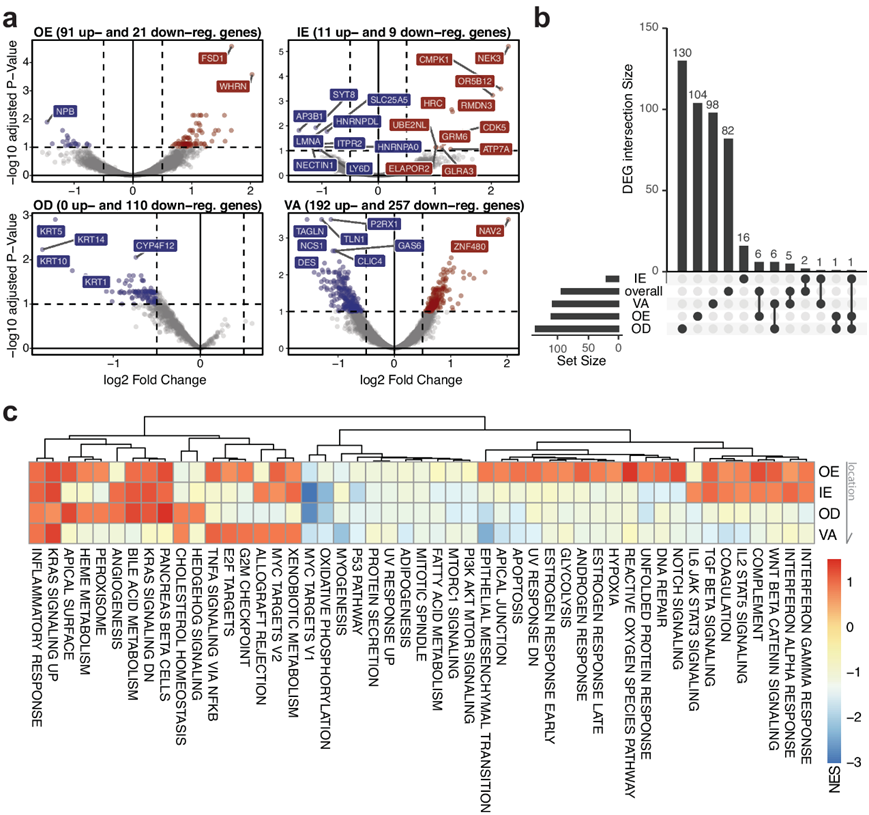
图2. 区域特异性基因表达谱和细胞组成变化。
(a) 火山图显示按 ROI 类型(分别为 OE、IE、OD 和 VA)划分的 DEG 。(b) UpSet 图比较区域特定 DEG 的交集。(c) 四个 ROI 类型的标志、非种系基因集富集分析。
图S3. GeoMx数据分析。
(a) UMAP可视化,其中虚线表示ROI类型特征。 (b) 皮肤蛋白相关基因表达水平。(c) ROI类型前20位变量基因在各ROI中的表达水平。
03
在航天后样本中观察到上皮屏障破坏和再生
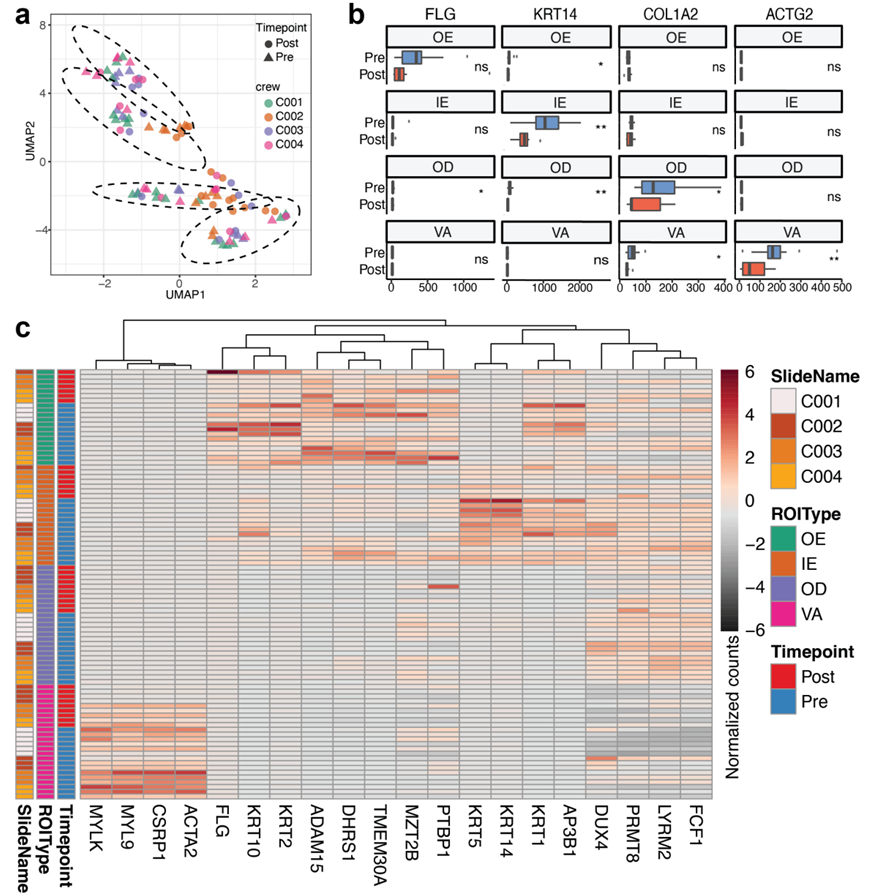
为了研究太空飞行对表型的影响,他们随后重点研究了与皮肤屏障形成、破坏和再生相关的基因和通路。通过通路分析,他们发现顶端连接、紫外线应激反应、缺氧和 TGFβ 信号传导的富集变化(图 2c)。具体来说,他们观察到与飞行前样本相比,飞行后丝聚蛋白(FLG)表达减少,该基因与皮肤屏障功能有关,通过控制细胞骨架成分之间的相互作用在表皮分化过程中起关键作用。FLG 的减少在 OE 区域最为明显,他们还观察到OE 区域HAS1、HAS2、HAS3、OCLN、CLDN、TGM2等转录本的减少(图 3a)。
蛋白质产生和反应的减少可能与 OE 区域 ROI 中角质形成细胞的减少和免疫特征的增加(可能与与 T 细胞和成纤维细胞的相互作用有关)有关(图 3b)。在成纤维细胞群中,他们还发现飞行后样本中网状成纤维细胞的基因特征增加,而乳头状成纤维细胞没有统计学上显著的变化,表明再生过程受到干扰(图S5a-c)。虽然聚类破坏相对较小,但在表皮(OE 和 IE)ROI 中发现黑素细胞-巨噬细胞相互作用增加(图 3c)。此外,与血管和淋巴管内皮细胞和周细胞相关的表达变化在皮肤各个区域各不相同。最明显的细胞特征变化出现在 OE 和 VA 区室。在 OE 区室,他们观察到与淋巴管内皮细胞相关的特征增加,这可能表明皮肤的血管和免疫系统发生了变化(图 3b)。虽然血液和淋巴毛细管通常并不常见于表皮,但这些适应可能提示皮肤的伤口愈合表型,这些结果支持了这一点,显示表皮中的损伤、炎症、细胞凋亡、ROS、缺氧、血管生成、TGF-β 表达等增加(图 2c)另一方面,在 VA 区室,与血液内皮相关的基因特征增加,淋巴管内皮减少,这也与血管重塑事件有关。
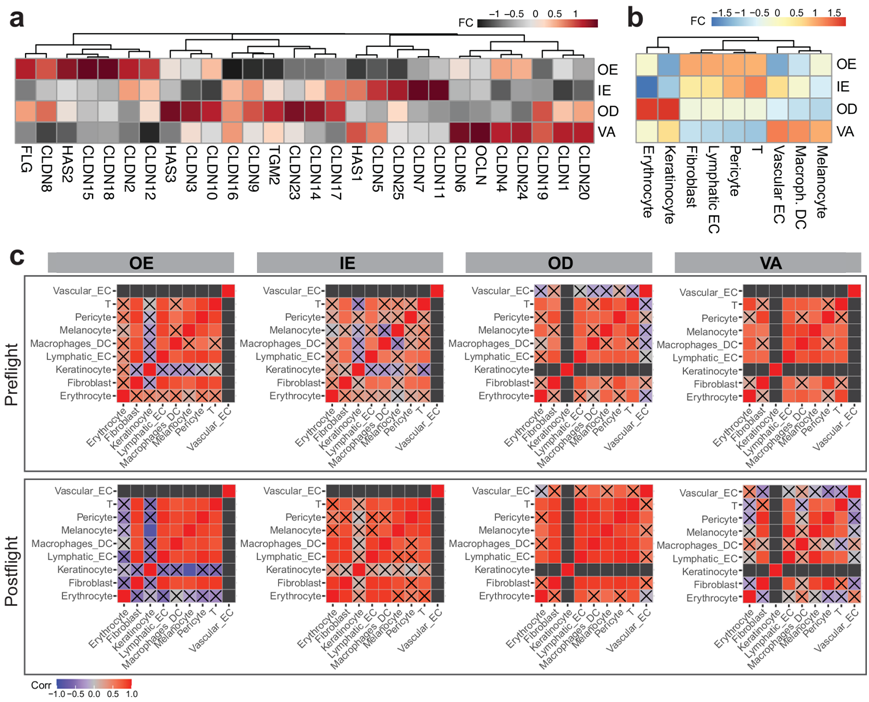
图3. 太空飞行后组织区域的细胞微环境变化。
(a) 感兴趣的基因表达变化。(b) 飞行后样本相对于飞行前样本的比例变化的差异倍数,按隔间划分。(c) 细胞类型相关矩阵变化。
图S5. 基因集富集分析。
(a) 细胞比例变化。(b) ssGSEA结果。(c)所有ROI的富集分数。
04
太空飞行期间皮肤与微生物群的相互作用发生变化
他们对活检前收集的皮肤拭子进行了宏基因组学和宏转录组学分析(图S6a)。将分类标签分配给 DNA 序列后,他们从宏基因组学分析中鉴定出 826 种细菌和 9819 种具有非零计数的病毒,从宏转录组学分析中鉴定出 88 种细菌和 1456 种病毒。从主成分分析(PCA) 来看,没有观察到主要的聚类,但是飞行后样本在 PCA 空间中彼此更靠近(图 4a)。样本的偏移主要来自葡萄球菌和链球菌科的物种,沿 PC2 轴。与飞行前相比,飞行后样本中细菌和病毒种类的总数略有下降,但宏基因组学数据中的 C003 和宏转录组学数据中的 C004 除外(图 4b)。
科对细菌种类进行总体比较显示,放线菌(例如放线菌 sp000220835)的丰度降低,而厚壁菌门/芽孢杆菌(例如Peptoniphilus C/B)和变形菌门/假单胞菌(例如弧菌柄杆菌、Sphingomonas carotinifaciens、Roseomonas mucosa/nepalensis)的丰度增加(图 4c-d,图S6b)。按属分组时,包括Cutibacterium(例如Cutibacterium acnes/avidum/modestum/porci)、Mycobacterium(例如Mycobacterium paragordonae、Mycobacterium phocaicum)和Pseudomonas(例如Pseudomonas aeruginosa/nitroreducens)在内的几种菌种均表现出统计学上显著的下降(p值 < 0.05)。包括Streptococcus(例如Staphylococcus capitis、Streptococcus mitis BB)和Veillonella(例如Veillonella atypica/parvula/rogosae)在内的几种菌种均表现出显著的增加(图4d)。此外, Staphylococcus属下的菌种,如Staphylococcus capitis/epidermidis/saprophyticus均表现出略微的下降,而其相对丰度在生物学重复中变化很大。
然后将细菌种类的变化与皮肤基因表达谱联系起来,特别是与皮炎相关的基因(即STAT3、STAT5B、FLG、CDSN和ADAM17),这些基因先前与葡萄球菌属有关,因为金黄色葡萄球菌依赖性特应性皮炎会激活免疫系统并降低微生物多样性(图4e,图S6c)。当对先前报道的细菌种类和相关基因进行子集化时,发现葡萄球菌属与JAK1呈现出反比关系(图 4e)。特别是,葡萄球菌与FLG、SPINK5和DSG1密切相关,所有这些都与上皮屏障(角质层和连接屏障)有关。此外,肉杆菌科、乳杆菌科、Nanosynbacteraceae和Weeksellaceae的微生物与屏障和免疫基因(CDSN、 DSP 、DSG1、SPINK5、FLG和JAK1)均表现出高度相关性,而Dermatophilaceae 和Dermabacteraceae的常见皮肤微生物则没有相关性。虽然需要更大的样本量,但皮肤微生物群落破坏(如在这些细菌科中观察到的破坏)也可能造成短期太空飞行期间屏障破坏和免疫激活。
此外,从与已知病毒组装体的比对中,他们发现与 Uroviricota(即Fromanvirus 、 Acadianvirus 、 Armstrongvirus 、Amginevirus 、Bixzunavirus)和 Naldaviricetes(即 Alphabaculovirus)相关丰度显著下降,而与Negarnaviricota (即Almendravirus、Orthotospovirus)和Cossaviricota (即Betapapillomavirus 、Betapolyomavirus)相关丰度增加。为了探索微生物与皮肤的相互作用,他们还从宏基因组学/转录组学数据中发现了微生物组变化与皮肤空间转录组学数据中的人类基因表达之间的潜在关联;这些包括与病毒门(即Uroviricota、Cressdnaviricota、Phixviricota)的关联,随着更多船员样本的收集,这是一个潜在的有趣领域(图S6d-e)。
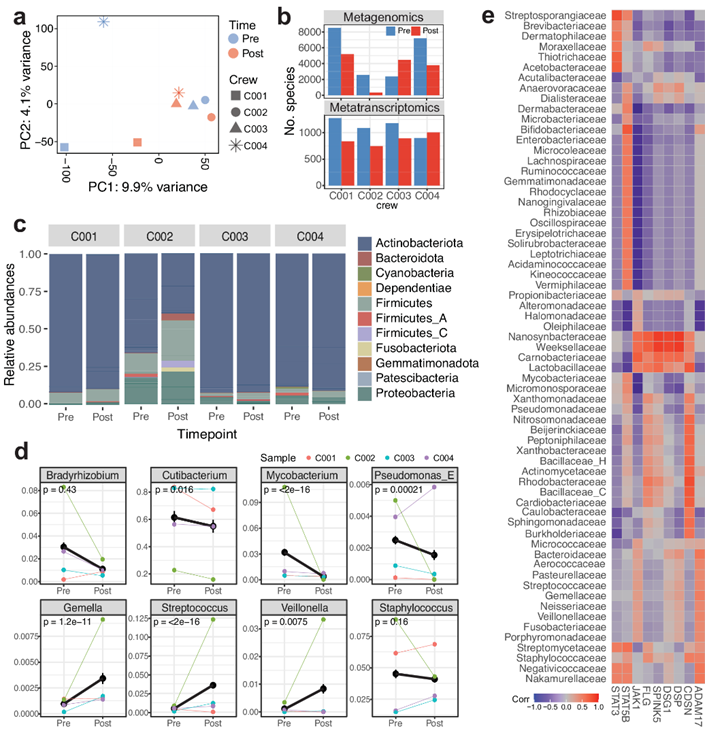
图4. 皮肤宏基因组学和转录组学分析皮肤-微生物群相互作用图。
(a) 所有宏基因组和宏转录组(细菌和病毒读数)相对丰度特征和所有机组人员在飞行前后的 PCA。(b) 非零计数的细菌和病毒种类总数。(c) 按样本和时间点的相对丰度,按科分组。(d) 按属分组的航天前后相对丰度的变化。(e) 通过宏基因组学数据识别的细菌门的相对丰度与已知与皮肤疾病和干扰相关的屏障/免疫基因的相关性。
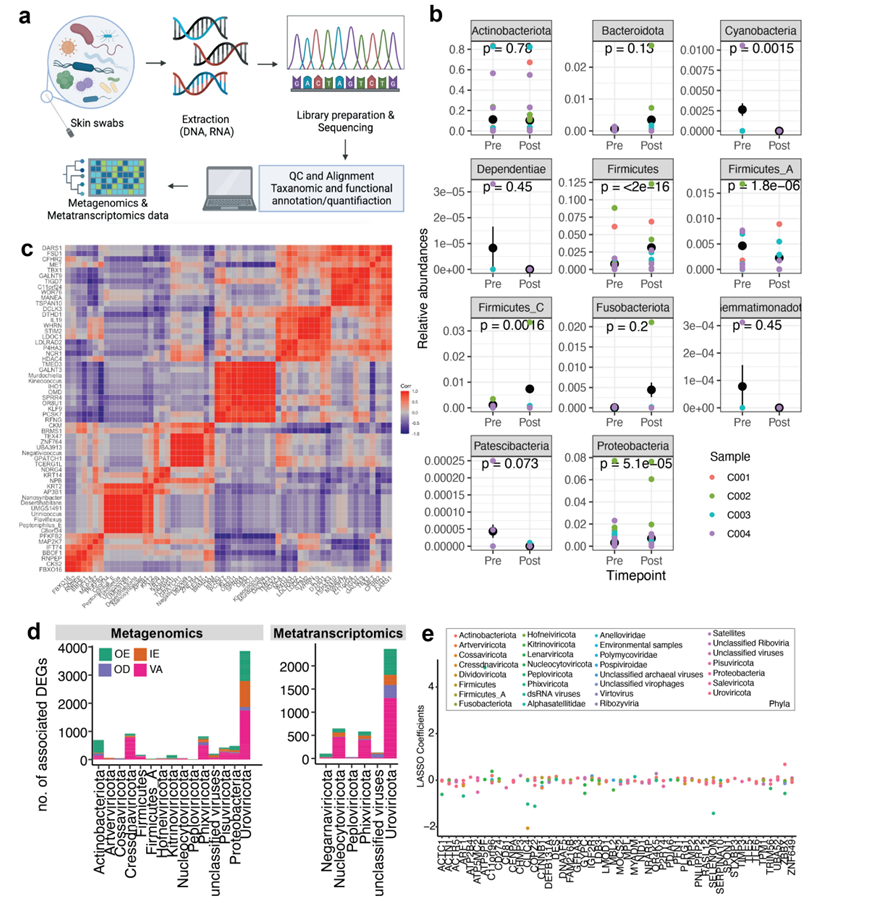
图S6. 整合宏基因组学/转录组学数据。
(a) 宏基因组学和转录组学数据处理的流程。(b) 相对丰度宏基因组变化与统计。(c) 差异丰度变化前25种细菌(效应大小)与25个OE deg之间的Pearson相关性。(d)与人类相关的基因数量。(e) 利用LASSO系数来探测外表皮区空间转录组学鉴定的门与人类基因之间的关联强度。
05
太空飞行引起的免疫变化
为了研究表皮下发生的免疫变化,他们还检测了血管区域与 PBMC中免疫细胞的变化,发现 VA ROI 中 T 细胞总体减少,巨噬细胞 DC 增加(图 3b),表明免疫-表皮存在相互作用。与此相关,他们还观察到组织内部区域(VA和OD ROI)的细胞因子和炎症信号增加,包括IL4、IL5和IFNG(图5a)。他们观察到这些特定的细胞因子在机组人员血清样本的细胞因子分析中也显示出增加(图5b)。为了将 VA ROI的免疫变化观察结果与全系统免疫系统变化进行比较,他们对时间点匹配的机组人员 PBMC 进行了多组学分析,包括单细胞核转录组(snRNA-seq)和ATAC分析(ATAC-seq)(图S7a)。分析了 9 种大体细胞类型的 151411 个细胞并进行了差异表达分析(图S7b-c)。总体而言,他们观察到 T 细胞在不同时间点的波动,这与皮肤空间转录组学数据的观察结果一致(图 5c-d,图S7d)。
在来自多组样本的 555 个 DEG 和来自 GeoMx VA ROI 的 446 个 DEG 中,发现了 12 个重叠的 DEG,包括ATP11A、CEP85L、CEPT1、DMXL1、DOP1A、EVI5、GSAP、MDFIC、SENP7、TBCK、VAV3和VPS13C(图 5c,图S7c)。这些基因中有几个与细胞代谢和胞浆运输有关。虽然所有这些重叠的 DEG 在 PBMC 中都是暂时的,即在飞行后立即的样本中(R + 1 时间点)上调并恢复到飞行前的表达水平,但这些基因的染色质可及性保持的时间稍长,最长可达 R + 45 时间点(图 5d)。
最后,他们从多组学数据中得出了细胞类型和太空飞行特异性基因特征,以检测 GeoMx 样本中的任何富集(使用单样本基因集富集分析或 ssGSEA 方法)(图 5e)。大多数免疫细胞特异性飞行后 DEG 富集都位于最内层 ROI(OD 和 VA)附近,T 细胞(CD4+ 和 CD8+)除外,它们在飞行后 OE ROI 中显示出富集。虽然之前有报道称太空飞行压力源会改变免疫系统,但表皮区域 T 细胞富集增加与活化的 T 细胞活性相关,并与炎症反应和屏障破坏有关。最后,他们发现 OE 区域中这些增加的 T 细胞特征可能与 Th17 T 细胞或银屑病没有直接联系,而是与从皮肤内层浸润的抗原相关和淋巴 T 细胞有更密切的联系(图 5f)。此外,使用皮肤病相关基因特征的ssGSEA 分析显示黑色素瘤特征略有增加,这种轻微的增加包括细胞死亡、免疫激活和应激反应的增加(图S7e-f)
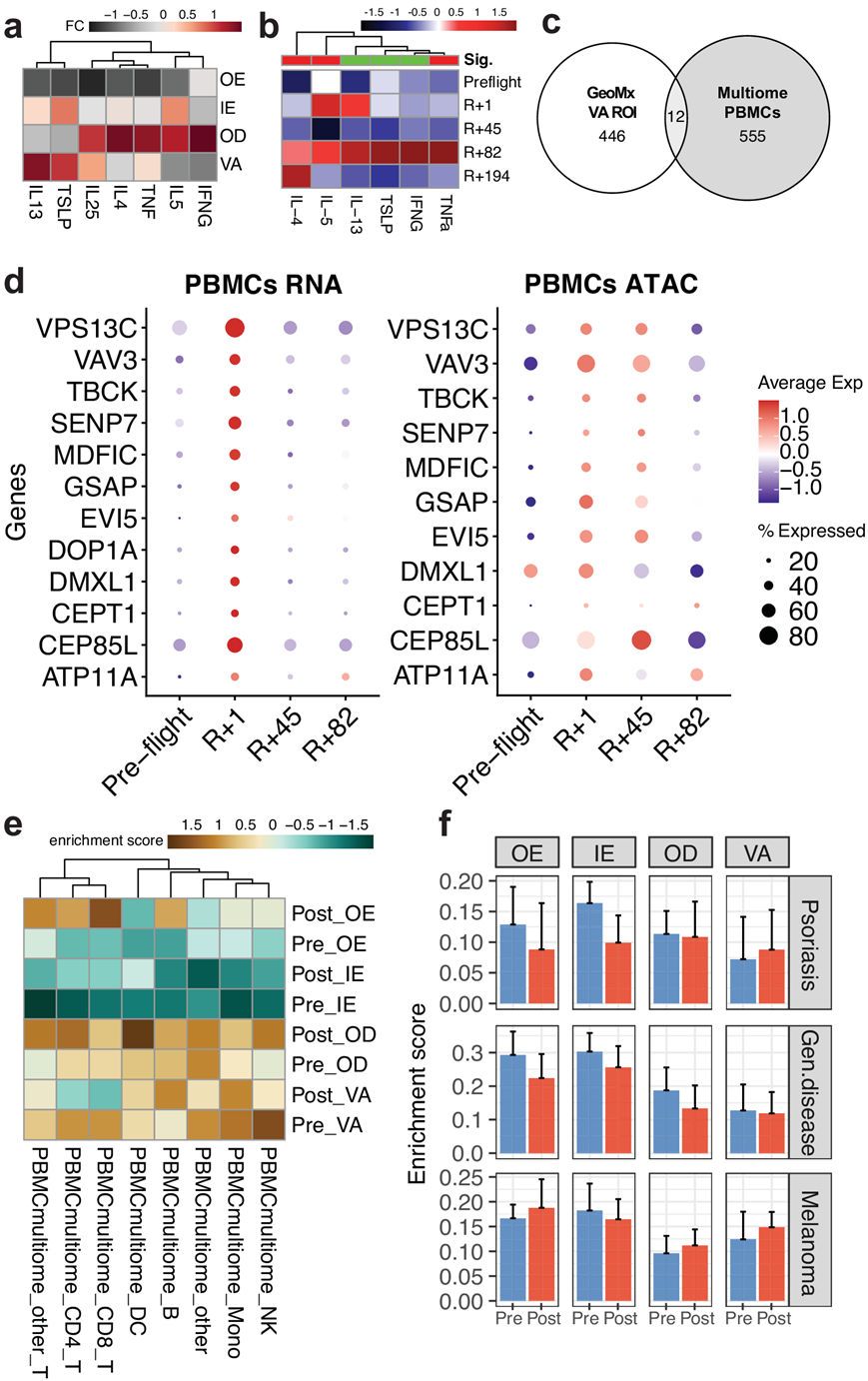
图5. 皮肤免疫系统的变化与外周血免疫细胞的变化有关。
(a) 显著的细胞因子变化。(b) 来自血清样本的细胞因子分析。(c) 比较 PBMC 多组数据和 VA ROI的空间转录组数据之间的 DEG 。(d) 点图可视化 mRNA 转录表达水平(左)和 ATAC 信号的基因活性得分(右)。(e) 按时间点和 ROI 类型在空间数据中飞行和细胞类型特异性基因特征的富集。(f) 使用从皮肤构建的基因特征进行基因特征富集分析疾病相关基因表达谱。
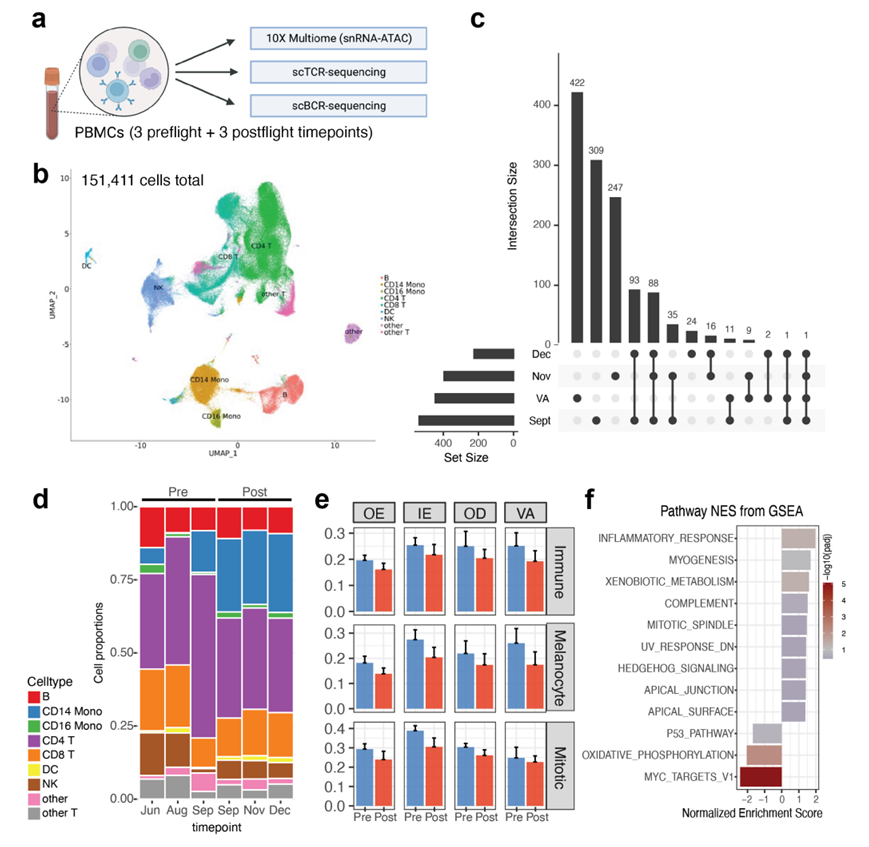
图S7. 整合免疫单细胞数据。
(a) PBMC的实验设计。(b) UMAP可视化。(c) UpSetR图比较重叠的deg(相对于飞行前时间点)在所有飞行后时间点。(d) 细胞比例在pbmc内的不同时间点发生变化。(e) 细胞特征变化。(f) 通路富集分析。
+ + + + + + + + + + +
结 论
为了研究短期太空飞行对皮肤的影响,本项研究在飞行前(L-44)和飞行后(R + 1)对 Inspiration4 机组人员进行了皮肤活检。利用多组学分析,包括 GeoMx™ 数字空间分析器、scRNA/ATAC-seq 和宏基因组学/宏转录组学技术,分析了四个区域的 95 个皮肤区域的空间基因表达和相关的微生物和免疫变化:外表皮、内表皮、外真皮和脉管系统。飞行后样本显示,所有皮肤区域与炎症和 KRAS 信号传导相关的基因均显著上调。这些与太空飞行相关的变化与特定的细胞反应有关,包括干扰素反应改变、DNA 损伤、上皮屏障破坏、T 细胞迁移和再生受阻,这些变化主要位于外层组织隔室。还将上皮破坏与皮肤拭子中的微生物变化和免疫细胞活动与来自同一机组人员和时间点的 PBMC 单细胞数据联系起来。本项研究结果首次收集和检查了宇航员的皮肤,为未来的太空任务和应对措施提供了见解。
+ + + + +



 English
English


