文献解读|Nat Genet(31.7):多组学分析确定了非洲裔美国急性髓系白血病患者的生存预测因素
✦ +
+
论文ID
原名:Multiomic profiling identifies predictors of survival in African American patients with acute myeloid leukemia
译名:多组学分析确定了非洲裔美国急性髓系白血病患者的生存预测因素
期刊:Nature Genetics
影响因子:31.7
发表时间:2024.10.04
DOI号:10.1038/s41588-024-01929-x
背 景
急性髓系白血病 (AML) 的特征是,由于基因组改变抑制了髓系发育,导致髓系祖细胞克隆性扩增。几十年前,人们首次通过反复出现的染色体改变认识到基因组改变对 AML 发病机制的重要性及其预后意义。不同人种的AML患者的基因组图谱和预后生物标志物尚未得到充分研究。
实验设计
结 果
01
黑人 AML 患者编码序列的变异
研究团队通过流式细胞(FACS)技术对 100 名黑人患者的白血病细胞和配对的 B 细胞和 T 细胞进行了分选,然后又进行了全外显子组测序 (WES),鉴定出 1971 个非同义编码变异,包括单核苷酸变异 (SNV)、插入和缺失 (indel) 和内部串联重复 (ITD)。162 个基因为复发性突变(即在两名或两名以上患者中发生突变),33 个基因在 4% 或更多患者中发生突变。已确定的 AML 相关突变中FLT3(32%)、DNMT3A(25%)、NRAS(23%)和NPM1(20%)最为常见,其次是IDH2(11%)、RUNX1(10%)、KRAS(9%)、ASXL1(8%)和WT1(8%)。值得注意的是, 7% 的患者发生了IDH1、PHIP、TET2和TP53突变(图1a)。此外,对三名患者的样本进行了单细胞 DNA 测序 (scDNA-seq),观察到的克隆模式与已发表的数据集一致(图1b)。
在 39 名细胞遗传学正常的 AML (CN-AML) 患者中,FLT3 (49%)、NPM1 (44%) 和DNMT3A (44%) 变异最为常见。然而,在 8% 的 CN-AML 患者中,他们检测到了几种通常与 AML 不相关的基因突变,包括IFNL3、MYC和PRAMEF15突变。同样,在 21 名患有核心结合因子 AML (CBF-AML) 的患者中,最常见的是NRAS突变(33%)、KIT 突变(24%) 和FLT3突变 (19%)。然而,在14% 的患者中均发现了PHIP、LRP6、PRH2、RHPN2和ZBTB7A的变异,从而确定了本研究队列中额外的、相对频繁的遗传事件。
在黑人患者的 162 个复发性突变基因中,只有 43 个(27%)在 323 名白人患者中发生复发性突变 (BeatAML),而 119 个基因(73%)在一名白人患者中发生突变或未发生突变。几种已知和迄今未报告的基因突变的频率在不同的祖先之间有所不同(图1c)。本研究的队列中有 4% 的人有 10 个基因发生突变,但在白人患者和其他先前的标志性测序工作中只有 2% 或更少的人有 10 个基因发生突变

图1. 黑人 AML 患者的突变情况。
(a) Oncoprint 显示通过 WES 在 4% 或更多黑人患者中检测到突变。(b) 使用 scDNA-seq 确定在三名黑人 AML 患者中检测到的驱动突变的克隆性。(c) 在 4% 或更多黑人患者中发生突变的基因上,白人(Beat AML)和黑人患者之间的突变百分比差异。(d) 与其他主要 AML 测序研究相比,4% 黑人患者中发生突变的基因的突变百分比。
此外, 7% 的黑人患者中存在的PHIP突变仅在一名白人患者中发现(图2a)。作为种系变异,PHIP突变会导致 Chung-Jansen 综合征,这是一种罕见的遗传性智力障碍。不到 2% 的骨髓增生异常综合征、原始细胞危象慢性粒细胞白血病和克隆性造血 (CH) 患者报告了体细胞PHIP突变。值得注意的是,他们对包含两个非洲患者队列的黑种人患者进行的PHIP靶向测序在尼日利亚患者中检测到3种PHIP突变(7%),但在南非患者中未检测到。他们发现,323 名白人患者中只有一名患者至少缺少其中一个基因的突变。相比之下,黑人患者有10%缺少这些基因的突变,因此在目前的标准临床分子检测中为“突变阴性”。
对融合基因的转录组分析(RNA-seq)发现12个CBFB::MYH11, 7个RUNX1::RUNX1T1, 4个KMT2A重排(3个KMT2A::AFDN和1个KMT2A::SEPT9)和2个BCR::ABL融合(图2b)。他们检测到四个框内融合 (In-frame fusions),影响了CBFA2T3,其中包括三个16号染色体的重排,在这些重排中,CBFA2T3分别与BANP、CYBA或ZFPM1融合,以及一个t(16;21)染色体易位,形成CBFA2T3::RUNX1融合。根据基因表达,这些融合没有与CBF-AML聚集在一起,表明不同的生物学影响。他们发现了4个隐性NUP98和2个NUP214融合,它们是AML的复发性异常。有趣的是,在2例患者中发现了累及17号染色体的GGNBP2::MYO19融合,这种融合已在巨大先天性痣中发现,但在AML中未发现。
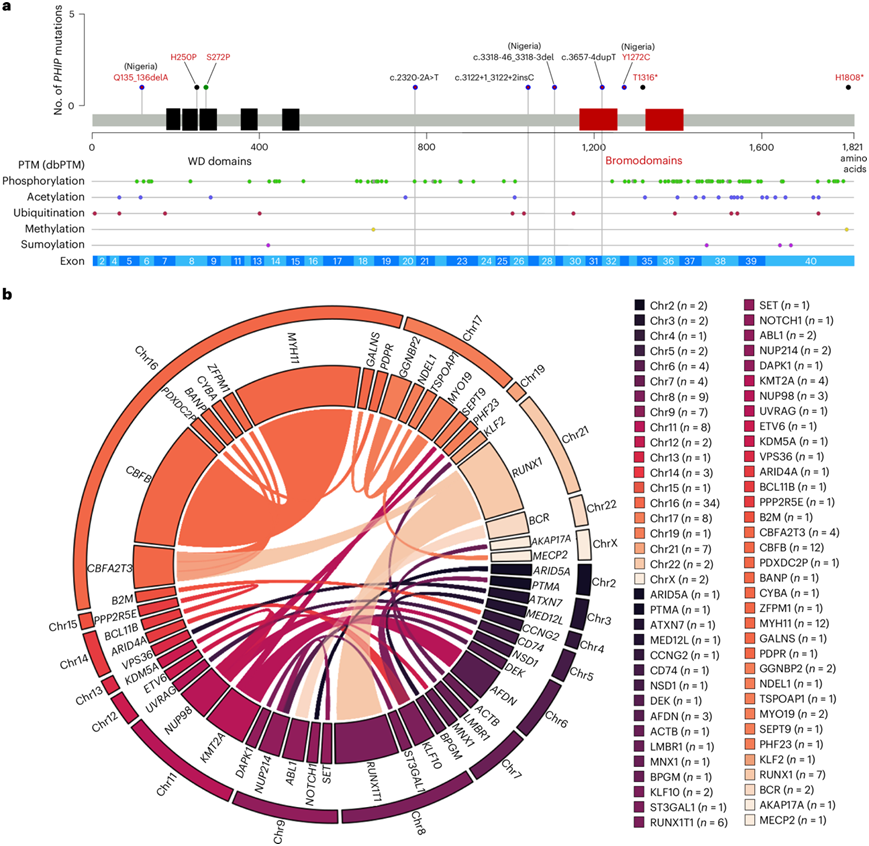
图2. PHIP基因突变和融合基因图谱。
(a) PHIP基因示意图,其中标明了翻译后修饰的位置和 WES 在黑人患者中检测到的突变的位置。(b) Circos 图显示了使用基于 RNA-seq 的发现在黑人患者中检测到的融合基因。
02
基于致癌驱动因素的转录谱
在基于转录组的基因表达分析和t分布随机邻域嵌入 (t-SNE) 数据可视化中,黑人和白人患者根据已知的驱动突变聚集在一起(图3a)。相对较大的中央t-SNE聚类包含有2022欧洲白血病网(ELN)定义的骨髓增生异常相关突变的黑种人和白种人患者样本(图3b)。基因表达分析表明,这些患者具有类似骨髓增生异常肿瘤的表达谱(图3c)。值得注意的是,骨髓增生异常相关聚类中的黑人患者比白人患者年轻,提示存在内在和/或外在导致发育不良的应激源(图3d-e)。此外,虽然骨髓增生异常相关 AML 聚类内的白人患者比该聚类外的白人患者年龄更大,但黑人患者之间没有显著的年龄差异,进一步凸显了黑人患者中骨髓增生异常。
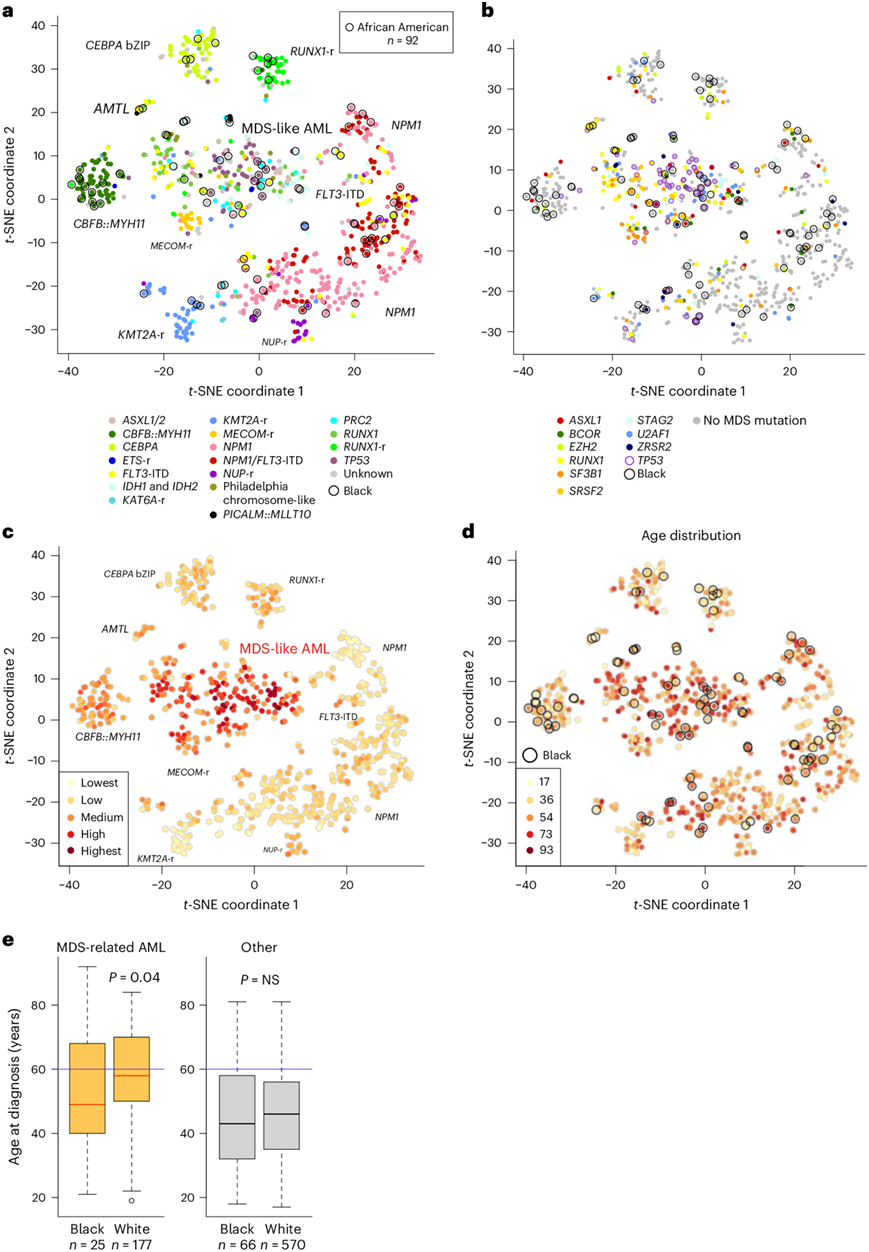
图3. 使用基于转录组的基因表达谱和t -SNE 可视化对 AML 患者进行聚类。
(a) 根据存在主要致癌驱动突变的基因表达对黑人和白人患者进行聚类。(b) 根据基因表达聚类的黑人和白人患者中骨髓增生异常相关突变的存在。(c) 黑人和白人患者基因表达谱与先前发表的骨髓异常增生基因表达特征的相似性。(d) 按患者年龄分布的基因表达聚类。(e) 患有骨髓增生异常相关突变的黑人和白人患者的年龄比较。
03
临床特点及治疗结果
结合社会经济综合数据,黑人 AML 患者的生存率也很低,无论是基于人群的分析还是临床试验。虽然黑人和白人患者的完全缓解 (CR) 率没有显著差异(图4a),但与白人患者相比,黑人患者在开始治疗后 30 天内死亡的频率更高,复发率更高,无病生存率 (DFS),无事件生存率 (EFS)和总生存率(OS)更差(图4a-b)。
为了确定与黑人患者治疗反应和生存相关的特征,他们对 DFS 进行了多变量分析,结果发现NPM1和NRAS突变是不良预后因素(图4c)。没有FLT3 -ITD 的NPM1突变在临床指南中是一个有利的风险标志物。在已确定的风险关联中,FLT3-ITD 的存在会对与NPM1突变的正向生存关联产生负面影响,而具有NPM1突变且FLT3-ITD−的黑人患者的DFS、EFS和 OS均比白人患者差,并且他们的 OS 与 2022 年 ELN 不良风险组患者的 OS 没有显著差异(图4d)。NRAS突变(未纳入2022年ELN遗传风险分层系统)也导致黑种人患者预后不良(图4e)。IDH1和IDH2突变与OS降低相关,这也是有IDH1和IDH2突变的黑种人患者的特异性(图4f)。
接下来,他们通过 MSK-IMPACT 分析了 43 名自述患有复发或难治性疾病的黑人患者的突变频率,这些患者的基因突变谱是在一线治疗失败后获得的,随后富集了更多不良风险特征,并与新诊断的联盟患者队列的基因组谱进行了对比。最常见的突变包括本研究研究中确定的几种不良风险标记,证明它们在黑人患者中的风险关联(图4g)。

图4. 黑人和白人 AML 患者临床结果比较。
(a-b) 黑人和白人患者的治疗反应和生存率比较。(c) 黑人和白人NPM1突变患者的OS与2022年ELN不良风险患者的OS比较。(d) 与2022年ELN不良风险患者的OS相比,NPM1突变黑人和白人患者的OS以及存在或不存在FLT3-ITD的OS。(e) 黑人和白人NRAS突变患者的OS与2022年ELN不良风险患者的OS比较。(f) 黑人和白人IDH1和IDH2突变患者的OS与2022年ELN不良风险患者的OS比较。(g) 基因突变频率分析。
04
NPM1突变 AML中的祖先相关转录组影响
为了了解黑人和白人患者中NPM1突变对生存的影响存在差异的可能原因,他们首先评估了共突变模式。除了已确定的共存突变特征外,20 名黑人NPM1突变患者中有 11 名携带至少一种尚未与 AML 有关的基因预测致病变异(图5a);然而,没有发现新的复发变异。接下来,为了评估可能的分子基础,他们分析了具有基因型确认血统的NPM1突变的黑人和白人患者的转录组。有趣的是,使用主成分和重新分类分析,发现了黑人和白人患者之间存在差异表达的区别性标记基因(图5b)。只有一名黑人患者的 AML 在表达上与白人患者的表型相似,而九名白人患者的表达谱与黑人患者的表达谱相似(图5c)。值得注意的是,这些在转录组学上与黑人患者“相似”的白人患者的 OS 也很差(图5d)。
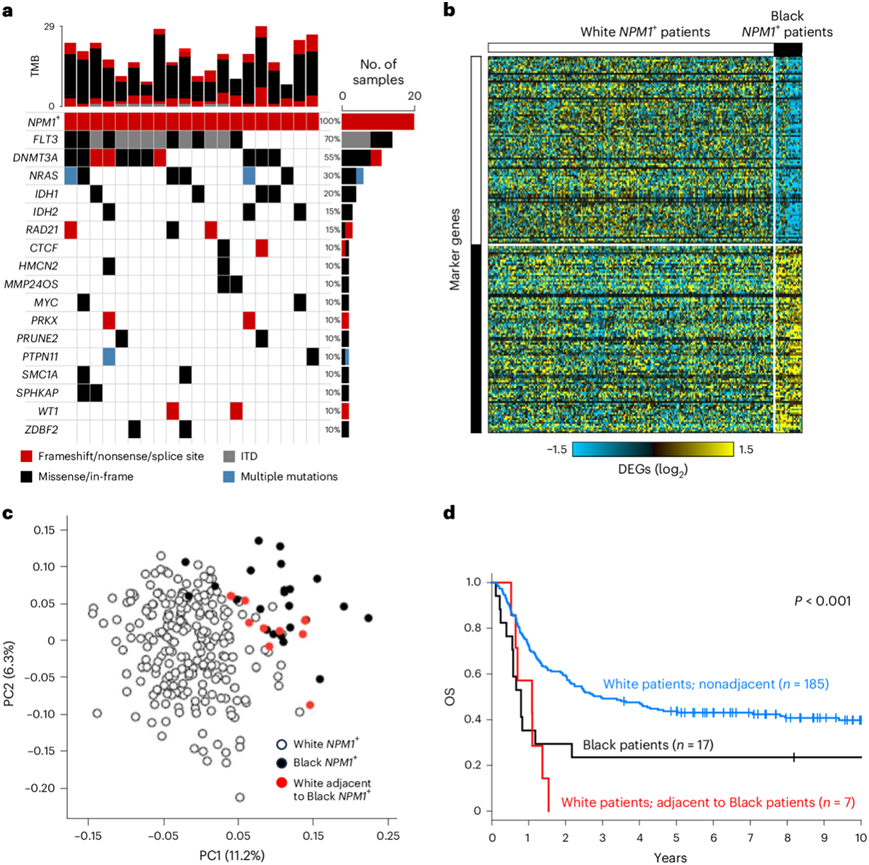
图5. 转录谱中与祖先相关的差异。
(a) 具有NPM1突变的黑人患者的突变肿瘤印记。(b) 祖先相关基因表达差异的标记热图。(c) 可视化NPM1基因表达变异的前两个主要成分。(d) OS的比较分析。
05
根据 iScore、LSC17 和 2022 ELN 评估治疗结果
炎症在 AML 的发展和进展中起着作用;高度炎症已成为独立于已确定的遗传特征的负面预后因素。使用最近发表的基于基因表达的iScore作为炎症的替代指标,他们发现与白种人患者相比,具有NPM1突变的黑种人患者有更高的高炎症水平。考虑到之前描述的高炎症与高危遗传特征和治疗应答之间的关联,以及研究发现的具有NPM1突变的黑种人患者的生存期较差,这一结果值得关注。对于黑种人和白种人患者,高炎症均预示着较差的EFS和OS(图6a-b)。
LSC17评分代表了一种经过验证的生存相关基因表达特征,反映了高分AML的“干性”。 LSC17评分可预测白人和黑人患者的EFS和OS(图6c-d)。在黑种人2022 ELN低危患者中,只有53%的LSC17评分低,而在白种人2022 ELN低危患者中,这一比例为69%。值得注意的是,NPM1突变的发生率存在差异:低LSC17的黑种人患者中只有13%有NPM1突变,而白种人患者中有38%有NPM1突变,这提示黑种人和白种人患者之间可能存在的生物学差异,需要进一步研究。同样,低LSC17组中只有16%的黑种人患者携带NRAS突变,而白种人患者中为26%,这与观察到的NRAS突变对生存产生的相反影响一致。NRAS 、IDH1、IDH2和NPM1突变对黑人患者的 OS 和 DFS的不利影响表明这些突变可作为黑人患者的不良风险标志物。事实上,实施这一改变改善了遗传风险分配,2022 ELN有利风险组的 3 年 EFS 和 OS 预测率分别从 37% 提高到 56% 和从 50% 提高到 78%,中等风险患者的 3 年 EFS 和 OS 预测率分别从 28% 提高到 38% 和从 35% 提高到 43%(图6e-f)。
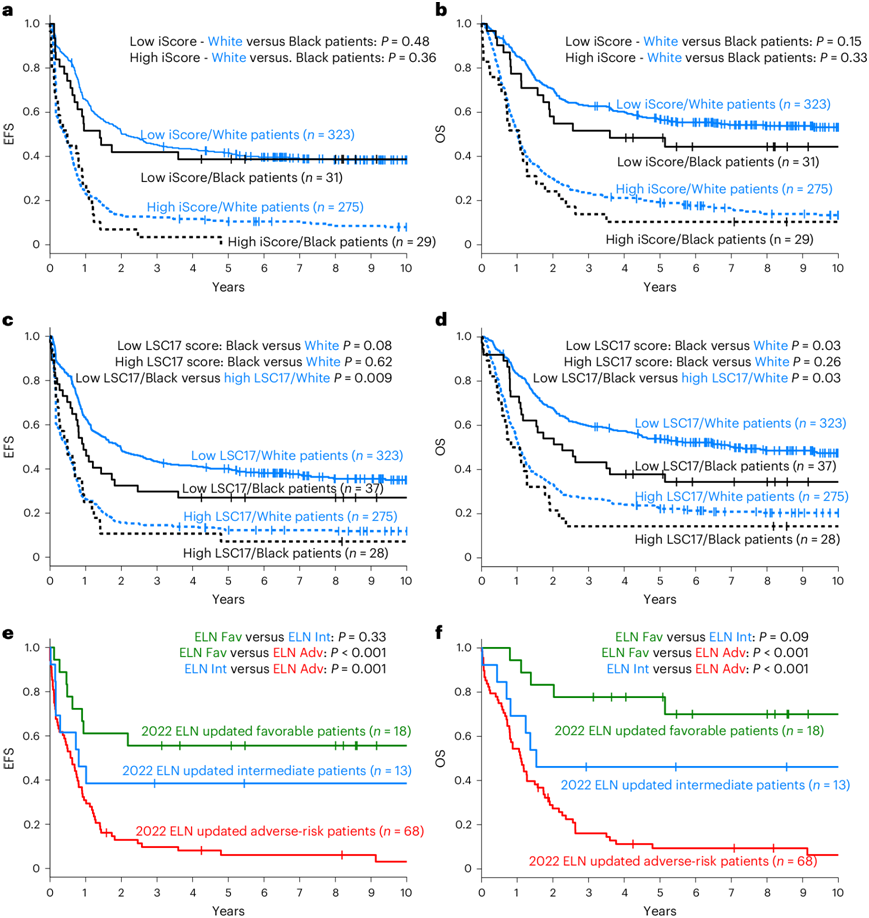
图6. 根据三种遗传风险分层系统分类的黑人和白人患者的治疗结果。
(a) 根据高和低 iScore 状态划分的黑人和白人患者的 EFS。(b) 根据高和低 iScore 状态划分的黑人和白人患者的 OS 。(c)黑人和白人患者的 EFS。(d) 黑人和白人患者的 OS。(e-f) 将NPM1、NRAS和IDH1和IDH2突变作为不良风险标志物纳入的生存分析。
06
NPM1突变 AML的细胞类型分布和通路激活
为了阐明导致观察到的表型差异的潜在生物学机制,他们对来自 6 名黑人和 7 名白人且存在NPM1突变的患者的 BM 样本进行了单细胞转录组分析(scRNA-seq)和转录组-表位细胞索引分析 (CITE-seq),共获得 112017 个细胞(图7a)。在 74 个比对的细胞群中,最常比对的细胞状态是注释的 MultiLin-GMP-1聚类(平均 34% 的细胞),这通常是非白血病 BM 中最不常见的过渡中间状态。有趣的是,当比较与祖先相关的细胞类型比例时,淋巴样髓系引发祖细胞 (LMPP-2) 细胞在黑人和白人患者之间显示出一致的差异(图7b)。虽然白血病细胞状态可能是治疗反应的重要介质,但根据祖先区分的转录组影响可以揭示独特的 AML 存活基因程序。为了排除细胞捕获频率的偏差,他们使用软件 cellHarmony 比较了参考注释的伪批量细胞群之间的基因表达。在比较共有的 AML 母细胞祖先程序和细胞状态特异性影响的黑人和白人患者的 scRNA-seq 谱系时,cellHarmony 揭示了细胞状态特异性和谱系影响(图7c)。
罕见的中间混合谱系祖细胞,巨核细胞-红细胞祖细胞 (MEP-2) 细胞群根据血统表现出最大的基因表达变化。值得注意的是,他们还观察到黑人患者的 MEP-2 细胞中NPM1的持续下调与白人患者相比,但在任何其他细胞群中均未观察到。使用基因集富集分析确定,黑人患者的剪接因子、转录、翻译和线粒体能量通路表达较低,这在患者中是一致的(图7d)。当考虑到 cellHarmony(MPP 和 MEP 结合)对祖细胞谱系的共同影响时,富集了大量通路,包括细胞凋亡、Wnt 信号传导、EGFR 信号传导和应激颗粒产生(AGO4、GIGYF2、MBNL1、CIRBP、DDX3X、HNRNPK、PABPC1、YBX1、ZFP36)(图7e)。
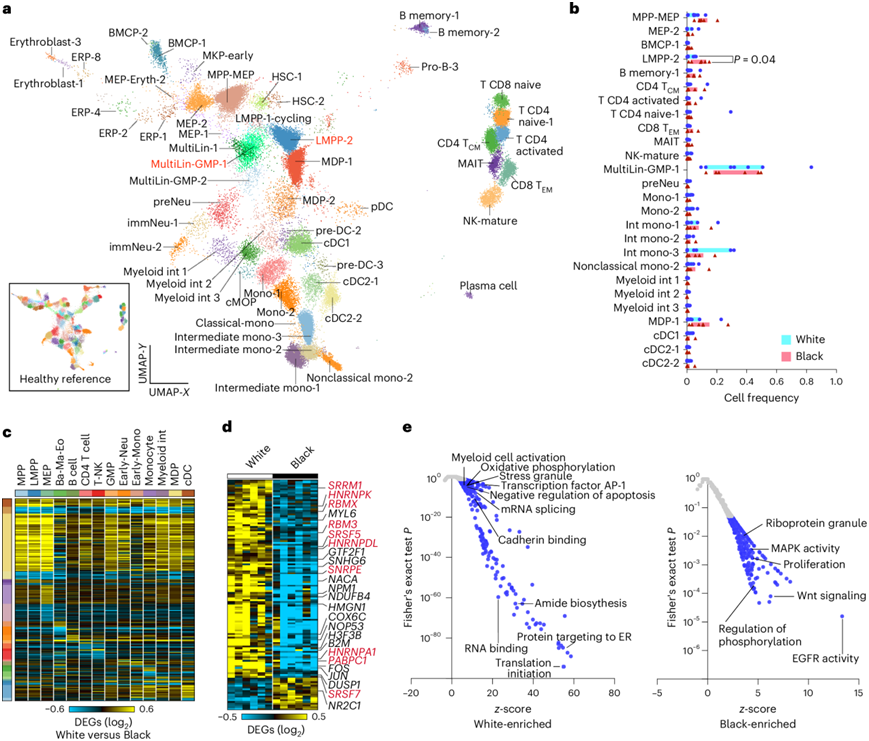
图7. 根据祖先识别NPM1突变AML患者中的持久克隆基因表达程序。
(a) UMAP可视化。(b) 每位AML患者相对于遗传祖先的细胞群频率。(c-d) 差异表达热图。 (e) 基因集富集分析。
+ + + + + + + + + + +
结 论
本项研究分析了 100 名经基因组证实具有非洲血统的 AML 患者的外显子组和转录组,并将他们的体细胞突变频率与 323 名自述患有 AML 的白人患者的体细胞突变频率进行了比较,其中 55% 的白人患者经基因组证实具有欧洲血统(白人;BeatAML)。在黑人患者中复发的 162 个基因突变中有 73%(包括在 7% 的患者中检测到的迄今为止未报告的PHIP变异)在一名白人患者中发现或未检测到。患有骨髓增生异常相关 AML 的黑人患者比白人患者年轻,这表明存在内在和/或外在的发育不良导致的应激源。在对黑人患者的多变量分析中,NPM1和NRAS突变与无病生存率较低有关,而IDH1和IDH2突变与总生存率降低有关。黑人和白人NPM1突变患者的炎症特征、细胞类型分布和转录特征不同。
+ + + + +



 English
English


