文献解读|Cell Metab(29.0):线粒体对大鼠组织运动训练的多组学反应
✦ +
+
论文ID
原名:The mitochondrial multi-omic response to exercise training across rat tissues
译名:线粒体对大鼠组织运动训练的多组学反应
期刊:Cell Metabolism
影响因子:29.0
发表时间:2024.05.02
DOI号:10.1016/j.cmet.2023.12.021
背 景
线粒体具有对全身代谢稳态至关重要的多种功能。耐力训练改变线粒体活性,但缺乏对这些适应的系统表征。
实验设计

结 果
01
耐力训练改变组织中线粒体体积的生物标志物
在此研究中,6个月大的雄性和雌性F344大鼠接受了在跑步机上进行的渐进性耐力训练,时间分别为1、2、4或8周。同时,还有与性别相匹配的静止状态的动物作为对照组。功能性生理评估显示,在训练8周后,与对照组相比,雄性和雌性动物的最大氧摄取量(VO2max)分别增加了12和10 mL/kg/min。雄性动物的体脂百分比随训练时间的增加而降低,而未训练的雄性动物体脂百分比无变化。相反,训练的雌性动物保持了她们的体脂百分比,而未训练的雌性动物在8周内体脂百分比增加了2.8%。研究团队在动物最后一次运动后48 h收集血液、血浆和18个实体组织,分别进行了转座酶可及性染色质测序(ATAC-seq)和还原亚硫酸氢盐测序(RRBS)、转录组学分析(RNA-seq)、蛋白质组学和翻译后修饰(PTM)分析(包括磷酸化蛋白质组、乙酰化组和泛素组)以及代谢组学/脂质组分析(图1A)。
为了估计训练过程中线粒体体积的变化,他们定量了线粒体数量的生物标志物,包括心磷脂含量和环状线粒体DNA (mtDNA)拷贝数。在训练0周、1周或8周的动物中,mtDNA定量仅限于15个组织。心磷脂是与人类骨骼肌线粒体体积密切相关的线粒体膜特异性脂质。心磷脂数据来自肾脏、肝脏、肺、腓肠肌骨骼肌(SKM-GN)和皮下白色脂肪组织(WAT-SC)。在4种组织[SKM-GN、股外侧肌骨骼肌(SKM-VL)、肾上腺和BAT]中,映射到线粒体基因组的RNA-seq读长百分比可作为mtDNA的替代指标(图1B)。在19个组织中,有15个组织的至少一项生物标志物对训练有显著应答。重点关注第8周,8个组织的线粒体读数百分比发生了变化,响应方向与mtDNA一致(图1C-D)。此外,响应最高的性组织组合表现出线粒体编码转录本的一致响应,表明mtDNA的数量和转录活性都发生了变化(图1E)。相比之下,肝脏表现出轻微的反应,仅在雄性的上调(图1F)。总之,他们发现了线粒体生物标志物在训练反应中的实质性跨组织差异变化。

图1. 训练引起的线粒体体积生物标志物的变化。
(A)实验设计。(B) mtDNA定量与线粒体RNA-seq读数百分比之间的相关性。(C) 8周训练后线粒体体积生物标志物的训练反应。(D)线粒体生物标志物显著训练反应次数的比较。(E-F) SKM-GN和肝脏生物标志物数据可视化。
02
线粒体对运动训练的多组反应在很大程度上是组织特异性的
训练调节了所有组织中与线粒体相关的分析物。总共有719个基因,占所有与线粒体相关转录本的63%,以及513个蛋白质(占所有与线粒体相关蛋白质的38%)在至少一种性别和组织中因训练而显著变化。反应最敏感的组织(转录本和/或蛋白质差异超过10%)包括肾上腺、棕色脂肪组织(BAT)、血液、结肠、心脏、肝脏、骨骼肌-颈部(SKM-GN)、骨骼肌-腿部(SKM-VL)和皮下白色脂肪组织(WAT-SC)(图2A)。SKM-GN、肝脏和心脏的蛋白质组学反应最大,而血液、心脏和肝脏的代谢组/脂质组变化最大。相比之下,研究中的三个脑区(皮质、海马和下丘脑)、肾、肺、睾丸和腔静脉几乎没有变化(图2A)。线粒体蛋白的磷酸化和泛素化几乎没有变化,可能是由于它们的短暂性。比较前九个反应组织的差异转录本表明,很大程度上是组织特异性反应,跨组织相关性大多较低,重叠程度中等(图2B)。肾上腺表现出最大的转录反应,其次是BAT和结肠,其中常见的调控基因编码三羧酸循环(TCA)酶和复合物亚基(图2B)。
利用图表分析结果,他们将在第8周重点讨论适应性。MitoCarta通路富集分析发现,在心脏、骨骼肌、WAT-SC和肝脏中,许多线粒体通路均有一致的上调(图2C)。在横纹肌组织中,线粒体的适应主要是性别一致的。不同性别之间的肝脏反应也相似,特别是在蛋白质组和乙酰基组,很少有转录变化。许多线粒体通路也在训练后的WAT-SC中增加,但主要表现出性别特异性调节。线粒体相关代谢物主要在肝脏、心脏和血液中发生变化。由于这些组织在代谢稳态中的核心作用,他们将血浆和其他反应组织之间的代谢组学反应进行了关联。肝脏反应与血浆显著相关,支持其在全身能量稳态中的中心作用。重要的是,动物中的许多运动干预在4周时终止,在4周时观察到的转录变化很少。雌性的总体反应明显高于雄性,通路富集分析显示OXPHOS和线粒体伴侣基因发生激活(图2C)。
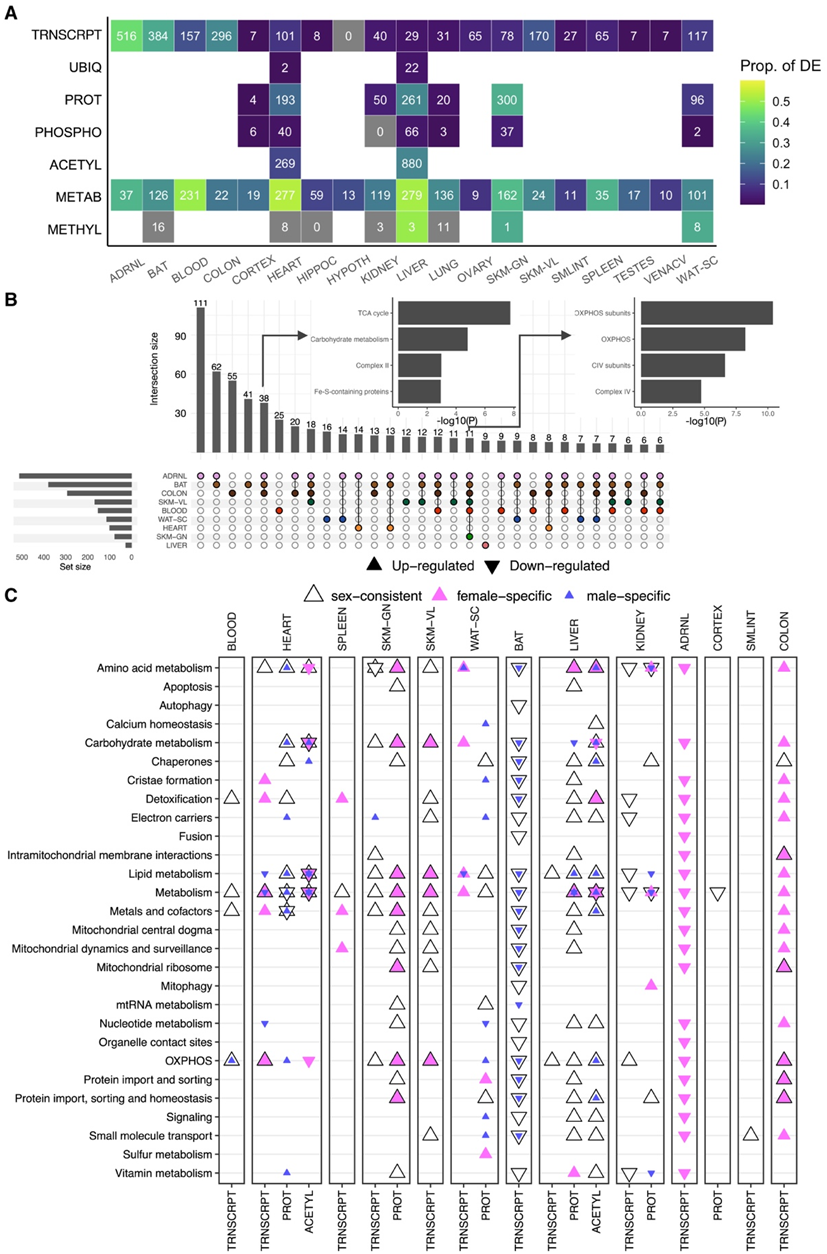
图2. 多组学线粒体对跨组织训练的反应。
(A)至少一种性别的线粒体相关分析物在训练时间过程中发生显著变化的数量热图。(B)不同组织间MitoCarta转录本的翻转图,识别了许多组织共有的组织特异性变化和差异特征。(C)前9个应答组织中8周时间点的MitoCarta通路富集。
03
肾上腺和 BAT 对耐力训练的反应表现出不同的转录动态
考虑了两种不同轨迹的分析,以了解其动力学。首先,他们分析了线粒体标志物,并观察到主要影响BAT和肾上腺的转录本(图S4A)。对这一分析的时间结果进行聚类分析,确定了四个富集不同线粒体功能的聚类(图S4B-C)。这些结果表明(1)雄性的BAT转录组应答降低,第8周(聚类1),以及(2)肾上腺反应分为两个聚类(2和4)。聚类1与图解分析及其富集结果一致,也与关键产热解偶联剂Ucp1的BAT转录组模式一致(图3A,图S4D-E)。相反,Ucp2的染色质可及性和相关基因表达与Ucp1呈负相关(图3B-C)。Ucp2不具有Ucp1的解偶联潜能,但能限制葡萄糖氧化,增强谷氨酰胺水解。综上所述,这些结果提示了雄性BAT在应对训练时能量保存的潜在机制。两个肾上腺聚类在雌性中表现出一致的下调,而在雄性中则在第1周显著上调(图S4B)。这种反应包括参与β-氧化、TCA循环和电子传递链(ETC)的基因。聚类2表现出下调模式,雄性和雌性的轨迹更相似,而聚类4显示出无效效应(图S4B)。
在肾上腺数据中,他们观察到Ppargc1a遵循相同的主要聚类轨迹,在雄性中在第1周时增加,在雌性中在第8周时减少。有趣的是,PGC1ɑ的几个已知相互作用蛋白显示出相同的模式,包括PPARs 19、FOSB、FOXO1和THRB(图3D)。由肾上腺皮质产生的糖皮质激素是已知的Ppargc1a表达的激活剂,能量平衡、温度和钙浓度的变化也是如此。DREM预测了几个转录因子(TF),包括CNBP、SAP18、PHF5A和CHURC1,在肾上腺中作为上游调控因子(图3E)。在雌性中,他们预测了其他TF,包括PPARA、PPARG和ESRRA(图3E),这些因子都是PGC1的相互作用因素ɑ。因此,DREM的结果表明,在耐力训练中,肾上腺中PGC1ɑ和线粒体生物发生的潜在上游调节因子。
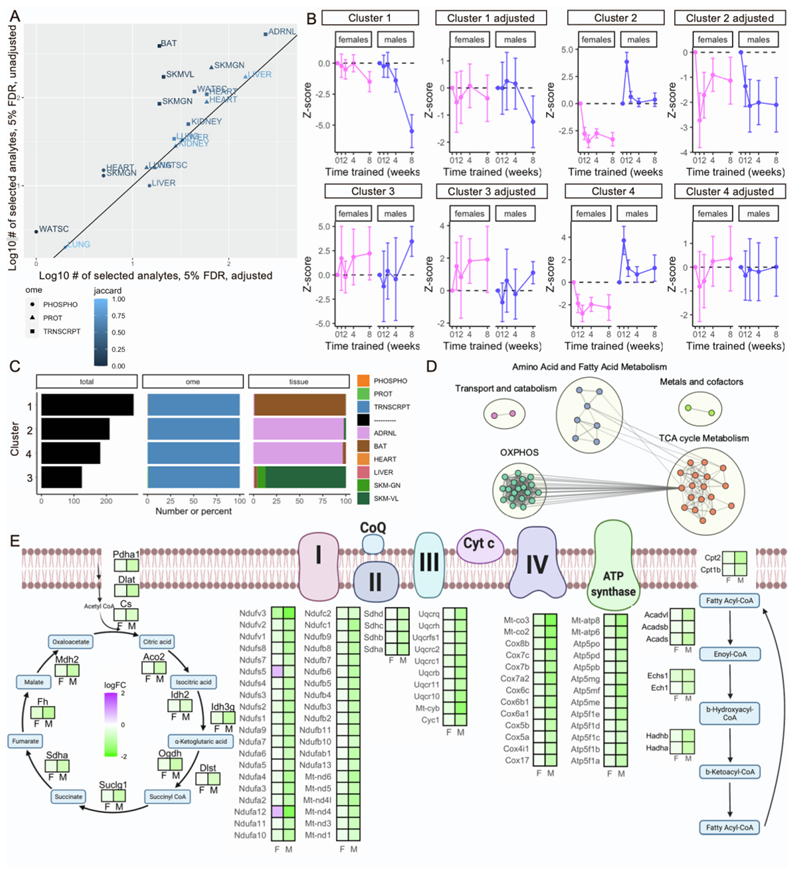
图S4. 肾上腺和棕色脂肪的转录反应受到线粒体生物标志物调节的影响。
(A)线粒体相关多组学分析物的数量。(B)聚类分析显示受线粒体体积生物标志物调整影响的差异基因模式。(C) 聚类特征。(D) BAT中最大差异路径对应的通路富集结果的网络视图。(E) 线粒体主要ATP产生途径的个体转录本变化。
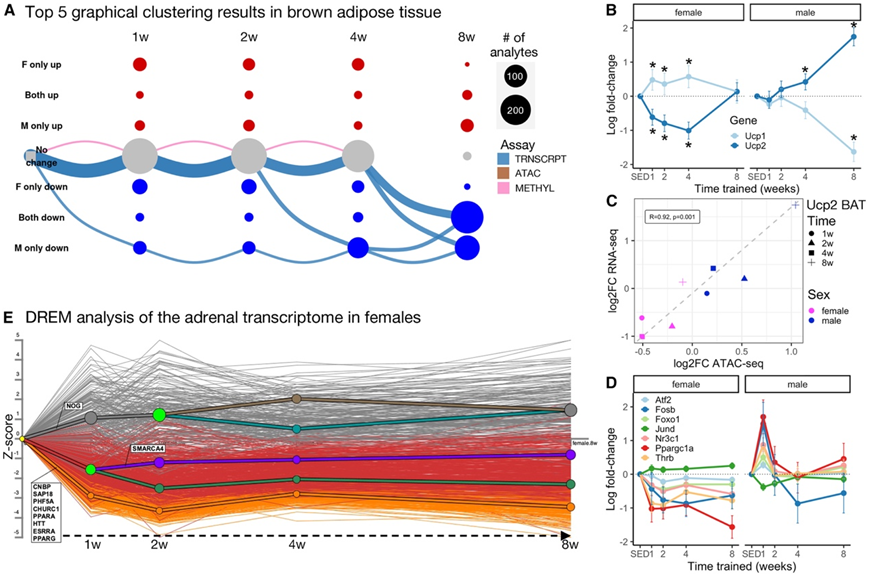
图3. 肾上腺和棕色脂肪组织在耐力训练中表现出不同的转录动力学。
(A)棕色脂肪组织(BAT)中线粒体相关训练差异分析物的图示。(B) Ucp1和Ucp2在雌性(左)和雄性(右)中的表达模式。(C) Ucp2表达变化与染色质可及性的相关性。(D)已知PPARGC1A/PGC1 α互作物的表达变化。(E)雌性肾上腺MitoCarta基因的DREM分析结果预测了几个转录因子参与了1周的反应。
04
训练诱导骨骼肌线粒体代谢的性别一致性上调
SKM-GN 分析物显示出性别一致的轨迹,在不同时间点上总体上调(图4A)。主要轨迹是由蛋白质丰度的变化驱动的,转录本和蛋白质的 OXPHOS 都发生变化。相比之下,脂质代谢和 TCA 循环酶几乎完全在蛋白质水平上受到调节。这些结果与 SKM-GN 和 SKM-VL 中性别一致上调基因的通路富集分析一致(图 4B,图S6A-C)。总的来说,肌肉组织中,差异转录本和蛋白质之间有显著的重叠(图S6D-E)。此外,雌性显著增加SKM-GN中的脂肪酸氧化蛋白,如ACSS1、ECHS1、ECI1和HADHA(图4C)。同样,线粒体复合物III相关通路仅在雌性中上调(图S6F)。正如预期的那样,SKM-GN和SKM-VL的mtDNA和生物发生通路均上调。线粒体自噬是一种受损线粒体的受控降解,是运动诱导的一种关键质量控制机制。线粒体自噬也可调节线粒体的总体体积和质量。因此,他们在SKM-GN中观察到线粒体自噬途径的转录诱导,并观察到DRP1(线粒体动力学的重要调节因子)增加。另一个质量控制机制是线粒体未折叠蛋白反应,这是一种对抗线粒体应激和功能障碍的适应性应激反应。促进反应的关键TF是ATF4、ATF5和DDIT3,其中ATF5主要在雌性SKM-GN和SKM-VL的早期训练时间点上调(图S6G)。
急性运动后骨骼肌中磷酸化蛋白质组发生变化,而复合物I磷酸化增加与心肌活性增加相关。他们观察到训练诱导骨骼肌复合体I磷酸化(图4D)。几种复合体I蛋白的丰度也发生了变化,但与磷酸化相比变化程度较小。他们观察到骨骼肌中与氧化能力增强相关的多层次调节,而氧化能力对于预防与年龄相关的线粒体功能下降至关重要。
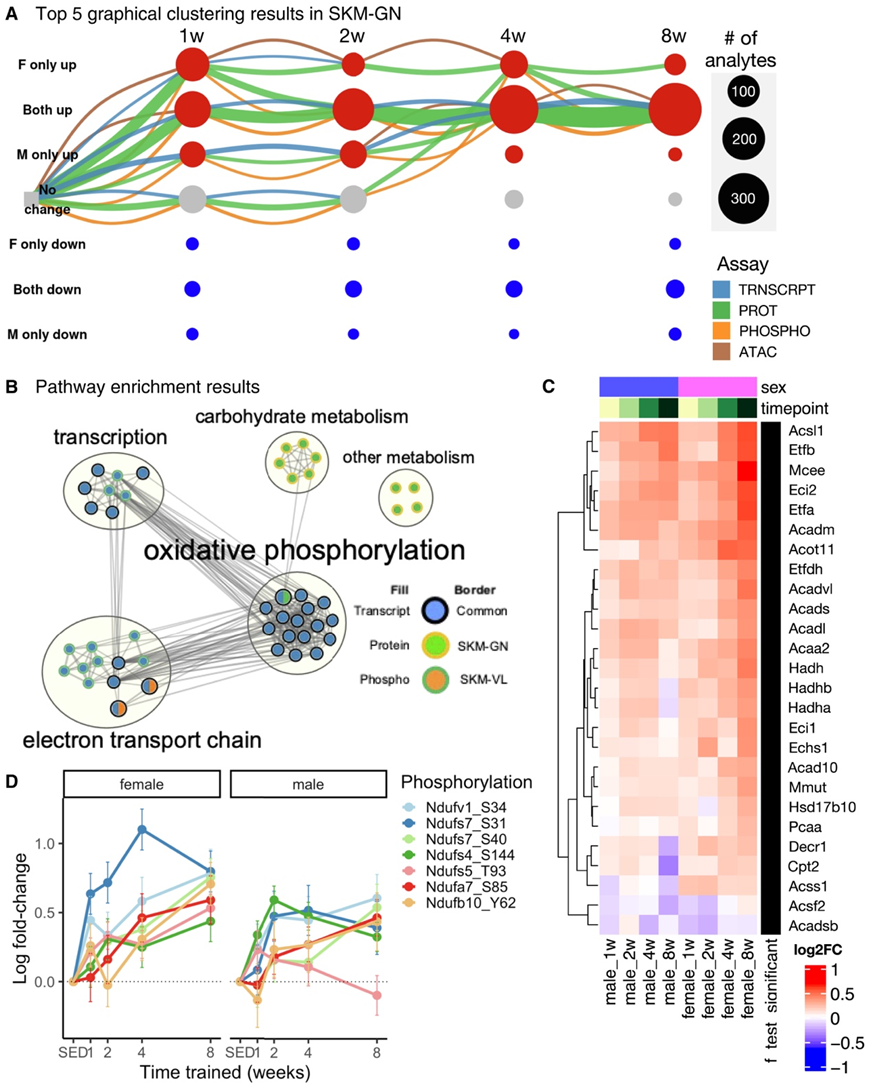
图4. 耐力训练诱导骨骼肌中代谢蛋白丰度在很大程度上与性别一致。
(A)通过构建汇总图来可视化分子训练响应的动态。(B)第8周分析物对应SKM-GN和SKM-VL性别一致上调节点的通路富集结果的网络视图。(C) SKM-GN蛋白组的脂肪酸氧化途径富集。(D)复合物I蛋白中显著差异蛋白磷酸化位点的变化。

图S6. 两性骨骼肌线粒体反应的一致性。
(A) 在每个训练时间点,SKM-GN转录本和蛋白质中显著上调和下调的分析物的数量。 (B-C) 基因集富集分析(GSEA)结果。(D) 三种肌肉组织中训练差异转录本重叠的维恩图。(E) SKM-GN和HEART中训练差异蛋白重叠的维恩图。(F) 线粒体复合物III蛋白表达变化。(G) SKM-GN(左)和SKM-VL(右)中线粒体未折叠蛋白反应转录因子(TF)的转录变化。
05
标力训练改变了心肌线粒体乙酰酶表达
对心脏线粒体分析物的差异分析揭示了跨时间点转录本和蛋白质的性别一致的上调轨迹(图5A)。第二大轨迹在第8周出现延迟下调(图5A-B)。与骨骼肌类似,训练增加了OXPHOS基因的转录丰度,而TCA、支链氨基酸(BCAA)和脂肪酸代谢途径受到调节(图5C)。性别一致的下调蛋白与辅酶Q代谢相关,而乙酰化降低发生在支链氨基酸和脂质代谢蛋白(图5D)。耐力训练引起线粒体蛋白的多个乙酰化改变(8周后有220个显著位点),这是已知的心脏生物能学调节机制,与心脏病致病性和衰老相关。大多数乙酰化变化的发生与蛋白质丰度的变化无关(图 5E-F)。蛋白质特异性乙酰化变化发生在关键生物能通路中(图 5G)。多种β-氧化、BCAA和TCA循环酶在多个乙酰化位点受到显著调节。参与β-氧化和BCAA分解代谢的ACAT1乙酰化减少发生在赖氨酸260和265(图5H),这两个位点的去乙酰化由于对辅酶A (CoA)的亲和力增加而增加了蛋白质活性。相反,训练诱导了心脏TCA循环酶顺乌头酸酶(ACO2)(图5I),这增加了其活性。这些结果表明,在训练的反应中,特定心脏线粒体蛋白发生了主要的乙酰化变化。

图5. 耐力训练改变了心肌线粒体乙酰酶。
(A)心肌中线粒体相关训练差异分析物的图示。(B)在每个时间点显著上调和下调的线粒体相关转录本和蛋白的数量。(C-D)通路富集结果对应的网络视图。 (E-F)蛋白质水平变化和乙酰化水平的相关性。(G) 8周后雄性和雌性代谢蛋白乙酰化和磷酸化的变化。(H-I)ACAT1和ACO2位点特异性乙酰化变化。
06
训练诱导肝脏代谢蛋白乙酰酶的重塑
八周的训练改变了所有组的线粒体分析物,其中大部分变化发生在蛋白质和 PTM 水平。发生的转录变化非常少(图 6 A),这可能与肝脏中较高的 mRNA 周转率有关。主要轨迹显示,在训练的前 4 周内,雄性特异性有所增加,而两性在 8 周后都有所增加(图 6 A)。该轨迹的通路富集主要由复杂 V 蛋白乙酰化、线粒体生物发生、支链氨基酸分解代谢以及脂质代谢蛋白的变化主导。第二大轨迹(> 200 种分析物)在训练的前 4 周期间保持不变,但随后到第 8 周时两性均有所增加(图 6 A),通路富集主要由线粒体编码的复合物 I 转录本的变化决定。
线粒体蛋白乙酰化占训练后肝脏观察到的显著变化的 60% 以上(图 2 A)。大多数差异乙酰化蛋白的丰度保持不变(图 6B-C),证明了响应训练的特定翻译后调节机制。他们观察到参与所有主要生物能过程的线粒体蛋白多个位点乙酰化的变化(图 6D)。特别是,参与脂质运输、脂质分解代谢、OXPHOS 和 BCAA 降解途径的酶的乙酰化程度增加。他们还观察到 SLC25A44 蛋白(一种线粒体 BCAA 转运蛋白)的增加,在人类骨骼肌中也随着训练而增加。与人类骨骼肌相似,复合物 V 中乙酰化的增加尤其显著(图6D)。在雄性的所有训练时间点,NAD+依赖的线粒体sirtuin SIRT3均有小幅增加,8周后在雌性中也有小幅增加(图6E)。
他们观察到HMGCS2中的赖氨酸310、447和473位点发生脱乙酰化(图6F),已知这些脱乙酰化可增强HMGCS2的酶活性。这些结果证明了耐力运动训练对肝脏线粒体蛋白质组和乙酰基组的可塑性,并为未来的机制研究提供了新的靶点。

图6. 通过蛋白质乙酰化训练诱导的肝脏线粒体适应。
(A)肝脏中线粒体相关训练差异分析物的图示。(B-C)肝脏中蛋白质丰度变化与乙酰化的相关性。(D)训练8周后雄性和雌性肝脏线粒体代谢蛋白乙酰化和磷酸化的变化。(E) SIRT3和SIRT4蛋白表达变化。(F) HMGCS2位点特异性乙酰化变化。
07
训练可上调人类T2D和肝硬化中下调的蛋白网络
线粒体功能障碍是慢性疾病的标志,包括肥胖、二型糖尿病(T2D)、非酒精性脂肪性肝病(NAFLD)和神经退行性疾病。他们发现T2D(骨骼肌)、肥胖和肝硬化(肝脏)以及HCM和心力衰竭(心肌)相关蛋白变化有显著重叠(图7 a)。对心肌梗死或NASH的反应与蛋白质变化的重叠不显著。在两个独立的数据集中,与人类T2D患者的蛋白质特征相比,大鼠对训练的反应有一个稳健的相反的调节(图7B)。他们重点研究了在T2D中受到相反方向调节的性别一致的差异蛋白,确定了一个密集的蛋白质相互作用网络(图7C),其中包括线粒体基质蛋白以及参与通过TCA循环和ETC产生ATP的蛋白,17-β-羟基类固醇脱氢酶 10 (HSD17B10)是一个关键蛋白。
在肝脏中,与雌性的训练反应相比,肝硬化患者有一个显著的相反的调节。运动上调的蛋白质主要与运动下调的蛋白质分开聚集(图7D)。在进行富集分析时,他们也观察到这区别:训练后,线粒体基质和代谢通路上调(在肝硬化中下调),而训练后,RNA加工通路下调。在T2D网络中也观察到的HSD17B10是关键的运动上调蛋白。它是一种多功能的线粒体脱氢酶,参与脂肪酸、氨基酸和类固醇代谢以及tRNA成熟。HSD17B10基因的突变导致HSD10线粒体疾病,导致神经变性、肝功能障碍和心肌病。在人肝细胞中,为了模拟疾病状况,沉默Hsd17b10转录本(图7E)导致氧消耗率和质子泄漏升高(图7F-G),这是线粒体代谢应激的一个指标,也发生在癌细胞中。在关键的OXPHOS蛋白水平上没有观察到差异(图7H)。与这一发现一致,在HSD10患者的肝脏中观察到复合物II的活性增加。

图7. 与II型糖尿病和肝硬化相比,训练对线粒体蛋白的调节作用相反。
(A)与病例对照蛋白质组学疾病队列中鉴定的蛋白相比,运动调节的差异蛋白之间重叠的意义。(B)比较关于非酒精性脂肪性肝病(NAFLD)的研究中重叠蛋白的意义。(C-D) GeneMANIA蛋白-反向调控的蛋白相互作用网络。(E)小干扰RNA (siRNA)敲除后HepG2细胞中HSD17B10蛋白丰度与阴性对照比较。(F-G)使用Seahorse检测敲低细胞与对照细胞的氧消耗率(OCR)。(H) western blot检测的电子传递链组分蛋白丰度。
+ + + + + + + + + + +
结 论
本项研究发现训练引起肾上腺、棕色脂肪、结肠、心脏和骨骼肌的多组学水平上的显著变化。结肠表现出非线性反应动力学,而线粒体通路在棕色脂肪和肾上腺组织中下调。肝脏中蛋白质乙酰化增加,脂质代谢发生变化,而横纹肌中氧化蛋白质增加。在人类糖尿病和肝硬化中,运动上调的蛋白网络发生下调。中枢网络蛋白HSD17B10的敲低会增加耗氧量,表明代谢应激。本项研究提供了线粒体对运动训练的反应的多组学图谱,并确定了与线粒体功能障碍相关的关键分子。
+ + + + +



 English
English


