文献解读|Nat Commun(16.6):具有不同复发风险的甲状腺乳头状癌的蛋白质组学和代谢组学综合特征
✦ +
+
论文ID
原名:Integrated proteogenomic and metabolomic characterization of papillary thyroid cancer with different recurrence risks
译名:具有不同复发风险的甲状腺乳头状癌的蛋白质组学和代谢组学综合特征
期刊:Nature Communications
影响因子:16.6
发表时间:2024.04.12
DOI号:10.1038/s41467-024-47581-1
背 景
甲状腺癌(TC)是内分泌系统最常见的恶性肿瘤,其中甲状腺乳头状癌(PTC)是最常见的甲状腺恶性肿瘤。虽然PTC一般恶性程度较低,长期预后良好,但复发率较高,高达20%的PTC患者出现复发。美国甲状腺协会 (ATA) 风险分层系统根据多种复发相关临床因素将复发风险 (RR) 分为低、中、高三个级别。血清甲状腺球蛋白(Tg)水平升高与PTC复发相关,并已应用于临床复发监测,但目前不同 RR 背后的分子基础仍未完全揭示。
实验设计
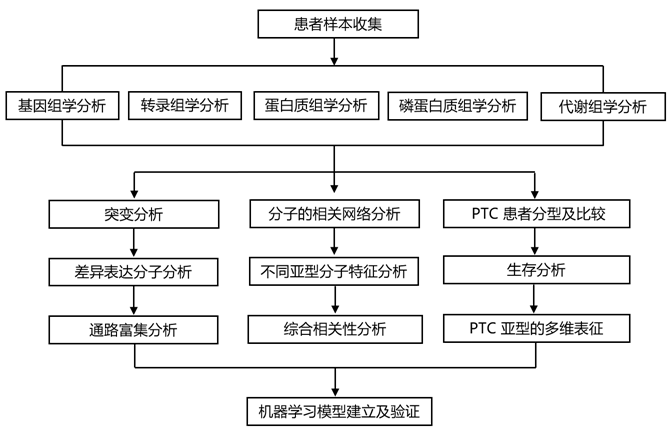
结 果
01
PTC的多组学研究
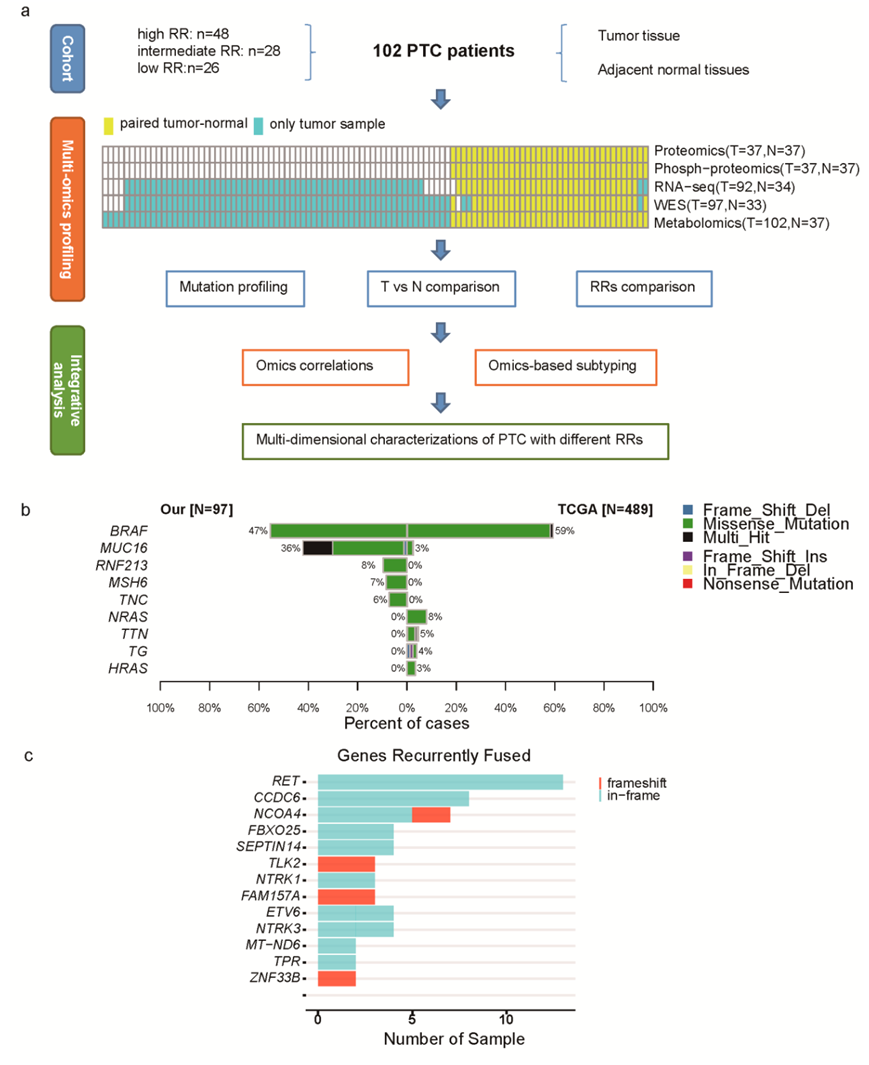
研究团队总共纳入了 102 名 PTC 患者,诊断时的平均年龄为 42 岁(范围为 15-77 岁),其中 63.73% 为女性。分别有 47.06% 高 RR、27.45% 中 RR 和 25.49% 低 RR患者。为了描述 PTC 的分子景观,他们进行了多组学数据,包括基因组学、转录组学、代谢组学、蛋白质组学和磷酸化(磷酸化)蛋白质组学(图 S1a)。基于全外显子组测序(WES)的基因组学数据来自97个肿瘤组织样本和33个配对的正常组织样本,基于rna测序(RNA-seq)的转录组学数据(16925个基因)来自92个肿瘤组织样本和34个配对的正常组织样本,代谢组学分析(503个代谢物)来自102个肿瘤组织样本和37个配对的正常组织样本。对37对肿瘤-正常组织进行蛋白质组学(3147个蛋白)和磷酸化蛋白质组学(652个磷酸化蛋白)分析(图 S1a)。
在97例中国PTC患者中,平均鉴定出74个非同义体细胞点突变和2个缺失突变。与大多数关于PTC的基因组研究一致,最常见的体细胞突变基因是BRAF(图1a)。此外,频繁突变的癌症相关基因还包括MUC16(36%)、RNF213(8%)和MSH6(7%),其突变频率高于癌症基因组图谱(TCGA) PTC数据集(图S1b)。MUC16突变在高RR的PTC患者中特异性富集,并与多种病理因素相关,包括高RR、复发、转移淋巴结大小大于3cm (LNM.3cm)、T3期、N1b期和M1期(图1c)。PTC患者中也有频繁的TERT启动子突变(C228T, 14%)。这些突变在高RR患者中也显著富集,并且经常与某些病理或临床因素重叠,包括高RR、复发、LNM.3cm、甲状腺外延伸(ETE)、淋巴结转移(LNM)或结外延伸(ENE)(图1d)。
在PTC中经常发现RET、NTRK和BRAF基因重排。RET融合(CCDC6-RET 8%,NCOA4-RET 5%)是最常见的融合,并且还发现了多种NTRK融合(NTRK3-ETV6, TPR-NTRK1, ETV6-NTRK3)(图S1c)。此外,在之前的PTC研究中还发现了其他几种罕见频率的基因融合(FBXO25-SEPTIN14, TLK2-FAM157A, ZNF33B-NCOA4)(图1a)。
图S1. 不同复发风险甲状腺癌患者的遗传特征分析。
(a) 多组学研究综述。(b) 队列中SMG与TCGA-PTC数据集的比较。(c) 基因融合结果。
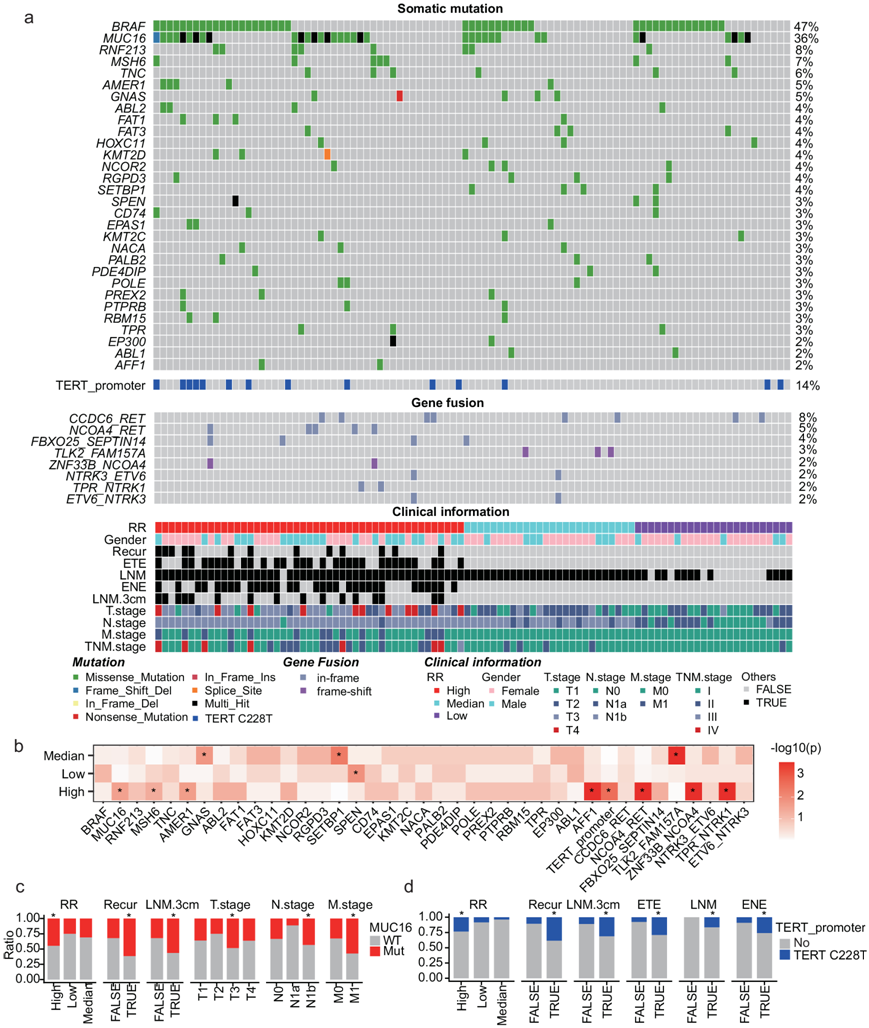
图1. 具有不同 RR 的 PTC 患者的遗传特征。
(a) 97 名 PTC 患者的基因谱和相关临床信息。(b) 显著富集的突变。(c-d) 临床特征显示MUC16或TERT启动子突变显著富集。
02
PTC患者肿瘤与正常组织的多组学比较
除了基因组改变外,还通过基于多组学分析数据比较肿瘤和匹配正常样本来识别差异表达分子(dem)。结果,共识别出4种类型的dem,包括1674个基因、1864个蛋白、391个磷酸化蛋白和334个代谢物(图2a)。其他代谢组学研究也发现了PTC肿瘤中FFA的增加。在PTC肿瘤组织中,tenascin (TNC)、纤连蛋白1 (FN1)、二肽基肽酶4 (DPP4)、主要vault蛋白(MVP)和FN1的磷酸化蛋白显著上调,而甲状腺过氧化物酶(TPO)、desmin (DES)和脂肪酸结合蛋白4 (FABP4)蛋白以及甲状腺球蛋白(Tg)、DES、血红蛋白δ亚基(HBD)和血红蛋白β亚基(HBB)的磷酸化蛋白在PTC肿瘤中下调(图2b)。据报道,TNC在髓质TC中表现出非常高的表达,在这里,他们发现它在PTC肿瘤中也上调。在所有类型的TC中均观察到FN1表达上调。TPO是合成甲状腺激素的重要酶,主要在正常甲状腺细胞中表达。与正常肿瘤相比,PTC肿瘤中TPO的表达水平降低。
四种类型的dem分别富集了通路,大多数富集的通路都是代谢通路(图2a),而基因、蛋白质和磷蛋白同时富集的通路都属于缬氨酸、亮氨酸和异亮氨酸降解、丙酮酸代谢、糖酵解/糖异生、精氨酸和脯氨酸代谢等代谢通路(图2c)。其中糖酵解和丙酮酸代谢也由差异表达的代谢物富集(图2d)。同时,至少三种类型的dem富集了氧化磷酸化、柠檬酸循环等多种代谢通路(图2d)。这些结果提示PTC肿瘤组织中显著的代谢改变。
基于多组学的通路分析能够全面描述通路改变。以糖酵解为例(图 2e),他们观察到虽然大多数酶在mRNA水平发生下调(例如HK1、PGM1),但其中一些酶在蛋白质或磷酸蛋白水平发生上调(例如ENO1、PCK1和PDHA1)。同时,代谢物的变化主要体现在葡萄糖、果糖、甘油酸-3P和丙酮酸水平的降低以及乳酸(L-乳酸)水平的升高(图 2e)。基于多组学的通路改变模式有助于进一步解释潜在的机制,包括直接酶LDHA(mRNA和蛋白质水平)的改变以及相关的上/下游变化(例如ENO1、PKM和PDHA1)。
除了代谢通路外,DEM 在代谢物、蛋白质和磷蛋白方面也显著富集了两种细胞死亡相关通路:坏死性凋亡和细胞凋亡(图 2d)。
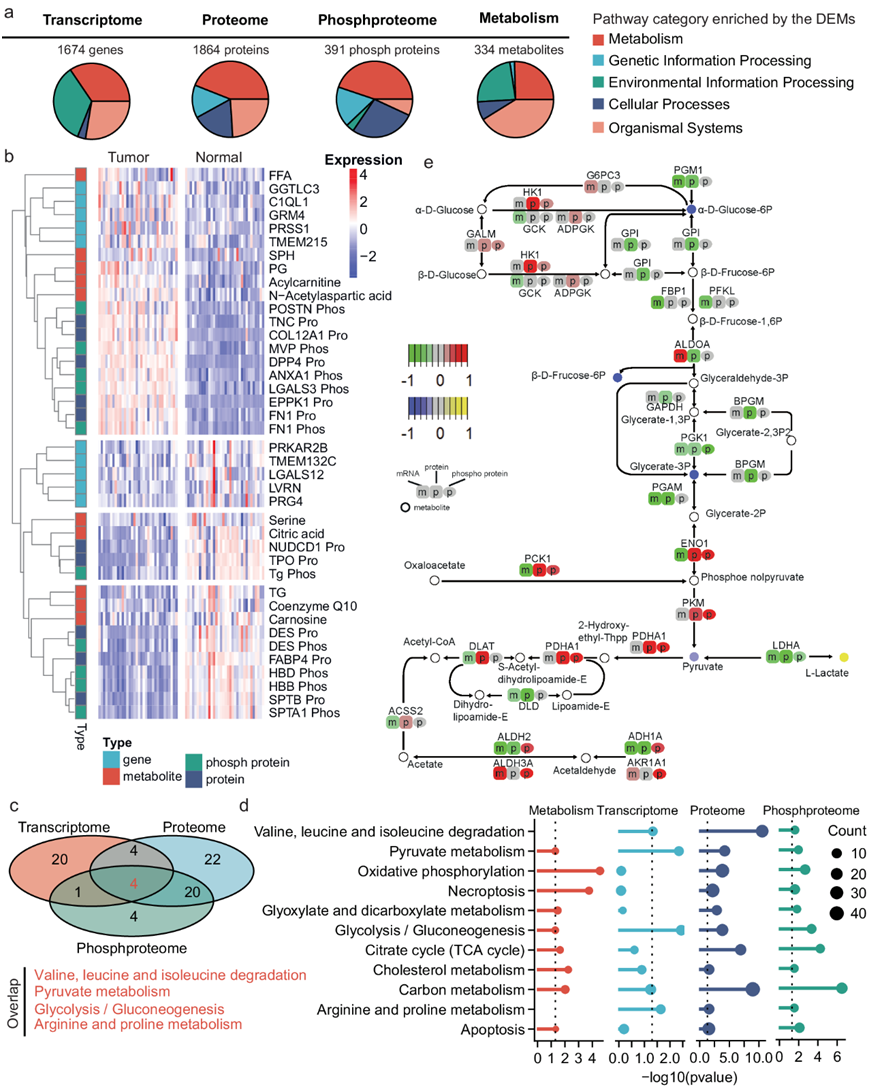
图2. 基于多组学的肿瘤和正常甲状腺样本分析。
(a) 由DEM富集的通路类别。(b) 显示排名靠前的 DEM 的热图。(c) 转录组学、蛋白质组学和磷酸化蛋白质组学确定的 DEM 分别富集的通路的维恩图。(d) 通路富集结果。(e) 糖酵解通路的肿瘤和正常样品之间的多组学差异。
03
具有不同 RR 的 PTC 的基于多组学的分子特征
他们还对 PTC 不同 RR 背后的分子表达特征进行了表征(图 3a)。高 RR PTC 患者的多种脂质(如 TG、FFA) 和其他代谢物(如组胺和犬尿氨酸)表现出较高的表达水平。高 RR 分别在MMP13、CST1、COL11A1等基因,Tg、PTRRG、VWA1 等蛋白质以及 EPPK1、ALDH1A1 和 LAMC1 等磷蛋白中也表现出较高的表达。中 RR患者的代谢物(如多种 FFA 和犬尿氨酸)、基因(如IGFN1、LOC391322和ZNRD1)、蛋白质(如 FTL、FABP5 和 APOB)以及磷蛋白(如 C1QB、HBB 和 HBD)表达较高。低RR患者的PG (18:2_18:2)和OAHFA (18:2_18:1)等代谢物、JSRP1、TCAP和TNNI2等基因、ACADL、ABHD11和FN1等蛋白质以及TNC、FN1等磷蛋白有较高表达。与肿瘤和正常样本之间的变化相比,高RR PTC肿瘤样本与中或低RR样本相比显示出相反的变化(图 3a)。TC肿瘤样本的Tg蛋白水平显著降低,但与其他肿瘤样本相比,高RR PTC样本的Tg蛋白表达更高(图 3a)。
RR相关分子的表达谱,尤其是FFA(FFA 26:2、FFA 24:2、FFA 26:4)和几种蛋白质或磷蛋白高度相关(图 3b)。FFA 26:2、Tg、FN1 和 5-脂氧合酶 (ALOX5)、磷酸化 FN1 和磷酸化 TNC 在相关网络中具有相对的中心位置,表明它们在交互调节或信号传导中发挥着至关重要的作用。ALOX5作为一种非血红素含铁酶,可以催化多不饱和脂肪酸的过氧化反应。ALOX5 的异常表达已在多种类型的癌症中观察到,包括 PTC。他们还发现ALOX5在高RR PTC患者中表现出特异性低表达,并且其改变与许多FFA的变化相关(图3b-d)。
不同的 RR 在通路概况上也表现出显著差异。对于高RR,各种代谢通路中的代谢物,(例如氨基酸的生物合成和糖酵解)均发生上调,而代谢酶的蛋白质水平发生下调(图 3c)。除了直接代谢酶外,还有其他蛋白质与PTC中的代谢物变化显示出显著的相关性(图 3f),例如蛋白质Tg、磷酸化蛋白质MSN(图3g-h)。
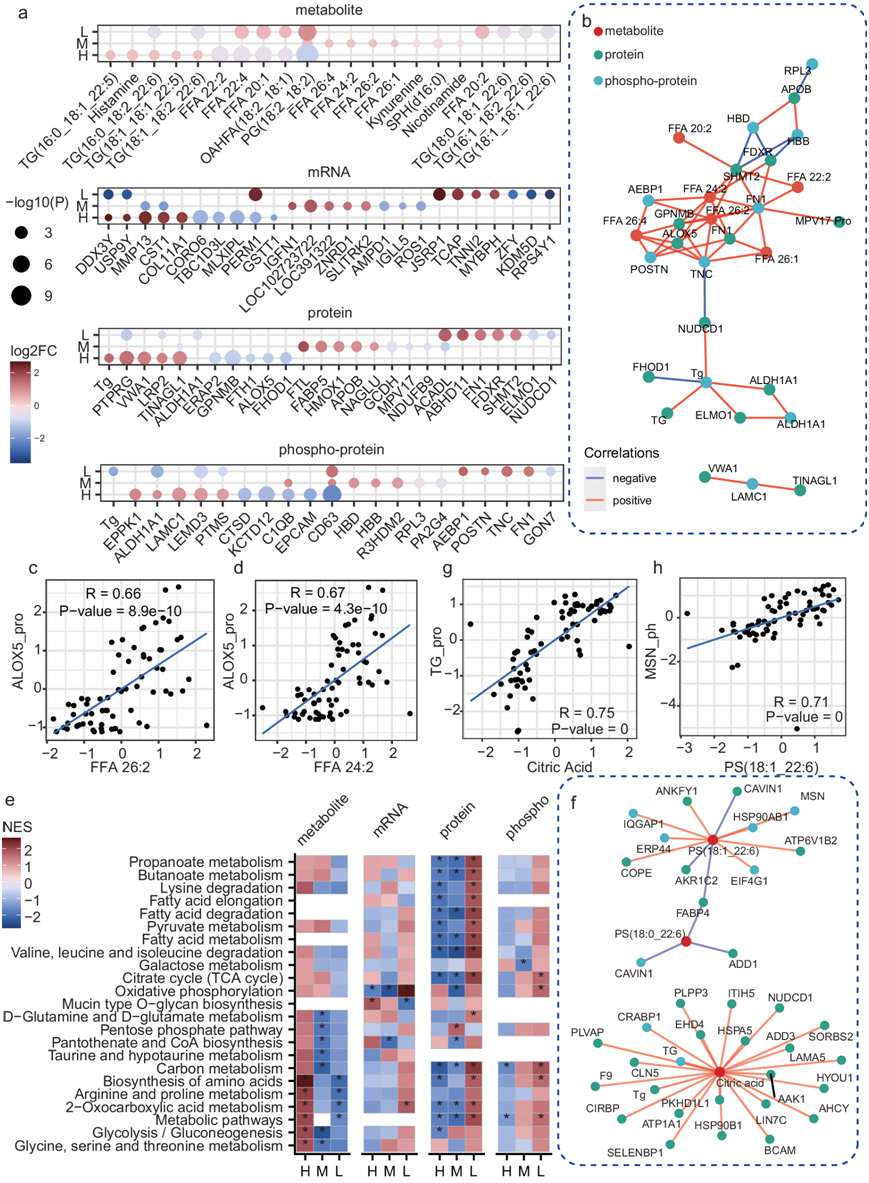
图3. 不同复发风险的多组学景观。
(a) 不同RR患者中表达差异显著的分子。(b) 分子相关网络在不同RR中表达差异显著。(c-d) 散点图显示ALOX5蛋白与代谢物FFA 26:2 和FFA 24:2之间的相关性。 (e) RR相关分子代谢通路富集结果。(f) 分子的相关网络。(g-h) 散点图显示代谢物柠檬酸和蛋白质 TG、代谢物 PS (18:1_22:6) 和磷蛋白 MSN之间的相关性。
04
多组学数据的综合相关性分析
不同类型组学数据之间的相关性基于一种名为DIABLO (data Integration analysis for Biomarker discovery using Latent cOmponents)的监督多组学整合分析方法进行评估,该方法可以同时最大化不同类型组学之间的相关性,并识别出区分不同样本组(即高、中、低RR组和正常样本组)的关键分子。因此,代谢组学、蛋白质组学和磷酸化蛋白质组学之间的一般相关性很高,表明代谢组学、蛋白质组学和磷酸化蛋白质组学之间存在共同的信息。根据信息从DNA传递到RNA再传递到蛋白质的中心规律,蛋白质组学预计将与转录组学高度相关。然而,转录组学与蛋白质组学或磷酸化蛋白质组学之间的相关性相对较低(图4a)。从基础上看,mrna -蛋白相关性较低,样本和基因的mrna -蛋白Spearman相关系数中位数分别为0.29和0.086。从通路角度看,代谢通路的基因/蛋白与其他通路的相关性相对较高(但仍在0.25 - 0.5之间),而核糖体、剪接体、mRNA、自噬等大蛋白复合物通路的基因/蛋白相关性较低(在- 0.25-0之间)。根据关键分子的表达谱和相互关系将其聚类为4个网络模块,不同模块具有不同的表达谱和相互作用模式(图4b-c)。第一个模块(M1)中的分子主要由细胞外基质(ECM)相关蛋白组成,包括FBLN5、NID1、NID2、COL4A2、TINAGL1、VWA1以及不同链的层粘胶蛋白(LAMA4、LAMB1、LAMC1),它们具有高度的相互相关性,在高RR组中的表达水平高于其他肿瘤样本,突出了ECM相互作用在PTC复发中的关键作用(图4b-c)。第二个模块(M2)由PGK1、PSMF1、PRDX1、TOM1等多种与代谢相关的磷酸化蛋白组成,它们在肿瘤组织中表达较低,尤其是在高RR肿瘤组织中(图4b)。它们的表达也与蛋白IGKV3-15、RPS27A、基因MYH11和HTR2A相关(图4c)。第三个模块(M3)是最大的模块,与匹配的正常组织相比,M3中的分子主要在肿瘤组织中表达更高(图4b)。M3中有三个子模块,由代谢物、基因和蛋白质/磷蛋白聚集(图4c)。M3的相关代谢物主要是脂类,包括磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)和鞘磷脂(SM)。大部分蛋白/磷酸化蛋白参与自噬(STAT3/ATP6V1B2/ATP6V1C1/HGS/LAMTOR2/VPS13C/HSP90AA1)。这些基因参与谷胱甘肽代谢(GGTLC3/GGT2)30、免疫应答(IFNE/PRSS2)和促甲状腺激素(TRHR)的胞吐分泌。同时,TRHR、C1QL4和AMY1B在M3网络中具有相互连接的位置。第4模块(M4)分子主要在中低RR组中表达较高(图4b)。FFA、二酰基甘油(DG)、磷脂酰甘油(PG)等代谢物与脂肪酸结合蛋白FABP5形成连接M4网络中基因和蛋白或磷酸化蛋白的中介层,M4中多个蛋白和磷酸化蛋白(ERAP2/CYBB/CD74/DYNC1H1/RAB7A)参与抗原加工和提呈,提示PTC中脂肪酸代谢与适应性免疫功能之间可能存在相互作用(图4c)。
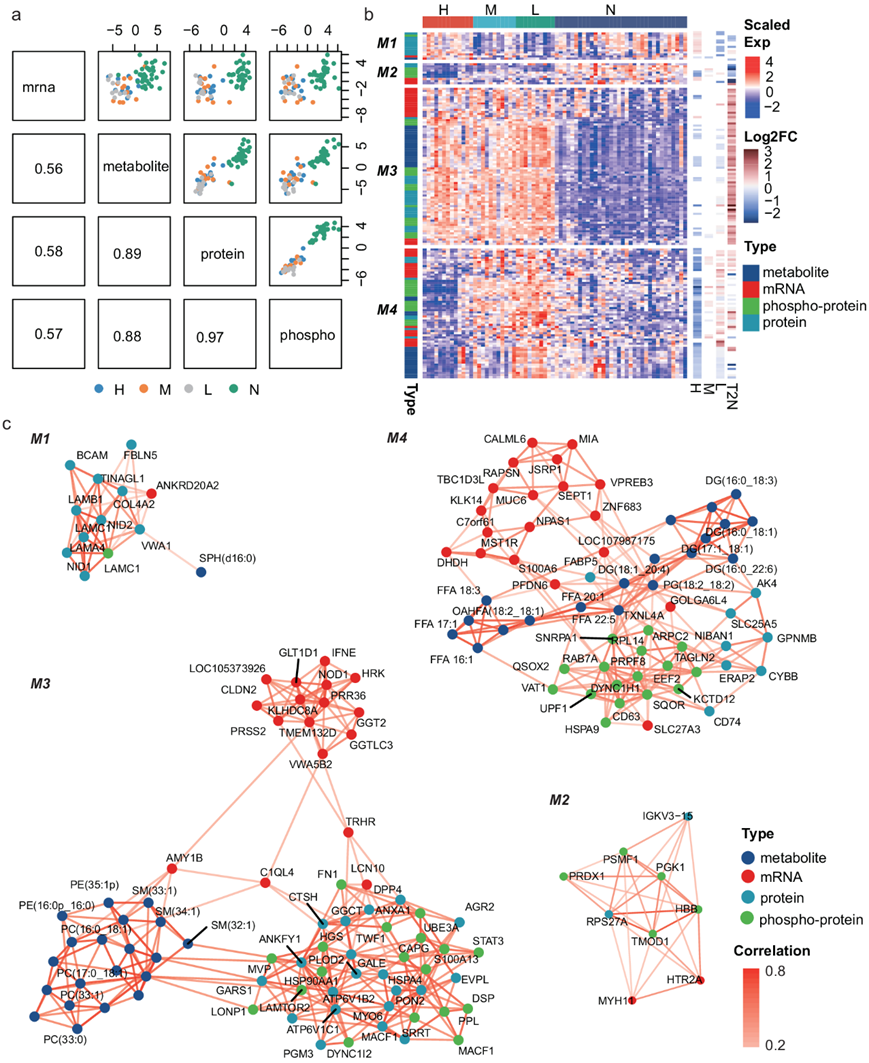
图4. 不同类型组学之间的相关性。
(a) 由不同类型的组学确定的第一个 DIABLO 成分之间的相关性。(b) 对前两个组分贡献最大的分子的热图。(c) 基于多组学的四个分子模块(M1至M4)的关联网络。
05
基于转录组学和代谢组学将 PTC 患者综合分层为四种亚型
值得注意的是,尽管大多数高RR样本显示M4中分子的低表达,但其中部分样本也显示出与中和低RR样本相似的表达谱(图 4b),这意味着可能存在不同于ATA风险分类的替代分子亚型。四种重新定义的亚型在转录和代谢谱(图5a)以及多种临床和突变特征(包括RR、T期、N期、BRAF突变、TERT启动子突变和ENE)上显示出显著差异(图5a-b)。CS1亚型中低RR患者较多,CS2 - CS4亚型中高RR患者较多(图5b)。CS2和CS3亚型有更多的T3期、N1b期患者,但BRAF和TERT启动子突变较少(图5b)。BRAF和TERT启动子突变显著富集于CS4亚型(图5b)。此外,在无复发生存方面,四种亚型具有不同的预后结果(图5c),其中CS2和CS3亚型在三种高rr富集亚型中分别表现出最差和最佳预后(图5d-e)。
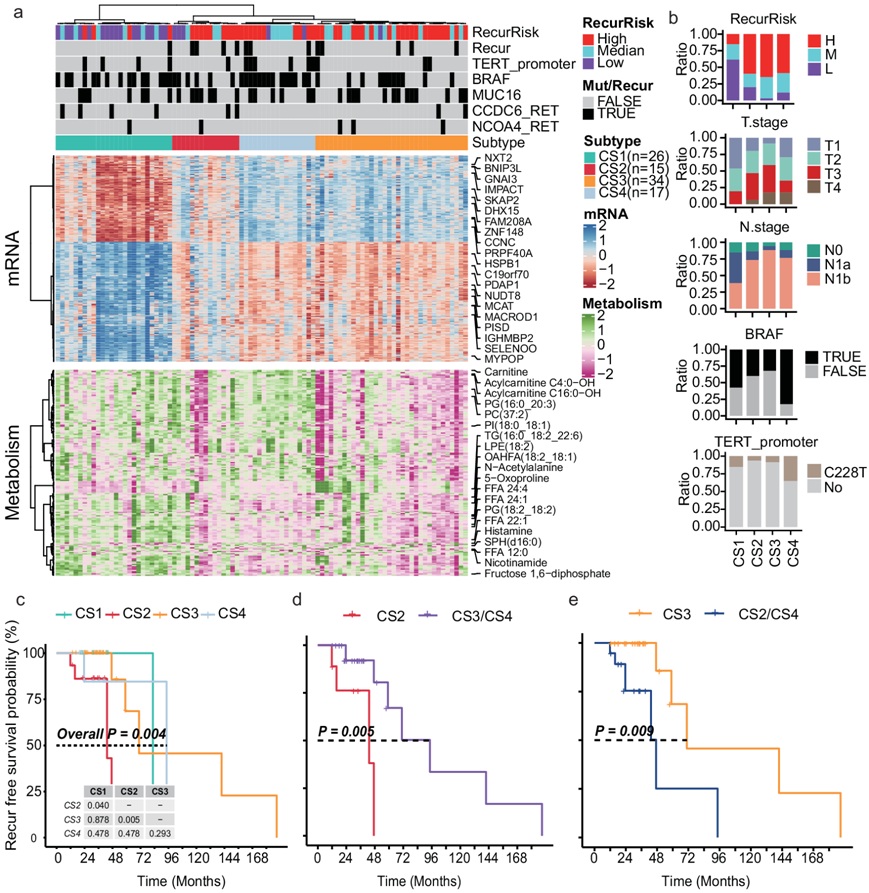
图5. 基于转录组和代谢组学概况的 PTC 患者的综合聚类。
(a) 热图显示基于转录组学和代谢组学的 PTC 患者的聚类结果。(b) 四个聚类中分布显著不同的临床特征条形图。(c-e)生存分析。
06
四种 PTC 亚型的多维表征
这四种亚型具有非常独特的分子谱,并且每种亚型都具有各种特异性上调或下调基因和代谢物(图 6a-b)。据报道,PTC 患者血清样本中纤溶酶原 (PLG) 的表达显著低于结节性甲状腺肿患者。低RR主导的亚型CS1中PLG的mRNA表达水平高于其他亚型(图 6a)。HSP6A是预测TC预后的潜在生物标志物。ECM1与多种癌症类型的肿瘤侵袭性和不良预后相关。HSP6A和ECM1都显示出CS2特异性的较高表达(图 6a)。从代谢物来看,CS1亚型的FFA、PG、果糖1,6-二磷酸等含量较高;CS2亚型的水苏碱含量较高;CS3亚型的TG、柠檬酸等含量较高;而CS4亚型的酰基肉碱、腺苷、组胺等含量较高(图 6b)。
CS2和CS3亚型显示出比CS1亚型更大的肿瘤尺寸(图 6c)。CS1亚型的转移淋巴结数量少于其他亚型(图 6d)。亚型CS2显示出比亚型CS1和CS4更高的肿瘤差异评分 (TDS),并且亚型CS3具有比亚型CS1更高的TDS(图 6e)。此外,与CS1和CS4亚型相比,CS2和CS3亚型均表现出较高的RAS评分和较低的BRAF评分(图 6f-g)。相应地,亚型CS2和CS3的BRAF突变频率低于CS1和CS4亚型(图 5b)。
虽然CS2和CS3亚型之间在肿瘤大小、转移淋巴结数量、TDS、BRAF和RAS评分方面没有观察到显著差异(图 6c-g),但是他们在通路谱中显示出相反趋势(图6h-i)。在代谢通路中,各代谢通路中酶的mRNA表达在CS2中上调,在CS3中下调(图6h)。相反,大多数免疫相关通路在CS3中上调,而在CS2中下调(图6i)。
他们根据研究中的 RNA-seq 数据和之前报道的 PTC的 scRNA-seq 数据集,使用反卷积方法来预测 PTC 肿瘤样本的肿瘤微环境组成。四种亚型也表现出独特的细胞组成,特别是上皮亚群(图 6j),这意味着不同的亚型来自不同类型的恶性甲状腺细胞(图 6j)。
根据四种亚型的临床、分子及通路特点,他们将四种亚型归纳为低RR及braf样型(CS1)、高RR及代谢型(CS2)、高RR及免疫型(CS3)、高RR及braf样型(CS4)。
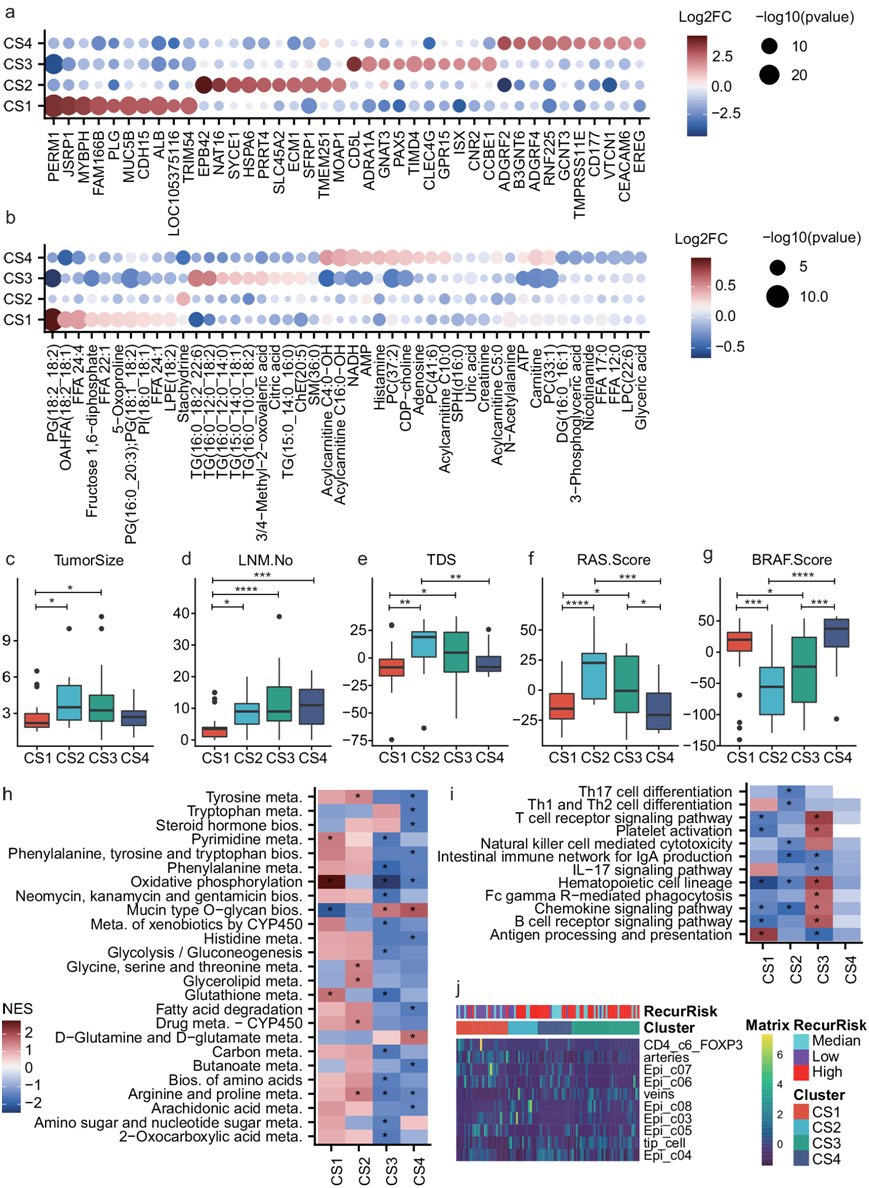
图6. 四种 PTC 亚型的特征。
(a-b) 基于转录组学(Deseq2检测)和代谢组学,在不同的聚类中显著上调的基因和代谢物。(c-g) 四个聚类中肿瘤大小、转移淋巴结数量 (LNM.No)、肿瘤差异评分 (TDS)、RAS 评分和 BRAF 评分的箱线图。(h-i) 四个聚类的代谢和免疫通路富集结果。 (j) 热图显示不同聚类的不同细胞组成。
07
PTC细胞中brAf状态相关亚型特征的验证
BRAF状态与PTC的不同亚型高度相关(图 5a-b和图6g)。同时,对于BRAF突变较少但复发率较高的两种亚型CS2和CS3,它们在一些BRAF突变相关基因中表现出相反的改变,例如LY6K(图 7a,图S10a-b)。与其他 PTC 细胞相比,IHH4 细胞表现出 BRAF 和 BRAFV600E 的高表达,并且 LY6K 在 PTC 细胞中高表达。为了干扰 BRAF 和 BRAFV600E 的表达,他们将两个独立的 BRAF 短发夹 RNA (shRNA) 引入 IHH4 细胞,导致 BRAF 和 BRAFV600E 的表达同时减少,同时下游因子 pMEK1/2 减少(图 7b,图S10c-e)。他们观察到LY6K表达随着BRAF/BRAFV600E下调而下降,表明对BRAF的潜在依赖作用(图 7c)。进一步的分析表明,LY6K 的恢复显著逆转了 BRAF 敲低细胞的细胞增殖和肿瘤发生(图 7d-f,图S10f)。这些结果表明,BRAF 状态可能与 PTC 内的其他因素(例如代谢信号)相互作用,从而在一定程度上共同促成四种独特的亚型。
接下来,为了验证 BRAF 状态和代谢信号之间的相关性,他们使用上述细胞系进行了代谢组学和转录组学分析。与BRAF 突变型 PTC 肿瘤样本中多种代谢物水平升高的观察结果一致,与 BRAF 敲低细胞相比,对照 IHH4 细胞也表现出一系列代谢物水平的提高,尤其是 PE 和 PC 物种(图S10g)。LY6K的恢复导致多种代谢物水平显著降低(图7g),药物代谢、戊糖与葡萄糖酸盐相互转化等部分代谢通路基因上调(图7h),这与LY6K高亚型CS2的大多数代谢物减少和各种代谢通路相关基因上调一致(图6b-h)。同时,LY6K的恢复也逆转了BRAF敲低产生的通路影响(图7h)。
为了在计算机上验证四种 PTC 亚型,他们将 PTC 数据分为训练和测试数据集,并根据训练数据集中排名前 30 的基因和代谢物的表达水平构建了一个亚型预测器(图 S10h-i)。
预测器可以在测试数据集中准确地对四种亚型进行分类,测试数据集上CS1至CS4的受试者工作特征曲线(AUC)下的面积为1、0.97、0.97、0.99(图7i)。同时,预测的 CS2 亚型概率与无复发生存率相关,其中高 CS2 概率与不良预后相关(图 S10j)。此外,为了通过只有转录组学可用的外部队列验证亚型,他们还训练了一个基于前300 mRNA表达的亚型预测器,并利用它在TCGA-PTC队列中找到四种亚型。该模型仍然可以识别出预后模式相似的亚型(图7j),其中CS2亚型预后最差(图S10k),BRAF突变较少(图S10l)。
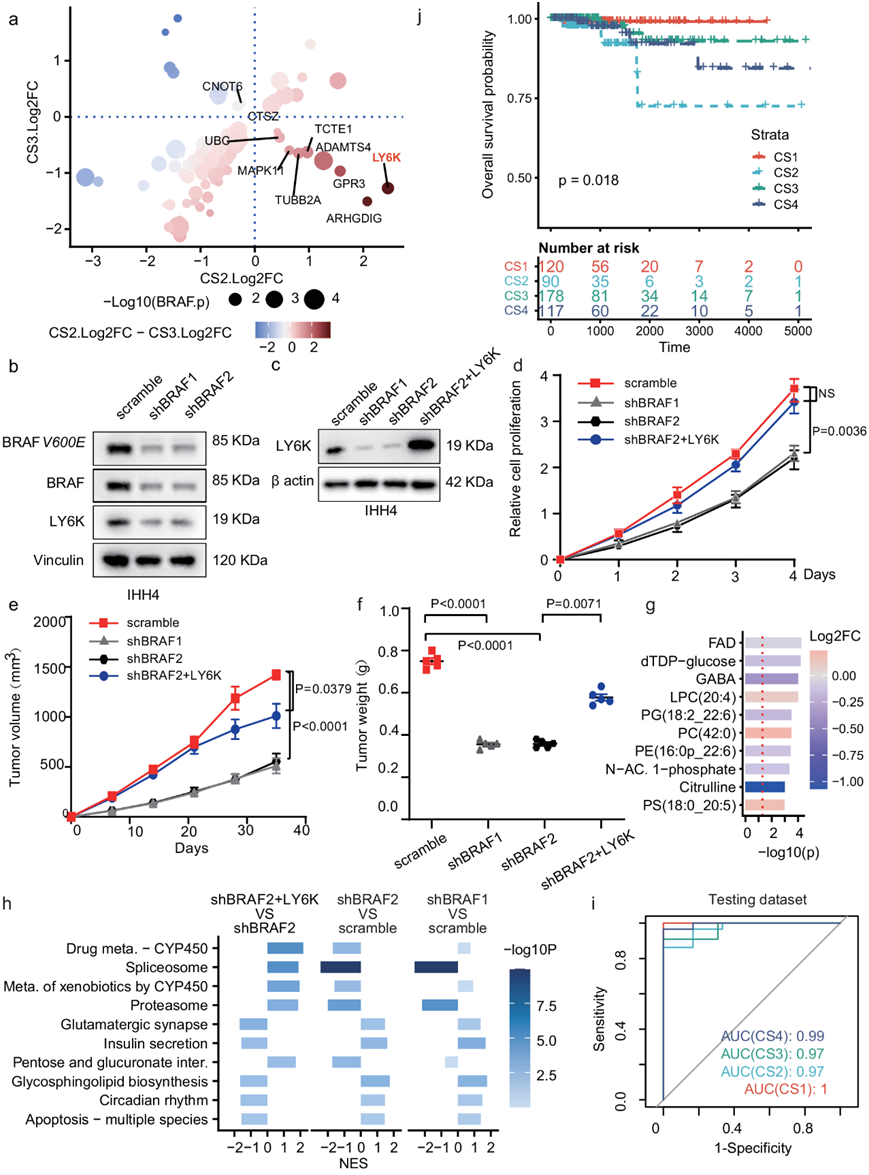
图7. 通过实验和计算方法验证亚型。
(a) CS2 和 CS3 亚型中 BRAF 相关基因差异表达的散点图。(b-c) 免疫印迹分析。(d) 指定细胞系的增殖分析。(e-f) 异种移植肿瘤进展和肿瘤重量。 (g) 差异表达代谢物的条形图。(h) 基于KEGG的GSEA结果用于比较不同细胞系之间的转录组学分析。(i) 用于预测测试数据集中 CS1 至 CS4 亚型的接收者操作特征 (ROC) 曲线。(j) TCGA-PTC 数据集中四种预测亚型的所有生存曲线图。
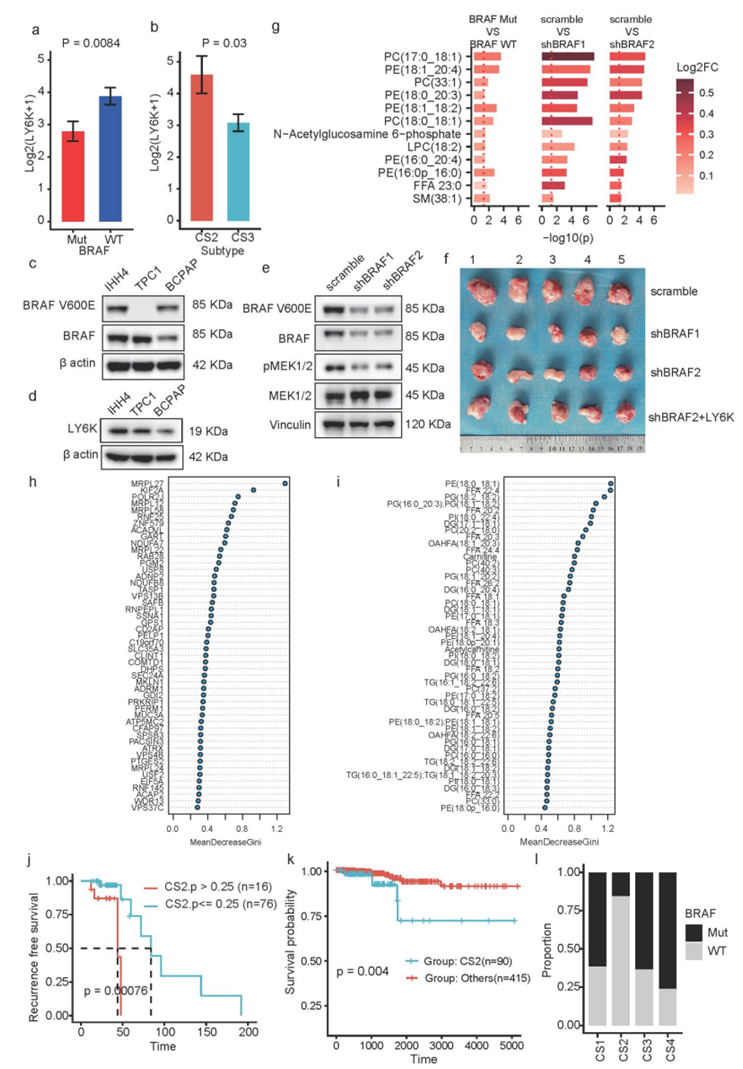
图S10. 通过实验和计算方法验证亚型。
(a) 突变型和野生型PTC肿瘤组织中LY6K平均表达的条形图。(b) LY6K在CS2和CS3亚型中平均表达的条形图。(c-e)免疫印迹分析。(f) 从注射IHH4细胞的小鼠中切除的肿瘤示意图。(g) 不同条件下代谢物差异表达的条形图。 (h i) 散点图显示了不同基因和代谢物对亚型预测的重要性。(j-k)生存分析。 (l) TCGA-PTC数据集中四个预测聚类中BRAF状态比例的条形图。
+ + + + + + + + + + +
结 论
本项研究对 102 名具有不同 RR 的中国 PTC 患者进行了综合蛋白质组学和代谢组学表征。基因组分析表明,高 RR 富集了MUC16和TERT启动子的突变以及NCOA4 - RET等多基因融合。综合多组学分析进一步描述了 PTC 的多维特征,尤其是代谢通路,并分析了不同 RR 的主导分子模式。此外,基于多组学数据将PTC患者分为四种亚型(CS1:低RR和BRAF样;CS2:高RR和代谢型,预后最差;CS3:高RR和免疫型,预后较好;CS4:高RR和BRAF样)。值得注意的是,考虑到 BRAF 和 TERT 启动子突变、代谢和免疫通路谱、上皮细胞组成、各种临床因素(尤其是 RR 和预后)以及药物靶标,这些亚型显示出显著差异。该研究可以深入了解PTC复发的复杂分子特征,有助于促进复发性PTC的早期诊断和精准治疗。
+ + + + +



 English
English


