文献解读|Drug Resist Updat(24.3):规避胃癌耐药性:化疗和免疫治疗反应动力学的空间多组学探索
✦ +
+
论文ID
原名:Circumventing drug resistance in gastric cancer: A spatial multi-omics exploration of chemo and immuno-therapeutic response dynamics
译名:规避胃癌耐药性:化疗和免疫治疗反应动力学的空间多组学探索
期刊:Drug Resistance Updates
影响因子:24.3
发表时间:2024.03.19
DOI号:10.1016/j.drup.2024.101080
背 景
胃癌 (GC) 是一种流行且致命的疾病,是全球第五大常见癌症,也是癌症相关死亡的第三大原因。免疫抑制性肿瘤微环境(TME)以免疫细胞浸润和免疫调节分子为特征,是化疗和免疫治疗的主要障碍,导致治疗耐药。GC的特点是对治疗表现出异质性反应,特别是与免疫加化疗相关的反应,因此需要精准医疗方法。
实验设计
结 果
01
单细胞转录组分析揭示胃癌化疗和免疫治疗反应的单细胞景观
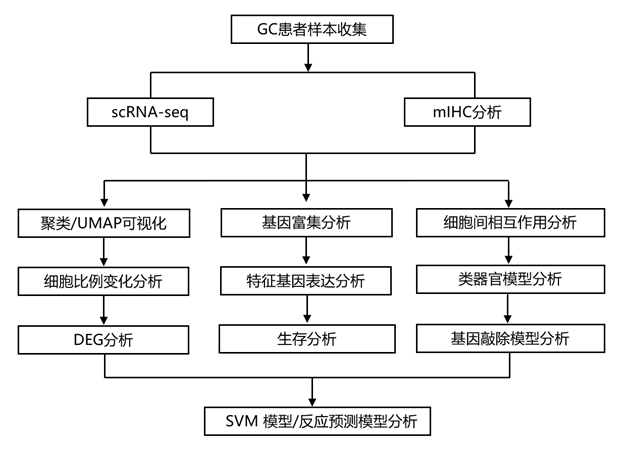
研究团队招募了诊断为非转移性、未接受过治疗的 GC 患者,并实施了由单剂量信迪利单抗(抗 PD1)联合奥沙利铂和 S-1 (SOX) 组成的治疗方案,持续三个周期,然后进行手术,收集患者术后组织并进行单细胞转录组分析(scRNA-seq)(图1A)。为了深入了解细胞异质性,他们对 scRNA-seq 数据进行了无监督聚类分析,将所得细胞聚类分为九个不同的细胞谱系(图1B-E),他们观察到反应组和耐药组之间的细胞比例没有显著差异。于是,他们进行了多重免疫组织化学 (mIHC)分析,结果显示与耐药组相比,反应组内上皮细胞的比例显著增加;相反,耐药组的T细胞、巨噬细胞(MP)和成纤维细胞水平显著升高(图1F -G)。

图1. 胃癌化疗和免疫治疗反应的单细胞景观。
(A) 研究设计和工作流程概述。(B) 本研究中按主要细胞类型着色的单细胞 UMAP 图。(C) 根据患者样本绘制的单细胞 UMAP 图:该图显示了不同患者的单细胞分布情况,有助于识别细胞群中潜在的患者特异性变异。(D) 主要细胞类型的典型标记基因的点图:点图说明了每种主要细胞类型的特定标记基因的表达水平,有助于不同细胞群体的识别和表征。(E) 按组可视化的细胞比例:该可视化提供了每个实验组内不同细胞类型的相对丰度或比例的概述。(F-G) 按组划分的胃癌 mIHC 代表性图像。
02
信迪利单抗+ SOX 治疗的 GC 患者成纤维细胞中三种主要表达模式的鉴定
他们进行了聚类分析,更深入地研究了 GC 肿瘤内成纤维细胞的异质性,识别出成纤维细胞的三个主要亚群,并根据差异表达基因 (DEG) 进行标记(图 2 A-B)。然后他们评估了每组中这些亚聚类的细胞比例(图2C),虽然观察到的差异没有达到统计学意义,但仍然可以观察到反应组和耐药组之间基质和小凹细胞的明显变化(图2D-E)。为了进一步了解成纤维细胞的分子特征及其与治疗耐药性的关系,他们使用火山图检测了三个成纤维细胞亚群中反应和耐药组特有的 DEG(图 2 F)。他们发现BMP4(在成纤维细胞凋亡中的发挥关键作用)在基质细胞中表达升高,并与预后改善相关。此外,研究发现,在胃癌中,小凹细胞中SERPINE1的高表达与不利的生存结果相关(图2G)。值得一提的是,SERPINE1 已在多项研究中确定为强效致癌基因。
此外,他们观察到反应组的中心凹细胞和基质细胞表现出与补体系统、炎症反应和活性氧相关的基因的富集,表明化疗和免疫治疗都触发了免疫活性(图2H)。相反,在反应组的小凹细胞中,细胞凋亡、胆汁酸代谢和p53途径显示出显著的激活(图2H)。
这些结果强调了基质细胞(尤其是 BMP4 表达升高的基质细胞)作为改善生存结果指标的重要性。相反,在接受信迪利单抗+ SOX 治疗的患者中,表达增强的 SERPINE1 的小凹细胞可作为不良预后的潜在指标。
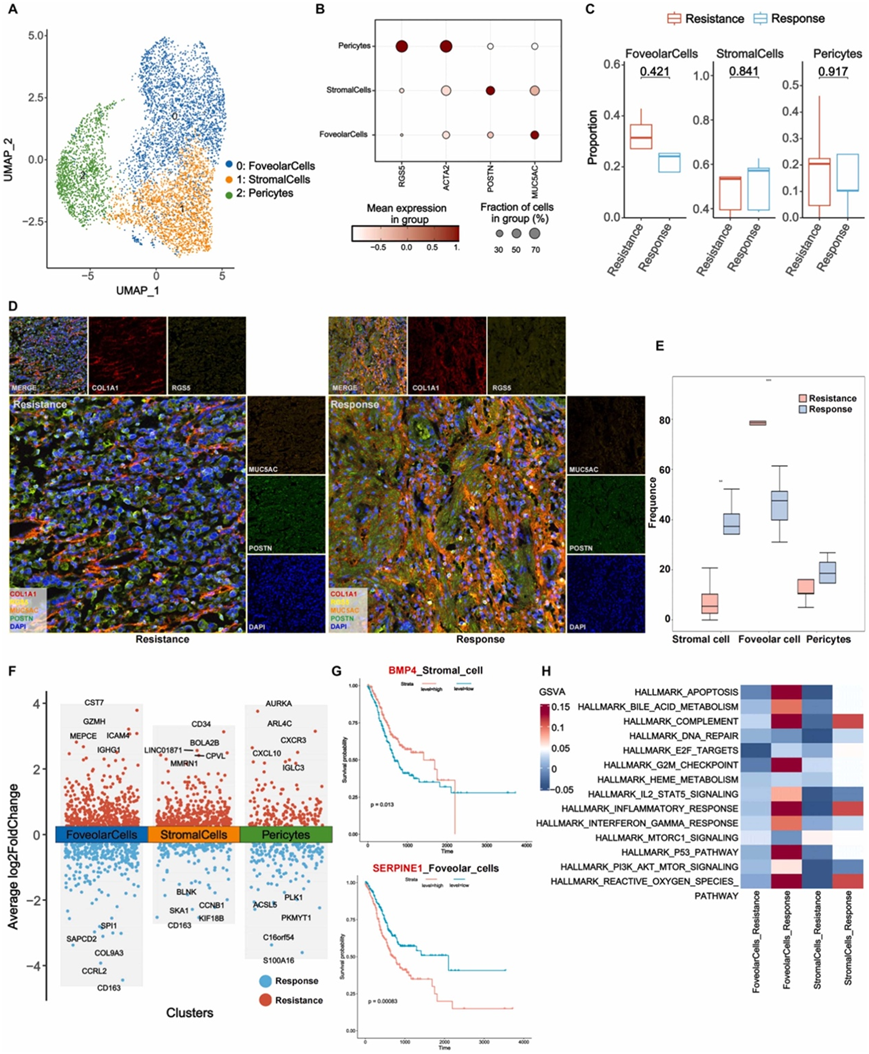
图2. 鉴定接受信迪利单抗加 SOX 治疗的 GC 患者成纤维细胞中的三种主要表达模式。
(A) 单细胞的 UMAP 图描绘了成纤维细胞中的三种主要表达模式:该图揭示了成纤维细胞基于其基因表达谱的聚类和分布。(B) 按聚类划分的成纤维细胞典型标记基因的点图:这些点图显示了每个聚类内成纤维细胞特有的典型标记基因的表达水平,有助于表征不同成纤维细胞亚群。(C) 按组可视化的细胞比例:该可视化提供了每个实验组内成纤维细胞的相对丰度或比例的概述。(D-E) 按组划分的胃癌 mIHC 的代表性图像。 (F) 按组显示三个聚类成纤维细胞差异表达基因(DEG)的火山图。(G) 生存分析。(H) 按组对基质细胞和小凹细胞中的 DEG 进行 GSVA 通路分析。
03
分析绘制接受信迪利单抗加 SOX 治疗的 GC 患者中 T 细胞的分布图
为了全面分析接受信迪利单抗加 SOX 治疗的 GC 患者的免疫状况,他们对 T 细胞进行了深入分析,旨在以更高分辨率揭示这些细胞群中的不同亚型。通过独立的重新聚类,他们成功地在整个患者队列的 T 细胞群中识别出 8 个亚群(图 3 A)。为了可视化每个聚类内变化最大的基因,他们生成了特征图(图 3 B)。他们观察到与应答组相比,耐药组中CD4+ Tcm细胞的比例有增加的趋势(图3C),这通过mIHC分析得到进一步验证,证实了两组之间T细胞亚群的明显分布(图3D-E)。
通过检测火山图中 CD4+ Tcm 细胞特异的DEG,发现反应组中 TFF1 显著上调(图 3 F)。TFF1 是一种肿瘤抑制基因,已知可阻碍肿瘤进展并诱导 GC 细胞凋亡。相反,与前期研究结果一致,观察到耐药组CD4+ Tcm细胞中与肿瘤转移和化疗耐药相关的致癌基因MBNL1表达水平升高(图 3 F)。他们还发现CD4+ Tcm细胞中SLC2A3表达水平升高与生存率降低之间存在显著相关性(图3G)。SLC2A3可以作为预测GC患者治疗抗性和不良预后的有价值的指标。
为了深入了解潜在的生物学功能和相关信号通路,他们使用标志通路集进行了 GSVA 通路富集分析。在反应组中,CD4+ Tcm 细胞表现出 DNA 修复、炎症和干扰素-γ反应的丰富,表明它们参与了信迪利单抗加 SOX 的治疗(图 3 H)。

图3. 绘制接受信迪利单抗加 SOX 治疗的 GC 患者中 T 细胞的分布图。
(A) 八个 T 细胞聚类的 UMAP 图。 (B) T 细胞典型标记基因的点图。(C) 按组可视化细胞比例:该可视化提供了每个实验组内 T 细胞的相对丰度或比例的概述。(D-E) 按组划分的胃癌mIHC的代表性图像。(F) 火山图按组显示 CD8+ Tem、Treg、NK T 细胞和 CD4⁺ Tcm 的 DEG 。(G) Kaplan-Meier 生存曲线。(H) 按组对 CD4⁺ Tcm 中的 DEG 进行 GSVA 通路分析。
04
分析巨噬细胞亚群在胃癌信迪利单抗+ SOX 治疗耐药中的作用
他们根据每个聚类内最独特的基因确定了六个不同的巨噬细胞 (MP) 亚聚类(图 4 A-B)。与耐药组相比,反应组中 CTSC 阳性巨噬细胞 (CTSC MP) 和常驻巨噬细胞的比例显著更高(图 4 C-E)。为了进一步探索这些亚聚类的分子特征,他们使用火山图分析了每个亚聚类特有的DEG(图4F)。CTSC MP 中 THOC2 表达升高与常驻 MP 中 FUCA1 表达升高之间存在显著相关性,与 GC 预后改善相关(图 4 G)。这表明这些基因可能在信迪利单抗加 SOX 治疗的反应中发挥至关重要的作用。
通过GSVA通路富集分析,他们发现缺氧、IL2 STAT5信号、炎症反应、干扰素-α和干扰素-γ通路内反应组的CTSC MP中DEG显著富集(图4H)。此外,在常驻 MP 的反应组中,他们观察到缺氧和干扰素-α 信号通路的明显激活模式(图 4 H)。此外,他们观察到常驻 MP 耐药组中免疫检查点的表达水平降低,特别是 CD86、CD40、HAVCR2、SIRPA 和 CD47(图 4 I)。
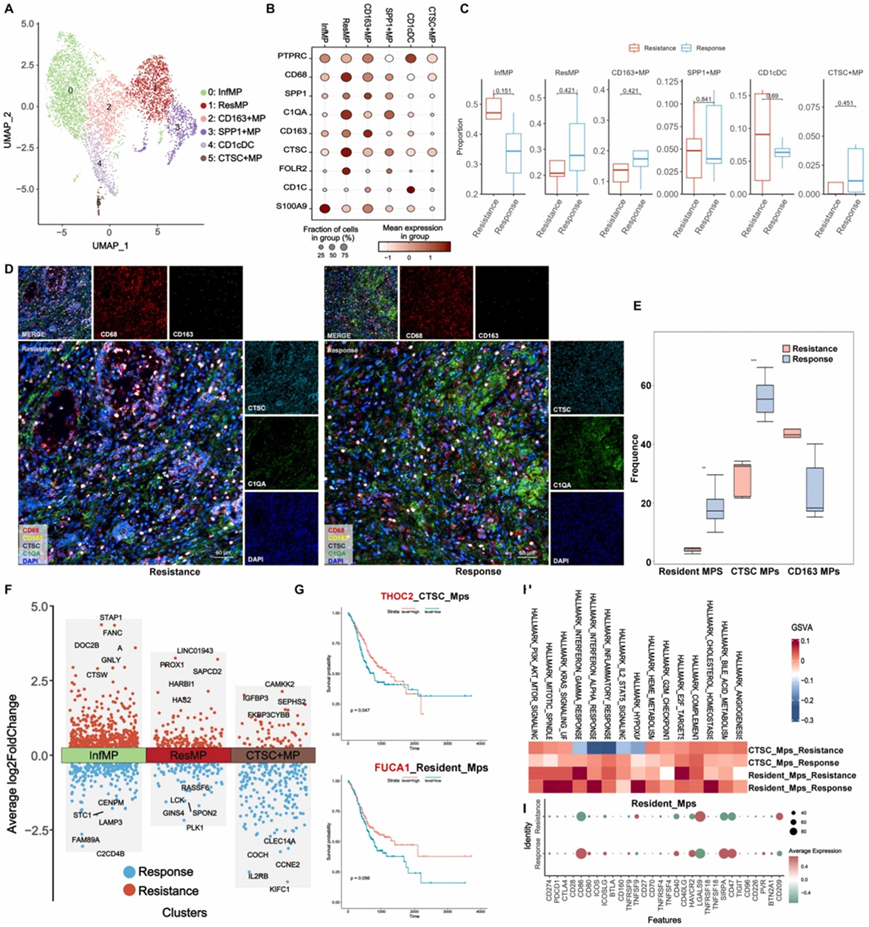
图4. GC 患者治疗后 MP 的分布情况。
(A) 六个 MP 聚类的 UMAP 图。(B) MP 典型标记基因的点图:这些点图说明了每个聚类内 MP 特有的典型标记基因的表达水平。(C) 按组可视化细胞比例:该可视化提供了每个实验组内 MP 的相对丰度或比例的概述。(D-E) 按组划分的胃癌 mIHC 代表性图像。(F) 火山图按组显示常驻 MP、炎症 MP 和 CTSC MP 的 DEG。 (G) Kaplan-Meier 生存曲线。(H) 按组对 CTSC MP 和常驻 MP 中的 DEG 进行 GSVA 通路分析。 (I) 按组划分的常驻 MP 中免疫检查点的表达水平。
05
探索上皮细胞群的多样性及其在胃癌信迪利单抗加 SOX 治疗耐药中的作用
他们深入研究了上皮细胞群,将它们分为四个不同的组:顶膜细胞、α细胞、干细胞和主细胞(图 5 A-B)。值得注意的是,观察到治疗后顶膜细胞的比例不断增加,这通过 mIHC 分析得到了进一步验证(图 5 C-E)。他们分析了反应组和耐药组之间的DEG(图5F),顶膜细胞中DUOX2的过度表达与治疗耐药性显著相关(图5F)。另一方面,GPX3 在癌症病例中经常因高甲基化而下调,表现出一种有趣的模式。 GPX3启动子的去甲基化导致GPX3表达,进而抑制癌细胞的增殖和迁移,表明顶膜细胞中 GPX3 的表达升高与对治疗的更有利反应相关(图 5 F)。
此外,他们观察到随着 LGALS9B 表达的升高,顶膜细胞的存活率显著提高(图 5G)。此外,他们观察到顶膜细胞耐药组中上皮间质转化(EMT)途径和脂质代谢的富集(图5H)。这些结果揭示了不同上皮细胞亚群对信迪利单抗加 SOX 治疗所发挥的不同作用。
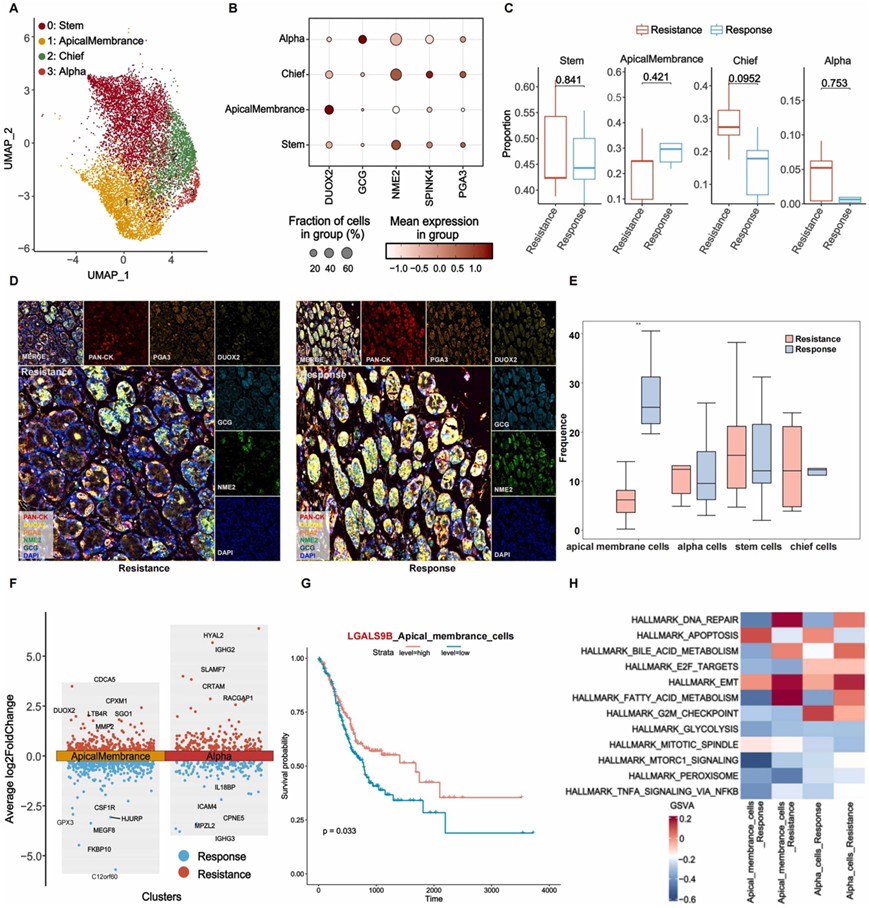
图5. 治疗后上皮细胞重新编程。
(A) 显示四种上皮细胞类型聚类的 UMAP 图。(B) 上皮细胞标记基因的点图:这些点图说明了每个聚类内上皮细胞特异性标记基因的表达水平。(C) 按组可视化细胞比例。(D-E) 按组划分的胃癌 mIHC 代表性图像。(F) 火山图按组显示顶膜细胞和α细胞的DEG。(G) Kaplan-Meier 曲线。(H) 按组对顶膜细胞中的DEG进行GSVA通路分析。
06
信迪利单抗加 SOX 治疗条件下顶膜细胞与常驻巨噬细胞之间的细胞相互作用
他们对顶膜细胞与氟尿嘧啶和奥沙利铂耐药性之间的关系进行了进一步分析,氟尿嘧啶和奥沙利铂是信迪利单抗加 SOX 治疗方案的两个关键组成部分(图 6 A),他们发现了顶膜细胞和常驻巨噬细胞之间的实质性相互作用(图 6 B)。配体-受体分析显示耐药组中TGFB1(转化生长因子β1)和HSPB1(热休克蛋白β-1)之间的相互作用,表明它们潜在的功能关联(图6C)。此外,他们发现反应组中 LTF(乳转铁蛋白)与 S100A14(S100 钙结合蛋白 A14)相互作用,表明该亚组中存在独特的相互作用模式(图 6 C)。
为了验证这些发现并可视化细胞相互作用,他们进行了 mIHC 分析。结果证实了耐药组中HSPB1阳性顶膜细胞和TGFB1阳性常驻巨噬细胞之间存在显著的相互作用(图6D)。
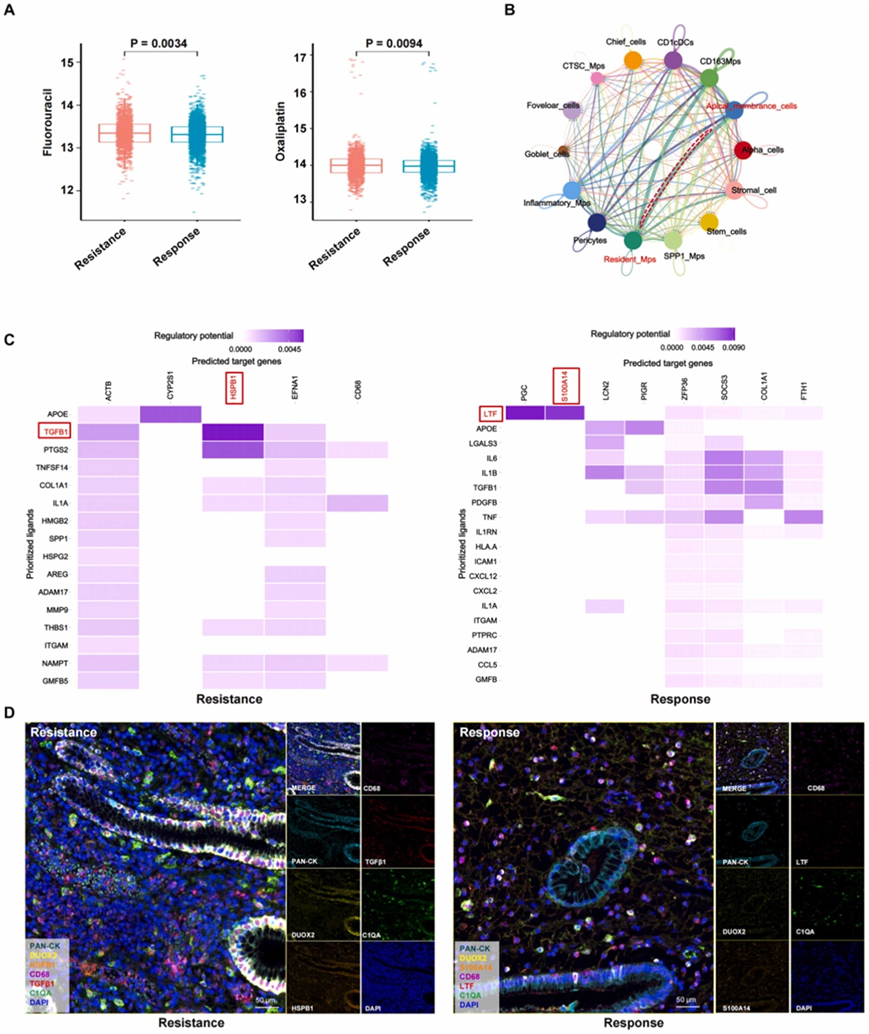
图6. 顶膜细胞和常驻 MP 之间的细胞通讯可预测对治疗的抗性。
(A) 按组划分的顶膜细胞对氟尿嘧啶和奥沙利铂的耐药性。(B) 细胞亚聚类之间的细胞相互作用强度。(C) 配体-受体分析显示了顶膜细胞和常驻 MP 之间潜在的相互作用。(D) 按组划分的细胞相互作用的 mIHC 代表性图像。
07
SMAD 通路和铁死亡是与治疗抗性相关的潜在信号通路
此外,为了找到影响信迪利单抗联合 SOX 反应的潜在信号通路,他们建立了源自接受信迪利单抗联合 SOX 治疗的胃癌患者来源的类器官(PDO)(图 7 A)。研究结果显示,生长速率存在显著差异,与响应组的类器官相比,耐药组的类器官生长速度显著加快(图 7 B)。SMAD 通路显著上调,伴随着铁死亡途径的显著抑制,导致在类器官中观察到对信迪利单抗与 SOX 组合的耐药性(图 7 C),靶向 SMAD 通路和铁死亡通路可能导致 GC 患者的治疗抗性。耐药组中HSPB1阳性顶膜细胞和TGFB1阳性常驻巨噬细胞之间存在显著的相互作用,而反应组中S100A14阳性顶膜细胞和LTF阳性常驻巨噬细胞之间存在明显的相互作用(图7D)。
此外,他们利用单向导RNA(sgRNA)破坏THP1细胞中的TGFB1和LTF基因建立敲除模型,同时引入重组蛋白LTF和TGFB1建立敲入模型。通过共培养巨噬细胞与胃癌细胞 (HGC-27),他们探讨了 TGFB1-HSPB1 和 LTF-S100A14 的相互作用,并仔细研究了 SMAD 通路和铁死亡的参与。结果表明,THP1细胞中TGFB1和LTF表达的调节除了影响胃癌细胞中的SMAD途径和铁死亡之外,还显著影响TGFB1-HSPB1和LTF-S100A14相互作用(图7E -F)。这些结果进一步证明了在信迪利单抗加 SOX 治疗的背景下,顶膜细胞和常驻巨噬细胞之间复杂的相互作用。
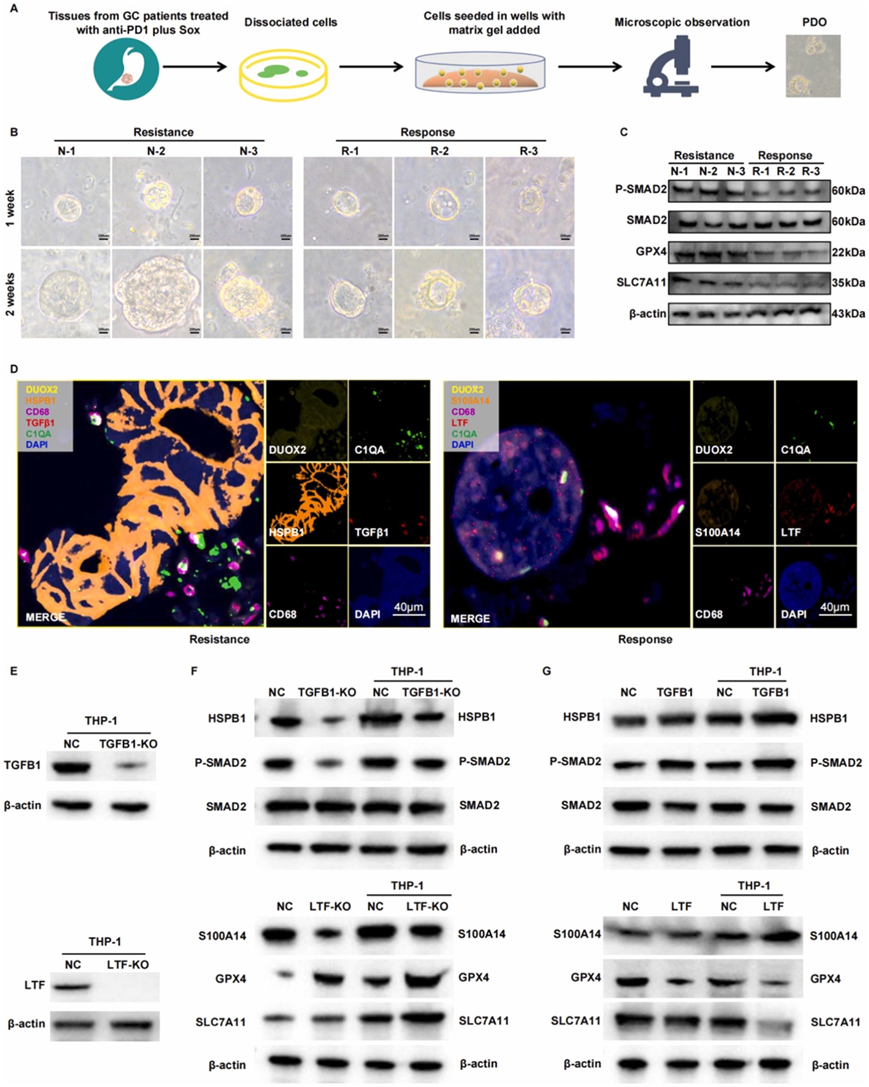
图7. 与治疗耐药性相关的潜在信号通路。
(A) 癌症患者类器官构建的流程图。(B) 来自抗性组和反应组的六个患者来源的类器官(PDO)的代表性图像。(C) 免疫印迹分析。(D) 按组划分的 PDO 中细胞相互作用的 mIHC 代表性图像。(E-G)免疫印迹分析。
08
利用 SVM 模型预测信迪利单抗加 SOX 疗法的反应
基于对顶膜细胞和常驻巨噬细胞之间细胞相互作用的发现,他们进一步开发了支持向量机 (SVM) 模型,其中包含六个关键标记(DUOX2、HSPB1、S100A14、C1QA、TGFB1 和 LTF)预测胃癌患者对信迪利单抗加 SOX 新辅助治疗的反应。最初,他们从 153 名诊断为胃癌的患者中获取了术前活检标本的石蜡切片,随后进行了 mIHC 分析(图 8A)。这些分析使他们能够可视化和量化组织样本中 DUOX2、HSPB1、S100A14、C1QA、TGFB1 和 LTF 的表达水平。
对于由 107 名胃癌患者组成的探索队列,他们他们构建了反应预测模型,并使用受试者工作特征 (ROC) 曲线评估其性能。值得注意的是,他们的模型表现出了卓越的预测能力,曲线下面积 (AUC) 值达到了 0.93(图 8 B)。这种高 AUC 值表明该模型能够准确区分治疗的反应者和耐药患者。此外,为了验证 SVM 模型的有效性,他们将其应用于独立的验证队列。在该队列中,招募了 46 名胃病患者,SVM 模型表现出非常良好的性能,达到了 0.84 的显著AUC 值(图 8 C)。这些结果验证了六标记 SVM 模型在预测胃癌患者对信迪利单抗联合 SOX 治疗的反应方面的稳健性和可靠性。
通过多组学分析,揭示了顶膜细胞和常驻巨噬细胞之间的显著相互作用。值得注意的是,TGFB1-HSPB1和LTF-S100A14相互作用显著激活SMAD途径或增强铁死亡途径,成为与治疗抗性相关的潜在信号传导途径(图8D)。
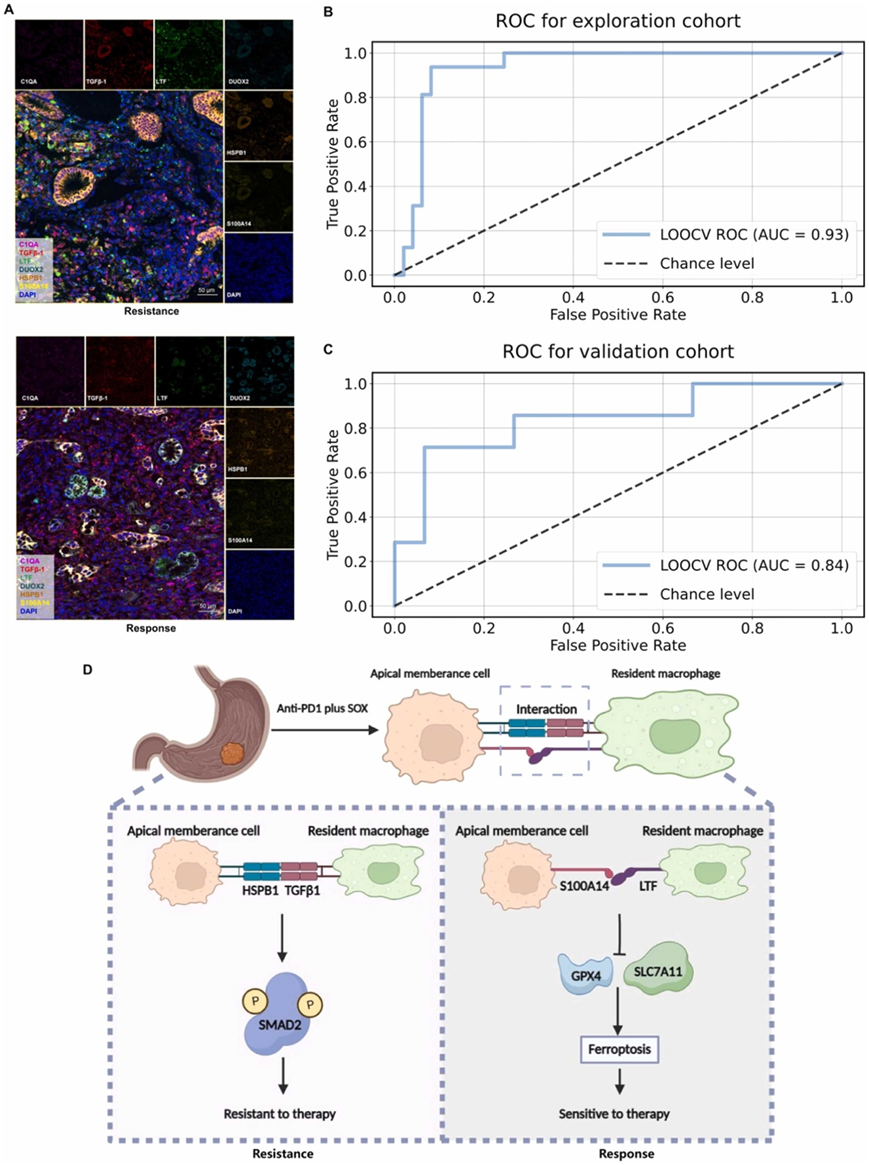
图8. 预测治疗反应的SVM模型。
(A) DUOX2、HSPB1、S100A14、C1QA、TGFB1 和 LTF 的 mIHC 染色代表性图像。(B-C) 勘探验证预测模型用ROC曲线表示。 (D) 胃癌患者对信迪利单抗(Sintilimab)联合SOX治疗的耐药或反应机制示意图。
+ + + + + + + + + + +
结 论
本项研究将顶膜细胞与氟尿嘧啶和奥沙利铂(治疗的关键成分)的耐药性联系起来。对这个细胞群的进一步研究揭示了与常驻巨噬细胞的实质性相互作用,强调了细胞间通讯在形成治疗抗性中的作用。随后的配体-受体分析揭示了特定的分子相互作用,本项研究的 SVM 模型结合了这些多组学和空间数据,表现出极好的预测能力,在探索和验证队列中 AUC 值分别为 0.93 和 0.84。这项研究强调了多组学和空间数据在治疗反应建模中的效用。
+ + + + +



 English
English


