文献解读|Cancer Cell(38.585):肠道微生物群介导的核苷酸合成减弱了直肠癌对新辅助放化疗的反应
✦ +
+
论文ID
原名:Gut microbiota-mediated nucleotide synthesis attenuates the response to neoadjuvant chemoradiotherapy in rectal cancer
译名:肠道微生物群介导的核苷酸合成减弱了直肠癌对新辅助放化疗的反应
期刊:Cancer Cell
影响因子:38.585
发表时间:2022.12.22
DOI号:10.1016/j.ccell.2022.11.013
背 景
术前新辅助放化疗 (nCRT) 是治疗局部晚期直肠癌 (LARC) 公认的标准治疗方法,然而,接受 nCRT 的患者中只有极少部分(15%–27%)能达到病理学完全缓解,而其中20%–40%的几乎没有反应。因此,迫切需要努力破译 LARC 对 nCRT 反应的潜在机制。放化疗结合放疗和化学药物,通过破坏 DNA 来根除或控制癌细胞的增殖。双链断裂是放化疗在细胞杀伤过程中引起的最致命的 DNA 损伤,癌细胞对放化疗的敏感性在很大程度上取决于它们对双链断裂和修复 DNA 损伤的反应能力。DNA 修复会受到微环境中各种代谢因素的影响,这促使人们努力发现与放化疗反应相关的可靶向外在介质。越来越多的证据表明,肠道微生物群通过炎症和免疫反应以多种方式与结直肠癌的发生和发展密切相关,其组成也会影响肿瘤对癌症治疗的敏感性。但是,目前关于肠道微生物群改变对放化疗疗效的功能影响知之甚少,微生物改变治疗效果的精确分子机制仍然难以捉摸。
实验设计

结 果
01

LARC患者的临床特征及放化疗对其粪便微生物群落的影响
研究者团队收集了126 名接受 nCRT 的LARC 患者来源的335份粪便并通过 16S rRNA测序(n = 353)和宏转录组学(n = 91)评估和分析肠道细菌特征的动态变化(图1A)。粪便微生物多样性在放化疗后显著降低(图1B-G),突出了放化疗对肠道微生物群的影响,并暗示该治疗可能会使 LARC 患者的肠道微生物群变得单一和更加同质化。
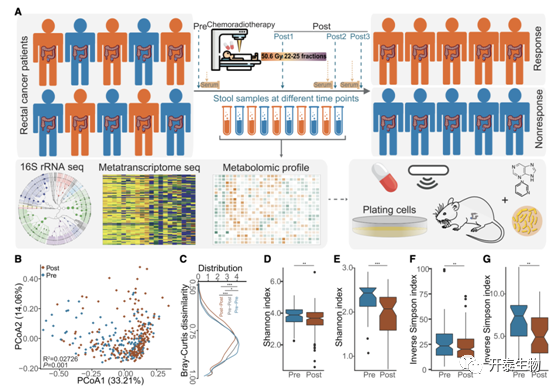
图1. nCRT 后粪便微生物群落的变化
(A) 本研究的实验设计。(B) 主坐标分析(PCoA)。(C) nCRT 前后 LARC 患者粪便样本之间扩增子序列变体(ASV)水平的 Bray-Curtis 相异距离分布。(D) Shannon指数(Pre组 n = 125,Post组 n = 228)(E)宏转录组的属组成 (Pre组n = 34,Post组n = 57)。(F) 逆辛普森指数(Pre组 n = 125 个粪便样本,Post组 n = 228 个粪便样本)(G) 宏转录组的属组成(Pre组n = 34,Post组n = 57)。
研究者团队进一步评估了门水平组间的细菌丰度,观察到每组样本的肠道微生物群在放化疗后存在相当大的差异(图2A),还观察到整个处理过程中不同时间点微生物组成和多样性的波动(图2B-C)。在门水平上,与 nCRT 后样本相比,拟杆菌门在 nCRT 前样本中富集,而厚壁菌门在 nCRT 后样本中富集(图2D)。在属水平上,总共观察到 36 个属在两组之间存在显著差异,其中多种公认的结直肠癌相关细菌,包括Alistipes, Bacteroides和Parabacteroides,在nCRT Pre组中显著富集,而Actinomyces, Coprococcus和Dorea,这三个属在结直肠癌腺瘤中过度表达,在nCRT Post组中显著富集(图2E -F)。有趣的是,nCRT Pre和Post组的大部分相关性均为正相关,表明在微生态系统中合作而非竞争占主导地位(图 2G)。基于NetShift分析,将与丁酸盐产生相关的属,包括Peptoniphilus、Blautia、Ruminococcus和Turicibacter,作为放化疗后直肠癌患者菌群中的潜在驱动类群(图2H)。丁酸盐是正常结肠菌的重要能量来源,可以通过调节基因表达、炎症、分化和细胞凋亡来影响肠道健康,产生丁酸盐的细菌具有抗肿瘤活性。确定的由产生丁酸盐的微生物驱动的有益网络增强了对直肠癌化疗治疗的理解。
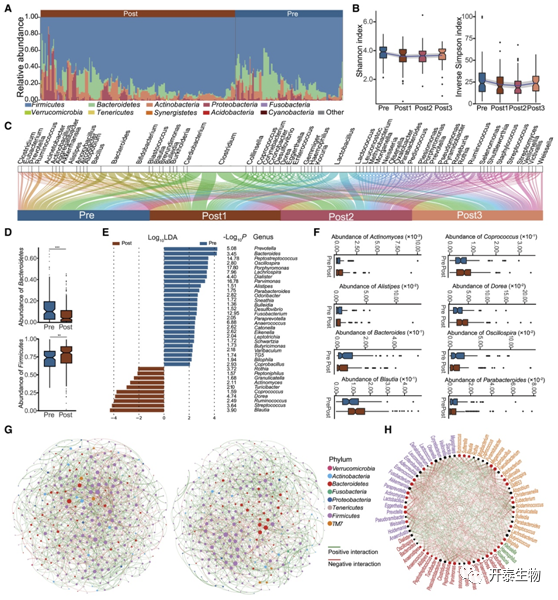
图2. 深度探究放化疗后 LARC 患者粪便微生物群的改变
(A) 根据 ASV 注释的物种,粪便微生物在治疗前 (Pre) 和治疗后 (Post) 癌症样本中门级的相对丰度。显示了每组中 10 个最丰富的门。(B 和 C) Shannon指数和逆辛普森指数的动态变化。(D)与直肠癌患者粪便微生物的放化疗有关的两个显著改变的菌门:拟杆菌门和厚壁菌门。(E) 在治疗后组(棕色)或治疗前组(蓝色)中,显著富集的属。(F)如 (E) 所示,两组不同菌属之间的相对丰度比较。(G) 基于治疗前(左)和治疗后(右)组的粪便样本构建的微生物组共现网络。节点代表 ASV,并根据它们的门进行着色,节点大小代表与其他节点的连接数。绿色和红色的边分别代表正负微生物相关性。(H) 基于对后来与放化疗相关的初始微生物组的细菌网络分析的潜在驱动属。节点大小与其缩放的相邻偏移分数成正比,红色节点表示在放化疗后它们的介数增加。大红色节点表示放疗背后特别重要的驱动分类群。线条颜色表示治疗后(红色边缘)和治疗前(绿色边缘)中存在的连接。
02

比较放化疗后有反应和无反应的 LARC 患者的不同粪便微生物群
为了进一步确定粪便微生物群变化与放化疗反应之间的关联,研究者团队根据 NCCN TRG 和客观反应将患者分为反应者和非反应者(图 3A-B)。然后对两组之间的宏转录组数据进行分析,鉴定出 7 种和 11 种细菌物种分别与对放化疗的反应和无反应相关(表1)。在与放化疗反应相关的物种中,早已证明B.coprophilus是与供体粪便微生物群移植后溃疡性结肠炎的疾病改善密切相关,而在放化疗后无反应组中B.vulgatus最多(Figures 3C and 3D)。考虑到有反应组和无反应组样本之间不同的微生物组组成,研究者团队随后在群落层面比较了这两组细菌物种之间的共丰度关联,与无反应组的稀疏相关网络相比(图4),反应组观察到更强的相关网络(图4A),且在有反应组中观察到几种有益菌群 (Rothia mucilaginosa, V. parvula, W. confusa, Streptococcus thermophilus) (图4A) 可能有助于直肠癌患者放化疗后的健康。拟杆菌属中的几个物种显示出很强的相关性,并在无反应组的生态网络中占据中心位置(图4B),表明它们在网络中的关键作用。在NetShift分析中,除了B.vulgatus外,拟杆菌属(Bacteroides genus)物种包括粪拟杆菌(Bacteroides faecis)、卵形拟杆菌(Bacteroides ovatus)和马氏拟杆菌(Bacteroides massiliensis)是对放化疗无反应的直肠癌患者微生物群中的潜在的主要物种(图3E),LARC患者粪便样本中B. ovatus, B. massiliensis, 或 B. faecis的丰度与B. vulgatus呈正相关(图3F)。这些拟杆菌在无反应LARC患者体内的富集促使研究者团队探讨它们在这些患者耐nCRT中的潜在作用。

图3. 粪便微生物群与 LARC 患者对放化疗的反应相关
(A-B) 来自 34 名无反应患者和 82 名有反应患者的放射图像 (A) 以及苏木素和伊红病理染色图像 (B)(比例尺,50 μm)。红色箭头代表病变部位。(C) 放化疗后有反应组和无反应组的物种显著富集。(D)比较放化疗前后反应组和无反应组间B. vulgatus的相对丰度。(E) 基于初始微生物组细菌网络的潜在驱动物种,后来与对放化疗无反应相关。节点大小与其缩放的邻居偏移分数成正比,红色节点表示它们的介数从响应到无响应的增加。大红色节点表示与对放化疗无反应相关的特别重要的驱动分类群。线条颜色表示无响应组(红色边缘)和响应组(绿色边缘)中存在的连接。(F) 相对丰度之间的皮尔逊相关性。
表1. 放化疗后反应组和无反应组粪便样本的菌群
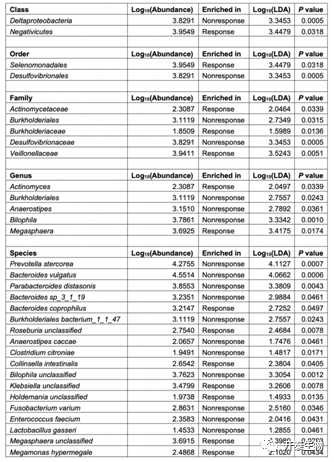
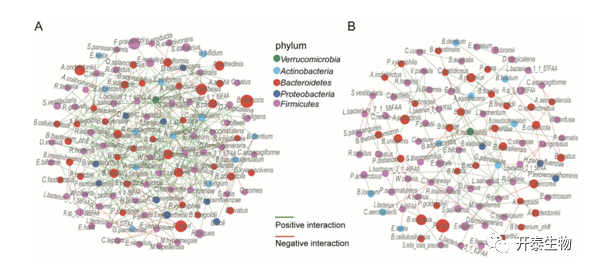
图4. 基于有反应组(A)和无反应组(B)的粪便样本构建的微生物群共现网络
03

代谢组学与宏转录组学的联合分析
为了深入了解微生物群落变化可能产生的功能后果,研究者团队审视了从粪便宏转录组学分析推断的功能模块,并注释了 20 个 MetaCycle 模块,这些模块在放化疗后反应组和无反应组之间存在差异,且观察到在放化疗后无反应组中富集了与核苷酸生物合成相关的几个模块(图5 A)。在与核苷酸生物合成相关的基因中,他们发现九个与嘌呤合成相关的基因,包括purF(它编码嘌呤从头生物合成中的限速酶)和五个与嘧啶核苷酸合成相关的基因在放化疗后无反应组中升高(图 5B-C),而在放化疗前它们在无反应组中并不占优势。同时,放化疗后两组之间差异丰富的代谢物的功能富集揭示了与核苷酸生物合成相关的几种途径,包括嘌呤和嘧啶核苷酸的补救途径以及嘧啶脱氧核糖核苷酸在哺乳动物中的补救途径(图5D)。在放化疗后无反应组中观察到与核苷酸生物合成相关的底物丰度升高,包括次黄嘌呤、尿苷、鸟苷、腺苷和胸苷(图5E)。
为了探索导致粪便代谢物差异的微生物物种,研究者团队使用基于代谢模型的代谢物观察和物种丰度整合,并预测与核苷酸生物合成相关的几种代谢物(例如鸟苷和肌苷)是由拟杆菌属物种调节的(包括B.ovatus、 B. thetaiotaomicron、 B. vulgatus、 和Bacteroides xylanisolvens)(图5F)。HUMAnN分析进一步表明B.vulgatus在核苷酸从头生物合成途径中起主导作用(图5G)。对细菌培养上清液的分析揭示了B. vulgatus可以产生与核苷酸生物合成相关的高丰度代谢物(图5E)。
这些数据共同揭示了B. vulgatus来源的核苷酸生物合成对宿主患者放化疗反应的潜在作用。
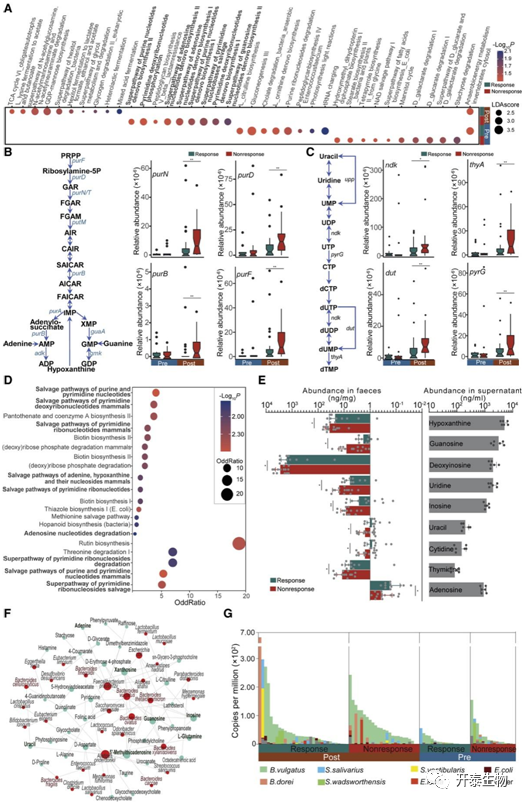
图5. 与直肠癌 nCRT 反应相关的核苷酸合成途径
(A–C) 放化疗前后反应组和无反应组微生物转录组改变的功能富集。简化的细菌嘌呤 (B) 和嘧啶 (C) 生物合成途径以及已鉴定的反应相关基因。(D) 基于放化疗后反应组和无反应组之间粪便样本投射分数的可变重要性,不同丰度代谢物的富集途径。(E) 放化疗后反应组 (n = 11) 和无反应组 (n = 14) 之间粪便样本中差异代谢物的绝对丰度。(F) 代表粪便微生物类群(红色节点)对特定代谢物(绿色节点)的显著作用的网络,该网络通过基于代谢模型的代谢物观察和物种丰度(MIMOSA)整合预测。节点大小根据其连接程度进行缩放。(G)通过HUMAnN分析,不同细菌种类对腺苷核苷酸从头生物合成途径I的贡献。
04

核苷补充剂或B. vulgatus 保护肿瘤免受5-氟尿嘧啶和电离辐射治疗
研究者团队首先进行体外细胞实验,发现外源性补充混合核苷可保护癌细胞5-氟尿嘧啶(5-FU)和电离辐射处理后的存活率(图6A-G),还促进了癌细胞受损 DNA 的修复,导致 γH2AX 的丰度降低(6H)。之后,他们又通过在小鼠异种移植瘤模型中进一步证实,外源性补充核苷混合物可保护结直肠癌细胞免受放射治疗(图7A-D)。接下来,他们又发现,B. vulgatus这个在放化疗后无反应组中核苷酸生物合成中占主导地位的富集最高的物种,具有一定的肿瘤保护作用,因为B. vulgatus 灌胃(BV)处理后可减弱5-FU对肿瘤的抑制作用(图7E-H)。
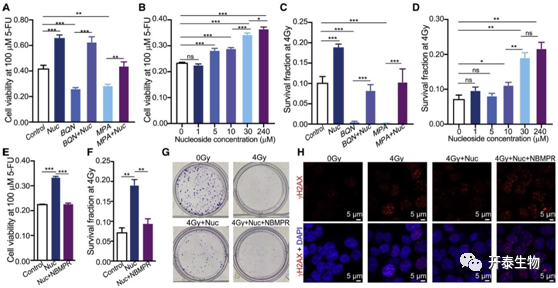
图6. 核苷补充保护癌细胞免受 5-FU 或辐射的治疗
(A–F) 用 100 μM 5-FU (A)/4-Gy 辐射 (C)、混合核苷 (Nuc) 和嘧啶生物合成抑制剂 BQN 或嘌呤生物合成抑制剂 MPA 处理的 HCT116 结直肠癌细胞的活力或存活分数。在 5-FU (B) 或 4-Gy 辐射 (D) 处理下,混合核苷 (Nuc) 的梯度浓度对 HCT116 细胞存活率或存活率(辐射后第 8 天)的影响。胸苷的浓度是其他核苷的三分之一。用 100 μM 5-FU (E) 或 4-Gy 辐射 (F)、30 μM 混合核苷 (Nuc) 和核苷转运蛋白抑制剂 NBMPR 处理的 HCT116 癌细胞的活力或存活分数。
(G) HCT116 细胞集落形成测定的图像。(H) 在 4-Gy 辐射后 24 小时进行指定处理的 HCT116 细胞中 γH2AX 染色的图像。
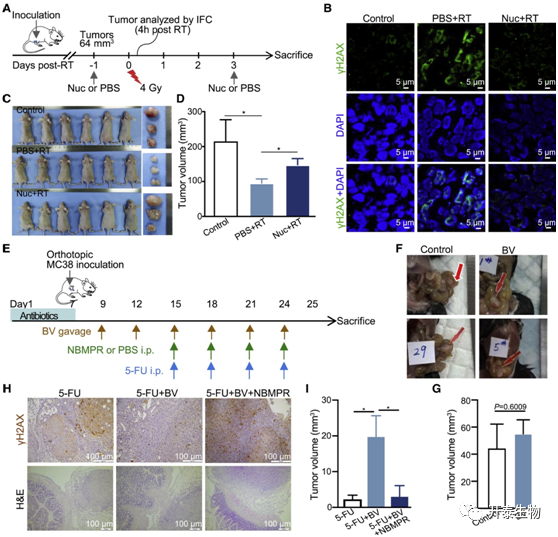
图7. 核苷补充剂或 BV 保护侧腹异种移植物或原位肿瘤免受辐射或 5-FU 治疗
(A)移植瘤小鼠模型的示意图设计。(B)免疫荧光。(C-D) 放疗后第 5 天指定治疗组之间肿瘤体积的比较。(E–G) MC38 原位小鼠模型和化疗时间表的示意性时间线。NBMPR,一种核苷转运蛋白抑制剂。(H) 指定治疗组的 γH2AX 免疫组织化学显示在上。来自原位小鼠的肿瘤和相邻小肠的苏木精和伊红 (H&E) 形态图像显示在下。(I) 计算指定治疗组的原位肿瘤体积。
05

DNA 修复和核苷水平与直肠癌患者对放疗的反应相关
研究者团队进行了基因集富集分析观察到参与 DNA 修复的基因在无反应肿瘤中的表达增加(图7A-B),和与含核碱基化合物转运相关的基因富集(图7C),强调放射治疗期间核苷酸补救的重要性。在放化疗后无反应的直肠癌患者血浆(图7D)和肿瘤组织(7E)中观察到与核苷酸生物合成相关的代谢物水平升高。这些数据表明,已鉴定的核苷转运蛋白和代谢物在治疗后癌细胞的存活中或在从头核苷生物合成中活性有限或低效的情况下具有有益作用。血清中的尿酸是外源性池和内源性嘌呤代谢的代谢产物,在放化疗后无反应(TRG2 和 TRG3)直肠癌患者中观察到血清尿酸水平升高且与不良预后有关(图7F-H),这提示尿酸水平可用于评估放化疗后直肠癌患者预后。
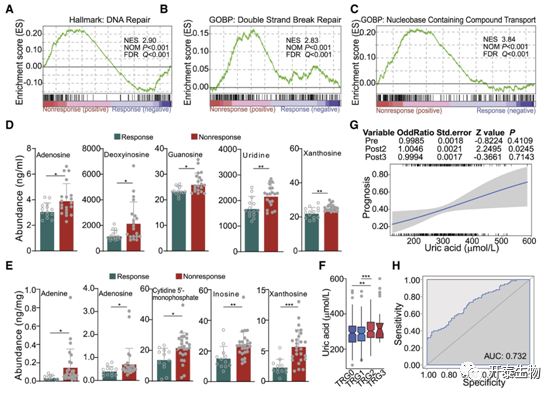
图8. DNA 修复和核苷水平与直肠癌患者对放疗的反应相关
(A–C) 基于转录组的基因集富集分析 (GSEA) 对直肠癌患者放疗相关的敏感和耐药肿瘤组织进行分析。(D-E) 血浆中与核苷酸生物合成相关的代谢物水平增加。(F) 有反应(TRG0 和 TRG1)和无反应(TRG2 和 TRG3)直肠癌患者放化疗后 (Post2) 的尿酸水平。(G) 551例直肠癌患者预后与三个不同时间点尿酸丰度之间的二元逻辑回归分析。(H) 基于广义线性模型预测独立数据集的 184 名直肠癌患者对放化疗反应的尿酸水平表现。
+ + + + + + + + + + +
结 论
研究者团队对 353 份患者来源的粪便样本进行了 16S rRNA 测序,发现 nCRT 后微生物多样性降低。多组学数据整合表明,普通拟杆菌介导的核苷酸生物合成与 LARC 患者的 nCRT 耐药相关,而无反应肿瘤的特征是与 DNA 修复和核苷转运相关的基因上调。核苷补充剂或B. vulgatus 灌胃能保护癌细胞免受 5-氟尿嘧啶或辐射治疗。对来自 735 名患者的 2,205 份血清样本的分析表明,尿酸是 nCRT 治疗的 LARC 患者的潜在预后标志物。他们的数据揭示了肠道微生物群介导的核苷酸生物合成在直肠肿瘤对 nCRT 的反应中的作用,并强调了在癌症治疗过程中癌细胞与肠道微生物之间相互作用的重要性。
+ + + + +



 English
English

