文献解读|Sci Adv(13.6):运动可减轻血流再循环并激活代谢传感器 催化血管保护性代谢物
✦ +
+
论文ID
原名:Exercise mitigates flow recirculation and activates metabolic transducer SCD1 to catalyze vascular protective metabolites
译名:运动可减轻血流再循环并激活代谢传感器 SCD1 催化血管保护性代谢物
期刊:Science Advances
影响因子:13.6
发表时间:2024.02.16
DOI号:10.1126/sciadv.adj7481
背 景
运动促进动脉循环中的脉动剪切应力并改善心脏代谢疾病。然而,运动介导的血管保护代谢传感器的研究仍然不足。
实验设计
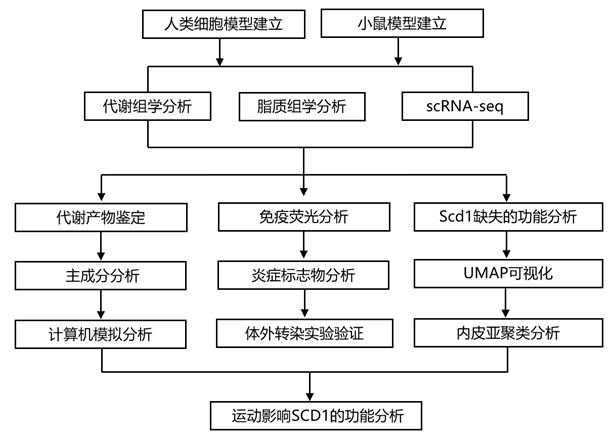
结 果
01
PSS激活内皮SCD1催化脂质代谢产物
为了响应周期性心脏收缩,动脉循环中的血流呈脉动,并且脉动剪切应力(PSS)是单向的并且与流动方向轴向一致。研究团队将人主动脉内皮细胞(HAEC)暴露于一个动态的血流系统中,该血流系统概括了动脉分叉或分支点的空间变化(图1A)。非靶向代谢组学分析表明,PSS使硬脂酰辅酶 A(辅酶 A)去饱和酶 1 (Scd1)催化的代谢物油酸(OA)增加了2倍,使振荡剪切应力 (OSS)增加了1.3倍(图1B-C)。饱和 FA (SFA) 前体棕榈酸和硬脂酸不受 PSS 或 OSS 的影响。代谢物热图和主成分分析 (PCA) 均显示 PSS 和 OSS 介导的代谢物与基础水平分离(图 1D-E)。
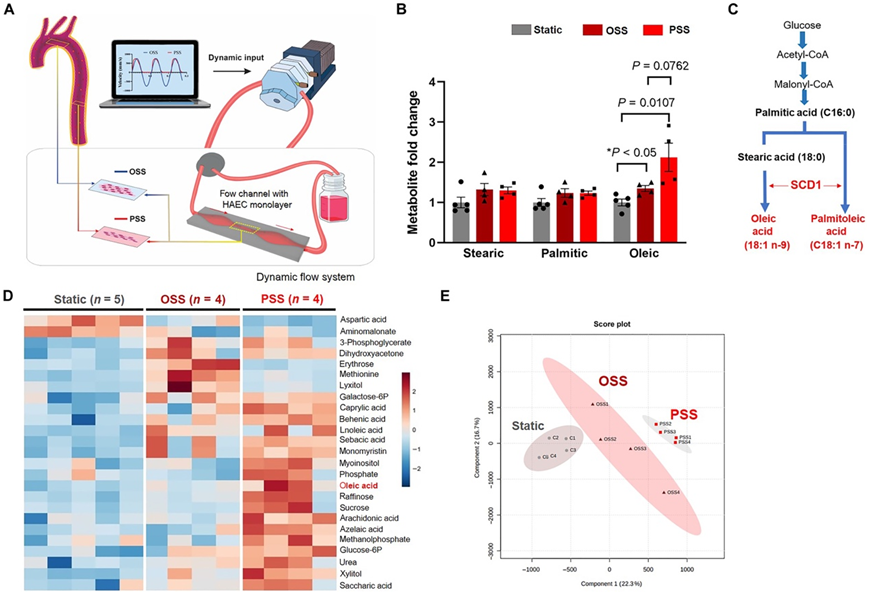
图1. PSS 调节内皮代谢组并增加 SCD1 催化的代谢物。
(A) 使用定制的动态流动系统来模拟动脉系统中剪切应力的空间和时间变化。(B)在静态条件、OSS或PSS下从HAEC裂解物中收集代谢物样本,用于非靶向代谢分析。(C) MUFA的生物合成描述了SCD1催化SFA(棕榈酸和硬脂酸)转化为MUFA(棕榈油酸和油酸)的限速步骤。(D)热图显示糖酵解物和脂肪酸代谢物均增加。(E)主成分分析(PCA)的评分图显示了代表性内皮代谢物的分离。
02
模拟运动介导的剪切应力以减轻主动脉弓小曲的血流再循环
为了证明运动介导的剪切应力的计算机分析,他们对小鼠主动脉弓进行了超声检测(图2A)。心电图(ECG)门控脉冲波(PW)多普勒可以表征随时间变化的入口流速(图2C),并根据运动条件进行校准。B型超声描绘了主动脉弓,三元Windkessel模型分别模拟了头臂动脉、左颈总动脉、左锁骨下动脉和降主动脉的出口边界条件(图2B)。通过四维(4D)(空间+时间)计算流体动力学(CFD)模拟完成了计算机分析,以概括整个心脏周期的速度彩色流线(图2E)、大曲率附近峰值速度剖面的大小以及主动脉弓小曲率处的时间平均壁剪切应力(TAWSS或τave)。CFD模型显示TAWSS较低,并且在较小的曲率处(虚线方框)有再循环(图2E-F)。为了计算运动介导的 PSS 与 OSS,他们结合了心率 (HR)和血流量的变化。计算机分析表明,运动增强的 PSS 增加了小曲率和大曲率的 TAWSS,并减轻了小曲率的血流再循环,同时振荡剪切指数(OSI ave)略有降低(图 2G)。因此,计算机分析证明运动调节 TAWSS 和 OSI ave,以减轻主动脉弓易受血流干扰的小曲率中的血流再循环。
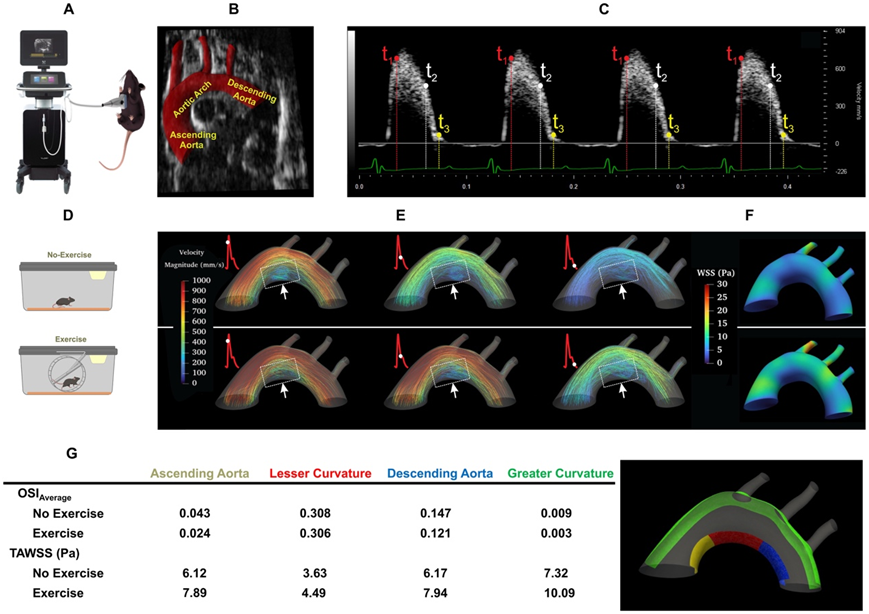
图2. 运动增强 PSS 的计算机分析。
(A)获取麻醉小鼠b型和PW型多普勒图像的超声系统示意图。(B)小鼠主动脉弓及三支、降主动脉的代表性B模图像及分割图。(C)在四个心电图门控心动周期内,从小鼠升主动脉获得PW多普勒测量。(D)小鼠在静态状态和自愿跑轮的示意图。(E)沿主动脉弓的速度色流线表明在小曲度处出现了紊乱的血流,而运动增强的剪切应力减轻了易发生紊乱血流的小曲度处的血流再循环。(F)计算几个心动周期的时间平均壁面剪切应力(TAWSS),并比较不运动和自主轮跑之间的差异。(G)在小弯度(升主动脉、主动脉弓和降主动脉)和大弯度之间比较OSIave(表面平均值)和TAWSS。
03
运动增强的 PSS 激活内皮 SCD1 催化脂质代谢产物
为了证明运动介导的代谢物,他们在 24 小时自愿轮跑之前和之后立即对雄性野生型 C57BL/6J 小鼠进行了非靶向代谢组学分析(图 3A-B)。运动后血浆OA显著升高,PA呈现升高趋势(图3C-E)。饱和棕榈酸和硬脂酸没有变化(图3D)。 PCA 证明了运动前后脂质代谢物的明显分离(图 3F)。
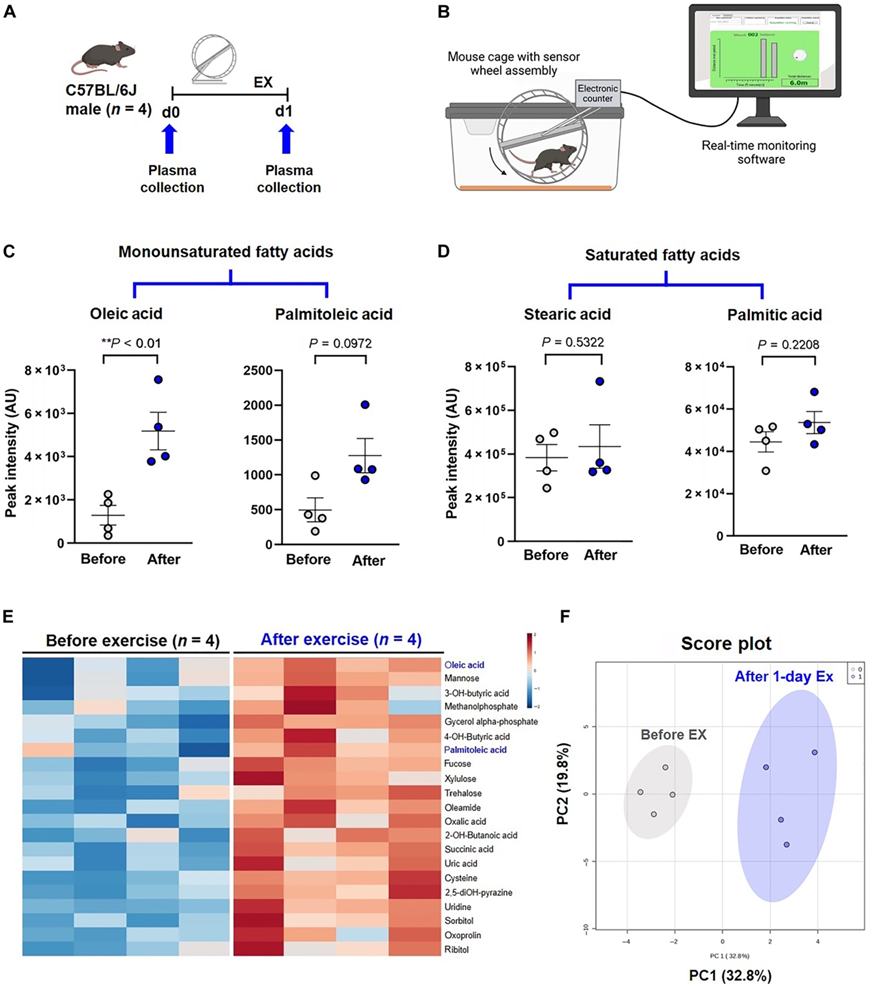
图3. 运动改变脂质代谢物的催化作用。
(A) 动物运动 (EX) 方案的示意图。(B) 自愿轮跑系统提供啮齿动物跑步活动的实时监控。(C)二十四小时运动增加OA和PA。(D) 运动不会改变 SFA 硬脂酸和棕榈酸的血浆水平。(E) 运动前后血浆代谢物的热图。(F) PCA 得分图。
自愿轮跑2周后,自主转轮运行2周后,主动脉内皮的表面免疫疗法显示Scd1在主动脉弓下曲和降主动脉中的表达增加(图4B-D)。Scd1 染色在亚细胞核周区域突出,与报道的 ER 区域一致,而内皮特异性缺失 Scd1 (Scd1EC−/−) 小鼠中不存在 Scd1 染色。使用Scd1特异性探针的原位杂交(RNAscope)证实了野生型小鼠运动后主动脉弓和降主动脉内皮Scd1表达增加(图4E)。总之,运动增强的 PSS 与激活内皮 Scd1 表达有关。
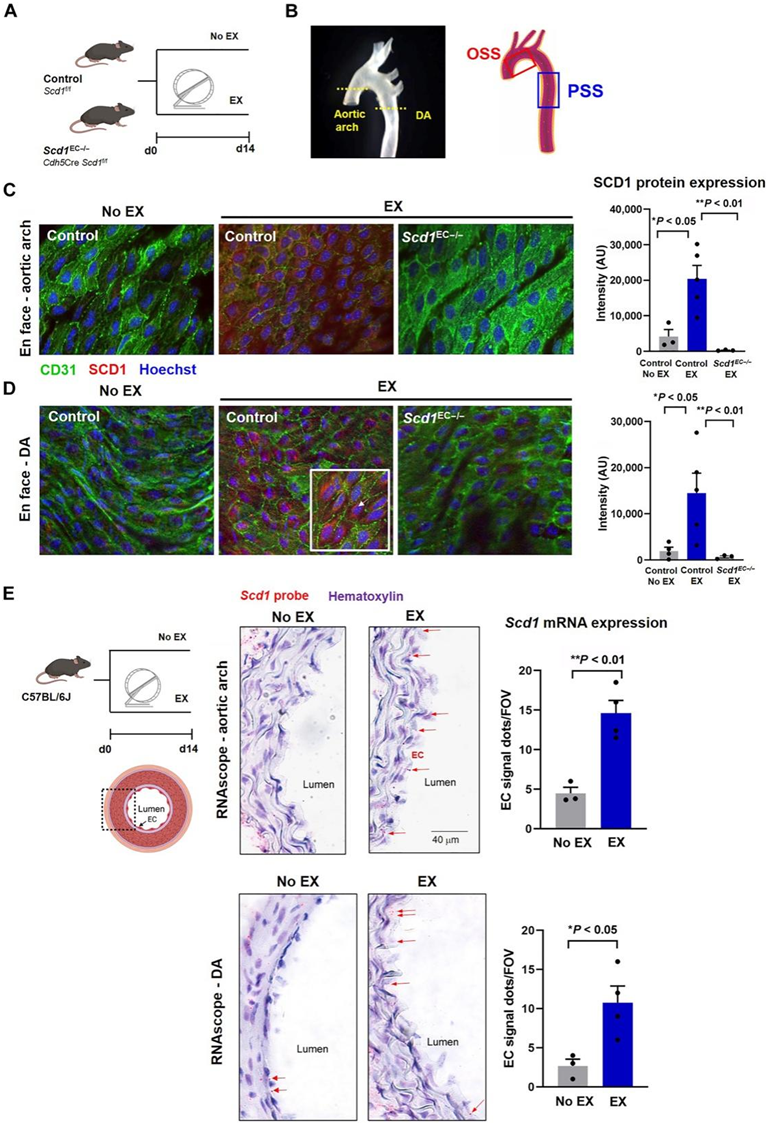
图4. 运动激活内皮 Scd1。
(A) 内皮特异性Scd1缺失小鼠接受了 14 天的自愿轮跑方案。 (B) Enface 免疫荧光通过共聚焦显微镜在主动脉弓与降主动脉 (DA) 水平成像。(C-D)免疫荧光染色分析。(E) 野生型 C57/BL6J 小鼠接受 14 天的自愿轮跑方案。
04
SCD1产物OA赋予内皮炎症反应
为了证明 SCD1 介导的代谢物对血管内皮保护的作用,他们评估了致动脉粥样硬化的炎症标志物。OA处理减少了HAEC中脂多糖(LPS)诱导的Vcam1、Icam1、Mcp1、Esel(E-选择素)和Cxcl8趋化因子mRNA表达(图5A)。OA 还降低了 ER 应激相关转录因子,即Atf3、Atf4和Atf6 mRNA 表达。
接下来,他们通过基于重组腺病毒的系统过表达内皮 Scd1,以证明Cxcl8及其受体Cxcr1和嗅觉受体 2 (Or6a2) mRNA 表达减少(图 5B)。脂质组学分析表明,Scd1过表达后,细胞内部和条件培养基中的OA浓度(FA 18:1)均增加(图5C)。
PCA 分析表明,与对照细胞相比,Scd1 过表达改变了脂质组学特征(图 S3B-C),并增加了甘油三酯中的 MUFA 含量(图 S3D)。来自过表达Scd1的HAEC的条件培养基减轻了HAEC中LPS诱导的炎症基因表达(图5D),表明细胞内和细胞外OA均赋予抗炎反应。
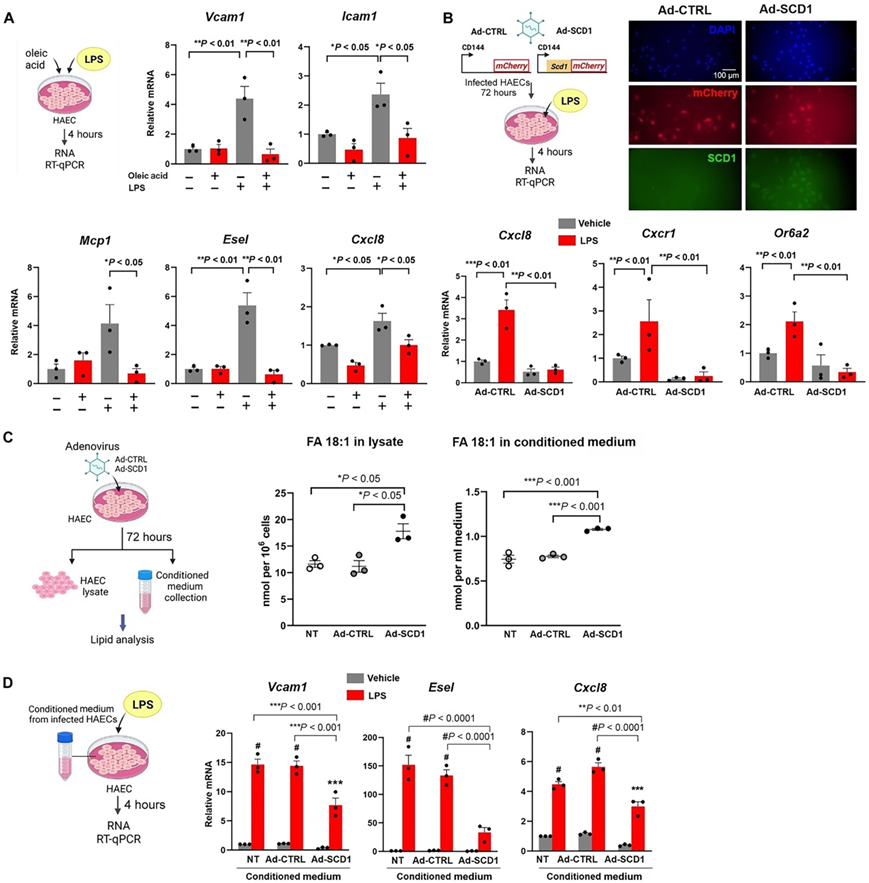
图5. OA 处理或 Scd1 过表达可减轻 HAEC 中的促炎介质。
(A)逆转录定量聚合酶链反应 (RT-qPCR)。(B)用腺病毒对照或腺病毒感染HAEC以过表达Scd1并进行LPS处理。(C) 用腺病毒对照或腺病毒转染 HAEC 以过表达 Scd1。(D)将在常规培养基中生长的HAEC单层改为从NT、Ad-CTRL和Ad-Scd1的HAEC收集的条件培养基,在存在或不存在LPS (20ng/ml)的情况下培养4小时。
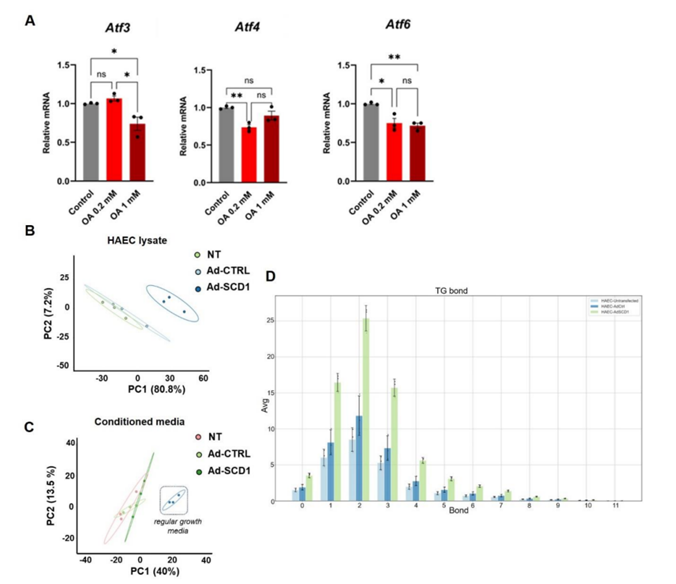
图S3. 油酸处理或SCD1过表达可减轻HAEC中的促炎介质。
(A) OA降低了内质网应激相关基因Atf3、Atf4和Atf6的表达。(B-C)在未转染(NT)或转染腺病毒(Ad-CTRL或Ad-Scd1)的HAEC细胞裂解液或条件培养基中定量的单个脂质PCA。(D)甘油三酯(TG)键分析表明,Scd1过表达显著增加了含有一个、两个或三个双键的细胞TG。
05
内皮特异性 SCD1 缺失消除了血管内皮保护
为了进一步证明Scd1介导的血管保护作用,他们开发了内皮特异性Scd1缺失的Ldlr−/−动脉粥样硬化小鼠模型。通过在Cdh5启动子下表达Cre重组酶[血管内皮型钙粘蛋白(VE-cadherin)] (Ldlr−/−Scd1EC−/−),他们生成了内皮缺失或不缺失Scd1基因的Ldlr−/−小鼠(Ldlr−/−Scd1EC−/−)。接下来,Ldlr−/−或Ldlr−/− Scd1EC−/−小鼠用高脂饮食(HFD)喂养28天,在主动脉中形成脂肪条纹(图6A)。第28天,靶向定量代谢组学分析显示,与没有SCD1缺失的Ldlr−/−小鼠相比,不运动组Ldlr−/− Scd1EC−/−小鼠的循环OA和PA基础水平有降低的趋势。运动组Ldlr−/− Scd1EC−/−小鼠的血浆OA和PA水平与不运动组相似,而运动组Ldlr−/−小鼠的OA和PA水平显著升高(图6B-C)。
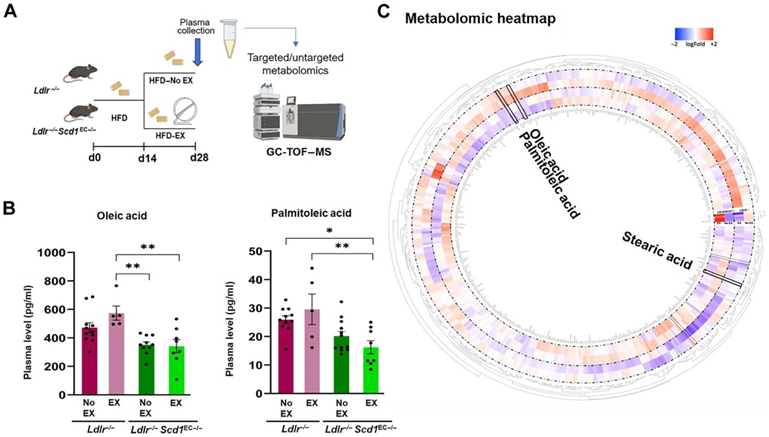
图6. 内皮特异性Scd1缺失的小鼠中运动介导的脂质代谢 OA 和 PA 减少。
(A) 实验方案。 (B) Ldlr −/−小鼠运动后绝对血浆 OA 浓度升高,而Ldlr −/− Scd1 EC−/−小鼠运动后 OA 浓度降低并保持降低状态。(C)非靶向代谢组学分析的圆形热图捕获了已知和未知的身份(ID)代谢物,并突出了使用Pareto方法归一化和缩放后OA和PA的变化。
计算机模拟显示,运动增强的 PSS 减轻了沿着主动脉弓小曲率的血流再循环(图 7A)。在HFD处理后Ldlr −/− 小鼠受干扰的血流暴露的小曲率中,血管细胞粘附分子 1 (Vcam1)的表达非常突出(左上)。HFD处理后Ldlr −/− Scd1 EC−/−小鼠的Scd1缺失也产生了相似的Vcam1染色表达(左下)。然而,在Ldlr−/−小鼠(右上)中,自愿轮跑14天减轻了Vcam1的表达,但在Ldlr −/− Scd1 EC−/−小鼠(右下)中没有(图7A-C)。在降主动脉内皮暴露于PSS(图7B),未观察到Vcam1表达。共聚焦成像证实了hfd饲喂的Ldlr−/−小鼠降主动脉中Vcam1阳性细胞数量较少,而内皮细胞Scd1 (Ldlr−/−Scd1EC−/−)的缺失增加了Vcam1阳性细胞数量。此外,14天的自愿运动并未减轻Ldlr −/− Scd1 EC−/−小鼠的Vcam1阳性内皮细胞(图7B-C)。
运动后,Ldlr −/−小鼠在主动脉弓易受血流干扰的区域出现了明显的 Scd1 染色,而Ldlr −/− Scd1 EC−/−小鼠中则没有这种染色,这通过 Scd1 特异性探针的原位杂交得到了证明(图7E)。因此,运动增强的 PSS 会激活内皮 Scd1,从而减少粘附分子的表达。
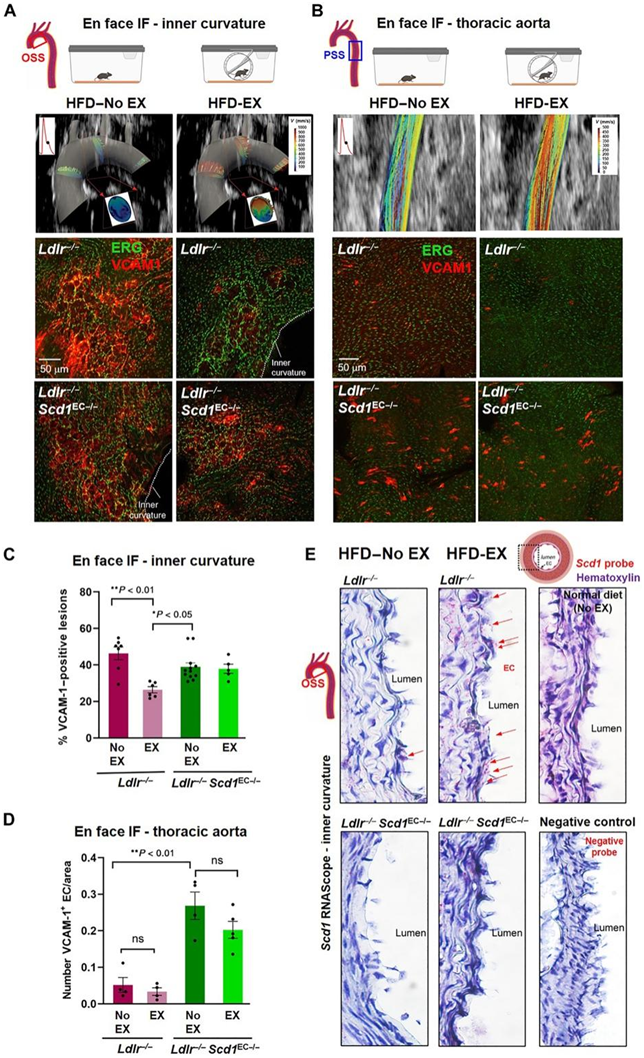
图7. 内皮特异性Scd1缺失会消除运动介导的抗炎介质。
(A-B)CFD 模拟主动脉弓与降主动脉 WSS 的空间和时间变化。(C-D)免疫荧光定量。(E) Scd1特异性探针(RNAscope)证实了Ldlr−/−小鼠运动后易血流紊乱的主动脉弓中明显的内皮Scd1染色,但在Ldlr−/− Scd1EC−/−小鼠中没有。
06
Scd1阳性但Vcam-1阴性内皮亚聚类的转录组分析
接下来,他们对Ldlr −/−小鼠的主动脉进行了单细胞转录组分析(scRNA-seq),这些小鼠经历了三种情况:(i)正常饮食,(ii) HFD和(iii) HFD 加 2 周运动(HFD-EX),持续4周(图8A)。转录谱的无偏聚类分析确定了具有特定血管谱系的九种细胞类型:B细胞、红细胞、内皮细胞、成纤维细胞、巨噬细胞、单核细胞、神经元、平滑肌细胞和T细胞(图8B)加上五个内皮细胞亚聚类(图8C-D)。
他们确定了一个明确的内皮亚聚类,其中较高水平的Ppar γ 和Scd1与低水平的Vcam1表达相关(图 8E-F)。
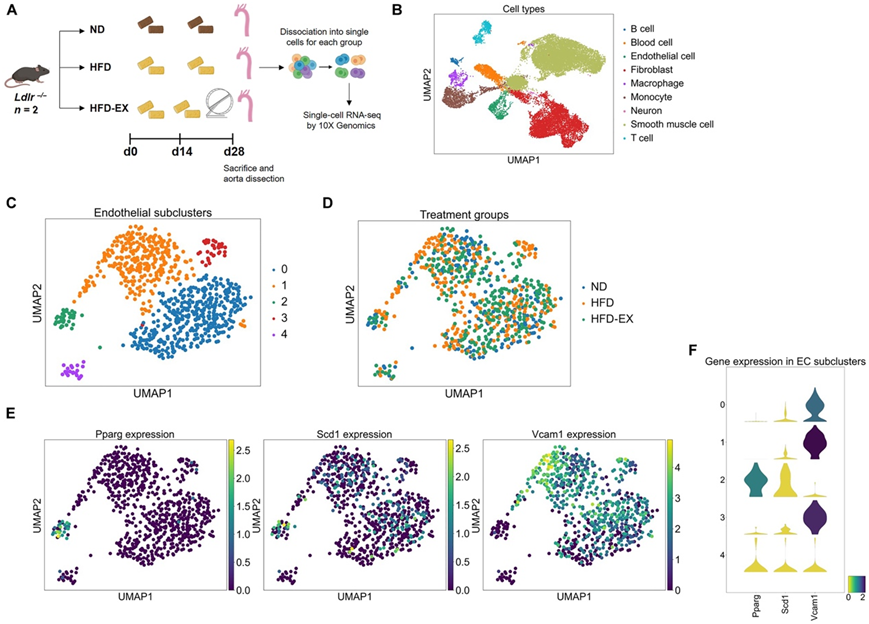
图8. 小鼠主动脉单细胞转录组学分析。
(A)实验方案示意图。(B-D)UMAP可视化。(E-F) Ppar γ、Scd1和Vcam1表达的变化可识别内皮亚聚类,其中较高水平的Ppar γ 和Scd1与低水平的Vcam1表达相关。
+ + + + + + + + + + +
结 论
本项研究的非靶向代谢组学分析表明,进行自愿轮跑运动的野生型小鼠表达增加的Scd1,其催化抗炎脂质代谢物,以减轻NF- κB 介导的炎症反应。计算机分析显示,运动增加了小鼠主动脉弓小曲率的时间平均壁剪切应力,但减轻了血流再循环和振荡剪切指数。运动后,高脂饮食的内皮Scd1缺失小鼠 (Ldlr −/− Scd1 EC−/−) 在小弯和降主动脉中形成持续的 Vcam1阳性内皮,而通过腺病毒转染的 Scd1 过度表达减轻了内质网应激,炎症生物标志物。主动脉的单细胞转录组学鉴定了与其他候选基因相互作用的Scd1阳性和Vcam1阴性内皮亚聚类。因此,运动可减轻血流再循环并激活内皮 Scd1 催化油酸和棕榈油酸来保护血管内皮。
+ + + + +



 English
English


