文献解读|Cell Rep Med(14.3):多细胞生态型塑造肺腺癌从毛玻璃样混浊向晚期的进展
✦ +
+
论文ID
原名:Multicellular ecotypes shape progression of lung adenocarcinoma from ground-glass opacity toward advanced stages
译名:多细胞生态型塑造肺腺癌从毛玻璃样混浊向晚期的进展
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.03.29
DOI号:10.1016/j.xcrm.2024.101489
背 景
肺腺癌 (LUAD) 是肺癌的主要亚型,尽管采用了现代一线治疗,但晚期患者的 5 年生存率仅为 50%。LUAD是一种具有多种临床放射学表现的癌症,从磨玻璃样混浊(GGO)到纯实性结节,其生物学特征差异很大,目前对这种异质性的理解是有限的。
实验设计
结 果
01
GGO和晚期LUAD细胞状态和多细胞生态型图谱
为了揭示早期GGO病变和晚期luad中存在的多细胞生态型和不同的细胞状态,研究团队分析了基于55例手术活检患者的单细胞转录组分析(scRNA-seq)数据(图1A)。
根据其放射学特征,将GGO样品分为6种不同的模式,包括纯GGO (pGGO)、高密度GGO (dGGO)、含25%实体成分的GGO (GGO25)、含50%实体成分的GGO50、含75%实体成分的GGO (GGO75)和含100%实体成分的GGO (GGO100)(图1A)。根据大小和淋巴结转移情况进一步划分实性结节亚组,包括1-2 cm实性结节(Solid1)、3 - 5 cm实性结节(Solid3)和伴有局部淋巴结转移的实性结节(SolidN),其中47例也进行了全外显子组测序(WES)分析(图1B)。该分类具有临床相关性,涵盖了门诊患者中观察到的大部分放射学异质性(图 1 B)。scRNA-seq 分析从总共 462784 个单细胞中产生了 33336 个独特的转录本(图 1 C)。其中,294507个细胞(63.64%)来自GGO样本,127204个细胞(27.49%)来自实性结节,其余41073个细胞(8.88%)来自正常样本(图1C)。无监督细胞聚类鉴定出 11 种主要细胞亚型,包括上皮细胞、内皮细胞、成纤维细胞、B 细胞、CD4+淋巴细胞、CD8+淋巴细胞、自然杀伤 (NK) 细胞、树突状细胞 (DC)、肥大细胞、多形核白细胞(PMN)和单核细胞/巨噬细胞(图 1C)。
通过最大化共关联模式将这些细胞状态聚集成群落,揭示了六种肺多细胞生态型(LME)(图1D)。LME 的基本细胞状态数量差异很大。例如,LME03包含所有生态型中最异质的细胞状态,其中上皮细胞主要具有EGFR突变、组蛋白去甲基酶KMT2D突变和肿瘤抑制基因TP53突变(图1E)。他们观察到LME01、LME02和LME04显著增加,而LME03和LME05随着从正常肺组织进展到晚期实性结节而减少(图1F)。
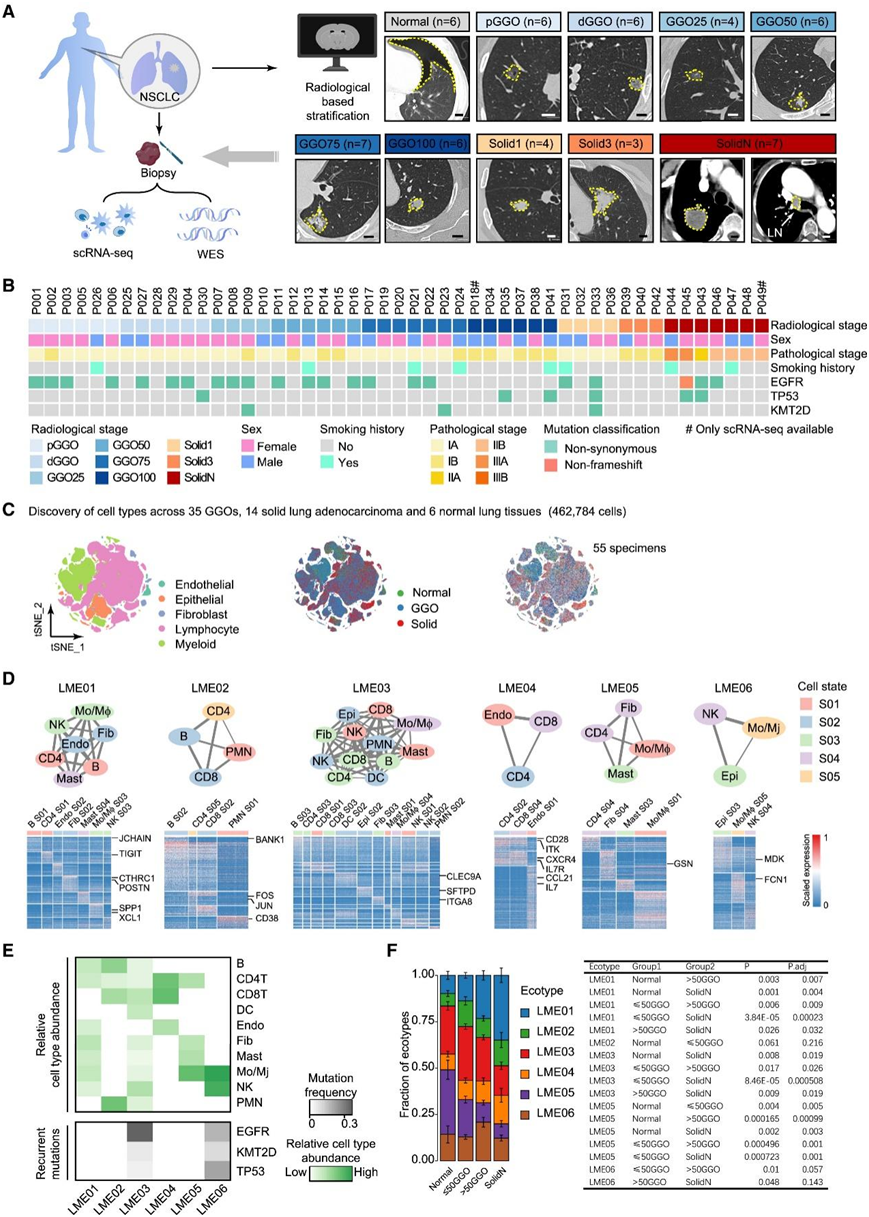
图1. GGO 和实体肺腺癌细胞状态和 LME 的表征。
(A) 示意图描绘了基于放射学模式的分析框架和患者分层。(B) 原发性未经治疗的肺腺癌个体的临床特征概述。(C) 按主要细胞分区(左)、组织类型(中)或来自不同患者的样本(右)划分的 t-SNE(t 分布随机邻域嵌入)。(D) 在未经治疗的肺腺癌个体中检测到的肺恶性生态型。(E) 发现队列中 LME 的特征。(F) 不同放射学临床阶段的 LME 分数。
02
GGO 和高级 LUAD 中的恶性细胞状态
GGO 可以保持休眠状态数十年,但随着实体部分比例的增加,最终会进展为高级实体结核。他们使用正常的免疫细胞、内皮细胞和成纤维细胞作为参考,通过推断大规模拷贝数变异 (CNV) 来识别恶性细胞(图 2 A)。基于恶性细胞识别,EcoTyper分析揭示了三种主要的上皮恶性细胞状态(图2B),包括在GGO和实体相关腺癌中高度富集的两种细胞状态(Epi S02和Epi S03)和一种细胞状态(Epi S01)(代表肺纤毛细胞)。在腺癌的情况下,Epi S02 在 GGO 衍生的患者样本中占主导地位(图 2 C),并表达与肺泡 II 型细胞和球杆细胞相关的经典标记基因,例如SFTPC、S FTPD和SCGB3A1(图 2 B)。这些细胞也显示出增加的丝裂原活化蛋白激酶(MAPK)途径活性,这可能与它们的恶性潜能有关。另一方面,Epi S03在实体结节或实体部分增加的ggo中更丰富(图2C),通过表达炎症因子(如CXCL14)、糖酵解酶(如GAPDH)和分化因子(如S100A9)将其与Epi S02区分开来。与状态S02相比,Epi S03似乎具有更高的转移潜力,表达包括midkine (MDK)和SERPINA1在内的转移相关基因。当分析来自评估奥西替尼的临床试验(NCT03433469)的scRNA-seq数据集时,他们观察到,与未接受治疗和进展性疾病患者相比,大多数残留疾病组的Epi S03水平较低或无法检测到,Epi S02含量较高(图2D)。在另一项独立的未经治疗的研究中也观察到了类似的结果,该研究根据LUAD的局部和远处转移对患者进行了分层,他们观察到Epi S02在伴有淋巴结或脑转移的晚期肺恶性肿瘤中显著降低,而Epi S03在伴有淋巴结或脑转移的同一肺恶性肿瘤中升高(图2E)。因此,在两个独立的队列中,恶性Epi S03可能代表一种更具侵袭性的恶性特征,其高水平显示较差的临床结果(图2F-G)。
由于来自同一患者的用于进行 scRNA-seq 和免疫化学的材料数量有限,他们使用多重免疫荧光 (mIF)研究了另外 10 个具有不同放射学模式的患者样本。为了识别区分 Epi S02 和 Epi S03 的基因特征,他们选择了 6 个基因进行评估:Epi S02、SFTPD、SEMA4A和AFF3以及SERPINA1和IFI16(图 2 H)。在以 pGGO 和 dGGO 为代表的早期肺部恶性肿瘤中,他们发现转化细胞沿着肺泡上皮形成单层生长,并仅表达 Epi S02 基因特征(图 2I-J)。实体部分出现在 GGO 放射学模式中时,恶性细胞表达 Epi S02 和 S03 基因特征,显示细胞状态转变(图2J)。在实体结节样本中,恶性细胞表达高水平的VIM和SERPINA1,以及较小程度的IFI16(图 2I-J),这些细胞不表达SFTPD、SEMA4A或AFF3。
GGO的早期发现显著提高了肺癌患者术后的总体生存率。然而,在具有亚实性部分的 GGO 中出现肺癌细胞状态 Epi S03 显示出较差的临床结果(图 2F-G)。
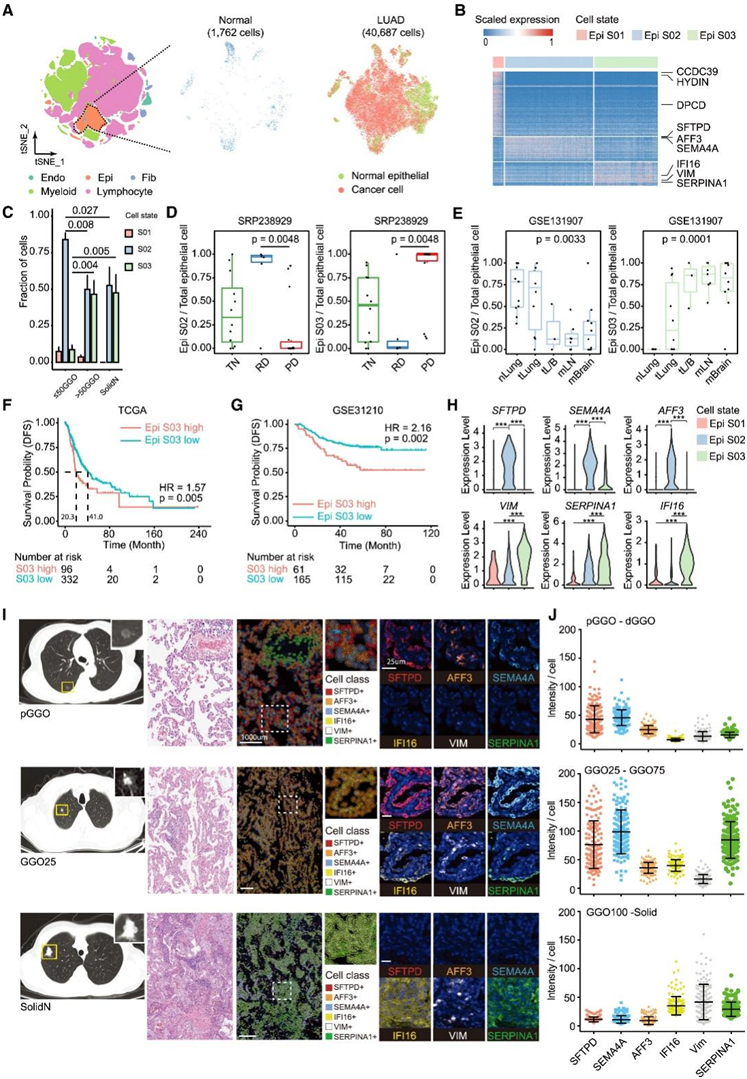
图2. GGO向实性结节进展时恶性细胞状态的鉴定。
(A) 基于 CNV 推断的上皮细胞的 t-SNE。(B) 热图显示 scRNA-seq 数据集的癌细胞状态中的标记基因,其中基因为行,肿瘤/邻近正常组织样本为列。(C) 癌细胞S03在肺腺癌进展的晚期富集。(D-E) SRP238929 队列和 GSE131907 队列中 Epi S02 和 Epi S03 细胞状态的分数。(F) Kaplan-Meier 图显示 TCGA I-II 期队列中 Epi S03 细胞状态特征高/低表达的患者之间无病生存率的差异。(G) Kaplan-Meier 图显示未接受治疗的早期肺腺癌患者队列 (GSE31210) 中 Epi S03 细胞状态特征高/低表达的患者之间无病生存率的差异。(H)单细胞水平上皮细胞状态特异性标记物的表达水平。(I) 对来自独立患者队列的福尔马林固定石蜡包埋的组织进行多重免疫荧光验证,以检测恶性细胞中特定细胞状态标志物的表达。(J) 基于 QuPath 的细胞状态标记表达水平定量。
03
实性结节后期出现包含 CXCL13+ CD8+耗尽 T 细胞的生态型
为了研究从 GGO 到晚期实性结节进展过程中的免疫微环境变化,他们重点关注细胞状态及其相应的多细胞生态型。使用 EcoTyper 算法,他们生成了肿瘤相关微环境细胞的全面细胞状态图谱(图 3 A-B)。他们观察到 LUAD 进展时 LME02 相关细胞状态水平升高,包括MS4A1+(也称为 CD20)B S02、CD40L+ CD4T S05、肿瘤反应性CXCL13+ CD8T S02 和CLEC4A+ PMN S01,类似于经典三级淋巴结构 (TLS) 的细胞组成。与LME02相似,CD8 T S02仅在晚期实体结节性LUAD中升高,但未达到统计学意义(图3A)。cd8t s02表达颗粒酶B、H等细胞毒性因子和CD38等活化因子。与其他CD8 T细胞状态相比,这种细胞状态也表达了更高水平的衰竭标志物,如PDCD1、LAG3和HAVCR2以及TOX转录因子(图3C),表明细胞处于终末衰竭状态。当他们对其他患者样本进行原位mIF时,确实观察到 TLS 样结构水平的增加,特别是来自具有实性结节放射学特征的患者的肿瘤样本(图3D)。在早期,例如pGGO,他们也观察到CD19 +细胞聚类。然而,如果没有清晰的 T 细胞区域,这些聚类不会形成成熟的 TLS(图 3D)。大多数肿瘤反应性CD8+ T细胞定位于瘤床周围,实性部分超过50%,而CD8+ T细胞和CD4+ T细胞在早期ggo相关阶段的分布更为均匀(图3E)。
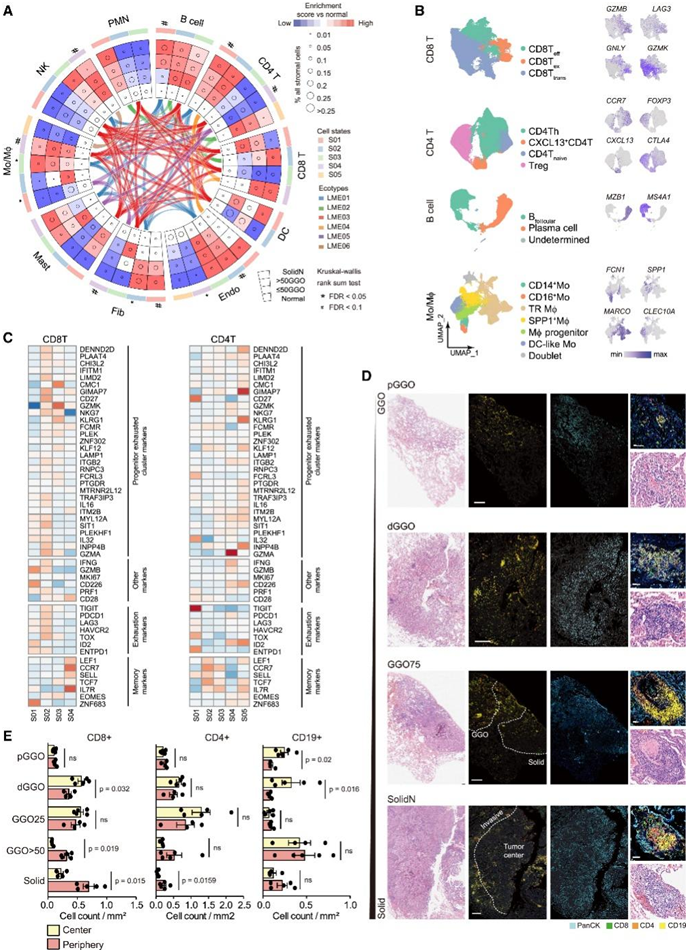
图3. GGO和亚实性结节微环境细胞状态的早期表现。
(A) GGO 和实体结节性肿瘤相对于正常肺组织的免疫细胞状态的组成变化。(B) UMAP可视化。(C) 热图显示 (A) 中 CD8+T 和 CD4+T 细胞状态中选择记忆和祖细胞耗竭淋巴细胞相关标记物的表达。(D) 多重免疫荧光检测肺腺癌进展时三级淋巴结构 (TLS) 的形成。(E) 基于 QuPath 的肿瘤中心和肿瘤周边细胞计数定量。
04
肿瘤表现出免疫和基质细胞相关的生态型,表明早期 LUAD 的进展
随着肺病变从ggo向实性结节发展,FOXP3+ CD4+ T细胞状态S01、MZB1+ B细胞状态S01、SPP1+单核/巨噬细胞(Mo/Mφ)细胞状态S03、胶原三螺旋重复含1阳性(CTHRC1+)成纤维细胞(Fib)细胞状态S02和肿瘤相关内皮细胞(Endo)细胞状态S02增加(图3A)。他们使用CellChat来研究该生态系统中抗肿瘤和促肿瘤区室相互作用的潜在机制(图4A)。在LME01生态型中,IgG+浆细胞(B细胞S01)和XCL1+细胞毒性NK细胞(NK细胞S03)可能是ggo的控制因子。在GGO 患者队列中,他们观察到MZB1+B 细胞 (B S01) 和SPP1+巨噬细胞 (Mo/Mφ S03) 并未与 CXCL13+ CD8+ T 细胞形成生态型。相反,它们可能通过与癌症相关成纤维细胞 (CAF) 和肥大细胞相互作用而重新极化(图 4 A)。他们检测到GAS6-MERTK、CSF1-CSF1R和IL13-IL13RA1在 LME01 相关 Fib S02 和SPP1+ Mo/Mφ S03 之间存在强烈的相互作用(图 4 A)。SPP1+ Mo/Mφ S03可能通过分泌白细胞介素-6 (IL-6)和il-1b与调节性T细胞(CD4T S01)相互作用,产生促肿瘤生态系统(图4A)。接下来,他们使用mIF来验证捕获的B细胞和CD4 T细胞,以检测它们与XCL1+细胞和CTHCR1+细胞的可及性。通过基于qupath的单细胞水平定量,他们发现在ggo样LUAD向晚期实性结节发展时,B细胞、CD4细胞与XCL1+细胞和CTHCR1+细胞的距离明显更近(图4B)。
此外,由于单核细胞来源的巨噬细胞的可塑性,他们在LME01中观察到的Mo/Mφ细胞状态可能与另一生态型中存在的其他Mo/Mφ细胞状态极化,突出了群落间的相互作用。利用monocle算法,他们发现CD68+/SPP1+/FABP4−巨噬细胞(Mo/Mφ S03)与Mo/Mφ S05分化(图4C-D)。Mo/Mφ S05对应的单核细胞也可能分化为dc样单核细胞(图4D)。从生态型角度看,Mo/Mφ S05与Epi S03和NK S04共同构成LME06,其比例随着GGO的进展而增加。Epi s03衍生的ANXA1,以及lme01相关的肥大细胞衍生的ANXA1可能与巨噬细胞表达的受体(如FPR2)相互作用(图4E)。这些特异性的细胞间相互作用可诱导单核细胞中GNA15和MCL1转录因子的表达,从而促进促肿瘤SPP1+巨噬细胞信号的激活(图4F-G)。
他们随后研究了 LME01 基因特征是否可以用作 III 期肺癌患者的预后指标。使用癌症基因组图谱 (TCGA) 的 LUAD 数据集,他们发现,LME01 特征水平较高的患者的中位生存率为 27.5 个月,而 LME01 水平较低的患者的中位生存率为 47.5 个月(风险比 [HR] = 1.57)(图 4 H)。这种效应在另一个独特的 LUAD I-II 期患者队列中更为明显,其中高水平的 LME01 特征预示着预后较差(图 4 I,HR = 2.49)。同样,他们在LUAD患者样本的RNA-seq数据中观察到与LME01特征相关的较差生存率(图 4 J)。
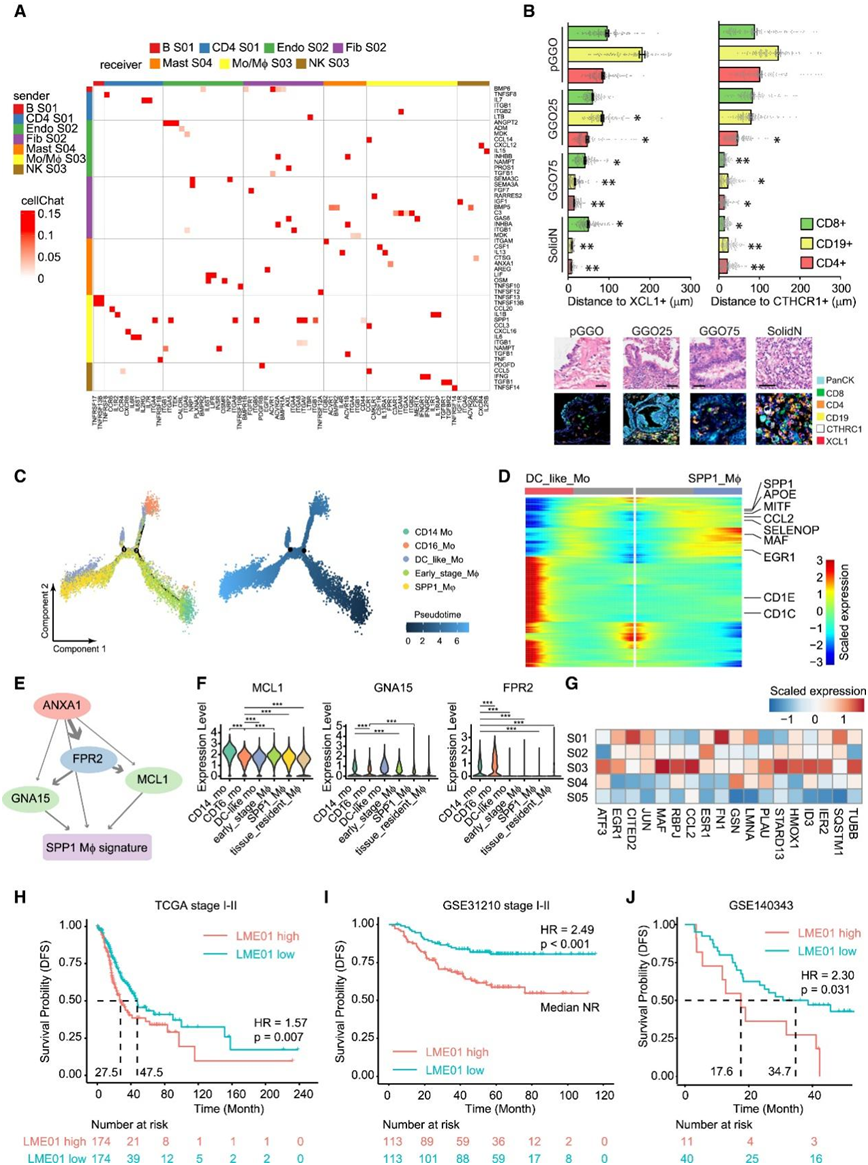
图4. 肺腺癌从GGO到亚实性结节进展过程中涉及的免疫和基质生态型。
(A) 由 CellChat 算法确定的 LME01 内细胞间相互作用的矩阵表示。(B) 基于多重免疫荧光的肺腺癌进展过程中B 细胞、CD4+T 细胞和 CD8 + T 细胞与XCL1+ 细胞和CTHCR1+细胞的距离的定量。(C) 基于 Monocle 的 Mo/Mφ 轨迹推断分析。(D) Mo/Mφ 成熟过程中沿伪时间轨迹的标记基因表达。(E) 肥大细胞和肿瘤细胞来源的膜联蛋白 A1 (ANXA1) 与Mo/Mφ 表达的FPR2受体相互作用。(F)单细胞水平受体和下游信号分子的表达水平。(G)在Mo/Mφ的不同细胞状态下表达的ANXA1调节的靶基因的表达水平。(H–J) 生存分析。
05
免疫系统早期检测 GGO 相关新抗原
通过使用 netMHCpan基于 scRNA-seq 数据的算法,他们探索了队列中的新抗原表现,在 LUAD 进展时观察到新抗原数量增加(图 5A)。值得注意的是,新抗原数量的增加与 CNV 呈正相关(图 5 B)。此外,在 LUAD 进展过程中观察到 T 细胞受体 (TCR) 多样性降低,这与 CNV 呈负相关(图 5 C)。这些观察结果表明肿瘤内异质性增加,这可能与后期CD8+ T 细胞毒性降低有关。接下来,他们使用 WES 数据集生成定制的搜索数据集,并收集了额外的 30 个 HLA-I 类相关免疫肽组患者样本,以探索 LUAD 早期阶段的新抗原景观(图 5D),观察到实性结节或实性部分超过75%的GGO中新抗原数量增加,并且亚克隆新抗原在实性结节中表现出代表性增加的趋势(图5E)。在验证队列中观察到通过质谱检测到的 HLA-I 类相关变异肽的类似趋势(图 5F)。此外,他们发现EGFR(L858R)突变是最常见的改变,netMHCpan预测显示,三种类型的EGFR(L858R)相关肽,包括KITDFGRAK, VKITDFGRAK和ITDFGRAKL,在发现队列中有很高的代表性(图5G)。预测KITDFGRAK和VKITDFGRAK肽与HLA-A11.01等位基因型和HLA-B07.02等位基因型的结合程度较低。结果显示,ITDFGRAK肽与HLA-C01.02等位基因型结合,结合活性较弱(图5G)。在验证队列中,他们没有在hla - i类相关免疫肽中检测到ITDFGRAK肽。然而,他们确实在两例具有GGO放射学特征的患者的肿瘤中检测到了KITDFGRAK和VKITDFGRAK肽(图5H)。
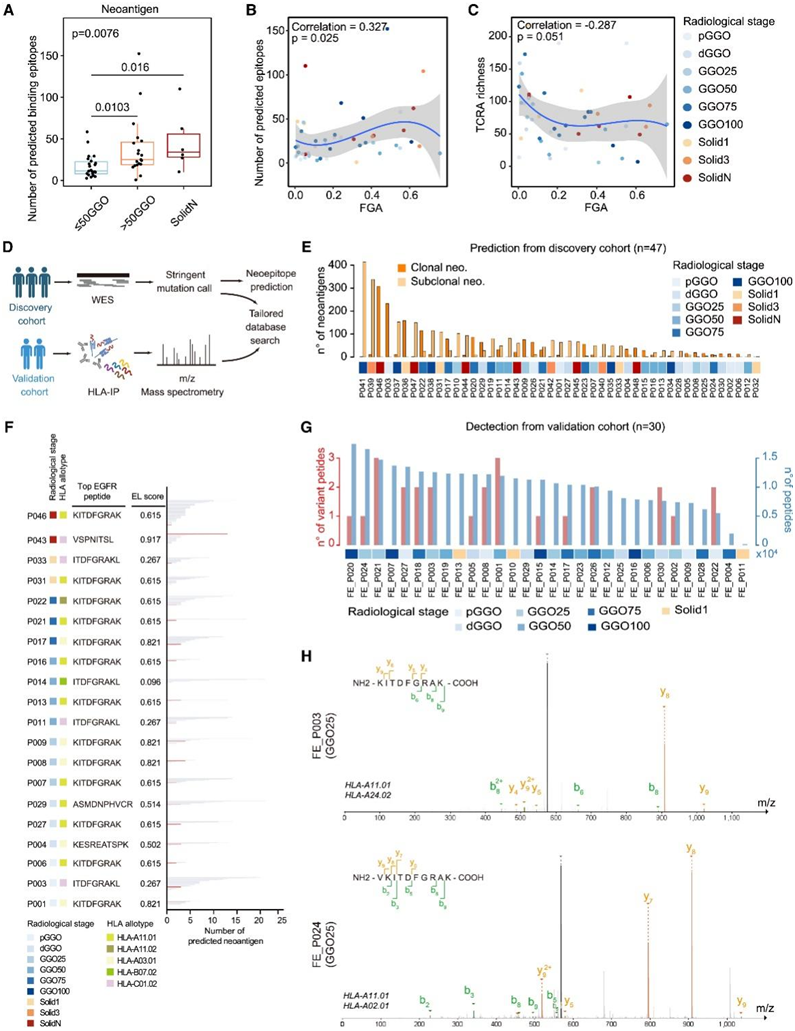
图5. WES和HLA免疫肽组检测的GGO相关新抗原。
(A) 肺腺癌不同放射学阶段的新抗原数量。(B-C) 拷贝数变异和新抗原数量以及单细胞数据集衍生的 T 细胞受体多样性之间的 Pearson 相关分析。(D) 两个独立患者队列中新抗原检测的示意图。(E) 显示了源自单细胞数据的克隆和亚克隆表达的新抗原的患者水平数量。(F) 显示了验证队列中 HLA 免疫肽组检测到的新抗原。(G)通过 netMHCpan 算法预测的EGFR (L858R) 突变患者中突变相关新抗原的推定表现的多样性。(H)来自具有 GGO 放射学特征的肺腺癌患者的HLA 抗体免疫纯化的EGFR (L858R) 肽的串联质谱分析。
06
EGFR (L858R) 相关新抗原诱导 CD8+ T 细胞反应性
为了探索 T细胞受体(TCR) 对EGFR (L858R) 相关新抗原的可能识别,他们采用了最近开发的机器学习模型TCRAI,使用 IFN-γ ELISPOT 测定作为训练集。在最大化 Youden 指数(阈值为 0.816)(图 6 A)时,他们的模型可以重复模拟基于EGFR新抗原肽刺激实验的体外实验(图 6 B)。随后,他们在scRNA-seq数据集中预测了CD8+ T细胞区室能够识别egfr突变衍生的新抗原的tcr。那些含有EGFR(L858R)突变的患者样本显示,CD8+ T细胞具有EGFR(L858R)-新抗原识别TCR的频率明显更高(图6C),其中包括三个保守的TCR基序。在早期生态型LME03中也观察到egfr突变相关新抗原的过表达(图6D)。这与lme03相关CD8T细胞状态S03对EGFR(L858R)新抗原的显性识别是一致的(图6E)。
这些结果表明TCF7+ PD1+ IFNG+ CD8+ T细胞可以在LUAD早期识别EGFR突变阳性的恶性细胞(图6E)。然而,随着GGO向实性结节的发展,这些特异性EGFR(L858R)识别的CD8+ T细胞通过表达更高水平的衰竭因子(如LAG3)记忆标志物(如IL7R)以及表达更低水平的细胞毒性标志物(如IFNG)而逐渐耗尽(图6F)。
为了证实CD8+ T细胞对EGFR(L858R)新抗原的识别,他们同时进行了mhc匹配四聚体测定和细胞内IFN-γ检测(图6G)。由于他们已经在一个独立的患者队列中验证了KITDFGRAK(称为K9R7肽)和VKITDGRAK(称为V10R8肽)的存在(图5H),他们合成了这两种肽及其野生型对应物,称为K9WT和V10WT。与新抗原预测一致,K9R7 和 V10R8 新抗原均可显著诱导 CD8+T 细胞反应性,显示 HLA-A11.01 四聚体染色增加和细胞内 IFN-γ 水平增加(图 6 H),而EGFR相关野生型肽不诱导HLA-A11.01匹配的CD8+ T细胞反应性(图6H-I)。

图6. GGO相关EGFR(L858R)新抗原可由CD8+ T细胞识别。
(A) 基于机器学习的建模,对识别 EGFR(L858R) 新抗原的 CD8+T 细胞进行分类。(B) 该模型预测在 2 个月的抗原治疗中最丰富的新抗原识别 T 细胞。(C) 识别 EGFR(L858R) 新抗原的 CD8+ T 细胞克隆更多地出现在 GGO 相关样本中。(D) 与其他EGFR野生型样本相比,早期 LME03 显示出更高的EGFR (L858R) 新抗原呈递频率。(E) EGFR (L858R) 新抗原识别 CD8+ T 细胞在每种细胞状态中的分布。(F) 肺腺癌进展时新抗原识别 T 细胞的效应因子和耗竭因子的表达。(G) HLA-A11.01 匹配的 CD8+ T 细胞的体外MHC 四聚体测定示意图。(H) EGFR (L858R) 新抗原相关 MHC 四聚体结合和细胞内 IFN-γ 浓度的流式细胞分析的代表性图像。(I)四个不同 HLA-A11.01 匹配供体中CD8+ T 细胞对EGFR (L858R) 新抗原的反应性的统计分析。
07
淋巴样内皮细胞驱动祖细胞CD8+ T 细胞进入耗尽细胞状态
大量研究表明,T 细胞耗竭是由持续呈递的抗原触发的CD8 + T 细胞的独特分化谱系。在耗竭谱系中,祖细胞耗竭的 T 细胞会产生终末耗竭的 T 细胞,这些 T 细胞在肿瘤部位积聚,无法执行效应功能。尽管EGFR(L858R)相关的新抗原在LUAD早期可能由CD8+ T细胞识别,但他们发现祖细胞样CD8+ T细胞(CD8T S04)与淋巴样内皮细胞(Endo S01)和CD4+ Th细胞(CD4 S02)一起形成LME04生态型(图7A)。
通过使用CellChat和NicheNet算法探索细胞间相互作用,他们发现淋巴样Endo s01分泌的CCL21可能通过与其相应受体CCR5相互作用募集CD8+ T细胞,从而促进LME04的形成。另一方面,来自Endo S01的TGFB2可能促进CD8+ T细胞衰竭(图7A-B)。通过结合NicheNet分析和基于monocle的轨迹分析,他们发现祖细胞样CD8T S04细胞状态沿细胞轨迹扩散,呈现亚稳态细胞状态(图7C)。此外,随着伪时间进展,T细胞衰竭基因特征的表达上调(图7D)。他们发现CD8T S04确实在四种CD8T细胞状态中显示出最高的祖细胞评分(图7F),而CD8T S01和S02在肿瘤反应性终末耗竭T细胞特征中显示出更高的评分(图7E)。
由于祖细胞CD8+ T细胞参与基于免疫检查点抑制剂的免疫治疗,LME04生态型的存在可能会阻碍过渡性CD8+ T细胞的功能并减轻患者对免疫治疗的反应。他们研究了四个独立的抗pd1 /PD-L1免疫治疗临床队列,发现与应答者相比,无应答者中LME04相关特征的表达明显更高(图7G-I),这与LME04特征表达较低的患者表现出持久应答的观察结果一致(图7J)。
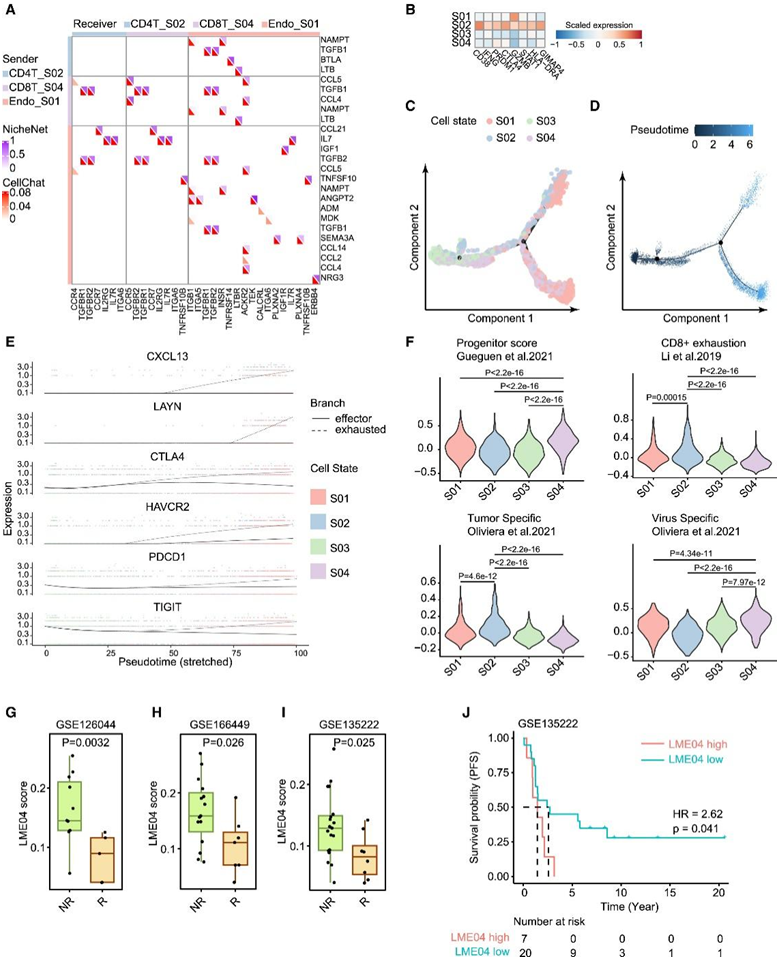
图7. LME04生态型定向治疗适应症。
(A) 由 CellChat 和 NicheNet 算法预测的 LME04 内的细胞间通信矩阵。(B) 不同 CD8+ T 细胞状态下淋巴内皮细胞调节的 CD8+ T 细胞相关靶基因特征的表达谱。(C-D) 基于 Monocle 的 CD8+ T 细胞轨迹推断分析。(E)从根CD8T S03到CD8T S04再到CD8T S01(实线)和CD8T S02的耗尽基因表达动力学曲线。(F) 基于已发表的相应基因特征的平均祖细胞评分、耗竭评分、肿瘤反应评分和病毒反应评分的小提琴图。(G–I) 三个独立免疫治疗数据集中 LME04 生态型基因特征的箱线图。(J) 对 27 名接受抗 PD-1/PD-L1 治疗的晚期非小细胞肺癌患者进行 LME04 生态型特征的患者生存分层测试
+ + + + + + + + + + +
结 论
本项研究通过机器学习模型分析、scRNA-seq和全外显子组测序分析了 58 名肺腺癌患者,并确定了与不同放射学模式和癌细胞相关的六种肺多细胞生态型 (LME)状态。值得注意的是,早期癌症中的 GGO 相关新抗原由CD8+ T 细胞识别,表明存在免疫活性环境,而实性结节则具有免疫抑制 LME,其中 CD8+ T 细胞耗尽,由特定基质细胞(如CTHCR1)驱动成纤维细胞。这项研究还强调了GGO 样本中的EGFR (L858R) 新抗原,表明潜在的 CD8+ T 细胞激活。
+ + + + +



 English
English


