文献解读|Nat Commun(16.6):NMR 和 MS 揭示特征代谢组图谱并优化食管鳞状细胞癌早期检测
✦ +
+
论文ID
原名:NMR and MS reveal characteristic metabolome atlas and optimize esophageal squamous cell carcinoma early detection
译名:NMR 和 MS 揭示特征代谢组图谱并优化食管鳞状细胞癌早期检测
期刊:Nature Communications
影响因子:16.6
发表时间:2024.03.19
DOI号:10.1038/s41467-024-46837-0
背 景
代谢变化先于恶性组织学变化。然而,目前尚不清楚食管鳞状细胞癌(ESCC)组织和生物液中是否存在可检测的特征代谢组以进行早期诊断。
实验设计

结 果
01
通过 NMR 和 MS 观察 ESCC 患者的早期组织代谢组图
在这项多中心回顾性分析中,研究团队纳入了来自中国南方三个中心的 560 名参与者,总样本量为 1153 人,以探讨与 ESCC 相关的代谢改变(图1)。
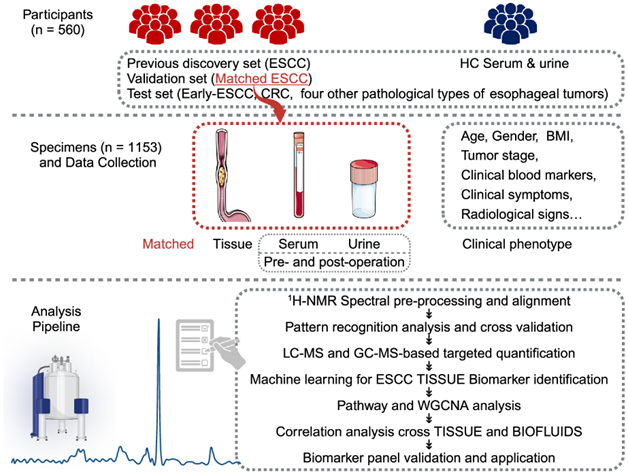
图1. 总体研究设计方案。
质子核磁共振(1H-NMR)和质谱(MS)是代谢组学中最主流的技术平台。正交偏最小二乘判别分析(OPLS-DA)显示,ESCC肿瘤与正常粘膜(图2A)、早期ESCC肿瘤与正常粘膜(图2B)、早期ESCC与晚期ESCC(图2C)之间代谢差异明显。外部排列测试验证了模型适合于数据分析(图2D-F)。根据筛选标准,分别鉴定出43、34、12和45个ESCC组织与正常黏膜、早期ESCC组织与正常黏膜、早期ESCC组织与晚期ESCC组织、晚期ESCC组织与正常黏膜的潜在代谢生物标志物(图2J)。KEGG通路分析显示,在ESCC从正常粘膜到早期和晚期组织的进展过程中,丙氨酸、天冬氨酸和谷氨酸代谢以及精氨酸相关代谢通路受到干扰(图2G-I)。此外,d -谷氨酰胺和d -谷氨酸代谢、谷胱甘肽代谢、牛磺酸/丙酮酸和组氨酸相关代谢过程在ESCC肿瘤发生过程中明显紊乱(图2K)。
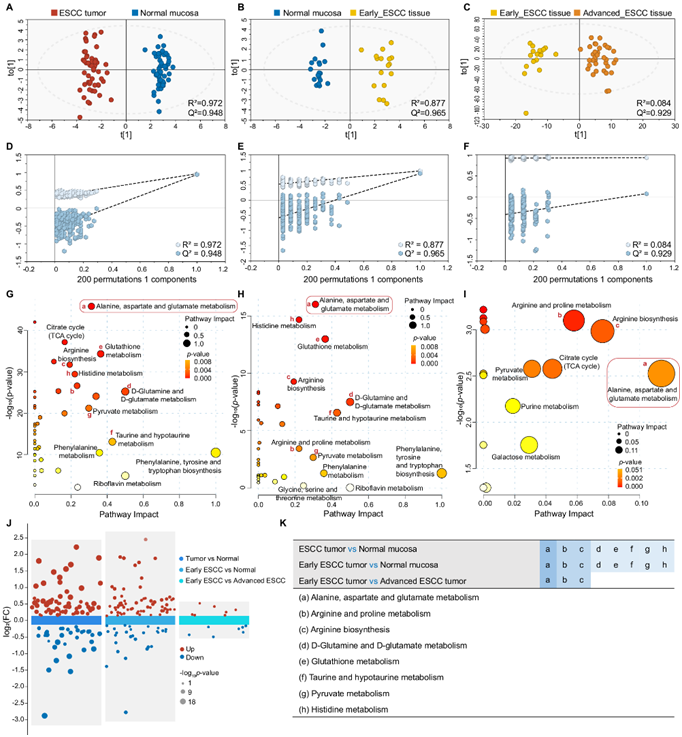
图2. 基于 NMR 的代谢组学显示 ESCC 患者的组织代谢组学景观。
(A-C) OPLS-DA 评分图基于不同阶段 ESCC 患者的1 H-NMR 组织光谱。(D-F) 通过排列分析(200 次)对相应模型进行统计验证。 (G-I) 代谢通路分析。 (J) 基于同一批样本的多火山图,显示不同组之间差异代谢物的比较。 (K) ESCC进化过程中主要代谢通路紊乱的统计分析。
02
对早期 ESCC 组织样本进行基于质谱的靶向定量分析
他们使用靶向定量 MS 来验证同一批早期 ESCC 组织的 NMR 结果。通过多反应监测 (MRM) 模式对 500 多种生化物质进行定量,包括通过液相色谱-串联质谱 (LC/MS-MS) 检测到的 13 类 544 种代谢物和通过气相色谱-串联质谱仪(GC/MS-MS)检测到的 11 种脂肪酸 (FA),涵盖在 NMR 中鉴定的大部分物质。他们从不同类别中鉴定出了 315 种差异代谢物(图 3A),并用火山图将它们可视化(图 3B)。对于跨 NMR 和靶向 MS 平台检测到的相同差异代谢物,观察到一致的表达趋势和显著通路(图 3C)。随机森林(RF)算法显示,谷氨酸是“丙氨酸、天冬氨酸和谷氨酸代谢”通路中的关键分子,是区分早期食管鳞癌和正常组织的最重要的代谢物。
为了检测早期食管鳞癌组织中独特的代谢生物标志物,他们通过整合 NMR 和 MS 数据矩阵构建了双向正交偏最小二乘 (O2PLS) 模型。然后,使用加载图(图 3D)确定了两个数据集中具有高相关性和权重的前 30 个代谢变量。结合组织内关键代谢通路的整体变化并综合考虑,他们确定了早期ESCC组织中癌症特异性的代谢生物标志物,包括2-羟基丁酸、3-羟基丁酸、3-羟基丙酸等。
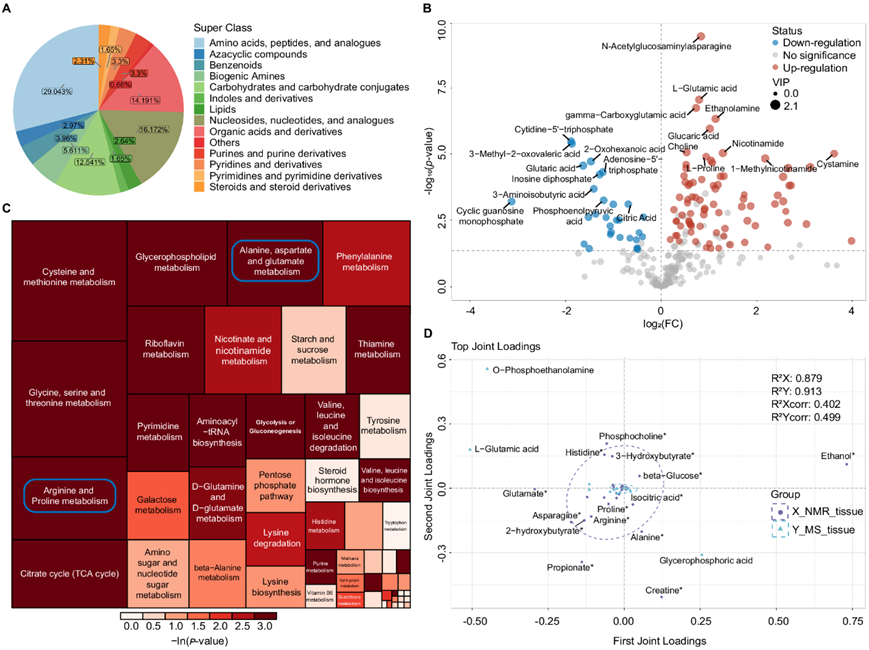
图3. 早期 ESCC 组织样本进行基于质谱的靶向定量分析,证实了 NMR 结果。
(a) 量化代谢物类别的饼图。(b) 对早期 ESCC 组织样本与正常对照进行火山图分析。(c) 早期 ESCC 组织样本中最富集的 KEGG 通路的树图。(d) 基于核磁共振和质谱的代谢组学分析了关键差异代谢物的O2PLS加载图。
03
生物液的代谢变化反映了食管鳞癌组织的特定变化
他们收集了 ESCC 患者术前和术后一周的血清和尿液样本,并通过 600 MHz NMR 波谱进行分析。使用 OPLS-DA 模型进行的两两比较显示,术前、术后和健康对照(HC)组之间的血清(图4A-C)和尿液(图 4G-I)谱存在显著差异。按照相同的组织分析筛选标准,他们确定了组间不同的血清和尿液代谢物,进一步进行了KEGG代谢通路富集分析(图4D-F, 图J-L),“丙氨酸、天冬氨酸和谷氨酸代谢”在生物体液中从荷瘤期到肿瘤切除期以及到健康状态的变化一致。
使用Mantel方法,他们发现组织代谢组与血清代谢组之间的相关性大于尿液代谢组,并且组织中的“丙氨酸、天冬氨酸和谷氨酸代谢”与生物体液代谢组的相关性比“精氨酸和脯氨酸代谢”更相关(图 4M-N)。进一步筛选后,血清特征(包括α -酮异戊酸、精氨酸、天冬酰胺等)和尿液特征(包括3-羟基丁酸、抗坏血酸、二甲胺等)与早期ESCC有关。
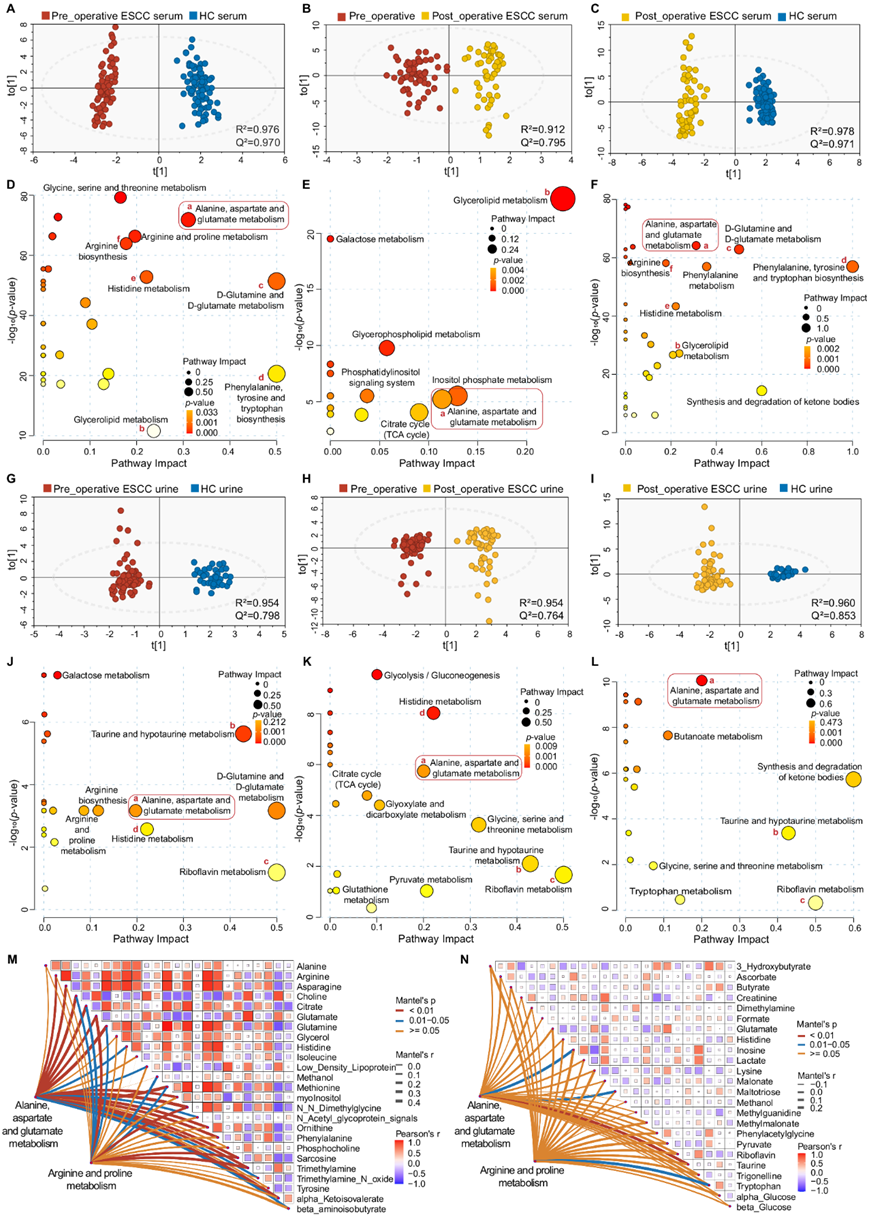
图4. ESCC患者手术前后血清和尿液代谢的变化。
(a-c) 各组间1H-NMR血清谱的OPLS-DA评分图。(D-F)ESCC患者血清的代谢通路分析。(G-I)各组间尿液的OPLS-DA评分图。(J-L) ESCC患者尿液中区别代谢物的代谢通路分析。(M-N) 早期 ESCC 患者组织代谢组和血清代谢组以及尿液代谢组之间的相关程度。
04
丙氨酸、天冬氨酸和谷氨酸代谢过程对于 ESCC 进展至关重要
加权基因共表达网络分析 (WGCNA) 用于探索早期 ESCC 的关键驱动代谢模块。为了比较早期 ESCC 组织和正常粘膜,他们将代谢物分为四个模块(图 5A)。有两个模块很重要:绿松石模块有 172 种代谢物,蓝色模块有 45 种代谢物。绿松石模块具有最高的权重,并且谷氨酸和天冬酰胺水平与特征代谢物水平最相关(图 5B)。Turquoise模块的功能富集分析显示了各种氨基酸代谢在驱动该模块中的作用(图 5C)。来自“丙氨酸、天冬氨酸和谷氨酸代谢”通路的关键分子确定为关键代谢物,与早期的KEGG代谢通路分析一致(图5D)。
为了进一步研究这一特征分子事件的复杂细节,他们使用TCGA-GTEx-ESCA数据集分析了相关代谢酶和转运蛋白的表达谱(图5E)。GLS(谷氨酰胺酶)、ASNS(天冬氨酸合成酶)、SLC1A5(溶质载体家族1成员5)和GPT2(谷氨酸-丙酮酸转氨酶2)表达水平的变化与涉及丙氨酸、天冬氨酸和谷氨酸代谢产物的14种代谢产物[包括2-氧-戊二酸、4-氨基丁酸(GABA)、柠檬酸、富马酸、L-丙氨酸、L-精氨酸-琥珀酸、L-天冬氨酸、L-天门冬氨酸、N-谷氨酰胺、N-乙酰基-L-天冬氨酸盐、N-氨基酰-L-天冬氨基酸、丙酮酸、琥珀酸]的变化一致(图5F)。

图4. WGCNA 分析、代谢酶表达的差异分析和关键代谢通路揭示了相关机制。
(a) 早期 ESCC 组织与正常粘膜:WGCNA 聚类树状图将差异代谢物分组为由树状图分支切割定义的不同代谢物模块(具有不同颜色)。(b) 早期 ESCC 组织与正常粘膜:散点图显示代谢物模块成员评分与性状之间的相关性。(c) 早期食管鳞癌组织与正常粘膜:绿松石模块中代谢物的功能富集分析。(d) 术前与术后血清组:唯一关键的 WGCNA 模块中针对 ESCC 患者食管切除术前后代谢变化的中心代谢物。(e) 丙氨酸、天冬氨酸和谷氨酸代谢通路中主要代谢酶的差异表达。(f) 丙氨酸、天冬氨酸和谷氨酸代谢通路的摘要。
05
血清和尿液生物标志物对ESCC早期诊断的验证
他们继续研究以验证 ESCC 生物流体生物标志物的诊断和预测能力。由于患者在临床实践中通常仅提供血液或尿液样本,因此他们分别分析了16个血清特征(图 6A,左图)和10个尿液特征(图 6A,右图) 。STAMP 分析显示 ESCC 和 HC 之间存在显著差异(图 6A-B)。受试者工作特征曲线(ROC)分析显示,大多数血清和尿液代谢物具有良好的诊断潜力,AUC高于0.80(图 6C-F)。血清生物标志物组在 70% 交叉验证 (CV) 下的 AUC 为 0.999,在 30% 保留数据下的 AUC 为 0.996,预测准确性为 0.996(图 6G-H)。尿液生物标志物组对于 70% CV 和 30% 保留数据的 AUC 均为 0.975,预测准确性为 0.909(图 6I-J)。任何五种代谢物都可以对 ESCC 实现良好的预测准确性(图 6K-M)。
他们建立了血清组(包括精氨酸、β -氨基异丁酸、谷氨酰胺、组氨酸、低密度脂蛋白)(图6L)和尿液组(包括3-羟基丁酸、二甲胺、丙二酸盐、对羟基苯基乙酸酯、牛磺酸)(图6N)分类模型,显示出良好的诊断能力。
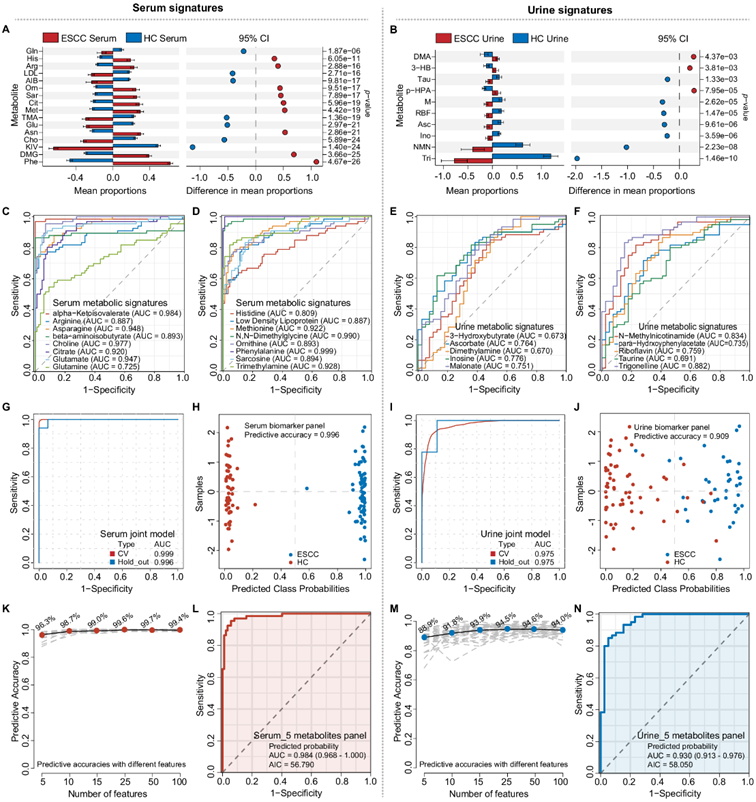
图5. 血清和尿液代谢物生物标志物的内部验证。
(a-B) STAMP分析显示ESCC组和HC组之间血清和尿液代谢物生物标志物的表达差异。(C-F) 16个血清和10个尿液代谢特征分别区分ESCC和HC的ROC曲线AUC。 (G-n) AUC 的最佳分类器预测每个样本的类别概率。
16种血清或10种尿液代谢物的任意5种组合都可以有效区分ESCC和HC,并且均优于常规临床标志物甚至其组合模型(图 7A),但是其诊断性能尿液特征稍逊于血清特征。
为了进一步评估生物流体分类器的跨实验室性能,他们比较了 ESCC 和结直肠癌(CRC)(一种常见的消化道肿瘤)之间的代谢差异,显示出两种癌症之间不同的代谢特征(图 7B)。此外,食管腺癌(EAC)、胃食管交界处腺癌(GEJ)、食管未分化癌和间质瘤等四种不同类型食管肿瘤的代谢谱与ESCC不同(图7D-E),进一步证实了ESCC独特的代谢组学特征。值得注意的是,在临床实践中,将早期ESCC与健康人群区分开来是一个巨大的挑战。因此,他们使用血清和尿液面板预测了18例新的早期ESCC病例(18份血清和18份尿液样本),准确率分别为0.994和0.879(图7F)。
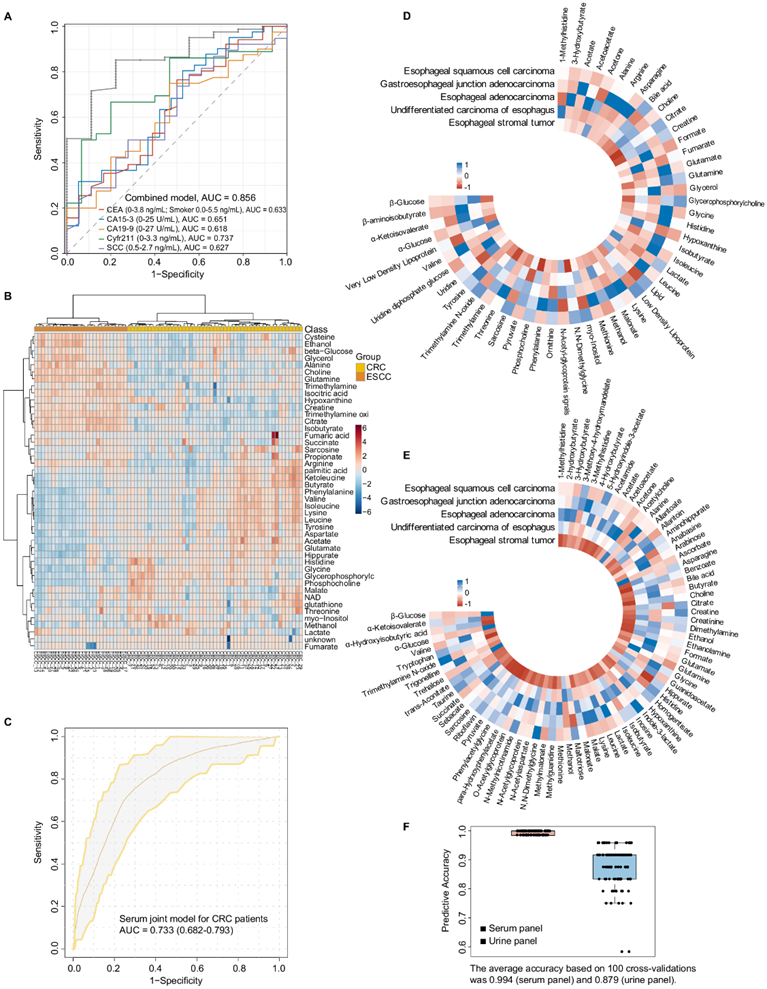
图7. 使用多中心数据对生物流体模型进行外部验证。
(a) 对临床常用的五种肿瘤生物标志物(CEA、CA15-3、CA19-9、Crfr211、SCC)进行 ROC 分析,区分 ESCC 和 HC。(b) 所有代谢物中 ESCC 和 CRC 组的无监督层次聚类。(c) ROC曲线显示血清联合模型对CRC患者的诊断效果较差。(d-e) Circos热图比较不同病理类型食管肿瘤的血清和尿液代谢谱。 (f) 基于 SVM 的分类器的性能通过 ROC 曲线进行检测,并通过 100 倍交叉验证进行评估。
+ + + + + + + + + + +
结 论
本项研究利用机器学习和 WGCNA,对来自三所医院 560 名参与者的 1153 个匹配的 ESCC 组织、正常粘膜、术前和术后一周的血清和尿液进行基于 NMR 和 MS 的代谢组学分析。事实证明,“丙氨酸、天冬氨酸和谷氨酸代谢”的异常在整个 ESCC 发展过程中普遍存在,并通过 NMR 和 MS 一致识别,并反映在发现和验证集中的 16 个血清和 10 个尿液代谢特征中。基于 NMR 的任意五种血清或尿液代谢物的简化组分类模型优于临床血清学肿瘤标志物诊断(AUC 分别 = 0.984 和 0.930),并且可以有效区分测试集中的早期 ESCC(血清准确度 = 0.994,尿液准确度 = 0.879) 。总的来说,基于 NMR 的生物流体筛查可以揭示 ESCC 的特征性代谢事件,并可用于早期检测。
+ + + + +



 English
English


