文献解读|Cell Rep(8.8):周围神经元激活塑造微生物组并改变肠道生理学
✦ +
+
论文ID
原名:Peripheral neuronal activation shapes the microbiome and alters gut physiology
译名:周围神经元激活塑造微生物组并改变肠道生理学
期刊:Cell Reports
影响因子:8.8
发表时间:2024.03.21
DOI号:10.1016/j.celrep.2024.113953
背 景
胃肠道(GI)由肠神经系统(ENS)的内在神经元以及中枢神经系统和外周神经节的外在神经元支配。胃肠道也含有多种微生物组,但 ENS 和微生物组之间的相互作用仍然知之甚少。
实验设计
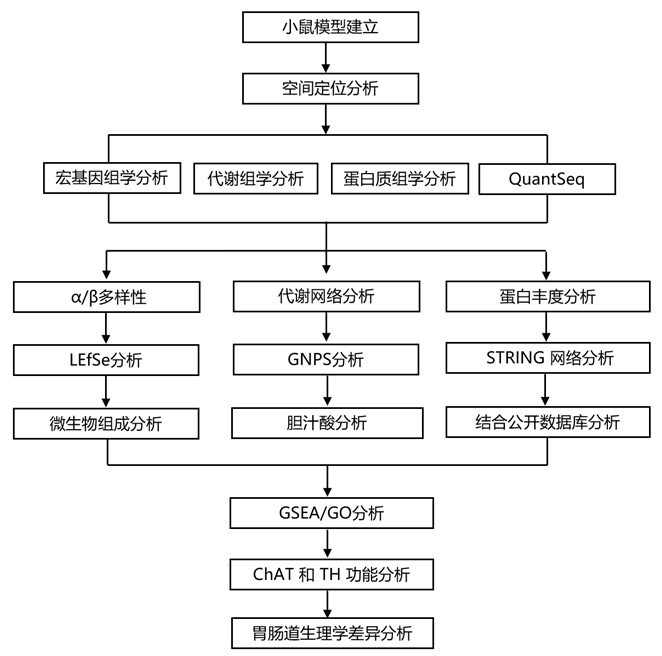
结 果
01
ENS 中ChAT+和 TH+神经元的独特空间定位
为了以更高分辨率绘制小鼠神经元图谱,研究团队使用重组腺相关病毒(AAV)来荧光标记体内肠神经元,并使用组织透明技术来增强完整胃肠道组织的可视化。PGP9.5,一种泛神经元蛋白,与小肠 (SI) 和结肠中病毒标记的神经元共定位(图 1 A)。
为了探索 ENS 的一般架构,他们通过单次静脉 (iv) 注射一组 AAV-PHP.S 包装多种荧光蛋白 (AAV-PHP.S-hSYN1-XFP) 来转导野生型小鼠,该蛋白广泛地标记肠道中的肠神经元,能够通过不同 XFP 组合随机转导产生的不同颜色来区分细胞(图 1 B)。有趣的是,近端结肠中的粘膜下神经元定位于组织中的自然褶皱区域(图1B)。
胆碱乙酰转移酶(ChAT)和酪氨酸羟化酶(TH)分别是乙酰胆碱和儿茶酚胺生物合成的限速酶,并且是大脑和外周神经传递的关键化学介质。为了可视化ChAT和TH神经元,他们使用了 Cre 重组酶 (Cre) 在相应基因启动子的控制下表达的小鼠品系,并使用转基因的工程化病毒构建体以双反方向 (DIO) 排列,以便转基因以 Cre 依赖性方式翻转和表达。用 AAV-PHP.S-hSYN1-DIO-XFP 转导 ChAT-Cre 或 TH-Cre 小鼠后,观察到这两种神经元群占据胃肠道的空间不同层,其中 ChAT +神经元主要位于肌间丛,而 TH +粘膜下神经丛中的神经元更加丰富(图 1 C)。在肌间神经丛的所有分析区域中ChAT +比 TH +神经元更多(图 1D)。相比之下,在 SI 中,TH +粘膜下神经元多于 ChAT +粘膜下神经元(图 1 E)。
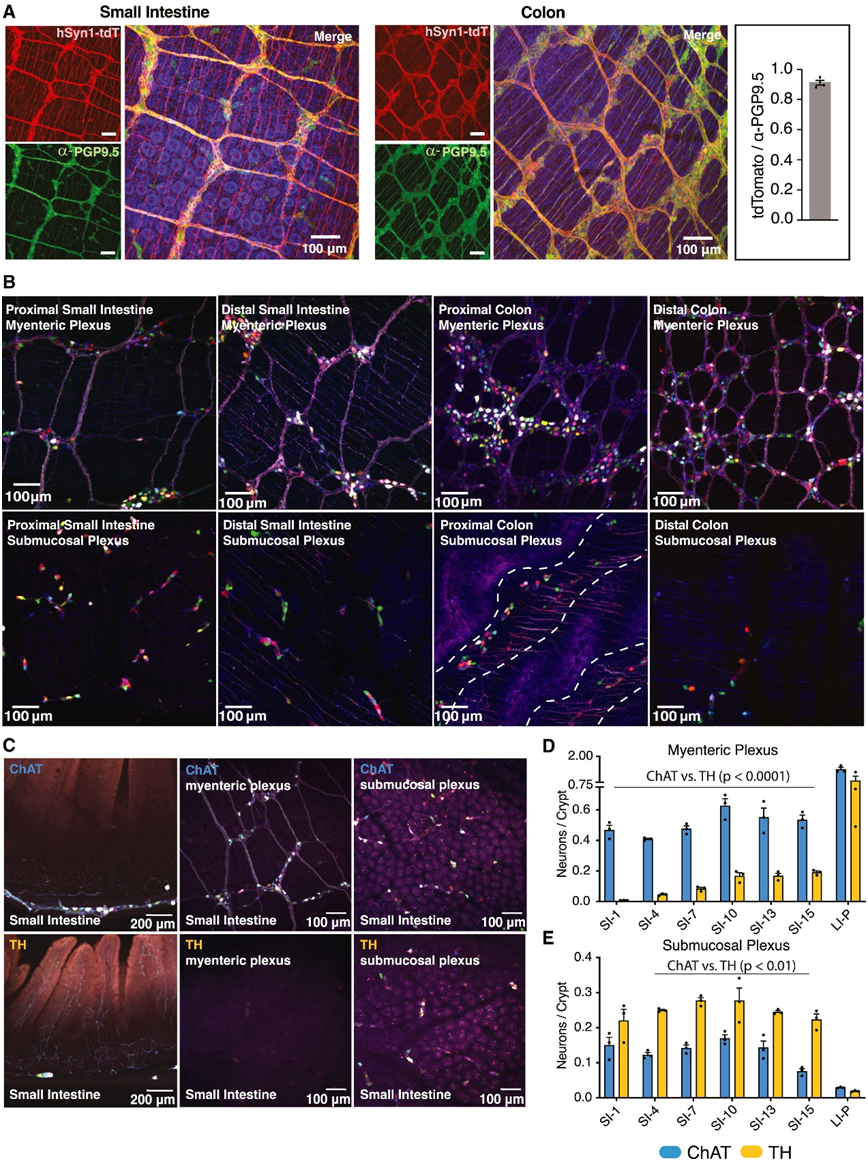
图1. ENS 中ChAT +与 TH +神经元分布。
(A) 感染 AAV-PHP.S-hSYN1-tdTomato 并用泛神经元抗体 PGP9.5 进行免疫标记的小鼠的 SI 和结肠的代表性图像。(B) AAV-PHP.S-hSYN1-XFP 感染小鼠的 SI 和结肠近端和远端区域的代表性图像。(C) 感染 AAV-PHP.S-hSYN1-DIO-XFP 的 ChAT-Cre 和 TH-Cre 小鼠的横截面以及肌间和粘膜下神经丛的代表性图像。(D-E) ChAT-Cre 和 TH-Cre 小鼠肌间神经丛和粘膜下神经丛中神经元的密度。
02
肠道相关神经元的激活重塑肠道微生物群
对于细胞特异性神经元激活,他们采用了一种 Cre 依赖性基因构建体,编码仅由设计药物 (DREADD) 激活的激活设计受体,称为 hM3Dq[它是一种修饰的神经递质受体,设计用于在暴露于化合物 21 (C21) (一种针对该受体的“设计药物”)时诱导神经元激活]。他们推断,肠道中的神经元激活可能会影响肠道微生物组的组成和群落结构。因此,他们在ChAT-Cre或TH-Cre小鼠上转导了具有激活型DREADD (AAV-PHP.S-hSYN1-DIO-hM3Dq-mRuby2)的病毒或仅表达荧光报告蛋白(AAV-PHP.S-hSYN1-DIO-mRuby2)的对照病毒。对C21激活ChAT+/TH+神经元前后(C21给药的第2、6和10天)以及收集的盲肠末端内容物的纵向粪便样本进行了宏基因组学分析(图2A)。在ChAT+激活的小鼠中,Faith的系统发育多样性(即α多样性)在第10天的粪便和盲肠样本中急剧下降(图2B),许多微生物类群的数量减少(图2I-K)。使用加权UniFrac距离和主坐标分析(PCoA)来确定微生物群落的组成(即β多样性),他们观察到在粪便和盲肠内容物中,ChAT+ 激活组和对照组之间存在差异,而TH+激活的小鼠和对照小鼠的样本中没有这种变化(图2C-H)。在实验过程中,疣微菌门在ChAT+激活的小鼠中显著富集(图2I)。
为了探索差异丰度的细菌分类群,他们使用线性判别分析效应大小(LEfSe),并生成描述差异丰度分类群系统发育关系的分支图(图2J-M)。这一分析表明,细菌种类Akkermansia muciniphila驱动了在ChAT+激活小鼠中的Verrucomicrobia的增加(图2N-O)。
除了鉴定微生物物种外,宏基因组分析还可以揭示微生物组中差异富集的基因家族和途径。ChAT+激活的小鼠,其基因家族和途径的多样性都发生了变化,在激活后9天的盲肠内容物和收集的粪便中都发生了明显的变化(图2P-S)。最显著的特征在ChAT+激活小鼠中下调,主要与细菌过程相关,如核苷酸生物合成和代谢以及蛋白质翻译和运输(图2P-S),这种下调与细菌α多样性的减少是一致的。
这些结果表明神经元激活在群落、物种和遗传水平上积极重塑肠道微生物群,而ChAT+和TH+神经元的作用存在相当大的差异。

图2. 肠道相关 ChAT +和 TH +神经元激活改变肠道微生物组。
(A) 实验流程。(B) 10天神经元激活后粪便和盲肠内容物的系统发育多样性。(C-H) ChAT+和TH+小鼠活化与对照的加权UniFrac主坐标分析(PCoA)。(I) 堆积条形图,显示粪便注射第 6 天和第 10 天以及盲肠内容物注射第 10 天相对丰度的门水平变化。(J–M) 盲肠微生物组的线性判别分析效应大小 (LEfSe)。(N-O) ChAT +和TH +小鼠的粪便和盲肠内容物中A. muciniphila相对丰度的变化。(P–S) 对照和激活小鼠的盲肠和粪便中细菌基因家族和通路的 β多样性。
03
神经元刺激影响肠道代谢组
鉴于小鼠和微生物密切且相互交织的共代谢,他们观察到的微生物宏基因组对神经元激活的反应发生了变化,这提示肠道代谢物的概况也可能发生变化。因此,他们进行了非靶向代谢组学分析,以检测肠道神经元激活后盲肠内容物和粪便的分子变化。在 ChAT +-和 TH +-激活的神经元中,与未激活的对照(无 DREADD)相比,在最后一次 C21 注射后 1 小时采集的盲肠样本中观察到代谢组谱的强烈分离(图 3 A-B)。因此,ChAT+和 TH+肠道相关神经元的靶向激活似乎强烈影响肠道代谢组。
他们应用了整体天然产物社会分子网络(GNPS)工具,揭示了ChAT+ 激活和TH+激活小鼠盲肠内容物中注释和未注释分子的代谢网络(图3C-D),能够识别对照和激活样品之间丰度差异的代谢物。TH+神经元的激活强烈增加了与亚油酸(ID: 626)、齐墩果酸甲酯(ID: 378)和coproporphyrin I (ID: 739) 光谱最接近的代谢物。与黄嘌呤(ID: 259)、染料木素(ID: 846)和反式阿魏酸(ID: 707)相似的代谢物在TH+神经元激活后减少。在ChAT+激活和TH+激活的小鼠中,分子网络主要由属于胆汁酸分子家族的化合物(图3C-D)。初级胆汁酸是由宿主(小鼠)胆固醇生物合成产生的化学物质,随后由肠道细菌共同代谢为次级胆汁酸。与初级胆汁酸胆酸(id: 108、114、215、219、221、224和259)最接近的代谢物在ChAT+激活小鼠的盲肠中显著富集(图3D-F)。光谱上类似牛磺酸共轭初级胆汁酸的其他代谢物,如牛磺酸胆酸(ID: 234和248)和牛磺酸胆酸(ID: 235),呈上升趋势。相反,与次级胆汁酸和胆汁酸代谢物光谱相匹配的特征,如熊去氧胆酸(ID: 13)、去氧胆酸(ID: 100)、β -羟基去氧胆酸(ID: 1和143)和12-酮去氧胆酸(ID: 19和138)在ChAT+激活小鼠中减少(图3D-F)。这些数据表明,ChAT+神经元的激活可能直接或间接地调节初级胆汁酸分泌和/或次级胆汁酸的代谢,这与许多代谢和免疫功能有关。
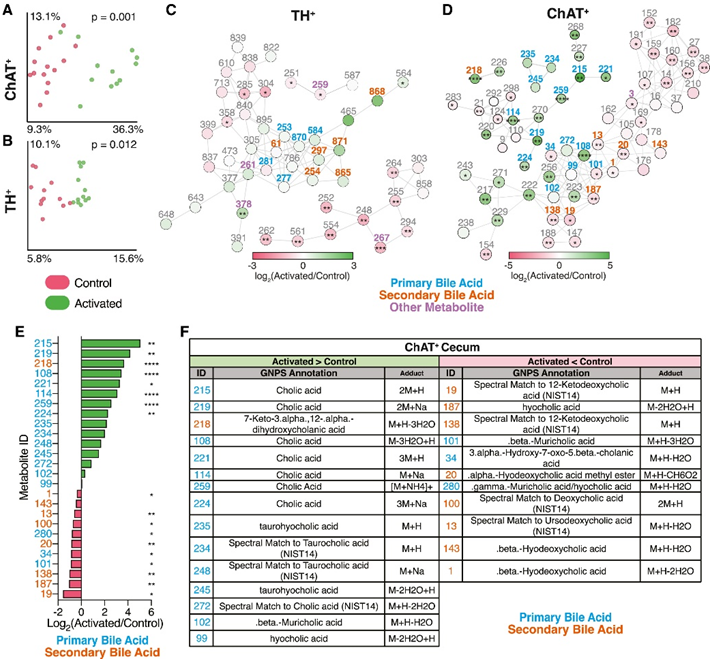
图3. 肠道相关 ChAT +或 TH +神经元激活改变宿主和微生物来源的代谢物。
(A-B)对照和激活的ChAT+和TH+小鼠的无细胞盲肠内容物的PCoA、代谢组分析。(C-D) 由 TH+和 ChAT +小鼠中已鉴定的盲肠代谢物构建的代谢网络。(E) 在激活的 ChAT +小鼠中,确定为上调(绿色条)或下调(红色条)的特定胆汁酸的差异倍数(FC)。(F)突出显示的胆汁酸注释。
04
神经元亚群不同地塑造肠道蛋白质组
来自小鼠、肠道微生物和饮食的蛋白质在胃肠道中汇聚并相互作用。他们通过LC-MS/MS对在C21最终治疗后1小时收集的ChAT+激活和TH+激活小鼠和对照组盲肠内容物的无细胞上清进行了蛋白质组学分析(图2A)。与在ChAT+激活小鼠中观察到的盲肠胆汁酸代谢物增加一致,他们报告了这些小鼠盲肠中Niemann-Pick c1样1蛋白(NPC1L1)的丰度增加(图4A)。NPC1L1在肠细胞的顶端表面表达,并且在从肠腔中吸收游离胆固醇(胆汁酸的前体)方面起着重要作用,特别是Mucin-19 (MUC19)和Zymogen颗粒16 (ZG16)(一种定位于分泌颗粒的蛋白),在ChAT+ 神经元激活后也呈上升趋势(图4A)。相反,其中一个高度下调的蛋白是由Aldh9a1基因编码的醛脱氢酶(Q3U367),该酶参与催化腐胺转化为γ-氨基丁酸(GABA)。虽然GABA是中枢神经系统中主要的抑制性神经递质,但对其在中枢神经系统中的作用知之甚少。ChAT+激活小鼠盲肠内容物中最显著上调的蛋白质是胰腺消化酶,包括乳糜蛋白酶(CTRL)、乳糜胰蛋白酶原B1 (CTRB1)和胰腺脂肪酶相关蛋白2 (PNLIPRP2)(图4A)。因此,上调蛋白的网络分析显示,与消化相关的KEGG通路占网络的大部分(图4B)。这与胆碱能的内脏神经元从胃肠道向消化系统的其他器官(包括胰腺)发送信号的证据是一致的。胰腺胆碱能神经支配在调节胰腺功能,如消化酶分泌、胰岛素释放等方面起着重要作用。
TH+ 肠道相关神经元的外周激活也改变了盲肠的腔内蛋白质组。值得注意的是,88%的差异富集蛋白与ChAT+激活小鼠中鉴定的蛋白不同。这种效应的总体方向也发生逆转:在TH+激活的小鼠中,约90%差异富集的盲肠蛋白发生上调,而在ChAT+激活的小鼠中,这一比例为约18%,这表明不同神经元亚群的激活与GI功能的相反变化有关。他们观察到TH+激活小鼠盲肠内容物中蛋白质-蛋白质相互作用增加的特征,证明了更多的网络节点和连接(图4D)。
丝状蛋白B (FLNB)和谱蛋白β链,非红细胞1 (SPTBN1)是TH+神经元激活后最显著富集的两种蛋白(图4C)。两者都与肠刷状缘和膜囊泡相关。因此,外壳蛋白也呈上升趋势(COPA 和 COPB2)(图 4C),囊泡介导的运输是改变的主要蛋白质网络之一(图 4D)。其他上调的蛋白质相互作用网络与代谢途径、核糖体活性和免疫系统相关(图 4D)。例如,免疫相关蛋白免疫球蛋白重链常数α (IGHA)(在 ChAT +激活中)、免疫球蛋白重链常数 γ 2C (IGHG2C) 和补体成分 3(在 TH +激活中)呈上升趋势(图 4 A-C)。
也许最有趣的观察是 TH+神经元激活后酸性哺乳动物几丁质酶 (CHIA) 的强烈消耗(图 4 C)。壳多糖是一种天然多糖,是真菌细胞壁的主要成分,但对小鼠肠道壳多糖酶的研究却很少。这一结果促使他们针对微生物蛋白质数据库查询泛蛋白质组数据集,结果表明 TH+神经元激活后 CHIA 丰度的减少,且伴随着微生物组中真菌相关肽的大量增加(图 4 E)。相比之下,真菌肽仅占 ChAT +激活小鼠管腔中富集肽的约 0.4%(图 4F)。
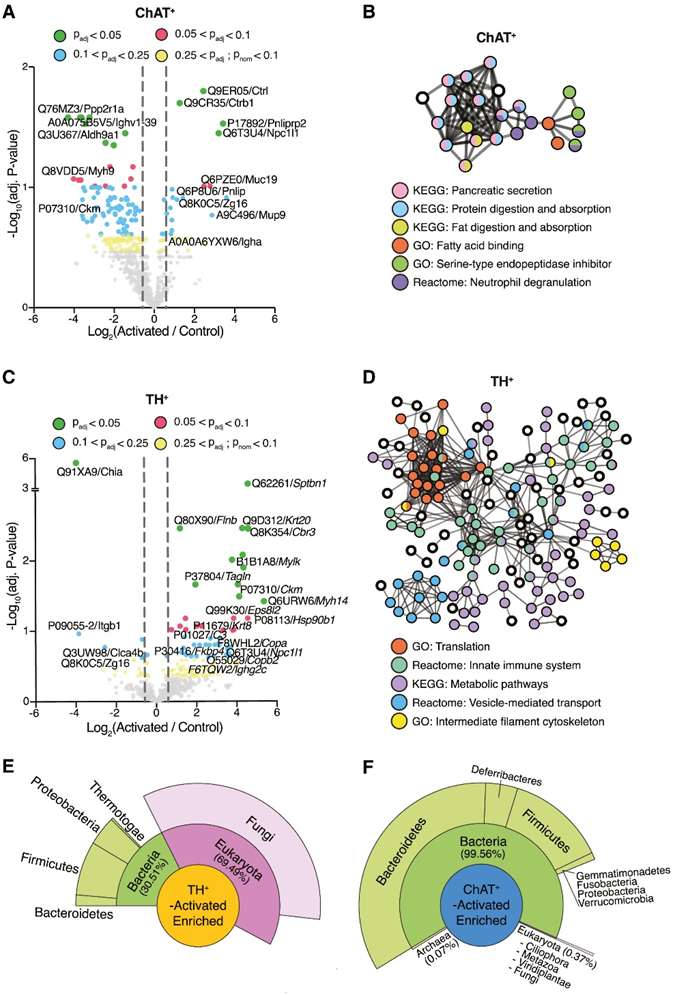
图4. 肠道相关 ChAT+或 TH +神经元激活改变宿主和微生物来源的管腔蛋白。
(A)差异表达宿主蛋白的火山图。(B) 宿主蛋白的 STRING 网络分析。(C)蛋白质组学火山图。(D)上调宿主蛋白的 STRING 网络分析。(E-F)上调的Unipept宏蛋白质组学分析。
05
ChAT +和 TH +神经元的激活改变肠道转录组
接下来,他们使用 QuantSeq(一种定量 3' mRNA 测序技术)对最后一次 C21 注射后 1 小时收获的远端 SI 和近端结肠的 1 cm 组织中的基因表达进行了分析。即时早期基因(IEG)的快速和瞬时表达广泛用作神经元活动增加的衡量标准,他们在ChAT+和TH+激活小鼠的SI和结肠中发现的IEG Fos、Egr1、Jun和Klf2是最显著上调的转录本(图5A-D)。在高活性细胞类型(如免疫细胞、平滑肌细胞和肠上皮细胞)的生长和分化过程中,这些ieg也发生上调。在远端SI中,他们发现了ChAT+ 激活小鼠和 TH+ 激活小鼠具有相似数量的差异表达基因(DEG)(图5A-C)。然而,调控方向不同,约73%的deg在ChAT+激活时上调,约58%的deg在TH+激活时下调。在ChAT+激活小鼠的远端SI中有29个DEG上调,而在TH+激活小鼠中只有2个DEG上调(图5E), 3个DEG下调(Hbegf、Soca3和Mcl1)(图5C)。ChAT+激活小鼠(169个上调,84个下调)和TH+激活小鼠(130个上调,62个下调)近端结肠中deg的上调比例相似(图5B-D)。
为了深入了解DEG的细胞功能,他们使用了基因集富集分析(GSEA)(图5F-I)。值得注意的是,在ChAT+激活小鼠的远端SI中,最富集的途径是“平滑肌细胞增殖的调节”,而在TH+激活小鼠中,最富集的途径是“对细菌的反应”,这与蛋白质组学数据集显示的免疫相关反应的增加一致(图5F-H)。在近端结肠中,他们在ChAT+激活和TH+激活的小鼠中观察到类似的途径(图5G-I),这表明转录组特征可能取决于激活神经元的背景。
在肌间神经丛和粘膜下神经丛中,他们发现 ChAT +神经元激活上调的通路比 TH+神经元更广泛,ChAT +神经元激活影响胃肠道中的多种细胞功能,包括内皮细胞、上皮细胞、免疫细胞和脂肪细胞(图5G)。
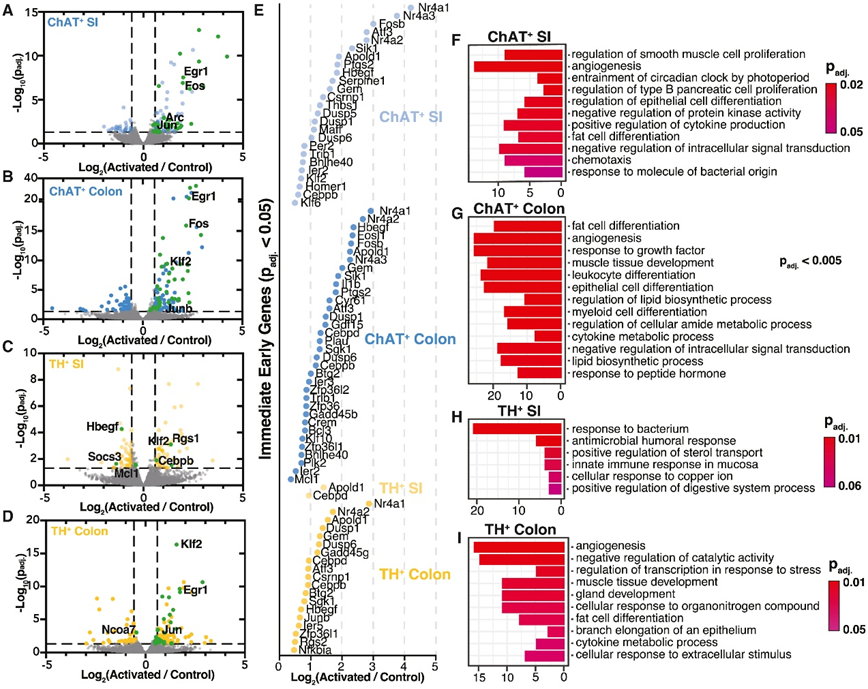
图5. ChAT +和TH +激活介导的转录组变化。
(a-D)差异表达基因分析。(E) 上调 IEG 的 FC。(F–I) GO分析。
06
ChAT +和 TH +神经元激活的不同功能性胃肠道结果
与对照小鼠相比,ChAT+或 TH+肠道相关神经元的激活导致全肠转运时间加快、粪便颗粒输出增加和盲肠内容物质量增加(图6A-C)。ChAT +激活但 TH +激活小鼠的粪便颗粒含水量增加(图6D-F)。为了进一步研究缺乏外源性神经支配的肠道运动,他们分析了离体系统中的推进性结肠迁移运动复合物(CMMC)。C21激活ChAT+神经元导致运动复合物迁移更频繁,而激活TH+神经元对cmmc没有影响(图6G-J)。
总之,这些数据表明,肠道中的ChAT+神经元介导肠液平衡和离体结肠运动。
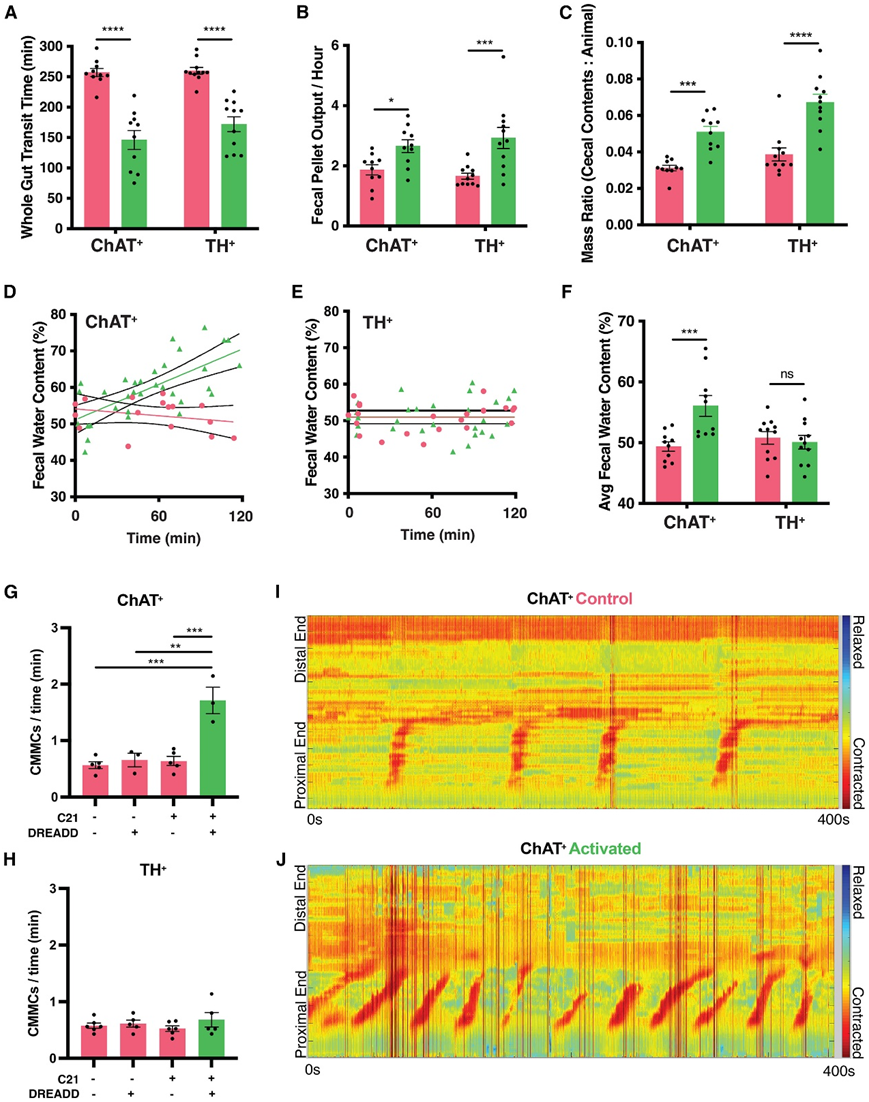
图6. ChAT +与 TH +小鼠激活后胃肠道生理学差异。
(A)全肠转运时间变化。(B) 小鼠中粪便颗粒输出的激活介导的变化。(C)小鼠中标准化盲肠内容物质量的激活介导的变化。(D-E)小鼠的粪便颗粒水含量。(F)小鼠的平均粪便颗粒水含量。(G-H)小鼠的离体CMMC频率。(I-J) 热图显示CMMC 的频率。
+ + + + + + + + + + +
结 论
本项研究激活小鼠中表达ChAT和表达TH的肠道相关神经元,以确定对肠道微生物群落及其代谢物以及宿主生理学的影响。由此产生的多组学数据集证明了离散周围神经元亚型在塑造微生物组结构中的广泛作用,包括调节胆汁酸谱和真菌定植。从生理学角度来看,ChAT +或 TH +神经元的激活会增加粪便排出量,而仅 ChAT+激活会导致结肠收缩力增加和腹泻样液体分泌。这些发现表明,外周激活神经元的特定子集在不涉及大脑信号的情况下,差异性地调节小鼠的肠道微生物组和胃肠道生理学。
+ + + + +



 English
English


