文献解读|Cancer Cell(48.8):时空单细胞分析揭示结直肠癌免疫治疗不同反应的细胞动态
✦ +
+
论文ID
原名:Spatiotemporal single-cell analysis decodes cellular dynamics underlying different responses to immunotherapy in colorectal cancer
译名:时空单细胞分析揭示结直肠癌免疫治疗不同反应的细胞动态
期刊:Cancer Cell
影响因子:48.8
发表时间:2024.07.08
DOI号:10.1016/j.ccell.2024.06.009
背 景
有效的免疫检查点阻断 (ICB) 治疗人类癌症可引发以 T 细胞为中心的有效抗肿瘤反应,并伴随局部肿瘤微环境(TME)的重塑以及全身免疫的改变。越来越多的结直肠癌 (CRC) 临床试验证明 ICB 具有显著的成功率,特别是对于微卫星不稳定 (MSI) 或错配修复 (MMR) 缺陷的患者。大多数 CRC 患者都具有微卫星稳定 (MSS) 表型,虽然 MSI-high 是广泛采用的 ICB 反应性预测生物标志物,并非所有 MSI-high患者都会出现持久的反应。因此,全面了解 ICB 治疗下的细胞和分子动力学将有助于制定新的临床策略,使更广泛的 CRC 患者受益。
实验设计
结 果
01
PD-1 阻断后人类 CRC 的动态单细胞跨组织景观
研究团队追踪了接受系统性抗 PD-1 免疫治疗及必要时随后手术的患者的整个治疗过程(图 1 A),共纳入 20 名 CRC 患者和另外 2 名十二指肠癌患者。除 P02 外,所有患者均接受了新辅助免疫治疗,而对于无法切除的转移性 CRC 的 P02,仅二线免疫治疗可行。治疗后获得了所有患者临床反应的综合评估,以肿瘤大小消退程度和临床反应水平为特征(图1B-C)。肿瘤消退是一个连续变量,表示治疗期间肿瘤大小的相对减少。临床上,本研究的队列包括“病情稳定”的无反应者(SD)以及进一步分级为“完全反应”(CR)或“部分反应”(PR)的患者(图 1B-C)。P02 归类为 SD,但在随访期间死亡。到目前为止,除P02以外的其他患者都还活着,P01 显示生存期超过 4 年。在反应者中没有报告复发病例,表明他们的反应持续了很长时间。值得注意的是,两名 MSS 患者达到 CR(P01 和 P09),六名 MSI 患者仍然为 PR(P15、P17、P19 和 P24)或甚至对 PD-1 阻断不敏感(P16 和 P25)。
为了全面分析局部和全身动态,他们同时采集了肿瘤结肠镜检查/手术活检伴随的外周血和邻近正常组织样本(图 1 D)。对新鲜采集的样本进行配对单细胞转录组分析(scRNA-seq)和单细胞 TCR 测序(scTCR-seq)。无监督聚类结合典型标记物注释揭示了六种主要细胞类型:T 细胞、B 细胞、先天淋巴细胞 (ILC)、髓细胞、基质细胞和上皮细胞(图 1 E)。在肿瘤中,他们观察到四种主要免疫细胞类型的不同反应关联。在基线时,反应组(CR 和 PR 组)表现出比无反应组(SD 组)更高的肿瘤 T 细胞浸润水平(图 1 F),表明基线反应者的 T 细胞免疫反应更强。值得注意的是,两名经历显著肿瘤消退并达到 CR 的 MSS 患者(与其他患者相比)表现出相对较高的 T 细胞比例。P01 的特征是POLE突变,而 P09 没有任何 DNA 修复缺陷,并且具有 4.75/Mb 的低肿瘤突变负担 (TMB),这些发现表明 T 细胞浸润水平可以预测治疗效果。
接下来,他们研究了 PD-1 阻断后肿瘤组织内主要免疫细胞类型的动态(图1F)。具体而言,髓系细胞的丰度在 SD 肿瘤中表现出独特的升高。对于 B 细胞和 T 细胞,在完全反应者和部分反应者之间观察到了不同的丰度偏差。在 PD-1 阻断后,CR 肿瘤中的 T 细胞比例下降,PR 肿瘤中的 T 细胞比例上升,而 B 细胞则呈现相反的趋势。总之,这些结果不仅证明了反应者和无反应者之间存在固有的细胞异质性,而且在反应性患者中也存在这种细胞异质性。

图1. CRC 患者新辅助抗 PD-1 治疗期间的动态单细胞图谱。
(A) 对接受新辅助抗 PD-1 治疗的 22 例患者进行动态追踪。(B) 入组患者的临床特征。(C) 样本的代表性磁共振成像(MRI) 图像。(D) 实验设计概述(上)和分析方法概述(下)。(E) UMAP可视化。(F) 箱线图显示肿瘤组织中 T 细胞的基线比例(左)和时间动态(右)。
02
肿瘤生态系统中的协调细胞程序
对于每种组织富集的细粒度细胞类型,他们使用了基于线性回归的预测指数 (Pi) 和治疗指数 (Ti)衡量基线细胞丰度和细胞动力学的反应关联。正Pi 或 Ti 值分别表示较高的基线比例或较大的动态变化与有利的反应相关。绝对值越大意味着与肿瘤消退的关联越强。令人惊讶的是,他们观察到抗 PD-1 治疗后多种细胞类型的协同动态(图 2 A)。在几种富含肿瘤的细胞类型中,包括 Tex (c23_CD8_Tex_LAYN)、4-1BB + Treg (c13_CD4_Treg_TNFRSF9)和 c70_Endo_COL4A1,他们发现丰度减少与有效治疗相关(这通过它们的负 Ti 值表现出来)。而那些正常富集的细胞,包括 c05_CD4_Tcm_GPR183 和 IgA 浆细胞 (c46_PlasmaB_IGHA1),则显示出相反的趋势(图 2 A)。
他们在肿瘤样本中识别出五个细胞程序(NMF1-5)(图 2 B)。NMF2由滤泡辅助性T细胞(c08_CD4_Tfh_IL6ST)、生发中心B细胞(c44_GCB_MKI67)、幼稚T细胞(c16_CD8_Tn_SELL)和B细胞(c40_NaiveB_IGHD)组成,与三级淋巴结构(TLS)有关,因此他们将其称为“TLS样程序”。
多种正常富集细胞类型,包括 c21_CD8_Trm_XCL1、c18_CD8_Tcm_ANXA1、各种成纤维细胞和内皮细胞亚型以及 IgA 浆细胞,在 NMF5 中富集,因此将其称为“组织重建程序”,可能代表恢复后重新建立的正常组织样微环境。最后,他们将NMF4 称为“肿瘤富集程序”,因为其聚集了多种肿瘤富集细胞类型,例如 Tex (c23)、4-1BB + Treg (c13)、Th17 (c07_CD4_Th17_CTSH)、LAMP3 + DC (c60_cDC_LAMP3) 和 IgG +血浆 B (c47_PlasmaB_IGHG1) 细胞。
接下来,他们检测了这些细胞程序是否与治疗效果有关,为每个细胞程序分配了一个相应的活性分数。类似于细胞类型动态,可以通过计算基线和治疗后肿瘤样本之间的活性分数差异来评估每个程序的活性动态。值得注意的是,在不同反应状态的患者中出现了这些程序的不同模式(图 2 C-D)。
对于 TLS 样程序,反应者在治疗后显示出活性的优先增加。他们使用多重免疫荧光染色分析证实了 17 名反应者的TLS 样程序的特异性增加,发现 CR 和 PR 患者在治疗后表现出 TLS 面积和计数增加(图 2 E-F)。然而,CR 和 PR 肿瘤在组织重建程序和肿瘤富集程序中表现出不同的动态。治疗后,在 CR 肿瘤中观察到较强的组织重建程序信号,而肿瘤富集程序信号较弱。相比之下,PD-1 阻断对 PR 肿瘤的这两个程序产生了相反的影响,对每位患者这三个程序的时间跟踪表明了相似的发现(图 2D)。
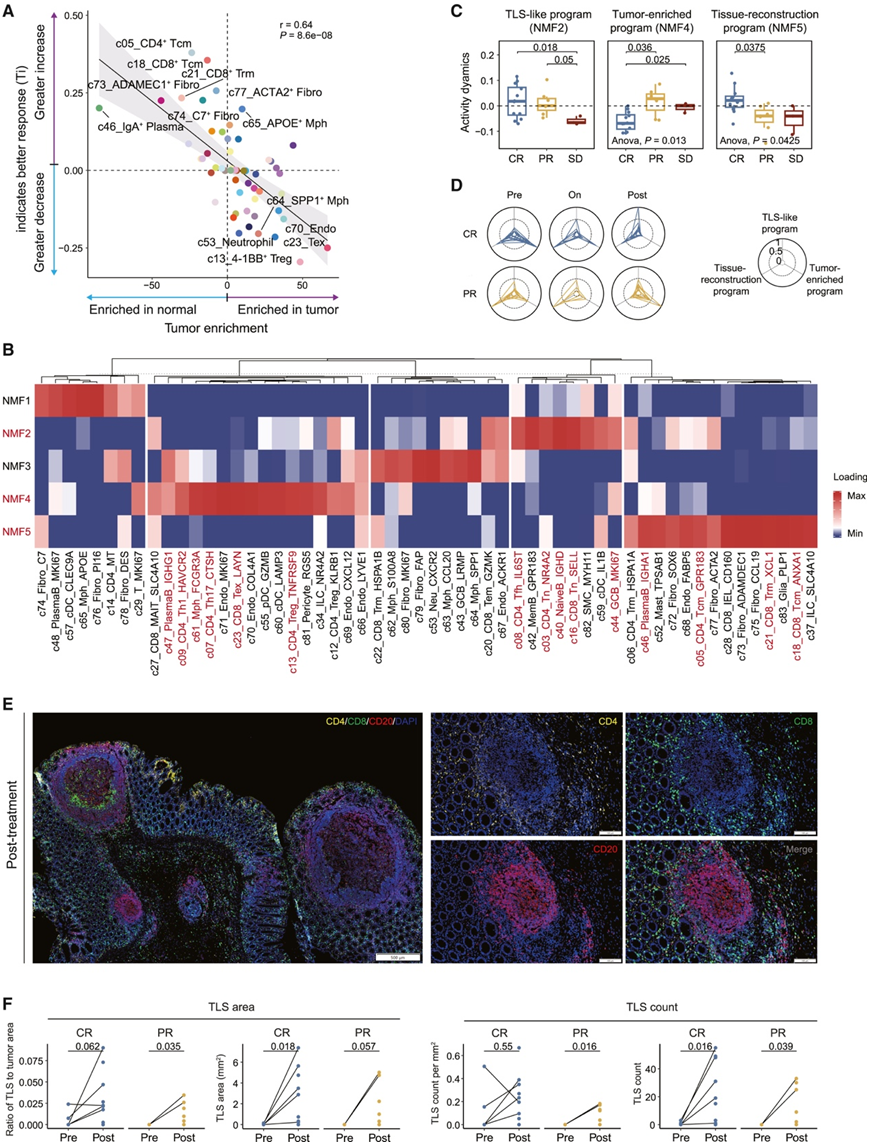
图2. TME 细胞程序表现出与响应性的不同关联。
(A) 散点图显示每种细胞类型的 Ti 和组织富集。(B) TME 中基于 NMF 的细胞程序。(C) 箱线图显示肿瘤中三个选定细胞程序的活性动态。(D) 雷达图显示不同治疗阶段每位有反应的患者所选程序的活性情况。(E) TLS 的代表性多重免疫荧光染色。(F) 折线图显示肿瘤样本中 TLS 的面积(左)和计数(右)。
03
肿瘤中耗竭 CD8+ T 细胞的反应关联
在 CR 和 PR 组之间观察到的不同动态模式促使他们进一步研究与治疗期间不同的抗肿瘤过程相关的关键细胞类型。他们主要关注肿瘤富集程序 (NMF4)。在所有 TME 细胞类型中,Tex (c23)、内皮细胞 (c71、c70) 和 Th17 (c07) 细胞在此程序中表现出最高负荷,表明这些细胞类型在定义 NMF4 方面有显著贡献。
在所有肿瘤微环境(TME)细胞类型中,Tex (c23)、内皮细胞 (c71、c70) 和 Th17 (c07) 细胞在该程序中显示出最高负荷,表明这些细胞类型在定义NMF4方面具有显著贡献。此外,对于肿瘤富集程序中的每种细胞类型,他们基于其在治疗过程中在肿瘤组织内的频率变化训练了分类器模型,以区分CR和PR患者。值得注意的是,Tex细胞表现出最高的曲线下面积(AUC)值,其次是pDC细胞(c55)和周细胞(c81)。这一发现与Tex细胞动态与治疗效果之间的强相关性一致(图2A)。考虑到Tex细胞表达了PDCD1和其他与衰竭相关的基因,包括LAYN、ENTPD1和HAVCR2(图3A),他们随后将研究重点缩小到这一细胞群体。肿瘤浸润的Tex细胞的临床相关性进一步评估不仅包括它们在所有CD8+ T细胞中的比例,还包括克隆扩增程度。基线时,CR肿瘤中浸润的Tex细胞在CD8+ T细胞中的比例高于反应较弱的细胞(图3B),这与基线时CR患者的CD8+ T细胞中T细胞耗竭相关基因的表达较高一致。此外,基线肿瘤中Tex的患病率和克隆扩增程度均与肿瘤消退相关。值得注意的是,4例MSI PR患者的Tex细胞丰度与其他PR患者一致。在所有CR患者中,MSS CR患者P09在基线时表现出最强的Tex扩增(图3D)。
接下来,他们试图研究给药后 Tex 细胞的时间动态。虽然在治疗后的 SD 肿瘤中检测到与基线的最小丰度偏差(图 3 E),但观察到 CR 和 PR 组之间的不同模式(图 3 E-F)。在 CR 肿瘤中,治疗后 Tex 细胞通常表现出丰度降低以及克隆扩增水平降低。然而,患者之间仍然存在异质性动态。在 P20 的治疗过程中,Tex 丰度经历了急剧上升,随后大幅下降,最终水平仍然高于基线(图 3 E)。值得注意的是,在其他几名 CR 患者中也观察到了不同程度的类似波动,这可能反映出在初始给药后迅速引发强烈的基于 Tex 的抗肿瘤免疫反应,然后随着肿瘤的有效根除而消退。对于大多数 PR 肿瘤,在 Tex 细胞中发现了显著的频率增加,并伴有强烈的克隆扩增程度(图 3E-F),表明治疗诱导的免疫刺激成功。
基线 Tex 比例高的响应性肿瘤在 PD-1 阻断后其比例下降,而基线比例低的响应性肿瘤在 PD-1 阻断后其比例急剧上升(图 3G)。进一步重新分析 NSCLC 队列中的 TCR 信息发现克隆扩增的类似趋势(图 3H)。
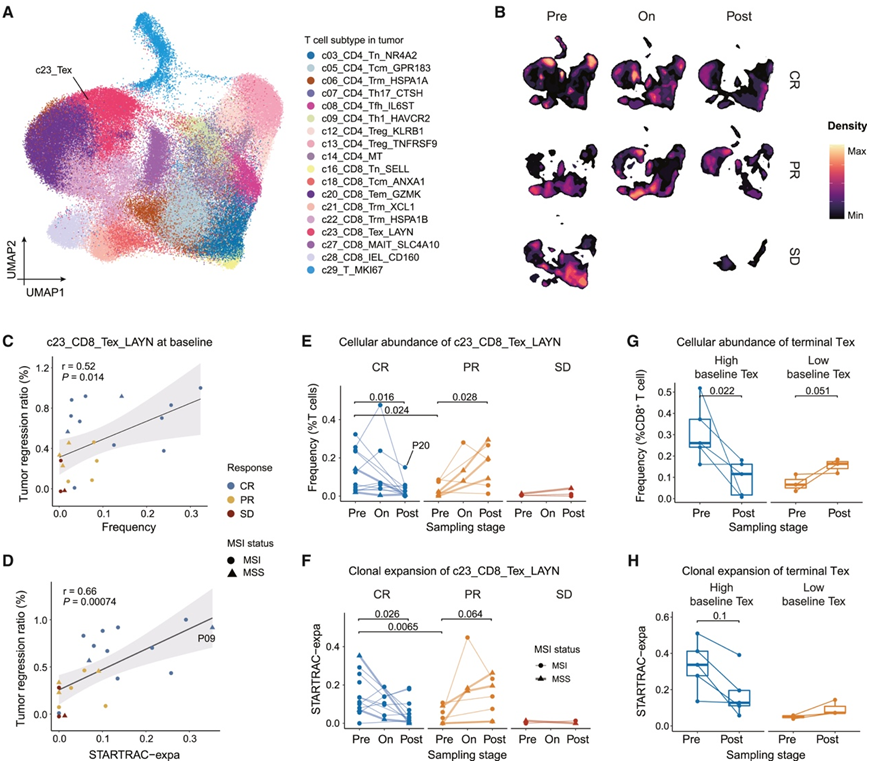
图3. 耗竭 T 细胞与治疗效果的关系。
(A)UMAP 图显示组织富集 CD8 + T 细胞的亚型。(B)UMAP 图显示不同治疗阶段和反应组的组织 CD8 + T 细胞密度。(C-D) 散点图显示肿瘤消退率与基线的相关性显示的是肿瘤组织中的 Tex 频率和基线克隆扩增水平。(E-F) PD-1 阻断后肿瘤内 c23_CD8_Tex_LAYN 的动态,以细胞丰度和克隆扩增水平为特征。(G-H) NSCLC 患者终末 Tex 的动态,以细胞丰度和克隆扩增水平为特征。
04
PD-1阻断过程中肿瘤反应样CD8+ T细胞的不同动态反映了治疗效果
蛋白质水平分析显示基线 CR 肿瘤和治疗后 PR 肿瘤中存在大量CD8+ CXCL13 +细胞的存在(图4A-C),SD 肿瘤显示出持久的 Ttr 样细胞缺乏(图 4 A)。为了阐明 PD-1 阻断在不同反应组中的相关影响,他们接下来检测了所有组织类型中 Ttr 样细胞群的转录异质性,Ttr 样细胞群的无监督聚类确定了具有不同功能状态的六个亚聚类(Ttr01-06)(图 4 D)。与其他细胞群不同,Ttr06 代表富含血液的循环细胞群。Ttr04 是一个增殖细胞群,Ttr05 高度表达干扰素刺激基因。在其他子集中,Ttr01 细胞标记为 Texp,因为它们的耗竭程度最小,并且已建立的 Texp 标记的活性最高。Ttr02 和 Ttr03 的特点是LAYN表达高于其他亚群。值得注意的是,在 Ttr02 中特异性地观察到了终末衰竭标志物(ENTPD1、TIGIT和LAG3)的高表达,因此将其定义为终末 Tex (Text) 细胞。
他们了 Ttr 样亚群的动态,以辨别 CR 和 PR 组之间的潜在区别(图 4 E-F)。治疗后,在 PR 肿瘤中观察到 Texp 和 Text 细胞的显著积累。相比之下,基线 CR 组中丰富的 Text 和增殖的 Tex 细胞在治疗后由 Texp 细胞取代(图 4 E-F)。通过在整个治疗过程中跟踪单个克隆内的 Ttr 样亚群分布,进一步巩验证了 CR 和 PR 组之间 Ttr 样细胞的这种不同转变(图 4 G)。
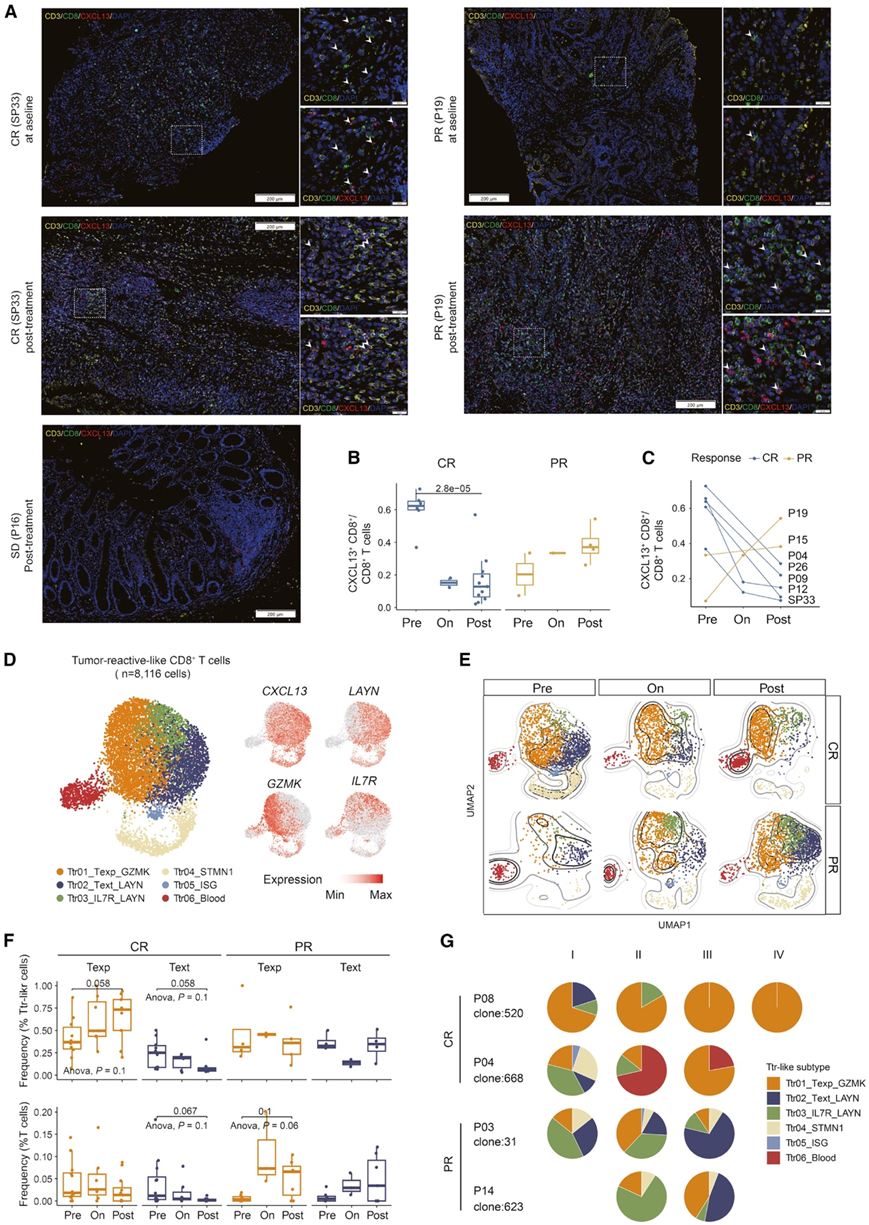
图4. PD-1阻断下的肿瘤反应样CD8 + T细胞。
(A)肿瘤活检中CD3 + CD8 + CXCL13 +细胞的代表性多重免疫荧光染色。(B)箱线图显示 CXCL13 + CD3 + CD8 +细胞占 CD3 +细胞的比例。 (C) CXCL13 + CD3 + CD8 +细胞比例动态。(D) UMAP 图显示所有组织类型的 Ttr 样亚型(左)和代表性基因的表达(右)。(E)UMAP 图显示 Ttr 样亚型在不同治疗阶段的分布。(F)箱线图显示 Texp 和 Text 占总 Ttr 样细胞(上) 和肿瘤内 T 细胞(下)的比例。(G) 饼图显示不同治疗阶段代表性克隆(考虑所有组织类型)的 Ttr 样亚型组成。
05
有效治疗干预下肿瘤反应样 CD8+ T 细胞的外周关联
他们追踪在血液中可检测到的克隆的 TCR,并将来自此类克隆的肿瘤或正常组织衍生细胞定义为“血液相关 Ttr 样”细胞(图 5 A)。然后,他们检测了治疗后血液相关 Ttr 样克隆在血液中首次可检测到的时间。令人惊讶的是,这些克隆的起源贯穿了整个治疗过程,包括基线阶段(图 5 B),进一步证明PD-1阻断可能有助于将先前存在的和新出现的Ttr样克隆从外周招募到TME中。在循环 Ttr 样细胞中观察到PDCD1的中等表达,随后在肿瘤中的血液相关 Ttr 样细胞中表达更高,而血液非相关 Ttr 样细胞表现出最高的PDCD1表达(图 5C)。同样,耗竭特征基因的表达从循环 Ttr 样细胞到血液相关 Ttr 样细胞再到血液非相关 Ttr 样细胞不断增强(图 5C)。与血液无关的 Ttr 样细胞相比,血液相关 Ttr 样细胞中检测到的GZMK和CCL4表达更高(图 5C)。与循环 Ttr 样细胞相比,肿瘤来源的 Ttr 样细胞中IFNG和多个主要组织相容性复合体 (MHC) II 相关基因的表达也显著增加,其中血液相关 Ttr 样细胞的表达水平最高(图 5C)。总体而言,在整个治疗过程中,CR 肿瘤的血液相关 Ttr 样细胞富集程度更高(图 5 D),尤其是在基线时(图 5 E)。
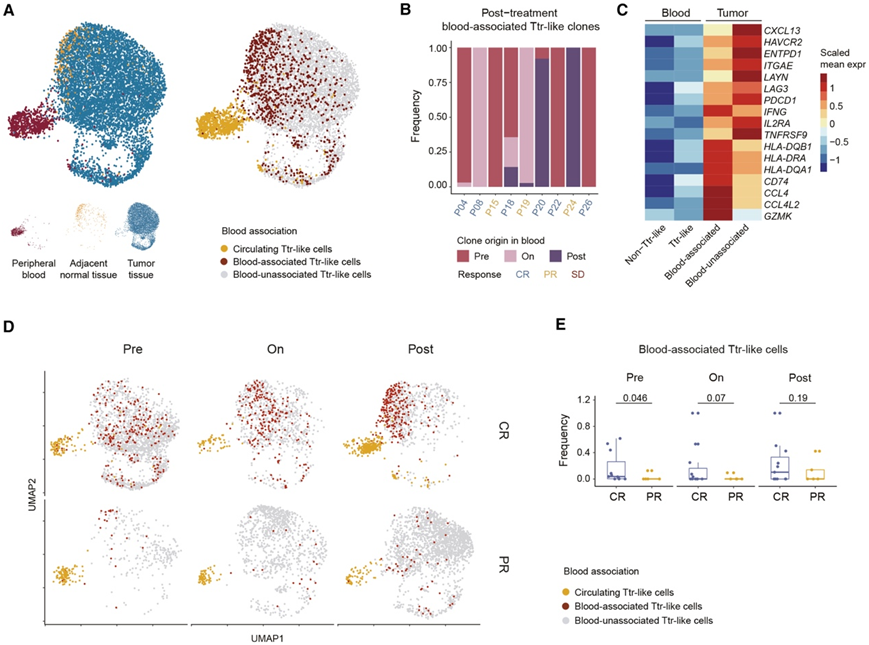
图5. PD-1阻断下肿瘤反应样CD8 + T细胞的外周关联。
(A)UMAP 图显示 Ttr 样细胞的解剖位置(左)和血液关联(右)。(B) UMAP 图显示 Ttr 样细胞的解剖位置(左)和血液关联(右)。(C) 热图显示了 Ttr 样亚群和循环非 Ttr 样细胞中代表性特征基因的表达。(D) UMAP 图显示 PD-1 阻断后 Ttr 样亚群的动态。 (E)箱线图显示不同治疗阶段肿瘤中血液相关 Ttr 样细胞的比例。
06
外周 T 细胞特征提示对 PD-1 阻断有反应
他们将重点转向 CD8+ T 细胞,以探索外周中的反应相关信号。分析克隆状态显示,反应者(CR 和 PR 患者)与无反应者(SD 患者)之间循环 CD8 + T 细胞的克隆多样性存在显著差异,无反应者的多样性明显较低(图 6 A)。此外,当他们将分析局限于治疗诱导的扩增的CD8+ T细胞克隆时,他们观察到克隆计数和肿瘤消退之间存在正相关,包括(1)新出现的克隆和(2)在治疗期间血液中克隆大小增加的克隆(图6B)。考虑到 TME 中血液相关 Ttr 样细胞的反应关联,他们接下来检查了外周中的 Ttr 样细胞(图 6 C)。与其他循环 CD8+ T 细胞相比,在循环 Ttr 样细胞群中观察到体积更大的克隆(图 6 D)。然后,他们研究了循环 Ttr 样细胞的具体表型。血液中 Ttr 样和非 Ttr 样 CD8+ T 细胞之间的差异表达分析显示,循环 Ttr 样细胞群表现出与细胞毒性相关的某些基因的更高表达,例如GZMB和PRF1;白细胞募集,例如CCL5;增殖,例如MKI67;和抗原呈递,例如HLA-DRA和CD74(图 6 E)。此外,在基线时,与其他循环 CD8+ T 细胞相比,在 Ttr 样细胞群中发现 MHC II 相关通路的优先富集(图 6 F)。然而,Ttr 样细胞群在血液中只构成 CD8+ T 细胞的少数亚群。
为了获得更简洁的反应预测标记,他们对 MHC II 相关基因采用了套索回归,将候选基因列表缩小到HLA-DRA、HLA-DQA1、HLA-DQB1和CD74。然后,利用这些基因构建了预测分数。正如预期的那样,预测分数可以更好地区分 CRC 队列中基线的 CR 组和 PR 组,AUC 为 0.798(图6G-H)。这些结果表明,该评分可能为 PD-1 阻断前预测临床反应提供潜在的非侵入性方法。同时,他们在治疗过程后追踪了循环 CD8+ T 细胞,并发现部分反应者的治疗后该预测评分显著升高(图6I)。
为了进一步证实循环 CD8 + T 细胞中 MHC II 相关特征与临床反应之间的关联,他们分析了来自另一个队列的系列血液活检,并使用流式细胞分析评估了 CD8+ T 细胞中 HLA-DR 的平均表达水平。与转录组水平的研究结果一致,CR 患者的 CD8 + T 细胞中 HLA-DR 的基线平均表达高于 PR 患者(图 6 J-K),而治疗后仅在 PR 患者中观察到平均表达的显著升高(图 6 J-K)。最后,在部分反应者的肿瘤和血液 CD8 + T 细胞中均观察到治疗后 MHC II 相关基因的上调。

图6. CRC 治疗反应相关的外周特征。
(A) 箱线图显示循环 CD8 + T 细胞的克隆多样性。(B) 肿瘤消退与循环 CD8+ T 细胞扩增或新出现的克隆计数之间的相关性。(C) UMAP 图显示循环 CD8+ T 细胞的亚型(左)和肿瘤反应性(右)。 (D) 密度图显示循环 CD8 + T 细胞克隆的克隆大小分布。(E) 火山图显示循环 CD8 + T 细胞中 Ttr 样细胞和非 Ttr 样细胞之间的差异表达基因。(F) 基线循环 Ttr 样和非 Ttr 样 CD8 + T 细胞中富集的通路。(G) CRC 队列(左)和外部 HNSCC 数据集中的预测评分的接收者操作特性 (ROC) 曲线(右)。 (H) 箱线图显示了CRC 队列(左)和外部 HNSCC 数据集中的基线预测评分(右)。(I) 箱线图显示 PD-1 阻断后预测评分的变化。(J) 代表性直方图显示外周 CD3+CD8+细胞中 HLA-DR 的荧光强度。(K) 箱线图显示外周 CD3+ CD8 +细胞中 HLA-DR 蛋白的平均表达。
+ + + + + + + + + + +
结 论
本项研究分析了 22 名接受 PD-1 阻断的患者的多个连续单细胞样本,以绘制 CRC 患者局部和全身免疫的演变。在肿瘤中,确定了表现出不同反应关联的协调细胞程序。具体而言,Tex和Ttr 样细胞与治疗效果密切相关,并且 Tex 细胞在 PD-1 阻断后与多种其他肿瘤富集细胞类型显示出相关的比例变化。此外,他们揭示了肿瘤中血液相关 Ttr 样细胞的耗竭程度较低的表型,并发现它们的丰度越高表明治疗效果越好。最后,基线时循环 CD8+ T 细胞中较高的MHC II 相关特征与更好的反应有关。
+ + + + +



 English
English


