文献解读|Cell Res(44.1):靶向促炎性 T 细胞作为潜在解决人类动脉粥样硬化的新型治疗方法
✦ +
+
论文ID
原名:Targeting pro-inflammatory T cells as a novel therapeutic approach to potentially resolve atherosclerosis in humans
译名:靶向促炎性 T 细胞作为潜在解决人类动脉粥样硬化的新型治疗方法
期刊:Cell Research
影响因子:44.1
发表时间:2024.03.15
DOI号:10.1038/s41422-024-00945-0
背 景
动脉粥样硬化(AS)是全世界心脑血管疾病的主要原因,是由脂质含量积累和慢性炎症引起的。传统策略主要侧重于降脂以控制 AS 进展,从而导致主要不良心血管事件 (MACE) 的残余炎症风险。虽然针对先天免疫的抗炎疗法减少了 MACE,但许多患者仍然面临重大风险。 AS 进展的另一个关键因素是适应性免疫,但其在预防 AS 中的潜在作用仍不清楚。
实验设计
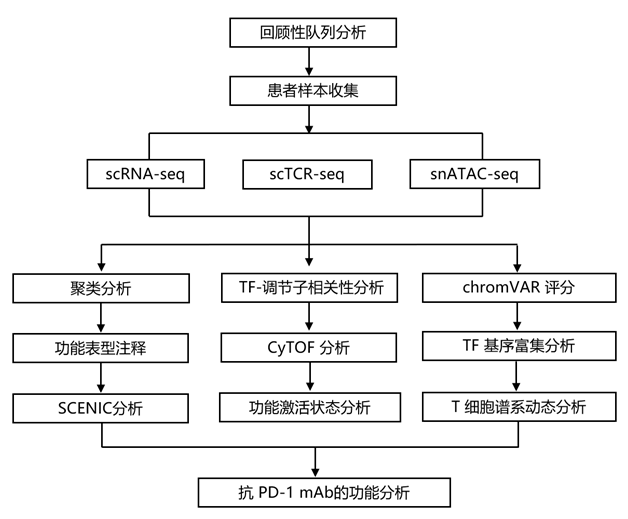
结 果
01
回顾性队列揭示了抗 PD-1 治疗在解决 AS 斑块方面的临床益处
为了探讨抗 PD-1 治疗对人类 AS 斑块进展的潜在影响,研究团队进行了一项回顾性队列研究,纳入了2018年1月1日至2022年5月1日期间在浙江大学第二附属医院(SAHZU)诊断和治疗的肿瘤患者(图1a), 并且在之前和/或之前至少有两次合格的颈动脉斑块超声成像记录。共有 168 名患者入组。其中,86例患者接受化疗联合抗PD-1治疗。 82 名患者仅接受化疗,未接受任何抗 PD-1 治疗。
通过对超声图像的双盲分析,他们检测了个体患者连续图像(扫描 1 和扫描 2)之间颈动脉斑块面积的变化(图 1b)。发现 接受抗PD-1治疗的患者斑块面积显著减少(图1c),其中60.5%(86人中的52人)斑块面积减少(图 1d )。相反,未接受抗PD-1治疗的患者AS斑块面积增加(图 1c)。虽然这些患者中有 29.3%(82 名中的 24 名)的 AS 斑块面积也减少,但这仍然显著低于接受抗 PD-1 治疗的组(图 1d)。接受抗 PD-1 治疗的患者中,AS 斑块面积的中位变化(ΔA:AS 斑块面积的变化)减少,而未接受抗pd -1治疗的患者中位数则有所增加(图 1e)。在年龄相对较大且高密度脂蛋白(HDL)水平略有降低的个体中观察到颈动脉斑块面积的减少。
他们进一步进行单因素和多因素回归分析,发现在接受或未接受抗pd -1治疗的患者中,抗pd -1治疗是颈动脉斑块减少的独立且显著的保护因素(图1f)。总的来说,这些临床结果表明,抗pd -1治疗可能会减少患者肿瘤中的AS斑块。
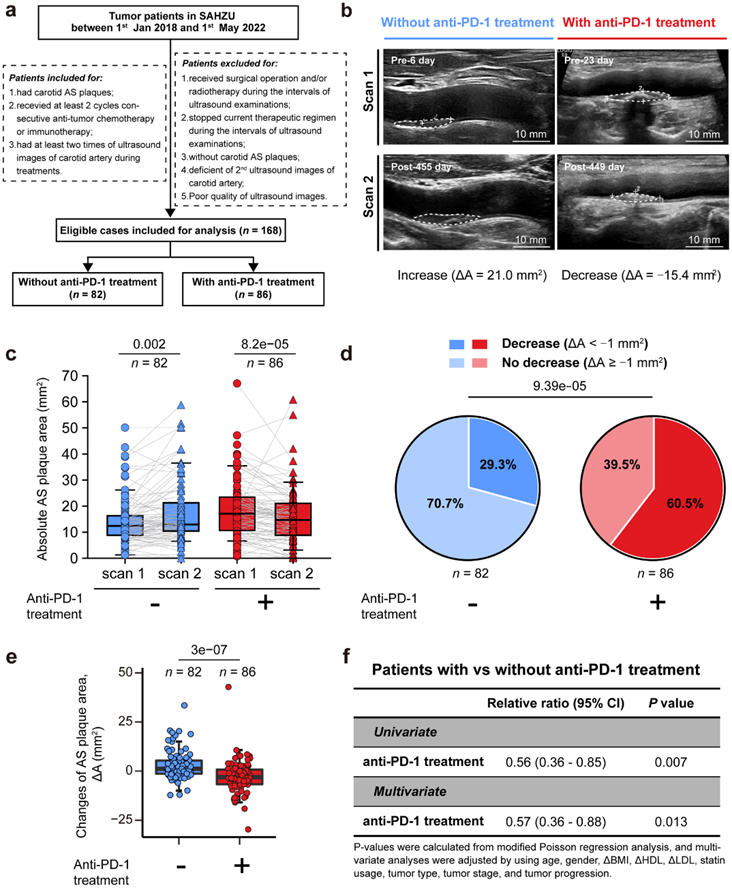
图1. 回顾性队列分析表明,抗 PD-1 疗法可在体内阻止并逆转 AS 斑块进展。
(a) 流程图显示了回顾性队列研究中合格患者的识别。(b-c) 在两个扫描时间点(扫描 1 和扫描 2),使用或不使用抗 PD-1 mAb 治疗的患者的颈动脉斑块的代表性超声图像以及 AS 斑块面积的比较。 (d) 未使用或使用抗 PD-1治疗的组中AS 斑块进展的成分比较。(e) 比较接受或不接受抗PD-1治疗的患者AS斑块面积(ΔA)的变化。(f) 对肿瘤患者中抗 PD-1 治疗与 AS 斑块进展的相对比率 (RR) 进行单变量和多变量(改良泊松)回归分析。
02
人类动脉粥样硬化T细胞图谱
为了研究抗 PD-1 mAb 减少人类 AS 斑块的机制,他们使用单细胞 RNA 测序 (scRNA-seq) 和配对单细胞 TCR 测序 (scTCR-seq) 来表征来自4 例人类 AS 的CD45+细胞斑块和3对外周血单核细胞(PBMC)(图 2a)。总共,他们获得了 62522 个 CD45+细胞,每个细胞平均有 1641 个基因,并将它们分为 26 个聚类。基于谱系特异性基因,他们注释了 17 个 T 细胞聚类(42921 个细胞)、2 个 B 细胞聚类(2099 个细胞)、5 个自然杀伤(NK)细胞聚类(15289 个细胞)和 2 个骨髓细胞聚类(2213 个细胞)(图 2b)。在通过单细胞处理从人类AS斑块中提取的细胞中,T细胞是最丰富的免疫细胞类型。他们进一步将 T 细胞重新聚集成 7 个 CD4 +和 11 个 CD8 + T 细胞聚类。这些T细胞聚类具有不同的组织分布(图 2c-d),并根据其差异表达基因(DEG)注释为不同的功能表型(图2b-c),包括幼稚/中央记忆T (Tn/Tcm) 细胞、重新表达 CD45RA (Temra) T 细胞的效应记忆细胞、粘膜相关不变 T (MAIT) 细胞和调节性 T (Treg) 细胞。
他们还鉴定了表达CCR6 (CD4-C3)的T辅助细胞(Th)17样细胞,表达ZNF683和RUNX3的组织常驻记忆T (Trm)细胞(CD8-C2),以及增殖T细胞(Tpro)(CD8-C11)表达一系列增殖相关基因(STMN1、MKI67、HMGB2和TPX2)。此外,他们鉴定了两个活化的CD8+ T细胞聚类(Tact)(CD8-C8,CD8-C9),高表达基因编码炎症因子(TNF和IFNG)、t细胞活化(CD69、JUN和FOS)以及线粒体相关代谢编程(MT-ND2、MT-CO1和MT-ND6),而不是细胞毒性相关基因(NKG7、GZMB和GNLY)(图2b),表明它们在AS斑块中的促炎表型而不是细胞毒性表型。
在分析了T细胞的组织分布(图2d),他们确定了两个CD4+ (CD4-C4和CD4-C5)和四个CD8+(CD8- c2、CD8-C3、CD8-C4和CD8-C8) T细胞聚类,它们主要分布在AS斑块中(图2c-d)。其中,CD4-C4和CD8-C3聚类分别是AS斑块中最丰富的CD4+ (14.9%)和CD8+ (14.8%) T细胞聚类。与其他 T 细胞相比, 两个聚类都表达更高水平的LMNA、MCL1、CXCR3和激活基因(CD44、FOS和KLF6)(图2b-c),表明它们具有效应记忆样表型。因此,他们将它们定义为LMNA+效应记忆T(Tem) 细胞。此外,CD4-C5和CD8-C4聚类是两个斑块特异性Tem样聚类,它们不仅与LMNA + Tem细胞共有部分DEG,而且还高表达PDCD1(定义为PDCD1 + Tem细胞)(图 2b-c)。他们进一步发现,在CD4+和CD8+ T细胞中,LMNA+和PDCD1+ Tem细胞高表达趋化因子受体(CXCR3和CXCR4)、ZFP36和TNFAIP3基因,而IL21R、DUSP2、DUSP4仅在CD8+ T细胞中表达。这些数据表明,所有这些基因表达可能有助于抑制T细胞的效应功能,形成长寿的Tem细胞。更重要的是,通路分析进一步证实斑块特异性LMNA+和PDCD1+ Tem细胞均富集“白细胞活化”、“白细胞稳态”和“细胞因子反应”信号通路(图2e-f)。这些结果表明这些 T 细胞具有潜在的炎症作用,可能有助于维持动脉粥样硬化斑块的慢性炎症稳态。
接下来,他们应用单细胞调节网络推理和聚类 (SCENIC) 方法来分析关键调节子,包括斑块特异性 T 细胞聚类中的必需转录因子 (TF) 及其靶基因。他们鉴定了三个基于调节子的AUCell聚类(AUC-C1、AUC-C2和AUC-C3),并发现T细胞聚类分布不均匀(图 2g)。表达LMNA +(CD4-C4和CD8-C3)和PDCD1 + (CD4-C5和CD8-C4)的Tem细胞主要分布在AUC-C1聚类中,表明这些细胞具有相似的转录调控通路。相关调控分析显示,AUC-C1 聚类中的 T 细胞高度表达调节子,如 REL、RELA、RELB、NFKB1和 NFKB2(图 2h),表明核因子-κB (NF-κB)信号的激活参与了LMNA+和PDCD1+ Tem细胞的炎症状态的编程(图 2h-i)。同时,这些细胞还富含与Tem细胞分化相关的 BACH2和FOXO1调节子(图 2h-i)。相反,IRF和JAK-STAT信号通路的调节子在AUC-C3聚类(主要是CD8-C8、CD8-C9)中高度表达,表明他们独特的激活通路(图 2h-i)。总的来说,他们确定了两条不同的促炎信号通路,它们独立地重塑了 AS 斑块中 T 细胞的功能状态,并且 NF-κB 信号通路的激活在斑块特异性LMNA +和PDCD1 + Tem 细胞中占主导地位,支持这些 T 细胞的转录调节维持 AS 斑块的慢性炎症。
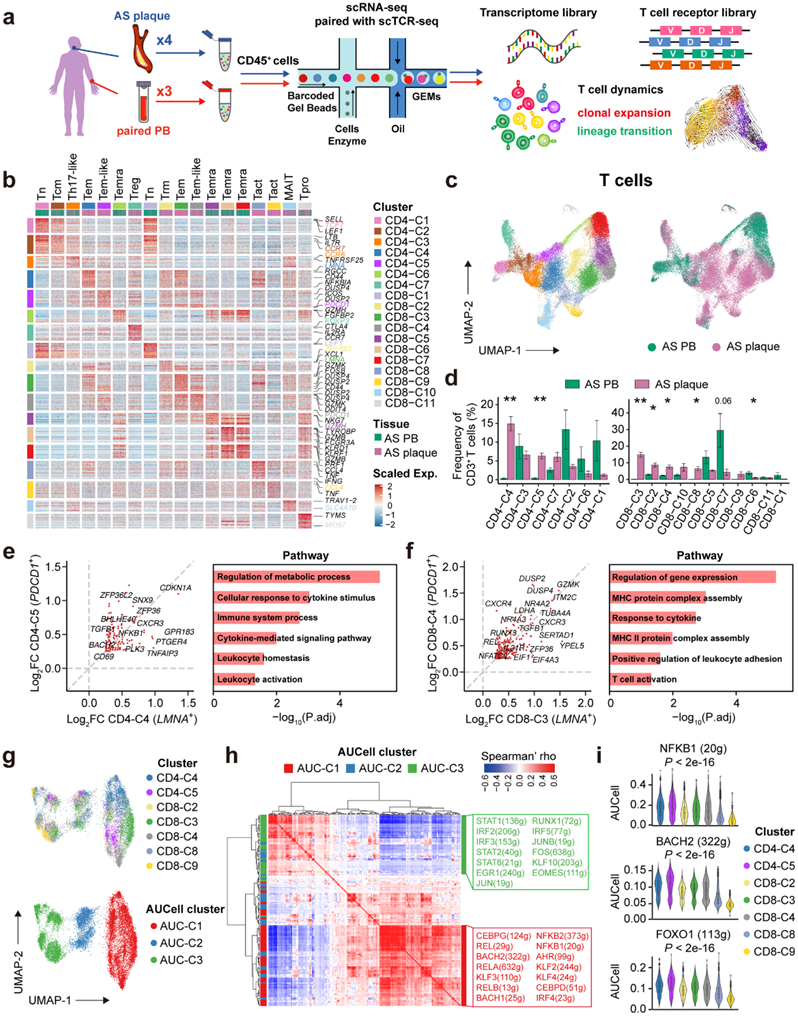
图2. scRNA-seq 分析揭示了人类 AS 斑块的 T 细胞图谱。
(a) 配对 scRNA-seq 和 αβTCR-seq 分析的实验设计。 (b) T 细胞聚类的 DEG,每个聚类的表型定义标记在顶部,并且聚类由聚类(左和上)和单个细胞的组织来源(上)着色。(c) 来自 scRNA-seq 数据的 40985 个 T 细胞的均匀流形近似和投影 (UMAP) 图。(d) CD4 +(左)和 CD8 +(右)T 细胞聚类的组成,按样本来源着色,并且聚类按 AS 斑块中的平均频率进行排序。 (e-f) 散点图显示CD4-C4 和 CD4-C5 聚类之间以及 CD8-C3 和 CD8-C4 聚类之间重叠 DEG(左)和富集通路(右)。 (g) 斑块特异性 T 细胞聚类中 T 细胞的 UMAP 图。(h) 热图显示成对的 TF-调节子相关性。(i) 小提琴图显示已识别斑块特异性 T 细胞聚类上调节子的 AUCell 评分。
03
飞行时间细胞计数(CyTOF)分析显示,AS斑块中的PD-1+ T细胞仍处于激活状态
为了表征人类 AS 斑块中 PD-1 + T 细胞的 T 细胞图谱和功能表型,他们对 64 个人类样本中的 CD45 +细胞进行了单细胞 CyTOF 分析,其中包括 44 个 AS 外周血 (PB) 和 20 个 AS 斑块。他们进一步分析了 T 细胞组成并鉴定了 35 个 T 细胞聚类(图 3a-b),包括 18 个 CD4 + (T01-T18)、12 个 CD8 + (T19-T30)、2 个 γδT ( T31 和 T32)、2 个 NKT(自然杀伤 T细胞)(T33-T34)和 1 个 DNT(双阴性 T细胞)(T35)细胞聚类。与 AS PB 中的相比 ,组织中的 T 细胞组成发生显著变化,AS 斑块中 CD8 + T 细胞的分数增加,CD4 + T、γδT 和 NKT 细胞的分数减少(图3c)。此外,斑块特异性 T 细胞主要由非细胞毒性 Tem 细胞 (CD45RA– CCR7–) 组成,Tn (CD45RA+CCR7+) 和效应 T (Teff)(颗粒酶 B+CD45RA+T-bet +)细胞比例减少。
他们比较了CD4+和CD8+ T细胞聚类细胞频率的差异倍数(图3d),发现CD4+的5个PD-1+(T11、T13和T14)T细胞聚类T24和T27只富集于AS斑块中,人AS斑块免疫荧光染色进一步证明了CD4+PD-1+和CD8+PD-1+ T细胞的存在(图3e)。随后,他们发现共刺激分子(CD28和ICOS)在PD-1+ T细胞上共表达,激活分子(HLA-DR和CD27)在PD-1+CD8+ T细胞上表达特别高(图3f)。此外,这4种功能标志物在AS斑块中的 PD-1+ T细胞上的表达显著高于PD-1 – T细胞(图3g),并且它们的表达水平也与PD-1表达高度相关。总而言之,这些结果表明 PD-1 + T 细胞主要位于人类 AS 斑块中,并表明它们与癌症中终末分化的耗竭 T (Tex) 细胞不同。
PD-1 与其他共抑制性免疫检查点受体的持续共表达,例如淋巴细胞激活基因 3 (Lag-3)、T 细胞免疫球蛋白和含粘蛋白结构域 3 (Tim-3),以及T 细胞免疫球蛋白和 ITIM(免疫受体酪氨酸抑制基序)结构域 (TIGIT)是肿瘤疾病中 T 细胞耗竭的标志。通过深入分析斑块特异性 T 细胞的单细胞转录组,检测了 AS 斑块中PD-1+ T 细胞的功能。他们鉴定了与T细胞中PDCD1表达高度相关的前30个基因,包括DUSP2、DUSP4、CXCR3、CXCR4、ICOS等,并将它们定义为斑块特异性PDCD1基因特征。他们计算并排列每个T细胞聚类的AUCell评分,发现表达最高水平PDCD1的CD4-C5和CD8-C4聚类排在前面,并定义为AS斑块中的PDCD1 + T细胞聚类。与上述CyTOF结果一致(图 3f-g),ICOS在转录组水平上 与PDCD1共表达。然而,与 T 细胞耗竭相关的典型共抑制分子或调节因子,例如HAVCR2、LAG3、TIGIT和TOX,并未在这些细胞上共表达,因此未归入与PDCD1相关的基因内(图3h)。
PD-1 信号通路伴随着 TCR 信号的激活,也有助于 T 细胞记忆的维持。通过分析PDCD1+ T细胞(CD4-C5和CD8-C4)的DEG ,他们鉴定了这两个聚类共有的30个基因(图 3i),包括与氨基酸转运相关的基因(SLC7A5)、T细胞炎症反应中的激活(DUSP2、DUSP4、CREM、ARID5A、PDE4B、RNF125和NR4A2)和趋化性(CXCR3和CXCR4)。他们进一步计算了这两个PDCD1+ T细胞聚类的调节子特异性得分,以确定其转录组调控(图 3j),并发现了CD4-C5聚类中的关键调节因子,例如转录因子RORA与结肠炎和炎症相关,以及PRDM1与T 细胞的效应功能相关。
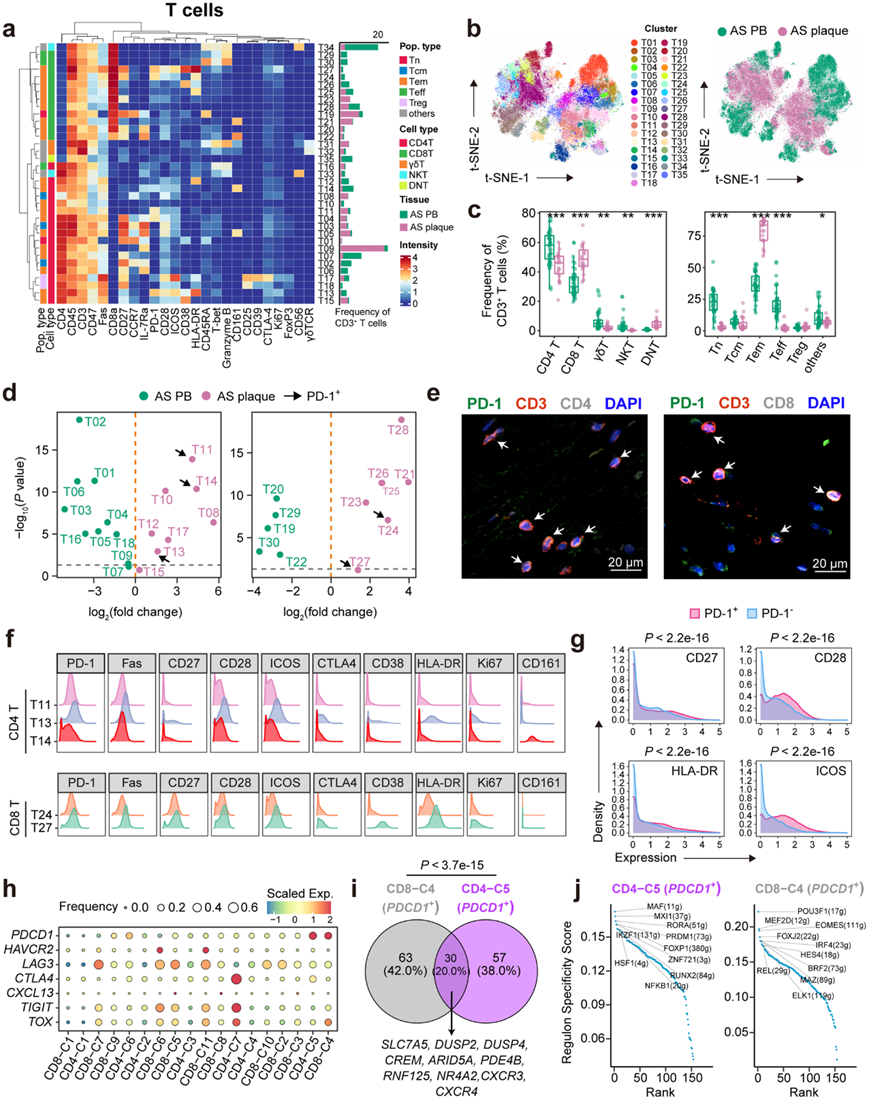
图3. 单细胞 CyTOF 分析揭示的人类 AS 斑块和 AS PB 的 T 细胞图谱。
(a) 显示 35 个 T 细胞聚类(T 细胞面板)的中值表达的热图,标有主要或功能子集(左)和聚类频率(右)。 (b) T 细胞的 t-SNE 图,按聚类或样本组着色。 (c) AS PB 和 AS 斑块中主要(左)和功能性(右)T 细胞亚群的组成。 (d) 火山图显示 AS 斑块中 CD4 +(左)和 CD8 +(右)T 细胞聚类的频率与 AS PB 中的相比不同。(e) 多色 IFC 染色确认代表性人类 AS 斑块中的PD-1 + CD4 +和 PD-1 + CD8 + T 细胞。 (f) 直方图显示 PD-1+ CD4+(上)和 PD-1+ CD8+(下)T 细胞聚类上选定的功能标记物表达。(g) 直方图显示斑块来源的 PD-1+和 PD-1– T 细胞上的 ICOS、HLA-DR、CD27 和 CD28 表达。 (h) 点图显示 T 细胞聚类中与耗竭相关的共抑制和调节基因的表达。 (i) PDCD1 + T 细胞聚类(CD4-C5 和 CD8-C4)之间共有 DEG 的维恩图。 (j) 点图显示了计算出的PDCD1 + T 细胞聚类(CD4-C5 和 CD8-C4)的调节子特异性分数。
04
AS斑块特异性PDCD1 + T细胞的表观遗传足迹和调控
为了研究 AS 斑块特异性 T 细胞中 T 细胞激活或耗竭相关基因的染色质可及性状态,从四个 AS 斑块样本中分选 CD3+ T 细胞。并进行单细胞核转座酶染色质可及性分析(snATAC-seq),共获得了 5598 个单个细胞核,并分为 12 个 T 细胞聚类。他们将这些聚类注释为静息 CD4 + (C8) 和 CD8 + (C1) T 细胞 (Tres)、CD8 + Teff 细胞 (C4) 、Treg 细胞(C11)、Th17 样细胞(C10)、CD8 +激活的 T 细胞(C6 和 C7)和 γδT 细胞(C12)。
为了研究 AS 斑块特异性 CD8 + PD-1 + Tem 细胞(C3 和 C5)的染色质可及性差异,他们将 snATAC-seq 数据集与基底细胞癌中耗竭的 CD8 + T 细胞进行了整合。与CD8+ Tres和Teff细胞(C1和C4)相比,CD8+ Tex(肿瘤特异性)和Tem(C3, C5;AS斑块特异性)细胞对PDCD1位点+5Kb和-5Kb顺式元件的可及性更高,PDCD1基因的预测活性也更高(图4a-b)。然而,其他T细胞耗竭相关基因(如CTLA4、HAVCR2和ENTPD1)的染色质可及性在斑块特异性Tem细胞中并不富集,而只在肿瘤特异性Tex细胞中富集(图4a-b)。这表明AS斑块特异性PD-1+ Tem细胞中的染色质调控程序与肿瘤中的PD-1+ Tex细胞不同,尽管两者都表达PD-1。
随后,他们应用chromVAR将TF 基序富集与集成的snATAC-seq数据集进行比较(图4c)。使用层次聚类,他们揭示了 T 细胞聚类内 TF 结合基序的主要亚组,包括富含 C3_CD8_Tem 和 C4_CD8_Teff 聚类的 TBX21 和 EOMES 基序的可及性,以及 AP-1 家族(FOS、JUN、BATF 和BATF3)和记忆相关基序(RUNX3、BACH1和BACH2)在C3_CD8_和C5_CD8_Tem聚类中富集(图 4c-d)。相比之下,协调 T 细胞耗竭的 TF 基序(例如 NR4A1、NR4A2 和 NR4A3)仅在肿瘤特异性 Tex 细胞中富集,但在斑块特异性 Tem 细胞中不富集(图 4c-d)。
AS斑块特异性PD-1 + T细胞(PT04、PT09、PT14和PT23)不表达其他T细胞耗竭标志物(例如Lag-3、Tim-3和TIGIT)(图 4e),但与T细胞激活相关的共刺激分子(CD28、CD69和HLA-DR)高表达(图 4e)。
接下来,他们从人类 AS 斑块和肺肿瘤样本中分选的 PD-1 + T 细胞(图4f)。与肺肿瘤来源的PD-1— T细胞类似,与肺肿瘤来源的PD-1+ T细胞相比,AS斑块特异性PD-1+ T细胞仍然能够分泌促炎细胞因子[IL-2和干扰素(IFN)-γ](图4g-h)。
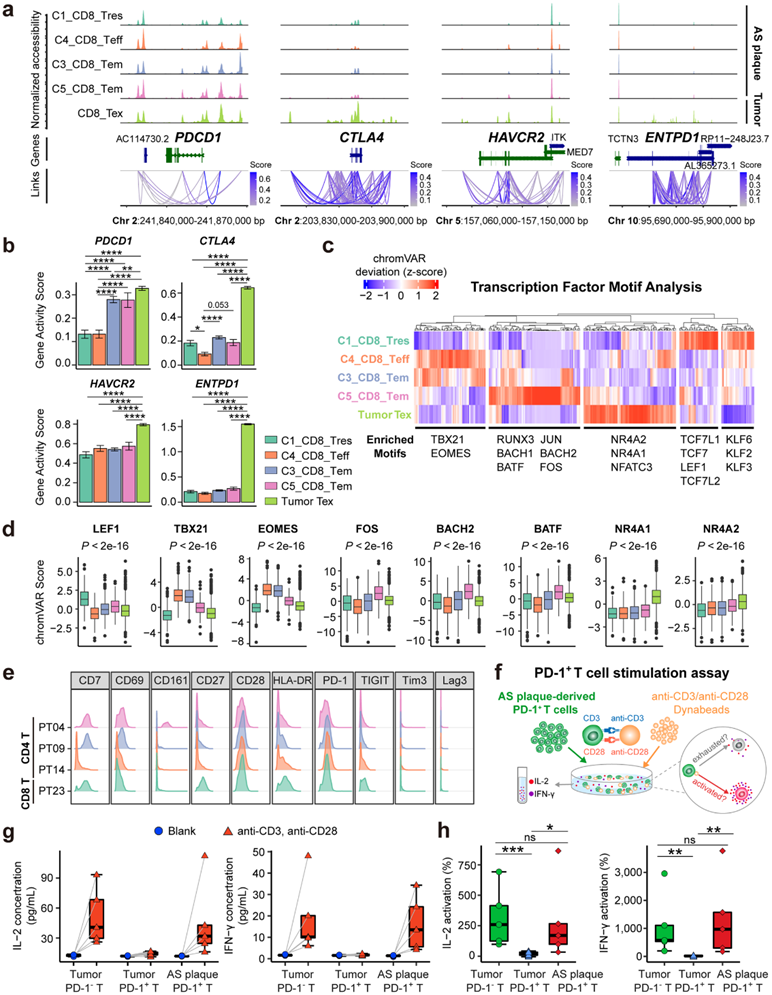
图4. AS 斑块特异性 PD-1+ T 细胞激活表型的体外验证。
(a) 已识别基因位点染色质可及性的覆盖图。 (b) 条形图显示指定基因的推断基因活性得分。(c) 热图显示 T 细胞聚类中 TF 基序的缩放 chromVAR 分数,并且基序通过层次聚类进行聚类。(d) T 细胞聚类中选定 TF 基序的 chromVAR 评分箱线图。 (e) PD-1 + CD4 +(PT04、PT09 和 PT14)和 PD-1+CD8 +T 细胞聚类上选定 T 细胞功能标记物表达的直方图。(f) 示意图显示体外 T 细胞刺激试验。(g-h) 显示上清液中IL-2和IFN-γ的浓度并比较它们的相对激活水平。
05
scTCR-seq 分析揭示人类 AS 斑块中的 T 细胞谱系动态
接下来,他们探索 AS 斑块中不同 T 细胞聚类之间的谱系关系,特别是LMNA +和PDCD1 + T 细胞,并揭示它们如何由 AS 微环境动态重塑。他们使用配对的 scTCR-seq 和 scRNA-seq 数据集构建了人类 AS 特异性T细胞受体(TCR) 库。利用这些数据,鉴定了 24407 个具有配对 TCR-α 和 -β 链的 T 细胞(约占总 T 细胞的 56.9%),以及用于下游谱系追踪的 12259 个不同的 TCR 克隆型。
对每对CD4+或CD8+ T细胞聚类的共有TCR克隆大小进行相关分析,进一步证实LMNA+、PDCD1+和NKG7+ T细胞聚类均具有显著且丰富的共有TCR克隆型(图5a-f)。TCR克隆型在其他T细胞聚类对之间也存在重叠,包括th17样(CD4- c3), LMNA+CD4+ T细胞(CD4- c4),以及Temra细胞聚类(CD8-C5、CD8-C6和CD8-C7),这表明这些聚类在AS斑块中是动态转换的(图5a-b)。
他们推断了 CD4 +和 CD8 + T 细胞聚类中PDCD1 +、LMNA +和NKG7 + T 细胞之间的定向分化轨迹。使用 RNA 速率分析,他们发现NKG7+ Temra 细胞(CD4-C6 和 CD8-C5)具有两个不同的分化方向。一个方向指向自身,表明其中一些细胞可以局部自我更新,而另一个方向则指向PDCD1+ T细胞,向LMNA+ T细胞移动并最终终止。这表明从NKG7+ Temra细胞向PDCD1+ Tem细胞(CD4-C5和CD8-C4)以及随后向LMNA + Tem细胞(CD4-C4和CD8-C3)分化终末的转变轨迹(图5g-i)。
此外,他们还确定了随细胞伪时间发生显著变化的前 50 个基因,发现细胞毒性基因(NKG7和PRF1)逐渐下调,而与T细胞活化相关的基因(CD44、FOS、NFKBIA和LMNA)和细胞骨架(TUBB4B、TUBB2A和VIM)随着细胞的增殖而持续上调。通过PDCD1+ Tem 细胞从NKG7 + Temra 到LMNA + Tem 的分化轨迹(图 5h-j)。这一结果表明,这些 T 细胞在分化时可能会逐渐失去细胞毒性,并可能达到持续激活的记忆状态。
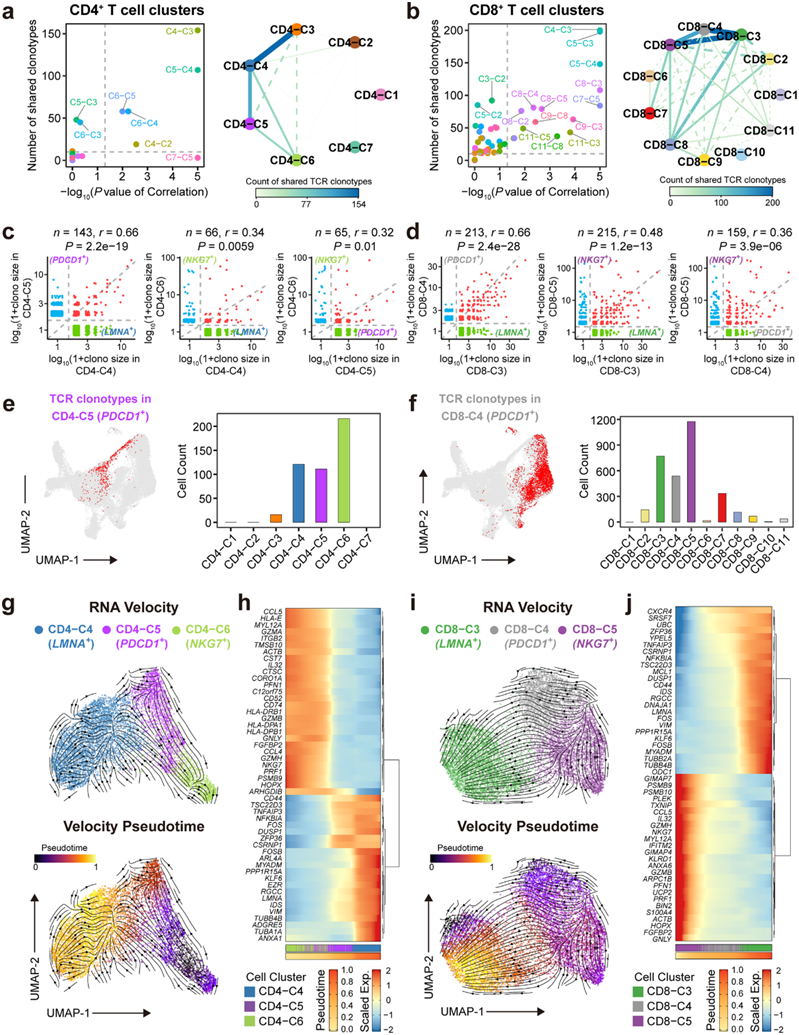
图5. 配对的 scRNA-seq 和 αβTCR-seq 揭示了 AS 斑块中 T 细胞动力学和 T 细胞的分化轨迹。
(a-b) 散点图(左)显示 T 细胞聚类对中共有 TCR 克隆大小的计数和相关性检验。 (c-d) 散点图显示所选 CD4 +和 CD8 + T 细胞聚类对中 TCR 克隆型的克隆大小。(e-f) CD4-C5和 CD8-C4聚类(左) 中具有已识别 TCR 克隆型的 T 细胞 UMAP 图。 (g,i)RNA速率分析。 (h,j) 热图显示了分析的 CD4 + 或 CD8 + T 细胞 中按伪时间排列的前 50 个 DEG。
06
人类 AS 斑块中 PD-1 配体的表达缺陷
他们检测了人类AS斑块中PD-1配体的表达。流式细胞分析显示,几乎没有CD45+免疫细胞和CD45 -非免疫细胞表达PD-L1或PD-L2(图6a)。
他们观察到人类 AS 斑块中的骨髓细胞上 CD64 (FcγRI) 和 CD32 (FcγRII) 高表达。这些受体可以很好地结合各种免疫球蛋白G(IgG)的Fc结构域。他们假设通过人 AS 斑块特异性骨髓细胞上的 FcR(例如 FcγRI/CD64)表面捕获的抗 PD-1 mAb 可能作为代理 PD-1 配体来抑制 T 细胞活化(图 6b)。他们首先验证了Nivolumab(一种抗人- pd -1 IgG4单抗)可以由CD64+人PBMC和CD64+细胞系捕获(图6c)。
他们通过使用单细胞生物力学粘附试验进一步验证了这一点,该试验检测到与Nivolumab结合的人AS斑块的原代PD-1+ T细胞与pbmc来源的CD64+细胞(61.5%)之间的粘附频率(Pa%)显著增加(图6d-e)。然后他们进行了体外实验,以确定 CD64 捕获的抗 PD-1 mAb(例如 Nivolumab)和 PD-1 之间的相互作用是否可以激活 PD-1 下游信号通路以抑制 T 细胞活化。通过将 PD-1 + Jurkat T 细胞与包有 Nivolumab 和抗 CD3/抗 CD28 mAb 的珠子结合,他们发现 PD-1 + Jurkat T 细胞的细胞因子释放 (IL-2) 显著受损和 T 细胞活化标记物(NFAT,活化 T 细胞核因子)表达减弱。随后,他们在存在或不存在纳武单抗的情况下将来自人AS斑块的原代PD-1 + T细胞与来自人PBMC的CD64 +细胞离体共培养,进一步证实了这一点(图6f)。Nivolumab 能够显著抑制 AS 斑块特异性 PD-1+ T细胞炎症细胞因子(IL-2、TNF-α 和 IFN-γ)的分泌(图6g)。
此外,他们进行了体外共培养刺激试验,通过在Nivolumab存在或不存在的情况下,将人AS斑块或肺肿瘤来源的CD45+细胞与抗cd3 /抗cd28-mab包被珠共培养(图6f)。Nivolumab的存在显著降低AS斑块来源的CD45+细胞中炎症因子(IL-2, IFN-γ和TNF-α)的分泌,但不影响肺肿瘤来源的免疫细胞(图6h)。
在接受抗pd -1单抗治疗的患者中,斑块面积 (ΔA)显著降低(图6i)。在使用具有 Fc 结合能力的抗 PD-1 mAb 治疗组中,大多数患者(48 名患者中的 33 名;68.7%)经历了 AS 斑块减少,明显高于其他两组。用具有非Fc结合能力的抗PD-1 mAb治疗组的斑块减少频率为20.0%,而未用抗PD-1治疗的组的频率为23.9%(图6j)。
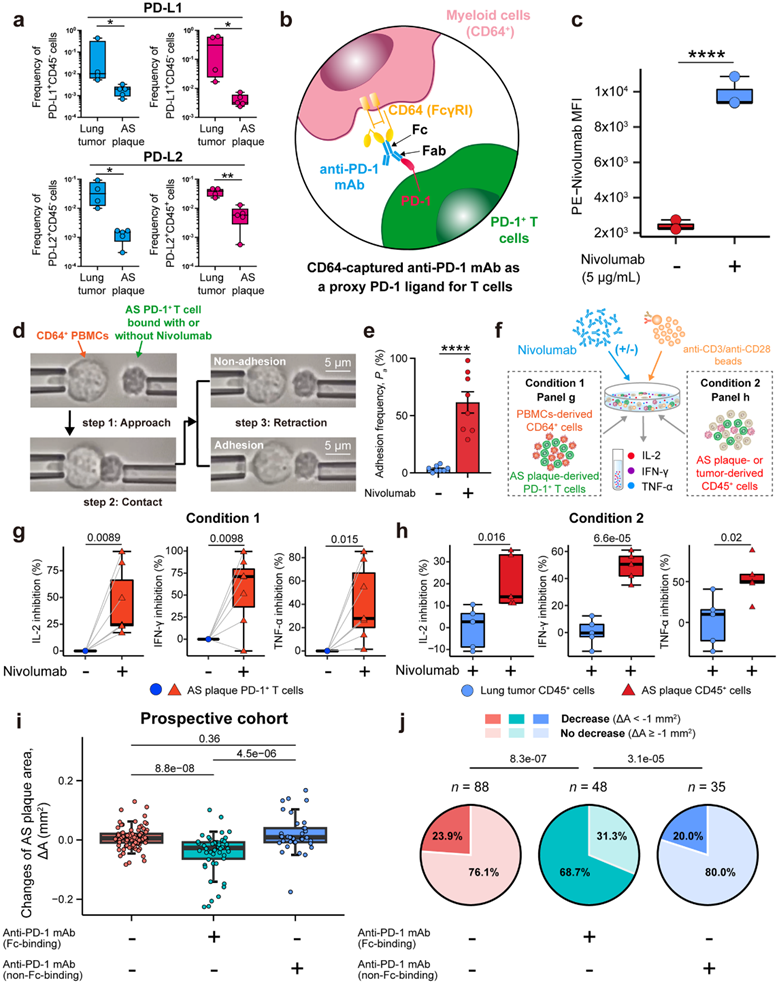
图6. FcγRI 捕获的抗 PD-1 mAb 作为 PD-1 配体,可在体外抑制 AS 衍生的 PD-1+ T 细胞,并减少人体 AS 斑块面积。
(a) 肺肿瘤和 AS 斑块中CD45-和 CD45 +细胞中PD-L1 +和PD-L2+细胞的频率比较。 (b) 该图显示 CD64 捕获的抗 PD-1 mAb 充当 PD-1 配体。(c) 平均荧光强度 (MFI) 。(d) 细胞间粘附频率 (Pa%)。 (e) 定量细胞间粘附频率。(f-h) 示意图显示从 PBMC 分选的原代 CD64+骨髓细胞和与抗 PD 共培养的 AS 斑块衍生的 PD-1+ T 细的离体刺激。 (i-j) 比较未治疗组或使用 Fc 结合抗 PD-1 mAb治疗的三组中 AS 斑块面积 (ΔA)的变化和 AS 斑块进展的组成或非 Fc 结合能力。
+ + + + + + + + + + +
结 论
本项研究对患有 AS 斑块的肿瘤患者进行了回顾性队列研究,发现抗PD-1单克隆抗体可显著减少 AS 斑块大小。通过多组学单细胞分析,全面表征了 AS 斑块特异性 PD-1 + T 细胞,这些细胞具有激活性和促炎性。抗 PD-1 mAb 当由骨髓表达的 Fc gamma 受体 (FcγR) 捕获时,会与 T 细胞上表达的 PD-1 相互作用。这种相互作用将抗 PD-1 mAb 转变为替代性 PD-1 配体,抑制 AS 斑块中 PD-1 配体缺乏的 T 细胞功能。具有 Fc 结合能力的抗 PD-1 mAb 可以有效减少 AS 斑块大小,而不具有 Fc 结合能力的抗 PD-1 mAb 则不能。本项研究表明,T 细胞靶向免疫疗法可以成为解决人类 AS 的有效策略。
+ + + + +



 English
English


